|
||||||||||||||||||||||||
表1
现有宫颈癌分子标志物分类
正文中引用本图/表的段落
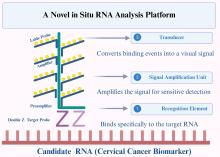
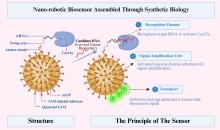
在宫颈癌的整个病程中,已发现诸多分子标志物在多种癌细胞表型相关的生物进程中发挥作用,可作为用于宫颈癌诊断、预后评估和药物疗效评估的潜在分子标志物。这些潜在宫颈癌分子标志物可按其在癌症进程中的功能归纳为七大类(见表1),包括HPV感染及癌变、细胞周期与增殖、细胞凋亡、上皮分化、侵袭和转移、癌干细胞和血管生成相关的分子标志物,Volkova等发表的综述对这七类潜在的宫颈癌分子标志物进行了系统性的总结[13]。HPV感染及癌变相关分子标志物,主要包括宫颈上皮细胞中的HPV DNA、病毒致癌基因表达产物E6/E7 mRNA和作为HPV E7介导的下游效应指标p16INK4a(以下简称为p16)蛋白,对这些标志物的检测可明确指示高危型HPV(16/18/31/33等)的感染情况[13-15]。细胞周期与增殖调控相关分子标志物主要以p53和Ki-67等为代表,其中p53在DNA损伤后可介导细胞周期阻滞或细胞凋亡,其突变的累积则可提示肿瘤进展[15, 16];Ki-67是经典的细胞增殖标志物,辅以Ki-67的检测的诊断方法可显著提高对高级别鳞状上皮内病变及癌变的识别准确性[15, 17-21]。细胞凋亡相关分子标志物主要以BCL-2/BAX等为代表,它们的表达失衡反映了肿瘤细胞逃逸凋亡的能力[22-24]。上皮分化相关分子标志物,如CK7、CK8、CK17和CK19等,其表达模式的改变可提示宫颈鳞状或腺状上皮的分化程度,可以反向指示肿瘤的恶性程度[25, 26]。侵袭与转移相关分子标志物有E-cadherin基因和CD44及MMP家族(如MMP-2/9)基因等,E-cadherin基因表达下调指示上皮-间质转化[16, 27],而CD44及MMP家族(如MMP-2/9)基因表达上调则指示基质降解增强与肿瘤细胞远端转移[28, 29]。癌症干细胞标志物,如ALDH1A1和OCT4与肿瘤干性、耐药及复发相关,可用于早期检测和疗效监测[30]。血管生成标志物,如VEGF可通过诱导新生血管促进肿瘤进展,而内源性抑制剂TSP-1则发挥拮抗作用,二者共同构成抗血管生成治疗评估的潜在靶点[31-34]。
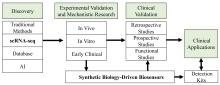
在宫颈癌的早期筛查和疾病诊治过程中,从宫颈脱落细胞、宫颈病变组织及血清中检测上述标志物的基因或蛋白的表达水平,将有助于宫颈癌风险人群的分流、临床分期以及预后判断。目前已有部分分子标志物已进入到临床应用阶段。检测高危型HPV DNA或其致癌基因E6/E7的表达,是识别宫颈病变风险的第一步。p16/Ki-67是一种相对客观的肿瘤诊断辅助检测方法,p16/Ki-67双重免疫组化染色检测,已在多个国家获批应用于宫颈癌的临床诊断,对于细胞学检查结果异常的女性,p16/Ki-67双染也是一个有效的临床分流工具[35, 36]。目前已知的p16/Ki-67检测的原理如下,p16可以将编码E6和E7的病毒基因整合到宿主基因组中,导致p16在向高级别宫颈病变转化的上皮细胞中的表达量增加[37];Ki-67表达存在于增殖活跃的细胞周期阶段(包括G1期、S期、G2M期)而在静息阶段G0期不表达,因此Ki-67高表达是细胞增殖活跃的标志[38]。已有多项研究证实p16/Ki-67检测具有多重临床意义。Ki-67和p16的表达水平与宫颈病变程度呈正相关,检测p16和Ki-67的蛋白表达水平,可用于区分短期内转化风险高或转化风险低的病灶[39];相较于传统的液基细胞学方法,p16和Ki-67的蛋白表达的联合检测可以提高CIN2+病变筛查的灵敏度[20];对于CIN2+病变筛查的特异性约为68%,高于细胞学筛查(38%)和高危HPV检测(22%)的特异性[40]。p16/Ki-67的实例说明,发展针对潜在分子标志物的宫颈癌分子诊断方法,开展宫颈癌的早期筛查、诊断、预后评估与转移预测等临床功能研究是分子标志物实现临床转化的必经阶段。而其他潜在宫颈癌分子标志物虽在实验室研究和初步临床研究中展示出一定的肿瘤指示功能,但由于临床研究尚不充分,暂未纳入临床应用范围,如血清SCC-Ag(鳞状细胞癌抗原),其术前水平可预测淋巴结转移的风险,术后水平的变化则可能与疾病复发和患者生存率相关[41, 42];部分细胞角蛋白(如CK7,CK17)的表达模式具有鉴别宫颈病变类型及进展趋势的潜力等[25]。
除了1.1部分内容中提及的具有一定潜力和已有应用的宫颈癌诊疗分子标志物,表2总结了近15年来已通过较完善的体内外细胞实验、动物实验和初步临床样品实验验证的宫颈癌相关的16个有待进一步临床验证的分子标志物,这些标志物的生物学功能及其在肿瘤发生发展过程中的作用机制已得到初步阐明,相关的临床意义也逐渐显现,在宫颈癌的早期诊断、疗效监测和预后评估等方面具有潜在应用价值。从参与的肿瘤调控机制来看,这16个基因呈现出明显的功能分化模式,促癌相关基因占主导,共14个基因(约占87.5%),包括APOC1、E2F8、FABP5、KLF5、HSPA2、ITGA3、LPCAT1、MYO1B、NRP1、PAK5、POU5F1B、SEPTIN9、SND1和STAT3;相比之下,仅有2个抑癌相关基因FSTL1和RHCG得到了较充分的实验验证。在功能分布上,这些基因展现出高度的功能域重叠性的特征。所有基因均参与"细胞黏附、侵袭与转移"的调控。12个基因(约占75%)被证实参与细胞增殖、凋亡及分化相关过程,仅ITGA3、NRP1、PAK5和SEPTIN9四个促癌相关基因目前缺乏直接证据。这一高度一致性表明细胞侵袭转移能力的获得是宫颈癌恶性进展的关键生物学特征。值得注意的是,ITGA3表现出血管生成相关的独特功能,而MYO1B、SEPTIN9与HPV感染相关的促癌作用有关。
本文的其它图/表
|