... 人工血液的研究进展[14-22] ...
人类对血液替代品的探索最早可以追溯到17世纪(
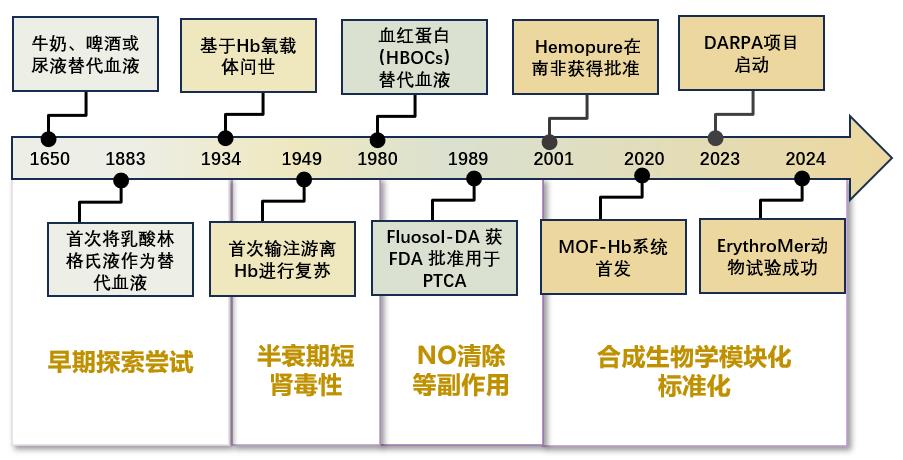
图1).1650年,英国科学家Christopher Wren尝试用尿液、羊血、牛奶、啤酒、生理盐水等体液或液体替代血液进行输注,但效果甚微[
23].1883年,乳酸林格氏液(铁盐和非生物物质)的出现,标志着人造血液研究的早期突破.随着Landsteiner对各种血型的研究,使输血成为安全可靠的医疗手段,人类对红细胞输氧功能的认知也逐步深化,从而正式开始研究血液的替代品[
24].1934年,首例血红蛋白基氧载体问世[
25],1949年,Amberson等人[
26]首次在产后出血患者中使用游离Hb进行输注.1980年,以Hb为原料制备的HBOCs成为热点.HBOCs能够运输氧气,并且不需要进行兼容性测试[
27].然而,HBOCs具有存活期短且易被清除的缺点,并伴随着肾毒性、高血压等副作用,因此绝大部分相关产品未能上市;尽管研究者通过聚合、包裹等策略改善其稳定性,但NO清除等副作用仍未完全解决.与此同时,另一类以全氟化碳(PFCs)为代表的氧载体因具备优异的物理溶氧能力与化学惰性而受到关注[
28].其中,全氟碳乳产品Fluosol-DA于1989年获得美国FDA批准,可作为临时氧载体用于经皮腔内冠状动脉成形术(PTCA)中辅助运载氧气,并被证实能发挥心肌保护作用[
29].但由于剂量限制、PFCs代谢缓慢等问题,相关研究后续推进缓慢; 随后,研究者将目光转向合成生物学领域,并迎来相关突破:2001年,Hemopure在南非获得批准上市[
30];到2020年MOF-Hb系统[
31]成功开发,通过金属有机有机框架封装Hb,有效提升了Hb的稳定性;再到2023年美国国防高级研究计划局的DARPA项目,启动旨在推动可输注氧载体的应用;以及2024年一种红细胞代用品ErythroMer在动物实验中成功验证其安全性和携氧性能.这些成果均展现合成生物学策略在解决血液短缺问题上的巨大潜力. ...
Artificial blood
1
2002
... 人类对血液替代品的探索最早可以追溯到17世纪(图1).1650年,英国科学家Christopher Wren尝试用尿液、羊血、牛奶、啤酒、生理盐水等体液或液体替代血液进行输注,但效果甚微[23].1883年,乳酸林格氏液(铁盐和非生物物质)的出现,标志着人造血液研究的早期突破.随着Landsteiner对各种血型的研究,使输血成为安全可靠的医疗手段,人类对红细胞输氧功能的认知也逐步深化,从而正式开始研究血液的替代品[24].1934年,首例血红蛋白基氧载体问世[25],1949年,Amberson等人[26]首次在产后出血患者中使用游离Hb进行输注.1980年,以Hb为原料制备的HBOCs成为热点.HBOCs能够运输氧气,并且不需要进行兼容性测试[27].然而,HBOCs具有存活期短且易被清除的缺点,并伴随着肾毒性、高血压等副作用,因此绝大部分相关产品未能上市;尽管研究者通过聚合、包裹等策略改善其稳定性,但NO清除等副作用仍未完全解决.与此同时,另一类以全氟化碳(PFCs)为代表的氧载体因具备优异的物理溶氧能力与化学惰性而受到关注[28].其中,全氟碳乳产品Fluosol-DA于1989年获得美国FDA批准,可作为临时氧载体用于经皮腔内冠状动脉成形术(PTCA)中辅助运载氧气,并被证实能发挥心肌保护作用[29].但由于剂量限制、PFCs代谢缓慢等问题,相关研究后续推进缓慢; 随后,研究者将目光转向合成生物学领域,并迎来相关突破:2001年,Hemopure在南非获得批准上市[30];到2020年MOF-Hb系统[31]成功开发,通过金属有机有机框架封装Hb,有效提升了Hb的稳定性;再到2023年美国国防高级研究计划局的DARPA项目,启动旨在推动可输注氧载体的应用;以及2024年一种红细胞代用品ErythroMer在动物实验中成功验证其安全性和携氧性能.这些成果均展现合成生物学策略在解决血液短缺问题上的巨大潜力. ...
Artificial Blood: A Futuristic Dimension of Modern Day Transfusion Sciences
1
2019
... 人类对血液替代品的探索最早可以追溯到17世纪(图1).1650年,英国科学家Christopher Wren尝试用尿液、羊血、牛奶、啤酒、生理盐水等体液或液体替代血液进行输注,但效果甚微[23].1883年,乳酸林格氏液(铁盐和非生物物质)的出现,标志着人造血液研究的早期突破.随着Landsteiner对各种血型的研究,使输血成为安全可靠的医疗手段,人类对红细胞输氧功能的认知也逐步深化,从而正式开始研究血液的替代品[24].1934年,首例血红蛋白基氧载体问世[25],1949年,Amberson等人[26]首次在产后出血患者中使用游离Hb进行输注.1980年,以Hb为原料制备的HBOCs成为热点.HBOCs能够运输氧气,并且不需要进行兼容性测试[27].然而,HBOCs具有存活期短且易被清除的缺点,并伴随着肾毒性、高血压等副作用,因此绝大部分相关产品未能上市;尽管研究者通过聚合、包裹等策略改善其稳定性,但NO清除等副作用仍未完全解决.与此同时,另一类以全氟化碳(PFCs)为代表的氧载体因具备优异的物理溶氧能力与化学惰性而受到关注[28].其中,全氟碳乳产品Fluosol-DA于1989年获得美国FDA批准,可作为临时氧载体用于经皮腔内冠状动脉成形术(PTCA)中辅助运载氧气,并被证实能发挥心肌保护作用[29].但由于剂量限制、PFCs代谢缓慢等问题,相关研究后续推进缓慢; 随后,研究者将目光转向合成生物学领域,并迎来相关突破:2001年,Hemopure在南非获得批准上市[30];到2020年MOF-Hb系统[31]成功开发,通过金属有机有机框架封装Hb,有效提升了Hb的稳定性;再到2023年美国国防高级研究计划局的DARPA项目,启动旨在推动可输注氧载体的应用;以及2024年一种红细胞代用品ErythroMer在动物实验中成功验证其安全性和携氧性能.这些成果均展现合成生物学策略在解决血液短缺问题上的巨大潜力. ...
Blood substitutes: Basic science, translational studies and clinical trials
1
2022
... 人类对血液替代品的探索最早可以追溯到17世纪(图1).1650年,英国科学家Christopher Wren尝试用尿液、羊血、牛奶、啤酒、生理盐水等体液或液体替代血液进行输注,但效果甚微[23].1883年,乳酸林格氏液(铁盐和非生物物质)的出现,标志着人造血液研究的早期突破.随着Landsteiner对各种血型的研究,使输血成为安全可靠的医疗手段,人类对红细胞输氧功能的认知也逐步深化,从而正式开始研究血液的替代品[24].1934年,首例血红蛋白基氧载体问世[25],1949年,Amberson等人[26]首次在产后出血患者中使用游离Hb进行输注.1980年,以Hb为原料制备的HBOCs成为热点.HBOCs能够运输氧气,并且不需要进行兼容性测试[27].然而,HBOCs具有存活期短且易被清除的缺点,并伴随着肾毒性、高血压等副作用,因此绝大部分相关产品未能上市;尽管研究者通过聚合、包裹等策略改善其稳定性,但NO清除等副作用仍未完全解决.与此同时,另一类以全氟化碳(PFCs)为代表的氧载体因具备优异的物理溶氧能力与化学惰性而受到关注[28].其中,全氟碳乳产品Fluosol-DA于1989年获得美国FDA批准,可作为临时氧载体用于经皮腔内冠状动脉成形术(PTCA)中辅助运载氧气,并被证实能发挥心肌保护作用[29].但由于剂量限制、PFCs代谢缓慢等问题,相关研究后续推进缓慢; 随后,研究者将目光转向合成生物学领域,并迎来相关突破:2001年,Hemopure在南非获得批准上市[30];到2020年MOF-Hb系统[31]成功开发,通过金属有机有机框架封装Hb,有效提升了Hb的稳定性;再到2023年美国国防高级研究计划局的DARPA项目,启动旨在推动可输注氧载体的应用;以及2024年一种红细胞代用品ErythroMer在动物实验中成功验证其安全性和携氧性能.这些成果均展现合成生物学策略在解决血液短缺问题上的巨大潜力. ...
Clinical experience with hemoglobin-saline solutions
1
1949
... 人类对血液替代品的探索最早可以追溯到17世纪(图1).1650年,英国科学家Christopher Wren尝试用尿液、羊血、牛奶、啤酒、生理盐水等体液或液体替代血液进行输注,但效果甚微[23].1883年,乳酸林格氏液(铁盐和非生物物质)的出现,标志着人造血液研究的早期突破.随着Landsteiner对各种血型的研究,使输血成为安全可靠的医疗手段,人类对红细胞输氧功能的认知也逐步深化,从而正式开始研究血液的替代品[24].1934年,首例血红蛋白基氧载体问世[25],1949年,Amberson等人[26]首次在产后出血患者中使用游离Hb进行输注.1980年,以Hb为原料制备的HBOCs成为热点.HBOCs能够运输氧气,并且不需要进行兼容性测试[27].然而,HBOCs具有存活期短且易被清除的缺点,并伴随着肾毒性、高血压等副作用,因此绝大部分相关产品未能上市;尽管研究者通过聚合、包裹等策略改善其稳定性,但NO清除等副作用仍未完全解决.与此同时,另一类以全氟化碳(PFCs)为代表的氧载体因具备优异的物理溶氧能力与化学惰性而受到关注[28].其中,全氟碳乳产品Fluosol-DA于1989年获得美国FDA批准,可作为临时氧载体用于经皮腔内冠状动脉成形术(PTCA)中辅助运载氧气,并被证实能发挥心肌保护作用[29].但由于剂量限制、PFCs代谢缓慢等问题,相关研究后续推进缓慢; 随后,研究者将目光转向合成生物学领域,并迎来相关突破:2001年,Hemopure在南非获得批准上市[30];到2020年MOF-Hb系统[31]成功开发,通过金属有机有机框架封装Hb,有效提升了Hb的稳定性;再到2023年美国国防高级研究计划局的DARPA项目,启动旨在推动可输注氧载体的应用;以及2024年一种红细胞代用品ErythroMer在动物实验中成功验证其安全性和携氧性能.这些成果均展现合成生物学策略在解决血液短缺问题上的巨大潜力. ...
Artificial blood: the history and current perspectives of blood substitutes
1
2020
... 人类对血液替代品的探索最早可以追溯到17世纪(图1).1650年,英国科学家Christopher Wren尝试用尿液、羊血、牛奶、啤酒、生理盐水等体液或液体替代血液进行输注,但效果甚微[23].1883年,乳酸林格氏液(铁盐和非生物物质)的出现,标志着人造血液研究的早期突破.随着Landsteiner对各种血型的研究,使输血成为安全可靠的医疗手段,人类对红细胞输氧功能的认知也逐步深化,从而正式开始研究血液的替代品[24].1934年,首例血红蛋白基氧载体问世[25],1949年,Amberson等人[26]首次在产后出血患者中使用游离Hb进行输注.1980年,以Hb为原料制备的HBOCs成为热点.HBOCs能够运输氧气,并且不需要进行兼容性测试[27].然而,HBOCs具有存活期短且易被清除的缺点,并伴随着肾毒性、高血压等副作用,因此绝大部分相关产品未能上市;尽管研究者通过聚合、包裹等策略改善其稳定性,但NO清除等副作用仍未完全解决.与此同时,另一类以全氟化碳(PFCs)为代表的氧载体因具备优异的物理溶氧能力与化学惰性而受到关注[28].其中,全氟碳乳产品Fluosol-DA于1989年获得美国FDA批准,可作为临时氧载体用于经皮腔内冠状动脉成形术(PTCA)中辅助运载氧气,并被证实能发挥心肌保护作用[29].但由于剂量限制、PFCs代谢缓慢等问题,相关研究后续推进缓慢; 随后,研究者将目光转向合成生物学领域,并迎来相关突破:2001年,Hemopure在南非获得批准上市[30];到2020年MOF-Hb系统[31]成功开发,通过金属有机有机框架封装Hb,有效提升了Hb的稳定性;再到2023年美国国防高级研究计划局的DARPA项目,启动旨在推动可输注氧载体的应用;以及2024年一种红细胞代用品ErythroMer在动物实验中成功验证其安全性和携氧性能.这些成果均展现合成生物学策略在解决血液短缺问题上的巨大潜力. ...
Bio-inspired nanomedicine strategies for artificial blood components
1
2017
... 人类对血液替代品的探索最早可以追溯到17世纪(图1).1650年,英国科学家Christopher Wren尝试用尿液、羊血、牛奶、啤酒、生理盐水等体液或液体替代血液进行输注,但效果甚微[23].1883年,乳酸林格氏液(铁盐和非生物物质)的出现,标志着人造血液研究的早期突破.随着Landsteiner对各种血型的研究,使输血成为安全可靠的医疗手段,人类对红细胞输氧功能的认知也逐步深化,从而正式开始研究血液的替代品[24].1934年,首例血红蛋白基氧载体问世[25],1949年,Amberson等人[26]首次在产后出血患者中使用游离Hb进行输注.1980年,以Hb为原料制备的HBOCs成为热点.HBOCs能够运输氧气,并且不需要进行兼容性测试[27].然而,HBOCs具有存活期短且易被清除的缺点,并伴随着肾毒性、高血压等副作用,因此绝大部分相关产品未能上市;尽管研究者通过聚合、包裹等策略改善其稳定性,但NO清除等副作用仍未完全解决.与此同时,另一类以全氟化碳(PFCs)为代表的氧载体因具备优异的物理溶氧能力与化学惰性而受到关注[28].其中,全氟碳乳产品Fluosol-DA于1989年获得美国FDA批准,可作为临时氧载体用于经皮腔内冠状动脉成形术(PTCA)中辅助运载氧气,并被证实能发挥心肌保护作用[29].但由于剂量限制、PFCs代谢缓慢等问题,相关研究后续推进缓慢; 随后,研究者将目光转向合成生物学领域,并迎来相关突破:2001年,Hemopure在南非获得批准上市[30];到2020年MOF-Hb系统[31]成功开发,通过金属有机有机框架封装Hb,有效提升了Hb的稳定性;再到2023年美国国防高级研究计划局的DARPA项目,启动旨在推动可输注氧载体的应用;以及2024年一种红细胞代用品ErythroMer在动物实验中成功验证其安全性和携氧性能.这些成果均展现合成生物学策略在解决血液短缺问题上的巨大潜力. ...
Fluosol?: The first commercial injectable perfluorocarbon oxygen carrier
1
2006
... 人类对血液替代品的探索最早可以追溯到17世纪(图1).1650年,英国科学家Christopher Wren尝试用尿液、羊血、牛奶、啤酒、生理盐水等体液或液体替代血液进行输注,但效果甚微[23].1883年,乳酸林格氏液(铁盐和非生物物质)的出现,标志着人造血液研究的早期突破.随着Landsteiner对各种血型的研究,使输血成为安全可靠的医疗手段,人类对红细胞输氧功能的认知也逐步深化,从而正式开始研究血液的替代品[24].1934年,首例血红蛋白基氧载体问世[25],1949年,Amberson等人[26]首次在产后出血患者中使用游离Hb进行输注.1980年,以Hb为原料制备的HBOCs成为热点.HBOCs能够运输氧气,并且不需要进行兼容性测试[27].然而,HBOCs具有存活期短且易被清除的缺点,并伴随着肾毒性、高血压等副作用,因此绝大部分相关产品未能上市;尽管研究者通过聚合、包裹等策略改善其稳定性,但NO清除等副作用仍未完全解决.与此同时,另一类以全氟化碳(PFCs)为代表的氧载体因具备优异的物理溶氧能力与化学惰性而受到关注[28].其中,全氟碳乳产品Fluosol-DA于1989年获得美国FDA批准,可作为临时氧载体用于经皮腔内冠状动脉成形术(PTCA)中辅助运载氧气,并被证实能发挥心肌保护作用[29].但由于剂量限制、PFCs代谢缓慢等问题,相关研究后续推进缓慢; 随后,研究者将目光转向合成生物学领域,并迎来相关突破:2001年,Hemopure在南非获得批准上市[30];到2020年MOF-Hb系统[31]成功开发,通过金属有机有机框架封装Hb,有效提升了Hb的稳定性;再到2023年美国国防高级研究计划局的DARPA项目,启动旨在推动可输注氧载体的应用;以及2024年一种红细胞代用品ErythroMer在动物实验中成功验证其安全性和携氧性能.这些成果均展现合成生物学策略在解决血液短缺问题上的巨大潜力. ...
Hemoglobin-based Oxygen Carriers: Current State-of-the-art and Novel Molecules
1
2019
... 人类对血液替代品的探索最早可以追溯到17世纪(图1).1650年,英国科学家Christopher Wren尝试用尿液、羊血、牛奶、啤酒、生理盐水等体液或液体替代血液进行输注,但效果甚微[23].1883年,乳酸林格氏液(铁盐和非生物物质)的出现,标志着人造血液研究的早期突破.随着Landsteiner对各种血型的研究,使输血成为安全可靠的医疗手段,人类对红细胞输氧功能的认知也逐步深化,从而正式开始研究血液的替代品[24].1934年,首例血红蛋白基氧载体问世[25],1949年,Amberson等人[26]首次在产后出血患者中使用游离Hb进行输注.1980年,以Hb为原料制备的HBOCs成为热点.HBOCs能够运输氧气,并且不需要进行兼容性测试[27].然而,HBOCs具有存活期短且易被清除的缺点,并伴随着肾毒性、高血压等副作用,因此绝大部分相关产品未能上市;尽管研究者通过聚合、包裹等策略改善其稳定性,但NO清除等副作用仍未完全解决.与此同时,另一类以全氟化碳(PFCs)为代表的氧载体因具备优异的物理溶氧能力与化学惰性而受到关注[28].其中,全氟碳乳产品Fluosol-DA于1989年获得美国FDA批准,可作为临时氧载体用于经皮腔内冠状动脉成形术(PTCA)中辅助运载氧气,并被证实能发挥心肌保护作用[29].但由于剂量限制、PFCs代谢缓慢等问题,相关研究后续推进缓慢; 随后,研究者将目光转向合成生物学领域,并迎来相关突破:2001年,Hemopure在南非获得批准上市[30];到2020年MOF-Hb系统[31]成功开发,通过金属有机有机框架封装Hb,有效提升了Hb的稳定性;再到2023年美国国防高级研究计划局的DARPA项目,启动旨在推动可输注氧载体的应用;以及2024年一种红细胞代用品ErythroMer在动物实验中成功验证其安全性和携氧性能.这些成果均展现合成生物学策略在解决血液短缺问题上的巨大潜力. ...
Haemoglobin-loaded metal organic framework-based nanoparticles camouflaged with a red blood cell membrane as potential oxygen delivery systems
2
2020
... 人类对血液替代品的探索最早可以追溯到17世纪(图1).1650年,英国科学家Christopher Wren尝试用尿液、羊血、牛奶、啤酒、生理盐水等体液或液体替代血液进行输注,但效果甚微[23].1883年,乳酸林格氏液(铁盐和非生物物质)的出现,标志着人造血液研究的早期突破.随着Landsteiner对各种血型的研究,使输血成为安全可靠的医疗手段,人类对红细胞输氧功能的认知也逐步深化,从而正式开始研究血液的替代品[24].1934年,首例血红蛋白基氧载体问世[25],1949年,Amberson等人[26]首次在产后出血患者中使用游离Hb进行输注.1980年,以Hb为原料制备的HBOCs成为热点.HBOCs能够运输氧气,并且不需要进行兼容性测试[27].然而,HBOCs具有存活期短且易被清除的缺点,并伴随着肾毒性、高血压等副作用,因此绝大部分相关产品未能上市;尽管研究者通过聚合、包裹等策略改善其稳定性,但NO清除等副作用仍未完全解决.与此同时,另一类以全氟化碳(PFCs)为代表的氧载体因具备优异的物理溶氧能力与化学惰性而受到关注[28].其中,全氟碳乳产品Fluosol-DA于1989年获得美国FDA批准,可作为临时氧载体用于经皮腔内冠状动脉成形术(PTCA)中辅助运载氧气,并被证实能发挥心肌保护作用[29].但由于剂量限制、PFCs代谢缓慢等问题,相关研究后续推进缓慢; 随后,研究者将目光转向合成生物学领域,并迎来相关突破:2001年,Hemopure在南非获得批准上市[30];到2020年MOF-Hb系统[31]成功开发,通过金属有机有机框架封装Hb,有效提升了Hb的稳定性;再到2023年美国国防高级研究计划局的DARPA项目,启动旨在推动可输注氧载体的应用;以及2024年一种红细胞代用品ErythroMer在动物实验中成功验证其安全性和携氧性能.这些成果均展现合成生物学策略在解决血液短缺问题上的巨大潜力. ...
本文的其它图/表