|
||
|
合成生物学在干细胞早期胚胎发育模型中的应用
合成生物学
2025, 6 (3):
669-684.
DOI:10.12211/2096-8280.2025-013
早期胚胎发育过程中如何从单细胞合子逐步形成复杂组织与器官,是发育生物学长期关注的核心问题。然而,哺乳动物尤其是人类胚胎着床后的发育因技术和伦理限制而难以直接观测,导致对关键时空调控机制的认识仍然不足。近年来,多能性干细胞衍生的类胚胎和类器官模型迅速发展,为体外模拟早期胚胎发育和器官发生提供了新途径。与此同时,合成生物学借助工程化思维与可编程基因线路,为精确调控细胞分化、信号传递及细胞命运模式化提供了前所未有的技术支持。本文探讨基于干细胞的类胚胎和类器官模型如何融合合成生物学与定量生物学方法,从自下而上的“建物致知”角度探讨关键发育事件的机制。并针对目前模型与真实胚胎及器官在形态与功能层面的差距,探讨建立标准化评价体系及发展精准细胞行为调控策略的必要性,最后展望了合成发育生物学在干细胞类胚胎与类器官模型中潜在的应用前景。 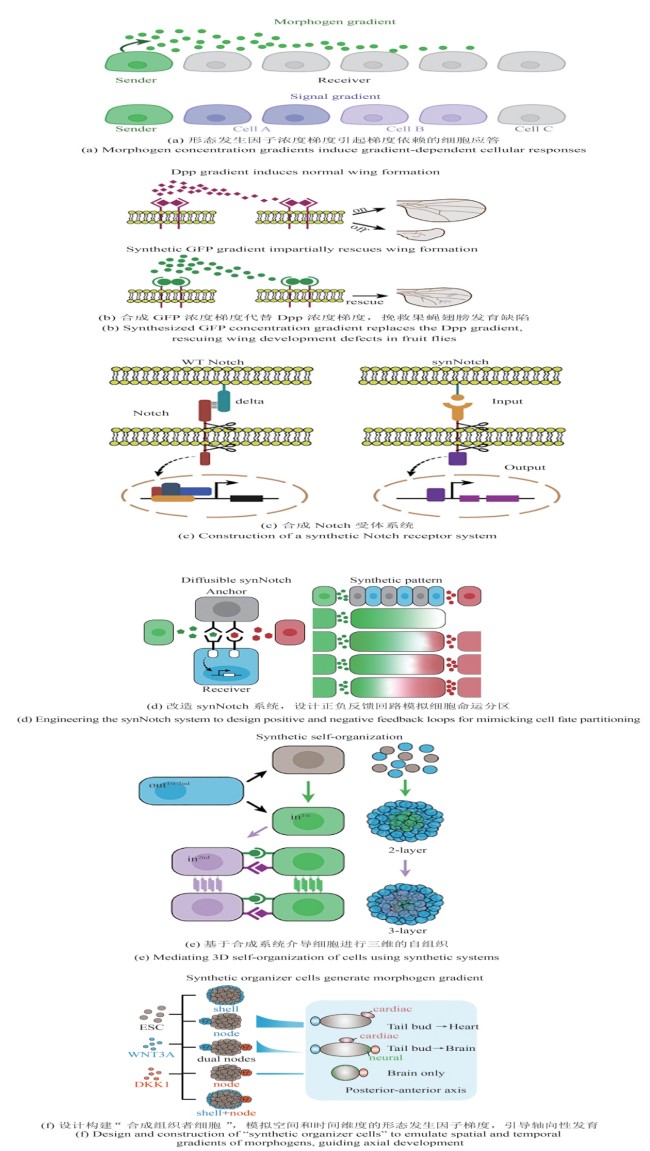 View image in article
图2
合成信号分子浓度梯度控制生物细胞图式及三维结构
正文中引用本图/表的段落
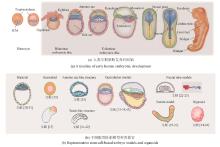
胚胎发育始于受精卵与卵裂,随后分化为滋养外胚层(trophectoderm,TE)和内细胞团(inner cell mass,ICM)。其中,内细胞团进一步分化为上胚层(epiblast)和原始内胚层(primitive endoderm,又称下胚层hypoblast)。上胚层将发育成所有成体细胞类型,而滋养外胚层和下胚层分别贡献于胎盘和卵黄囊的形成。在胚胎植入后,上胚层后部形成原条(primitive streak),上胚层细胞通过原条迁移,形成中胚层(mesoderm)和定型内胚层(definitive endoderm),而留在上胚层的细胞最终发育为外胚层(ectoderm)[图1(a)]。这一过程被称为原肠运动(gastrulation),是细胞命运决定和形态发生的关键步骤。然而,由于技术和伦理限制,对这一发育关键时期的研究长期受阻,导致相关认知仍较为有限。为突破这一瓶颈,研究人员尝试在体外构建可控、可观察的简化模型,以模拟早期胚胎发育过程。经过近几十年的发展,科学家建立了具有不同发育潜能的PSC,包括原始态(na?ve)、中间态/形成态(intermediate/formative)和始发态(primed),这些干细胞在可控培养环境下能够模拟胚胎发育,为研究早期细胞命运决定机制提供了重要工具[8-10]。早期研究发现,由数百个ESC形成的聚集体(即胚状体,embryoid bodies),虽然能分化出多种胚胎组织,但整体结构与自然胚胎仍有较大差异[11-12]。Warmflash等[13]在直径约700 μm的碟形微图案区域上培养人类胚胎干细胞(hESC),并通过BMP4信号诱导生成类似人类原肠胚胚盘(embryonic disc)的细胞命运图式(cell fate patterning),揭示了多能性干细胞在二维(2D)培养环境下的自组装能力,这一模型被称为二维类原肠胚(2D-gastruloid)。与此同时,Martinez Arias课题组的一系列研究表明,在三维(3D)培养条件下,多能性干细胞团经Wnt信号激活后可打破对称性(symmetry breaking),形成轴向极性(axial polarity)[14-18]。基于这些研究,科学家们进一步构建了模拟体节(somite)发育的部分胚胎模型(partial embryo model)[19-21]。这些模型分别用于轴向延长(axial elongation)、体节发生(somitogenesis)和分节时钟(segmentation clock)的研究。此外,基于芯片和微流控技术的神经管(neural tube)模型也成功再现了早期神经发育的关键过程,使研究人员能够在受控环境中探索神经模式化(neural patterning)、神经管形态发生及谱系特化(lineage specification)[22-23]。上述类原肠胚及部分胚胎模型中因不包含滋养外胚层和下胚层等胚胎外细胞类型,因而无法模拟上胚层与胚外组织的相互作用。来自Fu实验室的系列工作表明,在微流控系统中,人胚胎干细胞在BMP4信号作用下可产生类似人的羊膜腔结构,该结构可用于研究羊膜细胞在上胚层分化过程中的作用[24-26]。此外,Rivron等[27]通过将小鼠的滋养层细胞干细胞(trophoblast stem cell)与胚胎干细胞进行共培养得到类似小鼠囊胚的结构,称之为类囊胚(blastoid)。随后的工作证实,通过人类原始态干细胞自组装可以得到人的类囊胚结构[28-31]。近两年来,人的类胚胎模型成功重现了围植入期(peri-implantation)的形态发生过程,整合了胚胎和胚胎外细胞类型(extra-embryonic cell type),包括上胚层和下胚层[32-35]。在某些情况下,这些模型还包含滋养层和胚外中胚层(extra-embryonic mesoderm,ExM)[36-38]。通过引入滋养层、下胚层和胚外中胚层,类胚胎进一步揭示了细胞分化、细胞间相互作用,组织形成和形态发生的关键分子机制。尤其在胚盘形成、对称性破缺、发育轴建立和原始造血(primitive hematopoiesis)方面。这些创新模型为未来解析人类胚胎发育的基本机制提供了全新的工具,相关内容可参考已有的中文综述文章[39-40]。此外,由干细胞或祖细胞在三维培养系统中自组织形成的类器官(organoid),现已模拟出多种类似自然器官的结构[图1(b)]。因篇幅有限,本文重点介绍类胚胎模型,关于类器官的详细综述请参看文献[44,47-53]。
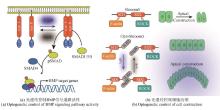
在胚胎发育过程中,单个细胞如何感知其所处环境的变化并随之而进行命运决定仍然是有待解答的问题。经典发育生物学理论认为胚胎发育过程中通过形态发生因子(morphogen)浓度梯度来建立空间位置信息,控制体轴极性产生和细胞命运分化[图2(a)]。然而,不同的信号通路其形态发生因子的浓度梯度建立,处于其中的细胞如何响应形态发生因子浓度变化而产生不同分化结果,是否有辅助因子参与,是否存在反馈回路等机制性问题需要深入研究[54-58]。借助合成生物学方法探索形态发生因子的有效浓度及梯度形成机制已成为合成发育生物学的一个重要研究方向。Stapornwongkul等[59]通过巧妙的工程化设计,利用绿色荧光蛋白(GFP)在果蝇翅膀原基中模拟了天然的Dpp(Decapentaplegic)浓度梯度。他们将GFP当作合成的形态发生因子,并将果蝇Dpp受体的胞外段与抗GFP纳米抗体相融合,构建了能响应GFP的受体。研究者通过调控细胞膜上锚定的GFP纳米抗体数量,使GFP在组织中形成可检测的扩散梯度,进而诱导内源性Dpp信号通路的激活。这样不仅可以在Dpp缺失的情况下补偿翅膀发育缺陷,也为探究Dpp信号梯度的形成与响应提供了可控模型[图2(b)]。另一种合成信号的实现方式是针对内源性通路的不同组分,进行按需替换或重组,构建一个“正交”(orthogonal)的输入-输出系统,最大限度避免对内源性信号干扰,从而聚焦研究特定通路[图2(c)]。例如,在发育过程中,Notch信号通路对于细胞命运决策至关重要:邻近细胞表面表达的配体与Notch受体结合后,引发胞内转录调控因子的剪切与释放,最终指导细胞行为[60]。基于这一原理,Morsut等[61]构建了合成Notch受体(synthetic Notch,synNotch)。受体胞外段用特异性识别GFP分子或短肽段的纳米抗体替代了原本Delta或Jagged等配体的识别结构,而受体胞内段则保留Notch关键调控域,同时引入目标转录调控因子。以GFP作为信号分子时,若相邻细胞表面锚定有GFP,含抗GFP抗体的synNotch受体就能特异识别该GFP并发生受体激活,随后释放胞内转录调控因子进入细胞核,以调控下游靶基因。利用synNotch系统,Toda等[62]通过将GFP与mCherry等蛋白改造为合成形态发生因子,配合GFP或mCherry锚定蛋白与synNotch受体,实现了可在多细胞环境中形成浓度梯度并激活基因表达的全新信号系统[图2(d)]。研究者通过调节锚定蛋白密度、加入抑制子及设计正负反馈回路,成功构建出多种空间图案,包括分段式的多域结构和快速达到稳态的分化模式。研究结果显示,这些完全外源的形态发生素无需干扰内源信号,即可精准调控细胞命运分区与图案化。上述研究提示,借助合成生物学手段可以在类胚胎或类器官模型中对发育通路元件进行改造,进而剖析这些通路在发育过程中的具体功能。这种策略为精准研究信号分子在形态发生过程中的作用提供了更灵活可控的实验工具。
synNotch也被应用于探索三维细胞自组装。Toda等将synNotch信号体系拓展到了三维培养环境,利用该受体回路控制经过改造的细胞表达不同强度的钙黏蛋白。根据“差异黏附假说”[63],细胞黏附能力的差异会使细胞在空间上彼此分层,从而自发形成不同类型的多细胞结构。实验结果显示,具有更高黏附力的细胞最终分布在球体结构的内层,其他细胞则分布于中层和外层,形成2~3层球体[图2(e)]。研究者进一步结合不同种类的钙黏蛋白,构建出了带有不对称特征的多细胞结构,实现了空间模式的形成与对称性破缺[64]。该研究中产生的细胞三维组织完成了空间图式形成以及对称性破缺的自组织行为,展示了定制化组织图式的潜力。在此基础上,Yamada等[65]利用合成细胞黏附分子(synthetic cell adhesion molecule,synCAM)构建了可自我组装的“合成组织者细胞”(synthetic organizer cell),为干细胞提供具有空间和时间分辨度的形态发生因子梯度,进而精准引导早期胚胎发育过程[图2(f)]。作者利用工程化手段改造L929成纤维细胞,使其能围绕小鼠胚胎干细胞形成指定的外形结构(如“壳”或“节点”),并在合适时机表达WNT3A、DKK1等关键信号分子,从而在人造三维体系中重现胚胎发育中“前-后”轴的建立、心肌等重要组织的形成。该研究不仅通过细胞黏附分子及诱导自杀开关等回路实现对组织者细胞的组装和信号释放的双重精准控制,还将活细胞作为“动态信号源”以克服传统因子添加方法的局限性。
本文的其它图/表
|