|
||
|
合成生物学在干细胞早期胚胎发育模型中的应用
合成生物学
2025, 6 (3):
669-684.
DOI:10.12211/2096-8280.2025-013
早期胚胎发育过程中如何从单细胞合子逐步形成复杂组织与器官,是发育生物学长期关注的核心问题。然而,哺乳动物尤其是人类胚胎着床后的发育因技术和伦理限制而难以直接观测,导致对关键时空调控机制的认识仍然不足。近年来,多能性干细胞衍生的类胚胎和类器官模型迅速发展,为体外模拟早期胚胎发育和器官发生提供了新途径。与此同时,合成生物学借助工程化思维与可编程基因线路,为精确调控细胞分化、信号传递及细胞命运模式化提供了前所未有的技术支持。本文探讨基于干细胞的类胚胎和类器官模型如何融合合成生物学与定量生物学方法,从自下而上的“建物致知”角度探讨关键发育事件的机制。并针对目前模型与真实胚胎及器官在形态与功能层面的差距,探讨建立标准化评价体系及发展精准细胞行为调控策略的必要性,最后展望了合成发育生物学在干细胞类胚胎与类器官模型中潜在的应用前景。 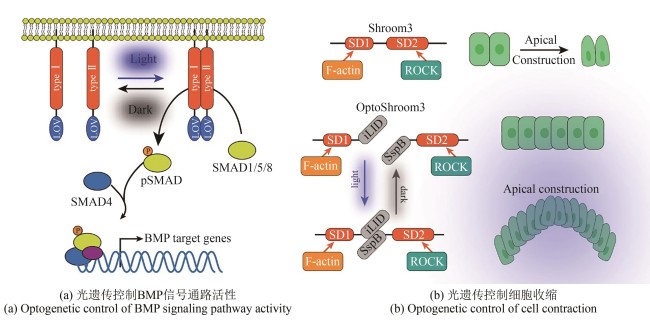 View image in article
图3
光遗传工具在发育生物学中的应用
(通过光-氧-电压感应结构域介导的二聚化调控细胞内酪氨酸激酶活性,进而引发SMAD1/5的磷酸化,并促使其进入细胞核以启动BMP下游基因的表达。光遗传激活的Shroom3通过在顶端连接处招募ROCK,驱动细胞顶端收缩)
正文中引用本图/表的段落
光遗传学(optogenetics)是一种结合光学与遗传学的前沿技术,近年来广泛用于发育生物学研究。其核心原理是利用光敏蛋白精准调控细胞内信号,可结合成像技术实时研究细胞行为和基因调控,能够以高时空分辨率进行控制,使其成为探索发育信号通路的强大工具[80-81]。BMP是发育过程中的关键信号分子。然而,传统外源添加BMP蛋白或小分子的方法无法精准模拟其动态激活模式。鉴于BMP信号依赖Ⅰ型和Ⅱ型受体的四聚化驱动下游SMAD蛋白磷酸化[82-83],研究人员设计了OptoBMP受体系统[图3(a)]。该系统锚定BMP受体胞内激酶结构域于细胞膜,并在其C端融合藻类光敏蛋白LOV。蓝光刺激诱导LOV二聚化,使Ⅰ型和Ⅱ型受体接近,从而精准启动BMP信号通路[84]。
为探究胚胎形态发生机制,研究人员开发了体外重建形态发生行为的方法。在后生动物发育中,顶端收缩(apical constriction)是形成弯曲结构的核心机制[85-86]。顶端收缩的发生由肌动蛋白收缩驱动,通常由顶侧的Rho-ROCK信号通路引起,发生于胚胎发育的特定阶段和区域。体外重构弯曲形态的组织要求对细胞的收缩有很强的时空控制性。光遗传技术恰是一种能在分子乃至多细胞水平上实现精确时空控制的强大方法[87-90]。诱导具有复杂组织结构的形态发生过程具有较大技术挑战,为克服技术难点,研究人员开发了新的光遗传学工具OptoShroom3。其设计基于光敏蛋白iLID与其结合蛋白SspB,Shroom3包含两个结构域:F-Actin结合域SD1(Shroom domain 1)和ROCK结合域SD2(Shroom domain 2)。N端结构域SD1与iLID融合,C端结构域SD2与SspB融合,这种类似剪切体的形式构成OptoShroom3。在蓝光刺激下iLID发生构象改变从而与SspB结合,激活OptoShroom3引起顶端收缩[91]。该研究表明,诱导顶面收缩的时空控制可以根据初始组织背景触发多种类型的3D组织形变,为研究细胞形态和组织发育提供了新的工具[图3(b)]。
本文的其它图/表
|