|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
中性核心母乳寡糖生物合成的研究进展和发展趋势
合成生物学
2025, 6 (5):
1126-1144.
DOI:10.12211/2096-8280.2025-083
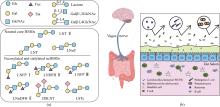
母乳寡糖(human milk oligosaccharide,HMO)是母乳中重要的功能和营养成分。其中,中性核心母乳寡糖(neutral core human milk oligosaccharide,ncHMO)主要包括乳糖-N-三糖(LNT Ⅱ)、乳糖-N-新四糖(LNnT)和乳糖-N-四糖(LNT),在婴幼儿健康发育过程中发挥着不可替代的生理作用。近年来,中性核心母乳寡糖的生物合成技术快速发展,其工业化生产从可能走向现实。本文综述了中性核心母乳寡糖的酶法和微生物细胞法合成研究现状,介绍了糖基转移酶和糖苷酶在酶法合成中性核心母乳寡糖的应用,讨论了糖基转移酶的催化特性、底盘细胞的种类及改造等关键因素对微生物细胞法合成中性核心母乳寡糖产量的影响,进一步对比了两种方法生物合成中性核心母乳寡糖的优缺点。目前,中性核心母乳寡糖的生物合成存在酶催化效率低、底盘细胞选择与适配性差、副产物多及内毒素污染等问题,需通过理性设计酶元件、优化安全底盘、动态调控代谢网络及强化发酵纯化工艺等策略协同攻关,有望实现母乳寡糖的低成本、高效绿色生产,为开发更具营养价值的婴幼儿健康食品提供核心支撑。
表3
β-1,4-半乳糖基转移酶和β-半乳糖苷酶合成LNnT汇总
正文中引用本图/表的段落
酶法合成LNnT主要利用β-1,4-半乳糖基转移酶(β-1,4-galactosyltransferase,β-1,4-GalT,EC 2.4.1.22)和β-半乳糖苷酶(β-galactosidase,EC 3.2.1.23)。β-1,4-GalT能够催化UDP-半乳糖(UDP-galactose,UDP-Gal)的半乳糖基转移至LNT Ⅱ,形成LNnT。Wakarchuk等[54]首次表征了脑膜炎奈瑟氏菌(Neisseria meningitidis)的Nm-LgtB蛋白功能,证实其能够严格识别β-GlcNAc并作为一种β-1,4-半乳糖转移酶催化LNnT合成。酶法合成过程中,不同β-1,4-GalT催化合成LNnT的转化率不同(表3)。
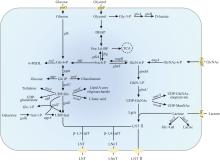
由于大肠杆菌缺乏β-1,3-N-乙酰氨基葡萄糖基转移酶,需将其引入才能利用外源添加的乳糖或N-乙酰氨基葡萄糖和内源合成的UDP-N-乙酰氨基葡萄糖(UDP-GlcNAc)合成LNT Ⅱ(图2)。内源UDP-GlcNAc合成通路包含glmM、glmU以及glmS等关键基因,Zhu等[76]利用不同拷贝数质粒微调UDP-GlcNAc合成通路表达强度,并定点突变了glmS以解除前体物GlcN-6-P的反馈抑制,敲除竞争路径中wecB和nagB后,5 L发酵罐中LNT Ⅱ产量高达46.2 g/L。乳糖作为合成LNT Ⅱ的直接底物,不同大肠杆菌菌株利用其效果不同。与大肠杆菌BL21(DE3)相比,大肠杆菌JM109需过表达lacY以提高乳糖渗透率[77]。此外,还需敲除lacZ防止乳糖降解[77]。Hu等[78]利用几丁质降解产物GlcNAc为底物,敲除lacZ和nanE阻断副反应途径减少底物浪费,过表达nagA、glmM和glmU以增强前体UDP-GlcNAc的供应,通过基因表达优化,3 L发酵罐中LNT Ⅱ产量为15.8 g/L,为利用生物质原料合成HMO提供了新思路。Sugita等[79]过表达大肠杆菌内源转运体基因setA显著提高了LNT Ⅱ产量,但SetA转运LNT Ⅱ具体转运机制尚不清晰。除了改造传统大肠杆菌,还可以改造益生菌大肠杆菌Nissle 1917合成LNT Ⅱ[80]。最近,Li等[81]首先确定了脑膜炎奈瑟氏菌MC58来源的LgtA具有合成LNT Ⅱ优势,基于高通量筛选平台确定高效突变体R13H/L24M/R205C,并在其C端融合InfB促融标签减少了包涵体形成,最后通过RBS工程和优化关键限速酶表达提高了LNT Ⅱ合成水平,在5 L发酵罐中产量达57.44 g/L,为目前报道最高水平。Wang等[82]采用两步法全细胞催化策略,开发了大肠杆菌-酵母耦合系统,以GlcNAc和乳糖为底物在5 L发酵罐中合成了52.34 g/L LNT Ⅱ,乳糖转化率达95.95%。
本文的其它图/表
|