|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
中性核心母乳寡糖生物合成的研究进展和发展趋势
合成生物学
2025, 6 (5):
1126-1144.
DOI:10.12211/2096-8280.2025-083
母乳寡糖(human milk oligosaccharide,HMO)是母乳中重要的功能和营养成分。其中,中性核心母乳寡糖(neutral core human milk oligosaccharide,ncHMO)主要包括乳糖-N-三糖(LNT Ⅱ)、乳糖-N-新四糖(LNnT)和乳糖-N-四糖(LNT),在婴幼儿健康发育过程中发挥着不可替代的生理作用。近年来,中性核心母乳寡糖的生物合成技术快速发展,其工业化生产从可能走向现实。本文综述了中性核心母乳寡糖的酶法和微生物细胞法合成研究现状,介绍了糖基转移酶和糖苷酶在酶法合成中性核心母乳寡糖的应用,讨论了糖基转移酶的催化特性、底盘细胞的种类及改造等关键因素对微生物细胞法合成中性核心母乳寡糖产量的影响,进一步对比了两种方法生物合成中性核心母乳寡糖的优缺点。目前,中性核心母乳寡糖的生物合成存在酶催化效率低、底盘细胞选择与适配性差、副产物多及内毒素污染等问题,需通过理性设计酶元件、优化安全底盘、动态调控代谢网络及强化发酵纯化工艺等策略协同攻关,有望实现母乳寡糖的低成本、高效绿色生产,为开发更具营养价值的婴幼儿健康食品提供核心支撑。
表4
β-1,3-半乳糖基转移酶、N-乙酰乳糖酶和β-半乳糖苷酶合成LNT汇总
正文中引用本图/表的段落
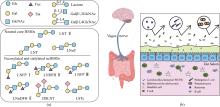
ncHMO作为HMO的重要成分和其他关键功能性HMO的核心骨架结构,其生理功能正被逐步揭示[图1(b)]。LNT Ⅱ为三糖,易被益生菌代谢或直接与宿主受体结合,能够上调肠道免疫因子DEFB1表达,对上皮细胞表面进行糖基化修饰,促进益生菌植物乳杆菌WCFS1肠道黏附与增殖[21]。LNnT能够促进肠道干细胞增殖分化,巩固肠道屏障,效果优于低聚半乳糖[22]。LNnT还能显著调节健康成年人的肠道菌群,特别是促进青春型双歧杆菌Bifidobacterium adolescentis的增殖。LNT能促进两歧双歧杆菌B. bifidum的增殖,并提高肠道乙酸含量[23]。轮状病毒是导致婴幼儿患胃肠炎的主要病原体,其感染依赖于表面蛋白VP4的VP8*结构域与宿主细胞表面聚糖的特异性结合[24]。研究表明,LNT通过氢键和疏水相互作用与VP8*稳定结合,在缓解胃肠炎方面发挥作用[25]。LNT及LNT Ⅱ衍生糖(LNFP Ⅰ、LNFP Ⅱ、LNFP Ⅲ和DSLNT)通过黏附于致病性大肠杆菌和霍乱弧菌产生的不同外毒素而显示出抗病原活性[26]。随着母乳寡糖制备技术的提高,ncHMO衍生糖的研究也日益受到关注。LNFP Ⅲ能够激活小鼠骨髓树突状细胞,以TLR4依赖的方式引发Th2免疫应答[27]。LSTc可以减少肺炎链球菌的定植和黏附,预防肺炎链球菌感染[28]。ncHMO还可与其他HMO联用通过脑-肠轴促进大脑神经发育和认知功能完善[29]。
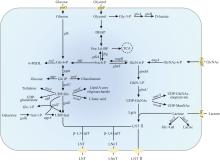
酶法合成LNT常用β-1,3-半乳糖基转移酶(β-1,3-galactosyltransferase,β-1,3-GalT,EC 2.4.1.—)、N-乙酰乳糖酶(lacto-N-biosidase,EC 3.2.1.140)和β-半乳糖苷酶(β-galactosidase,EC 3.2.1.23)。基于β-1,3-GalT的酶法合成LNT需要价格昂贵的底物,因此酶法合成LNT的研究较少(表4)。目前,仅有大肠杆菌O55:H7和紫色色杆菌(Chromobacterium violaceum)来源的β-1,3-GalT用于分步酶法合成LNT,在获得LNT Ⅱ的基础上,LNT转化率分别高达87%和99% [66-67]。
N-乙酰乳糖酶能水解LNT并从其非还原端释放二糖lacto-N-biose(Galβ1, 3GlcNAc,LNB),少数N-乙酰乳糖酶具有转糖苷活性,通过β-1,3-糖苷键直接耦合LNB和乳糖合成LNT [68]。目前已报道了两个能合成LNT的N-乙酰乳糖酶(表4)。金杆菌(Aureobacterium sp.)L-101来源的N-乙酰乳糖酶转糖苷活性较弱,LNT转化率仅为0.6%[57]。两歧双歧杆菌JCM 1254来源的N-乙酰乳糖酶研究较多,其能将LNT水解为乳糖和LNB以供自身吸收代谢,当以pNP-LNB和乳糖为底物时,能够检测到转糖苷活性[73]。Schm?lzer等[68]利用定点突变得到了LnbB突变体D320E,以LNB-oxa为供体和乳糖为受体合成LNT转化率达30%,对产物的二次水解作用明显降低,但仍存在较高的LNB-oxa水解活性。W394是LnbB活性中心的关键残基,位于底物结合亚位点-1的疏水区域。利用蛋白质工程获得了W394F和W394H突变体[69-70]。突变体W394F利用pNP-LNB为糖基供体,合成LNT转化率达32%;突变体W394H明显降低产物的二次水解,W394H分别以LNB-oxa或pNP-LNB反应3 h和2 h,LNT转化率分别为72%和8%。W394F突变保留了芳香环的疏水特性,维持底物结合的基本框架,但移除了吲哚环的N—H基团削弱底物结合强度,从而减少过渡态的稳定,抑制水解倾向[69]。W394H突变通过引入极性氨基酸削弱疏水作用,抑制水解过渡态的稳定[70]。
不同来源的β-半乳糖苷酶具有不同的区域选择性,催化形成的糖苷键类型取决于其活性位点对受体分子羟基的特异性识别。因此,某些β-半乳糖苷酶主要生成β-1,4-糖苷键,而另一些则倾向于生成β-1,3-糖苷键[57,59]。LNnT合成用β-半乳糖苷酶较多,而LNT合成用β-半乳糖苷酶数量较少(表4)。Murata等[57]从环状芽孢杆菌(Bacillus circulans)中鉴定出一种对β-1,3-糖苷键具有水解特异性的β-半乳糖苷酶。该酶能够高效地从LNT中释放半乳糖,还能催化合成LNT及其同分异构体(Galβ1, 6GlcNAcβ1, 3Galβ1, 4Glc)。为了提高LNT的纯度和转化率,Miyazaki等[71]在反应体系中加入了10%的助溶剂N, N-二甲基甲酰胺和来自于大肠杆菌的特异性水解LNT同分异构体的β-半乳糖苷酶,获得的LNT转化率更高(22%)。Li等[72]从玉米乳酪杆菌(Lacticaseibacillus zeae)中挖掘了能够合成LNT的又一新酶LzBgal35A,以oNPG为糖基供体和LNT Ⅱ为糖基受体合成LNT转化率为45.4%,为目前报道最高值。
伴放线聚集杆菌(Aggregatibacter actino-mycetemcomitans)来源的β-1,4-GalT(GenBank:AP014520.1)催化LNT Ⅱ和UDP-Gal合成LNnT的转化率达65%,而睡眠嗜组织菌(Histophilus somni)来源的β-1,4-GalT(GenBank:WP_081376949.1)合成LNnT的转化率仅为33%[ Crystal structure and structure-guided tunnel engineering in a bacterial β-1,4-galactosyltransferase 1 2024 ... 伴放线聚集杆菌(Aggregatibacter actino-mycetemcomitans)来源的β-1,4-GalT(GenBank:AP014520.1)催化LNT Ⅱ和UDP-Gal合成LNnT的转化率达65%,而睡眠嗜组织菌(Histophilus somni)来源的β-1,4-GalT(GenBank:WP_081376949.1)合成LNnT的转化率仅为33%[ Highly efficient chemoenzymatic synthesis of β1-4-linked galactosides with promiscuous bacterial β1-4-galactosyltransferases 1 2010 ... 伴放线聚集杆菌(Aggregatibacter actino-mycetemcomitans)来源的β-1,4-GalT(GenBank:AP014520.1)催化LNT Ⅱ和UDP-Gal合成LNnT的转化率达65%,而睡眠嗜组织菌(Histophilus somni)来源的β-1,4-GalT(GenBank:WP_081376949.1)合成LNnT的转化率仅为33%[ C-terminal domains of β-galactosidase from Paenibacillus macquariensis modulate product distribution by altering substrate binding conformation 1 2025 ... 少数β-半乳糖苷酶能够利用廉价的乳糖合成LNnT,相比于β-1,4-GalT,β-半乳糖苷酶更适合LNnT大规模制备.酶源与反应条件是提高LNnT合成效率的重要因素.Murata等[ High galacto-oligosaccharide production and a structural model for transgalactosylation of β-galactosidase Ⅱ from Bacillus circulans 0 2020 Discovering and efficiently promoting the extracellular secretory expression of Thermobacillus sp. ZCTH02-B1 sucrose phosphorylase in Escherichia coli 1 2021 ... 少数β-半乳糖苷酶能够利用廉价的乳糖合成LNnT,相比于β-1,4-GalT,β-半乳糖苷酶更适合LNnT大规模制备.酶源与反应条件是提高LNnT合成效率的重要因素.Murata等[ Characterization and synthetic application of a novel beta1,3-galactosyltransferase from Escherichia coli O55: H7 2 2009 ... 酶法合成LNT常用β-1,3-半乳糖基转移酶(β-1,3-galactosyltransferase,β-1,3-GalT,EC 2.4.1.—)、N-乙酰乳糖酶(lacto-N-biosidase,EC 3.2.1.140)和β-半乳糖苷酶(β-galactosidase,EC 3.2.1.23).基于β-1,3-GalT的酶法合成LNT需要价格昂贵的底物,因此酶法合成LNT的研究较少(
A bacterial β1-3-galactosyltransferase enables multigram-scale synthesis of human milk lacto-N-tetraose (LNT) and its fucosides 3 2019 ... 酶法合成LNT常用β-1,3-半乳糖基转移酶(β-1,3-galactosyltransferase,β-1,3-GalT,EC 2.4.1.—)、N-乙酰乳糖酶(lacto-N-biosidase,EC 3.2.1.140)和β-半乳糖苷酶(β-galactosidase,EC 3.2.1.23).基于β-1,3-GalT的酶法合成LNT需要价格昂贵的底物,因此酶法合成LNT的研究较少(
本文的其它图/表
|