|
||
 View image in article
图6
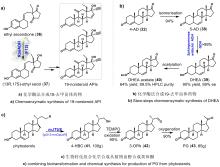
3-甾酮-Δ1-脱氢酶参与的松类甾药的化学酶法合成
正文中引用本图/表的段落
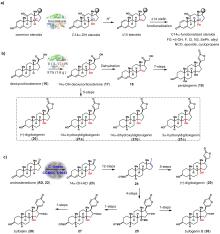
3-甾酮-Δ1-脱氢是甾体药物合成过程中最重要的反应之一,双键的引入通常会增强甾体药物活性或赋予其新的生理活性。例如,泼尼松龙的抗炎能力是氢化可的松的四倍,是可的松的五倍[52]。 鉴于化学脱氢效率低且区域-立体选择性差,在生物制药行业中通常借助生物催化的手段将双键引入到甾体母核中,3-甾酮-Δ1-脱氢酶(KstD)是负责甾体Δ1-脱氢的关键酶,并得到了广泛的研究和应用[53-54]。据报道,多种含KstD的真菌和细菌可催化不同甾体底物的C-1(2)位脱氢,其中节杆菌(Arthrobacter simplex)和诺卡氏菌(Nocardioides simple)因其优越的生物转化效率在工业界广泛应用[55-56]。2017年,郭灿城教授团队[57]以9α-OH-AD(29)为起始原料,利用A. simplex和N. simplex为生物催化剂,分别以22.9%和38.5%的总收率完成了重要甾体药物倍他米松(30)和氟轻松丙酮酯(31)的化学酶法合成(图6A,B)。此化学酶法合成路线革新了倍他米松和氟丙酮的生产模式,在成本、安全性和环境友好方面具有显著优势。
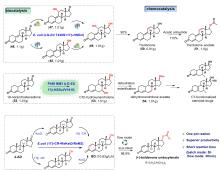
随着基因组学和转录组学的发展,不同微生物来源的KstDs酶逐渐被挖掘鉴定,并将其在其他模式底盘宿主(芽孢杆菌、大肠杆菌、毕赤酵母等)中进行异源表达和催化应用,从而避免了野生菌生物转化过程中的副产物积累。此外,对已鉴定的KstDs进行酶工程改造,使得这类生物催化剂展示出更强的有机溶剂耐受性和优异的甾体Δ1-脱氢活性 [58-60]。2022年,Wang等人[61]从丙酸杆菌中纯化了一种新型的Δ1-脱氢酶(PrKstD),其具有高效的催化活性和底物谱宽泛性,可催化18种甾体化合物的Δ1-脱氢,并有效转化高浓度氢化可的松(80 g/L)生成泼尼龙松,转化率高达90 %以上。同年,陈芬儿教授团队[62]通过对来自M. smegmatis mc2 155 的KstD(MsKstD1)进行酶工程改造,得到的4突变体KstD(MK4)成功阻断了甾体底物与酶的非催化空腔结合,从而提高了其催化效率。2023年[63],该团队将高效催化剂KM4应用到16β-甲基皮质激素的合成中,结合Mn 催化氧化还原水合等化学合成手段,实现了二丙酸倍氯米松(beclomethasone dipropionate,33),丙酸氯倍他米松(clobetasol propionate,34)和二丙酸倍他米松(betamethasone dipropionate,35)的简洁不对称合成,该化学酶法合成路线的实用性和简洁性也为其他相关甾体合成提供了指导(图6C)。
本文的其它图/表
|