Common principles and best practices for engineering microbiomes
1
2019
... 自20世纪初创建以来,合成生物学突破了传统的“自上而下”理念,形成了以人工设计为主导、系统化和标准化生物技术为手段的“自下而上”正向工程学思路,构建标准化和通用型的生物元件模块(如基因线路、酶、代谢途径等),在简约型底盘细胞中进行整合、测试和优化,实现定量可控的平台化新生命系统的高效运行.基于合成生物学的工业生物技术也成为了解决当前人类健康、资源、能源和环境等问题最具潜力的技术方法.在合成生物学的飞速发展过程中,产物合成核心元件的标准化及其与底盘细胞的适配性则是制约人工生物合成系统“能力提升”的“卡脖子”问题[1].为了克服这一难题,我们必须解决以下几个基础问题:阐明合成代谢调控机制,建立微生物合成的理论与方法,设计及构建人工微生物合成体系(工程化菌种),实现生物合成的定向性和高效性. ...
A network property necessary for concentration robustness
1
2016
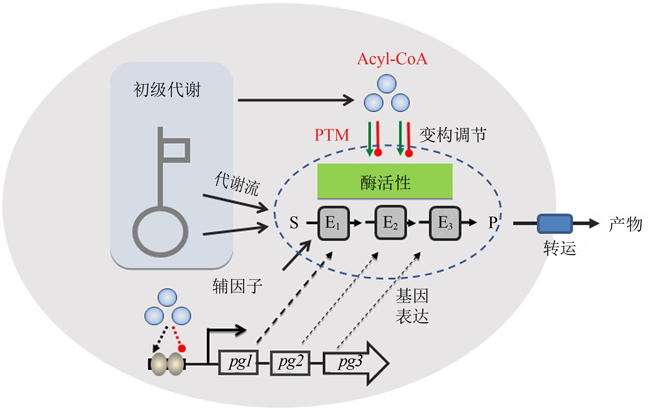
... 现有的产业化应用菌株主要是通过传统的随机选育方法或单一代谢途径修饰的方法获得.生物学家逐渐发现,传统的代谢工程方法仅仅通过合成途径的优化改造,对于高效生物合成的作用是非常有限的,甚至导致对细胞行为的不良影响,危及整个工程菌的性能[2-3].随着生命科学技术的发展,系统生物技术方法、网络调控分子机制、人工元件设计及模型优化已经越来越渗透到微生物合成体系研究领域[4-6],微生物高效合成产物主要取决于合成途径中关键节点酶的催化效率及前体供应,考虑到合成代谢通路的动力学控制并不仅仅局限在一个单独的反应或途径中,而是分布在整个网络甚至整个系统中,微生物合成的工程改造必须从单个代谢通路的优化转变到代谢调控网络及生物系统的优化(图1).因此,加深理解微生物合成代谢与调控的分子基础,揭示工程化设计的(内源及外源)生物合成体系与细胞整体代谢网络的交互作用及适配性机制是当前微生物合成理论与方法研究的重要方向. ...
In silico constraint-based strain optimization methods: the quest for optimal cell factories
1
2016
... 现有的产业化应用菌株主要是通过传统的随机选育方法或单一代谢途径修饰的方法获得.生物学家逐渐发现,传统的代谢工程方法仅仅通过合成途径的优化改造,对于高效生物合成的作用是非常有限的,甚至导致对细胞行为的不良影响,危及整个工程菌的性能[2-3].随着生命科学技术的发展,系统生物技术方法、网络调控分子机制、人工元件设计及模型优化已经越来越渗透到微生物合成体系研究领域[4-6],微生物高效合成产物主要取决于合成途径中关键节点酶的催化效率及前体供应,考虑到合成代谢通路的动力学控制并不仅仅局限在一个单独的反应或途径中,而是分布在整个网络甚至整个系统中,微生物合成的工程改造必须从单个代谢通路的优化转变到代谢调控网络及生物系统的优化(图1).因此,加深理解微生物合成代谢与调控的分子基础,揭示工程化设计的(内源及外源)生物合成体系与细胞整体代谢网络的交互作用及适配性机制是当前微生物合成理论与方法研究的重要方向. ...
Genomewide landscape of gene-metabolome associations in Escherichia coli
2
2017
... 现有的产业化应用菌株主要是通过传统的随机选育方法或单一代谢途径修饰的方法获得.生物学家逐渐发现,传统的代谢工程方法仅仅通过合成途径的优化改造,对于高效生物合成的作用是非常有限的,甚至导致对细胞行为的不良影响,危及整个工程菌的性能[2-3].随着生命科学技术的发展,系统生物技术方法、网络调控分子机制、人工元件设计及模型优化已经越来越渗透到微生物合成体系研究领域[4-6],微生物高效合成产物主要取决于合成途径中关键节点酶的催化效率及前体供应,考虑到合成代谢通路的动力学控制并不仅仅局限在一个单独的反应或途径中,而是分布在整个网络甚至整个系统中,微生物合成的工程改造必须从单个代谢通路的优化转变到代谢调控网络及生物系统的优化(图1).因此,加深理解微生物合成代谢与调控的分子基础,揭示工程化设计的(内源及外源)生物合成体系与细胞整体代谢网络的交互作用及适配性机制是当前微生物合成理论与方法研究的重要方向. ...
... 微生物拥有极其复杂的调控网络和响应机制以应对培养环境及胞内代谢状态变化,利用多种调控模式调节胞内代谢网络及代谢流分布[4,7-12].已有的研究表明,微生物细胞调控其(内源性或嵌入性)工程化设计生物合成体系有以下3种方式:基因转录及翻译调节胞内代谢酶丰度[13-15];变构效应及翻译后修饰调控胞内代谢酶活性[16-17];前体供应及辅因子浓度影响合成代谢反应速率[18-19].与此同时,代谢工程及合成生物学的研究重点也相应地聚焦在:生物合成元件的挖掘、设计、优化、改造及组装;调控元件及调控网络优化,维持合成代谢酶的高表达;前体及辅因子工程,强化前体与辅因子供应;代谢酶优化改造,解除产物的变构反馈抑制.这些分工明确的系统性研究深化了对微生物合成理论与方法的理解,实现了微生物药物[20-23]、生物燃料及化学品[24-27]、生物基聚合物[28-30]的高效合成.然而,作为微生物固有体系的组分,翻译后修饰(post-translational modification, PTM)系统对工程化生物合成途径的调控机制及合成效率的影响仍缺乏系统研究,基于翻译后修饰的代谢工程及合成生物学也鲜有报道. ...
Creating a functional single-chromosome yeast
0
2018
Creating functional chromosome fusions in yeast with CRISPR-Cas9
1
2019
... 现有的产业化应用菌株主要是通过传统的随机选育方法或单一代谢途径修饰的方法获得.生物学家逐渐发现,传统的代谢工程方法仅仅通过合成途径的优化改造,对于高效生物合成的作用是非常有限的,甚至导致对细胞行为的不良影响,危及整个工程菌的性能[2-3].随着生命科学技术的发展,系统生物技术方法、网络调控分子机制、人工元件设计及模型优化已经越来越渗透到微生物合成体系研究领域[4-6],微生物高效合成产物主要取决于合成途径中关键节点酶的催化效率及前体供应,考虑到合成代谢通路的动力学控制并不仅仅局限在一个单独的反应或途径中,而是分布在整个网络甚至整个系统中,微生物合成的工程改造必须从单个代谢通路的优化转变到代谢调控网络及生物系统的优化(图1).因此,加深理解微生物合成代谢与调控的分子基础,揭示工程化设计的(内源及外源)生物合成体系与细胞整体代谢网络的交互作用及适配性机制是当前微生物合成理论与方法研究的重要方向. ...
Reconstruction of biochemical networks in microorganisms
1
2009
... 微生物拥有极其复杂的调控网络和响应机制以应对培养环境及胞内代谢状态变化,利用多种调控模式调节胞内代谢网络及代谢流分布[4,7-12].已有的研究表明,微生物细胞调控其(内源性或嵌入性)工程化设计生物合成体系有以下3种方式:基因转录及翻译调节胞内代谢酶丰度[13-15];变构效应及翻译后修饰调控胞内代谢酶活性[16-17];前体供应及辅因子浓度影响合成代谢反应速率[18-19].与此同时,代谢工程及合成生物学的研究重点也相应地聚焦在:生物合成元件的挖掘、设计、优化、改造及组装;调控元件及调控网络优化,维持合成代谢酶的高表达;前体及辅因子工程,强化前体与辅因子供应;代谢酶优化改造,解除产物的变构反馈抑制.这些分工明确的系统性研究深化了对微生物合成理论与方法的理解,实现了微生物药物[20-23]、生物燃料及化学品[24-27]、生物基聚合物[28-30]的高效合成.然而,作为微生物固有体系的组分,翻译后修饰(post-translational modification, PTM)系统对工程化生物合成途径的调控机制及合成效率的影响仍缺乏系统研究,基于翻译后修饰的代谢工程及合成生物学也鲜有报道. ...
Tradeoff between enzyme and metabolite efficiency maintains metabolic homeostasis upon perturbations in enzyme capacity
0
2010
Systems biology of microbial metabolism
0
2010
Systematic identification of allosteric protein-metabolite interactions that control enzyme activity in vivo
0
2013
A comprehensive genome-scale reconstruction of Escherichia coli metabolism
0
2011
Acetylation of metabolic enzymes coordinates carbon source utilization and metabolic flux
1
2010
... 微生物拥有极其复杂的调控网络和响应机制以应对培养环境及胞内代谢状态变化,利用多种调控模式调节胞内代谢网络及代谢流分布[4,7-12].已有的研究表明,微生物细胞调控其(内源性或嵌入性)工程化设计生物合成体系有以下3种方式:基因转录及翻译调节胞内代谢酶丰度[13-15];变构效应及翻译后修饰调控胞内代谢酶活性[16-17];前体供应及辅因子浓度影响合成代谢反应速率[18-19].与此同时,代谢工程及合成生物学的研究重点也相应地聚焦在:生物合成元件的挖掘、设计、优化、改造及组装;调控元件及调控网络优化,维持合成代谢酶的高表达;前体及辅因子工程,强化前体与辅因子供应;代谢酶优化改造,解除产物的变构反馈抑制.这些分工明确的系统性研究深化了对微生物合成理论与方法的理解,实现了微生物药物[20-23]、生物燃料及化学品[24-27]、生物基聚合物[28-30]的高效合成.然而,作为微生物固有体系的组分,翻译后修饰(post-translational modification, PTM)系统对工程化生物合成途径的调控机制及合成效率的影响仍缺乏系统研究,基于翻译后修饰的代谢工程及合成生物学也鲜有报道. ...
Phosphate regulator PhoP directly and indirectly controls transcription of the erythromycin biosynthesis genes in Saccharopolyspora erythraea
2
2019
... 微生物拥有极其复杂的调控网络和响应机制以应对培养环境及胞内代谢状态变化,利用多种调控模式调节胞内代谢网络及代谢流分布[4,7-12].已有的研究表明,微生物细胞调控其(内源性或嵌入性)工程化设计生物合成体系有以下3种方式:基因转录及翻译调节胞内代谢酶丰度[13-15];变构效应及翻译后修饰调控胞内代谢酶活性[16-17];前体供应及辅因子浓度影响合成代谢反应速率[18-19].与此同时,代谢工程及合成生物学的研究重点也相应地聚焦在:生物合成元件的挖掘、设计、优化、改造及组装;调控元件及调控网络优化,维持合成代谢酶的高表达;前体及辅因子工程,强化前体与辅因子供应;代谢酶优化改造,解除产物的变构反馈抑制.这些分工明确的系统性研究深化了对微生物合成理论与方法的理解,实现了微生物药物[20-23]、生物燃料及化学品[24-27]、生物基聚合物[28-30]的高效合成.然而,作为微生物固有体系的组分,翻译后修饰(post-translational modification, PTM)系统对工程化生物合成途径的调控机制及合成效率的影响仍缺乏系统研究,基于翻译后修饰的代谢工程及合成生物学也鲜有报道. ...
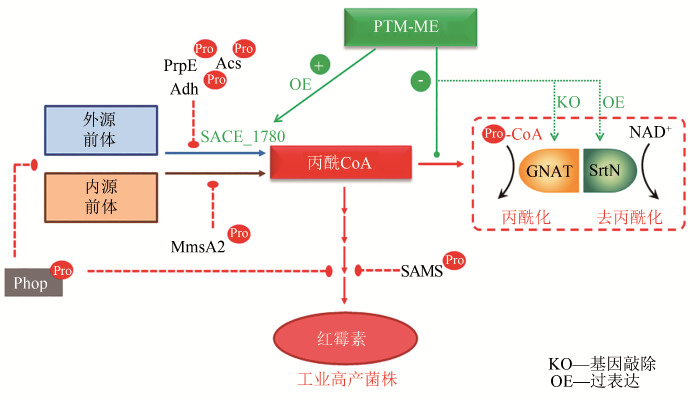
... 红霉素是医药和畜牧业中常用的大环内酯类抗生素.在红霉素的发酵生产过程中,研究者发现蛋白质丙二酰化和丙酰化会影响菌体生长及红霉素的合成,且胞内丙二酰化/丙酰化水平与产物合成效率呈负相关[17,85,100-101].红霉素合成前体丙二酰CoA/丙酰CoA的适量供应有利于产物合成,当前体丙二酰CoA/丙酰CoA积累过量时,又会产生酰基化效应,抑制产物合成.Xu等[85]运用丙二酰化修饰组学技术,从132个蛋白上共鉴定到192个丙二酰化修饰位点,结合生物信息学分析发现丙二酰化修饰蛋白在核糖体及中心代谢途径中显著富集,其中,乙酰CoA合成酶(Acs)和谷氨酰胺合成酶的活性受到丙二酰化的显著抑制.由于正丙醇或丙酸盐添加是提高红霉素发酵单位的常用手段,研究者随后对丙酰化组学的研究证实,酰基CoA浓度的动态改变会引起蛋白质酰基化水平与红霉素产量随之改变的连锁反应.利用定量酰基化组学技术,酶学特征分析和酰基化模拟分析,研究者确定了丙酰化修饰是影响红霉素产量的关键修饰,从两个层面负调控红霉素的合成:一是通过抑制丙二酸半醛脱氢酶(MmsA2)、丙醛脱氢酶(Adh)、SAM合成酶(SAMS)和丙酰CoA合成酶(PrpE)的活性阻碍丙酰CoA的合成;二是通过对全局调控因子PhoP的抑制,降低其PHO结构域的DNA结合活性,削弱靶基因红霉素合成基因簇的转录[13]以及细胞对碳源的利用.在此基础上,研究者利用PTM-ME策略,对酰基化酶和酰基化修饰系统分别进行了脱敏和优化改造.通过敲除丙酰转移酶(GNAT)、过表达去丙酰化酶(SrtN)和酰基化不敏感酶(SACE_1780)等方式,消除丙酰化对红霉素合成的抑制作用,最终实现工业高产菌中红霉素的产量翻番[81,96-97,99](图4). ...
DasR is a pleiotropic regulator required for antibiotic production, pigment biosynthesis, and morphological development in Saccharopolyspora erythraea
0
2015
Feast or famine: the global regulator DasR links nutrient stress to antibiotic production by streptomyces
1
2008
... 微生物拥有极其复杂的调控网络和响应机制以应对培养环境及胞内代谢状态变化,利用多种调控模式调节胞内代谢网络及代谢流分布[4,7-12].已有的研究表明,微生物细胞调控其(内源性或嵌入性)工程化设计生物合成体系有以下3种方式:基因转录及翻译调节胞内代谢酶丰度[13-15];变构效应及翻译后修饰调控胞内代谢酶活性[16-17];前体供应及辅因子浓度影响合成代谢反应速率[18-19].与此同时,代谢工程及合成生物学的研究重点也相应地聚焦在:生物合成元件的挖掘、设计、优化、改造及组装;调控元件及调控网络优化,维持合成代谢酶的高表达;前体及辅因子工程,强化前体与辅因子供应;代谢酶优化改造,解除产物的变构反馈抑制.这些分工明确的系统性研究深化了对微生物合成理论与方法的理解,实现了微生物药物[20-23]、生物燃料及化学品[24-27]、生物基聚合物[28-30]的高效合成.然而,作为微生物固有体系的组分,翻译后修饰(post-translational modification, PTM)系统对工程化生物合成途径的调控机制及合成效率的影响仍缺乏系统研究,基于翻译后修饰的代谢工程及合成生物学也鲜有报道. ...
Protein acylation affects the artificial biosynthetic pathway for pinosylvin production in engineered E. coli
4
2018
... 微生物拥有极其复杂的调控网络和响应机制以应对培养环境及胞内代谢状态变化,利用多种调控模式调节胞内代谢网络及代谢流分布[4,7-12].已有的研究表明,微生物细胞调控其(内源性或嵌入性)工程化设计生物合成体系有以下3种方式:基因转录及翻译调节胞内代谢酶丰度[13-15];变构效应及翻译后修饰调控胞内代谢酶活性[16-17];前体供应及辅因子浓度影响合成代谢反应速率[18-19].与此同时,代谢工程及合成生物学的研究重点也相应地聚焦在:生物合成元件的挖掘、设计、优化、改造及组装;调控元件及调控网络优化,维持合成代谢酶的高表达;前体及辅因子工程,强化前体与辅因子供应;代谢酶优化改造,解除产物的变构反馈抑制.这些分工明确的系统性研究深化了对微生物合成理论与方法的理解,实现了微生物药物[20-23]、生物燃料及化学品[24-27]、生物基聚合物[28-30]的高效合成.然而,作为微生物固有体系的组分,翻译后修饰(post-translational modification, PTM)系统对工程化生物合成途径的调控机制及合成效率的影响仍缺乏系统研究,基于翻译后修饰的代谢工程及合成生物学也鲜有报道. ...
... 酰基化修饰对代谢酶或调控因子转录水平和翻译后修饰水平的双层调控会直接影响酰基CoA类前体的有效供应和次级代谢产物的合成.例如,以丙酰CoA为前体的红霉素合成途径中,外源添加正丙醇或丙酸盐会诱发全局调控因子PhoP以及红霉素合成途径催化酶丙二酸半醛脱氢酶、丙醛脱氢酶、SAM合成酶和丙酰CoA合成酶的丙酰化,抑制红霉素合成基因簇的转录、前体丙酰CoA的利用和红霉素合成[100];以丙二酰CoA为前体的十一烷基灵菌红素生物合成中,丙二酸盐添加引起高水平的蛋白质丙二酰化,抑制产物的合成[101];以丁酰CoA为前体的丁醇合成过程中,丁醇合成途径代谢酶的丁酰化也抑制了终产物的合成[101];在人工构建的大肠杆菌细胞工厂用于赤松素的合成过程中,同样存在由于产物合成途径催化酶(4-对香豆酸连接酶和芪合成酶)的丙二酰化抑制了催化活性,从而导致赤松素的产率下降[16]. ...
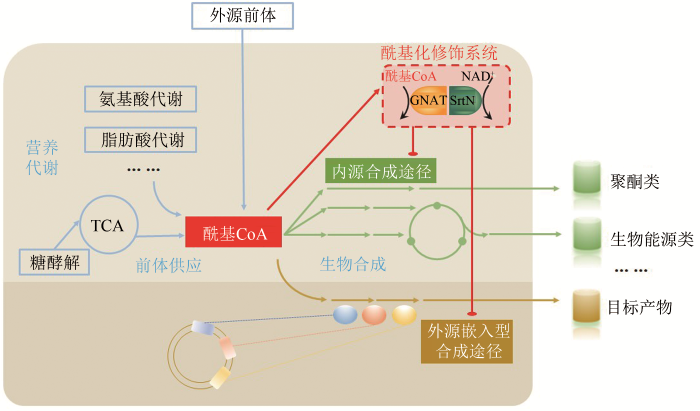
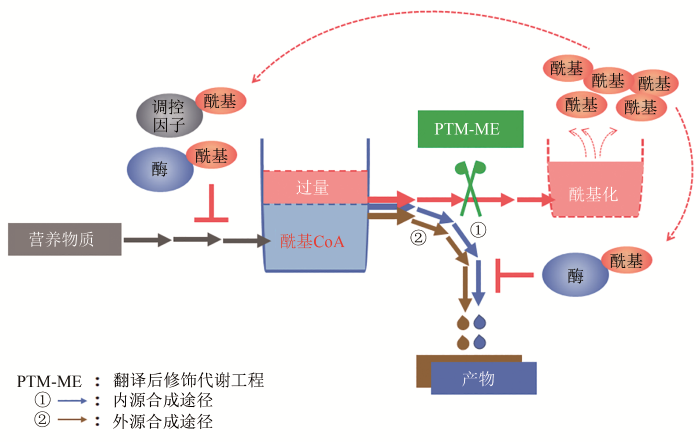
... 翻译后修饰代谢工程(PTM-ME)是2018年由我国科学家提出的一种新型的微生物合成代谢优化设计策略[16-17],与传统策略所不同的是,该策略集合了传统策略“开源节流”的优点,取长补短,从酰基CoA平衡及蛋白质翻译后修饰角度分析微生物内源性或嵌入性工程化设计生物合成体系与细胞整体代谢网络之间的互作机制,通过调节和优化代谢酶/酰基化系统,提高合成代谢途径代谢流以及与底盘细胞的适配性(图3).该策略的基本路线是:解析酰基化代谢的调控机制→筛选产物反馈抑制的关键靶点→代谢酶酰基化的脱敏改造或酰基化系统的优化改造,消除反馈抑制,强化产物合成.目前,PTM-ME策略已成功应用于聚酮化合物(红霉素)、生物能源类物质(丁醇)以及芪类化合物(赤松素)的高效合成. ...
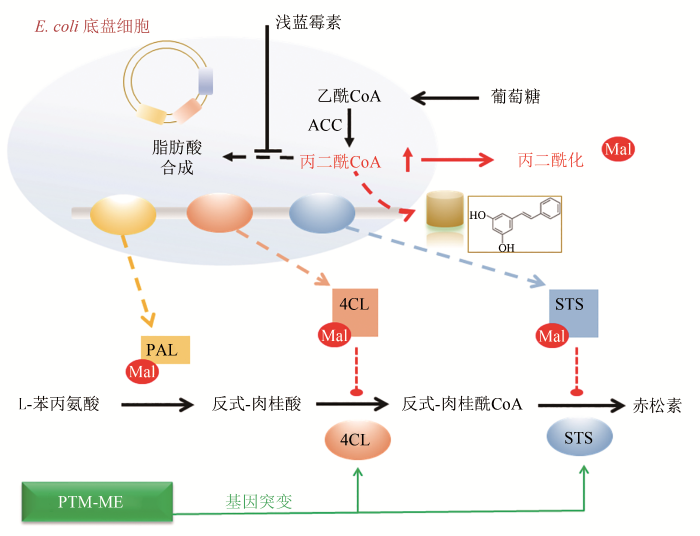
... 在人工构建的赤松素合成过程中,由于丙二酰CoA前体的供应是赤松素合成的限速步骤,因此添加丙二酰CoA激活剂浅蓝霉素,能有效提高丙二酰CoA前体的供应和赤松素产量[58].在随后的浅蓝霉素添加过程中,研究者再次发现了由于酰基化抑制导致的产物合成下降的现象,过量的浅蓝霉素添加诱发了三个合成元件催化酶的丙二酰化修饰,通过抑制4CL和STS的活性,阻碍赤松素的合成.对此,研究者利用PTM-ME策略,对酰基化敏感的4CL和STS丙二酰化位点进行改造,采取将赖氨酸替换为精氨酸的方式,将其改变为对酰基化不敏感的状态,在一定程度上消除了酰基化抑制效应,使得赤松素产量提高了近两倍(图5)[16].这些研究表明,PTM-ME策略对于解除内源性及外源性产物合成途径中酰基CoA诱发的酰基化反馈抑制、强化产物合成,都具有十分可观的成效. ...
Precursor supply for erythromycin biosynthesis: engineering of propionate assimilation pathway based on propionylation modification
3
2019
... 微生物拥有极其复杂的调控网络和响应机制以应对培养环境及胞内代谢状态变化,利用多种调控模式调节胞内代谢网络及代谢流分布[4,7-12].已有的研究表明,微生物细胞调控其(内源性或嵌入性)工程化设计生物合成体系有以下3种方式:基因转录及翻译调节胞内代谢酶丰度[13-15];变构效应及翻译后修饰调控胞内代谢酶活性[16-17];前体供应及辅因子浓度影响合成代谢反应速率[18-19].与此同时,代谢工程及合成生物学的研究重点也相应地聚焦在:生物合成元件的挖掘、设计、优化、改造及组装;调控元件及调控网络优化,维持合成代谢酶的高表达;前体及辅因子工程,强化前体与辅因子供应;代谢酶优化改造,解除产物的变构反馈抑制.这些分工明确的系统性研究深化了对微生物合成理论与方法的理解,实现了微生物药物[20-23]、生物燃料及化学品[24-27]、生物基聚合物[28-30]的高效合成.然而,作为微生物固有体系的组分,翻译后修饰(post-translational modification, PTM)系统对工程化生物合成途径的调控机制及合成效率的影响仍缺乏系统研究,基于翻译后修饰的代谢工程及合成生物学也鲜有报道. ...
... 翻译后修饰代谢工程(PTM-ME)是2018年由我国科学家提出的一种新型的微生物合成代谢优化设计策略[16-17],与传统策略所不同的是,该策略集合了传统策略“开源节流”的优点,取长补短,从酰基CoA平衡及蛋白质翻译后修饰角度分析微生物内源性或嵌入性工程化设计生物合成体系与细胞整体代谢网络之间的互作机制,通过调节和优化代谢酶/酰基化系统,提高合成代谢途径代谢流以及与底盘细胞的适配性(图3).该策略的基本路线是:解析酰基化代谢的调控机制→筛选产物反馈抑制的关键靶点→代谢酶酰基化的脱敏改造或酰基化系统的优化改造,消除反馈抑制,强化产物合成.目前,PTM-ME策略已成功应用于聚酮化合物(红霉素)、生物能源类物质(丁醇)以及芪类化合物(赤松素)的高效合成. ...
... 红霉素是医药和畜牧业中常用的大环内酯类抗生素.在红霉素的发酵生产过程中,研究者发现蛋白质丙二酰化和丙酰化会影响菌体生长及红霉素的合成,且胞内丙二酰化/丙酰化水平与产物合成效率呈负相关[17,85,100-101].红霉素合成前体丙二酰CoA/丙酰CoA的适量供应有利于产物合成,当前体丙二酰CoA/丙酰CoA积累过量时,又会产生酰基化效应,抑制产物合成.Xu等[85]运用丙二酰化修饰组学技术,从132个蛋白上共鉴定到192个丙二酰化修饰位点,结合生物信息学分析发现丙二酰化修饰蛋白在核糖体及中心代谢途径中显著富集,其中,乙酰CoA合成酶(Acs)和谷氨酰胺合成酶的活性受到丙二酰化的显著抑制.由于正丙醇或丙酸盐添加是提高红霉素发酵单位的常用手段,研究者随后对丙酰化组学的研究证实,酰基CoA浓度的动态改变会引起蛋白质酰基化水平与红霉素产量随之改变的连锁反应.利用定量酰基化组学技术,酶学特征分析和酰基化模拟分析,研究者确定了丙酰化修饰是影响红霉素产量的关键修饰,从两个层面负调控红霉素的合成:一是通过抑制丙二酸半醛脱氢酶(MmsA2)、丙醛脱氢酶(Adh)、SAM合成酶(SAMS)和丙酰CoA合成酶(PrpE)的活性阻碍丙酰CoA的合成;二是通过对全局调控因子PhoP的抑制,降低其PHO结构域的DNA结合活性,削弱靶基因红霉素合成基因簇的转录[13]以及细胞对碳源的利用.在此基础上,研究者利用PTM-ME策略,对酰基化酶和酰基化修饰系统分别进行了脱敏和优化改造.通过敲除丙酰转移酶(GNAT)、过表达去丙酰化酶(SrtN)和酰基化不敏感酶(SACE_1780)等方式,消除丙酰化对红霉素合成的抑制作用,最终实现工业高产菌中红霉素的产量翻番[81,96-97,99](图4). ...
Metabolic engineering of natural product biosynthesis in Actinobacteria
2
2016
... 微生物拥有极其复杂的调控网络和响应机制以应对培养环境及胞内代谢状态变化,利用多种调控模式调节胞内代谢网络及代谢流分布[4,7-12].已有的研究表明,微生物细胞调控其(内源性或嵌入性)工程化设计生物合成体系有以下3种方式:基因转录及翻译调节胞内代谢酶丰度[13-15];变构效应及翻译后修饰调控胞内代谢酶活性[16-17];前体供应及辅因子浓度影响合成代谢反应速率[18-19].与此同时,代谢工程及合成生物学的研究重点也相应地聚焦在:生物合成元件的挖掘、设计、优化、改造及组装;调控元件及调控网络优化,维持合成代谢酶的高表达;前体及辅因子工程,强化前体与辅因子供应;代谢酶优化改造,解除产物的变构反馈抑制.这些分工明确的系统性研究深化了对微生物合成理论与方法的理解,实现了微生物药物[20-23]、生物燃料及化学品[24-27]、生物基聚合物[28-30]的高效合成.然而,作为微生物固有体系的组分,翻译后修饰(post-translational modification, PTM)系统对工程化生物合成途径的调控机制及合成效率的影响仍缺乏系统研究,基于翻译后修饰的代谢工程及合成生物学也鲜有报道. ...
... 通过代谢工程及合成生物学手段强化酰基CoA前体的供应,是提高产物合成效率的常用策略.例如,在黄酮类物质的生物合成中,通过过表达异源乙酰CoA羧化酶和敲除酰基CoA:甘油二酯酰基转移酶的方式,优化丙二酰CoA合成途径,增强丙二酰CoA供应,显著促进泥质链霉菌中光神霉素合成[18].在委内瑞拉链霉菌中,敲除前体(2S)-丙二酸乙酯酰CoA代谢相关基因meaA,共表达泰乐菌素聚酮合酶与途径特异型调控因子PikD,增强前体供应,使泰乐酮产量提高了10倍[19].在红霉素的工业生产中,利用适量浓度正丙醇的添加,增强丙酰CoA供应,激活丙酰CoA羧化酶,加速甲基丙二酰CoA的转化率,可提高红霉素的产量[53-54];通过敲除丙酰CoA羧化酶的负调控蛋白PccD,提高丙酰CoA的同化效率和甲基丙二酰CoA供应,实现了红霉素产量的翻倍[55].在天蓝色链霉菌中,敲除G6P脱氢酶和过表达乙酰CoA羧化酶,增强丙二酰CoA的供应,最终使放线菌素的产量提高了近5倍[56]. ...
Characterization and engineering of the ethylmalonyl-CoA pathway towards the improved heterologous production of polyketides in Streptomyces venezuelae
2
2014
... 微生物拥有极其复杂的调控网络和响应机制以应对培养环境及胞内代谢状态变化,利用多种调控模式调节胞内代谢网络及代谢流分布[4,7-12].已有的研究表明,微生物细胞调控其(内源性或嵌入性)工程化设计生物合成体系有以下3种方式:基因转录及翻译调节胞内代谢酶丰度[13-15];变构效应及翻译后修饰调控胞内代谢酶活性[16-17];前体供应及辅因子浓度影响合成代谢反应速率[18-19].与此同时,代谢工程及合成生物学的研究重点也相应地聚焦在:生物合成元件的挖掘、设计、优化、改造及组装;调控元件及调控网络优化,维持合成代谢酶的高表达;前体及辅因子工程,强化前体与辅因子供应;代谢酶优化改造,解除产物的变构反馈抑制.这些分工明确的系统性研究深化了对微生物合成理论与方法的理解,实现了微生物药物[20-23]、生物燃料及化学品[24-27]、生物基聚合物[28-30]的高效合成.然而,作为微生物固有体系的组分,翻译后修饰(post-translational modification, PTM)系统对工程化生物合成途径的调控机制及合成效率的影响仍缺乏系统研究,基于翻译后修饰的代谢工程及合成生物学也鲜有报道. ...
... 通过代谢工程及合成生物学手段强化酰基CoA前体的供应,是提高产物合成效率的常用策略.例如,在黄酮类物质的生物合成中,通过过表达异源乙酰CoA羧化酶和敲除酰基CoA:甘油二酯酰基转移酶的方式,优化丙二酰CoA合成途径,增强丙二酰CoA供应,显著促进泥质链霉菌中光神霉素合成[18].在委内瑞拉链霉菌中,敲除前体(2S)-丙二酸乙酯酰CoA代谢相关基因meaA,共表达泰乐菌素聚酮合酶与途径特异型调控因子PikD,增强前体供应,使泰乐酮产量提高了10倍[19].在红霉素的工业生产中,利用适量浓度正丙醇的添加,增强丙酰CoA供应,激活丙酰CoA羧化酶,加速甲基丙二酰CoA的转化率,可提高红霉素的产量[53-54];通过敲除丙酰CoA羧化酶的负调控蛋白PccD,提高丙酰CoA的同化效率和甲基丙二酰CoA供应,实现了红霉素产量的翻倍[55].在天蓝色链霉菌中,敲除G6P脱氢酶和过表达乙酰CoA羧化酶,增强丙二酰CoA的供应,最终使放线菌素的产量提高了近5倍[56]. ...
Engineering biosynthesis of the anticancer alkaloid noscapine in yeast
1
2016
... 微生物拥有极其复杂的调控网络和响应机制以应对培养环境及胞内代谢状态变化,利用多种调控模式调节胞内代谢网络及代谢流分布[4,7-12].已有的研究表明,微生物细胞调控其(内源性或嵌入性)工程化设计生物合成体系有以下3种方式:基因转录及翻译调节胞内代谢酶丰度[13-15];变构效应及翻译后修饰调控胞内代谢酶活性[16-17];前体供应及辅因子浓度影响合成代谢反应速率[18-19].与此同时,代谢工程及合成生物学的研究重点也相应地聚焦在:生物合成元件的挖掘、设计、优化、改造及组装;调控元件及调控网络优化,维持合成代谢酶的高表达;前体及辅因子工程,强化前体与辅因子供应;代谢酶优化改造,解除产物的变构反馈抑制.这些分工明确的系统性研究深化了对微生物合成理论与方法的理解,实现了微生物药物[20-23]、生物燃料及化学品[24-27]、生物基聚合物[28-30]的高效合成.然而,作为微生物固有体系的组分,翻译后修饰(post-translational modification, PTM)系统对工程化生物合成途径的调控机制及合成效率的影响仍缺乏系统研究,基于翻译后修饰的代谢工程及合成生物学也鲜有报道. ...
Rewriting yeast central carbon metabolism for industrial isoprenoid production
0
2016
High-level semi-synthetic production of the potent antimalarial artemisinin
0
2013
A microbial biomanufacturing platform for natural and semisynthetic opioids
1
2014
... 微生物拥有极其复杂的调控网络和响应机制以应对培养环境及胞内代谢状态变化,利用多种调控模式调节胞内代谢网络及代谢流分布[4,7-12].已有的研究表明,微生物细胞调控其(内源性或嵌入性)工程化设计生物合成体系有以下3种方式:基因转录及翻译调节胞内代谢酶丰度[13-15];变构效应及翻译后修饰调控胞内代谢酶活性[16-17];前体供应及辅因子浓度影响合成代谢反应速率[18-19].与此同时,代谢工程及合成生物学的研究重点也相应地聚焦在:生物合成元件的挖掘、设计、优化、改造及组装;调控元件及调控网络优化,维持合成代谢酶的高表达;前体及辅因子工程,强化前体与辅因子供应;代谢酶优化改造,解除产物的变构反馈抑制.这些分工明确的系统性研究深化了对微生物合成理论与方法的理解,实现了微生物药物[20-23]、生物燃料及化学品[24-27]、生物基聚合物[28-30]的高效合成.然而,作为微生物固有体系的组分,翻译后修饰(post-translational modification, PTM)系统对工程化生物合成途径的调控机制及合成效率的影响仍缺乏系统研究,基于翻译后修饰的代谢工程及合成生物学也鲜有报道. ...
Top value platform chemicals: bio-based production of organic acids
1
2015
... 微生物拥有极其复杂的调控网络和响应机制以应对培养环境及胞内代谢状态变化,利用多种调控模式调节胞内代谢网络及代谢流分布[4,7-12].已有的研究表明,微生物细胞调控其(内源性或嵌入性)工程化设计生物合成体系有以下3种方式:基因转录及翻译调节胞内代谢酶丰度[13-15];变构效应及翻译后修饰调控胞内代谢酶活性[16-17];前体供应及辅因子浓度影响合成代谢反应速率[18-19].与此同时,代谢工程及合成生物学的研究重点也相应地聚焦在:生物合成元件的挖掘、设计、优化、改造及组装;调控元件及调控网络优化,维持合成代谢酶的高表达;前体及辅因子工程,强化前体与辅因子供应;代谢酶优化改造,解除产物的变构反馈抑制.这些分工明确的系统性研究深化了对微生物合成理论与方法的理解,实现了微生物药物[20-23]、生物燃料及化学品[24-27]、生物基聚合物[28-30]的高效合成.然而,作为微生物固有体系的组分,翻译后修饰(post-translational modification, PTM)系统对工程化生物合成途径的调控机制及合成效率的影响仍缺乏系统研究,基于翻译后修饰的代谢工程及合成生物学也鲜有报道. ...
Engineered reversal of the beta-oxidation cycle for the synthesis of fuels and chemicals
0
2011
Relative potential of biosynthetic pathways for biofuels and bio-based products
1
2011
... 微生物拥有极其复杂的调控网络和响应机制以应对培养环境及胞内代谢状态变化,利用多种调控模式调节胞内代谢网络及代谢流分布[4,7-12].已有的研究表明,微生物细胞调控其(内源性或嵌入性)工程化设计生物合成体系有以下3种方式:基因转录及翻译调节胞内代谢酶丰度[13-15];变构效应及翻译后修饰调控胞内代谢酶活性[16-17];前体供应及辅因子浓度影响合成代谢反应速率[18-19].与此同时,代谢工程及合成生物学的研究重点也相应地聚焦在:生物合成元件的挖掘、设计、优化、改造及组装;调控元件及调控网络优化,维持合成代谢酶的高表达;前体及辅因子工程,强化前体与辅因子供应;代谢酶优化改造,解除产物的变构反馈抑制.这些分工明确的系统性研究深化了对微生物合成理论与方法的理解,实现了微生物药物[20-23]、生物燃料及化学品[24-27]、生物基聚合物[28-30]的高效合成.然而,作为微生物固有体系的组分,翻译后修饰(post-translational modification, PTM)系统对工程化生物合成途径的调控机制及合成效率的影响仍缺乏系统研究,基于翻译后修饰的代谢工程及合成生物学也鲜有报道. ...
Bio-based production of monomers and polymers by metabolically engineered microorganisms
1
2015
... 微生物拥有极其复杂的调控网络和响应机制以应对培养环境及胞内代谢状态变化,利用多种调控模式调节胞内代谢网络及代谢流分布[4,7-12].已有的研究表明,微生物细胞调控其(内源性或嵌入性)工程化设计生物合成体系有以下3种方式:基因转录及翻译调节胞内代谢酶丰度[13-15];变构效应及翻译后修饰调控胞内代谢酶活性[16-17];前体供应及辅因子浓度影响合成代谢反应速率[18-19].与此同时,代谢工程及合成生物学的研究重点也相应地聚焦在:生物合成元件的挖掘、设计、优化、改造及组装;调控元件及调控网络优化,维持合成代谢酶的高表达;前体及辅因子工程,强化前体与辅因子供应;代谢酶优化改造,解除产物的变构反馈抑制.这些分工明确的系统性研究深化了对微生物合成理论与方法的理解,实现了微生物药物[20-23]、生物燃料及化学品[24-27]、生物基聚合物[28-30]的高效合成.然而,作为微生物固有体系的组分,翻译后修饰(post-translational modification, PTM)系统对工程化生物合成途径的调控机制及合成效率的影响仍缺乏系统研究,基于翻译后修饰的代谢工程及合成生物学也鲜有报道. ...
Integrated engineering of beta-oxidation reversal and omega-oxidation pathways for the synthesis of medium chain omega-functionalized carboxylic acids
0
2015
From zero to hero-production of bio-based nylon from renewable resources using engineered Corynebacterium glutamicum
1
2014
... 微生物拥有极其复杂的调控网络和响应机制以应对培养环境及胞内代谢状态变化,利用多种调控模式调节胞内代谢网络及代谢流分布[4,7-12].已有的研究表明,微生物细胞调控其(内源性或嵌入性)工程化设计生物合成体系有以下3种方式:基因转录及翻译调节胞内代谢酶丰度[13-15];变构效应及翻译后修饰调控胞内代谢酶活性[16-17];前体供应及辅因子浓度影响合成代谢反应速率[18-19].与此同时,代谢工程及合成生物学的研究重点也相应地聚焦在:生物合成元件的挖掘、设计、优化、改造及组装;调控元件及调控网络优化,维持合成代谢酶的高表达;前体及辅因子工程,强化前体与辅因子供应;代谢酶优化改造,解除产物的变构反馈抑制.这些分工明确的系统性研究深化了对微生物合成理论与方法的理解,实现了微生物药物[20-23]、生物燃料及化学品[24-27]、生物基聚合物[28-30]的高效合成.然而,作为微生物固有体系的组分,翻译后修饰(post-translational modification, PTM)系统对工程化生物合成途径的调控机制及合成效率的影响仍缺乏系统研究,基于翻译后修饰的代谢工程及合成生物学也鲜有报道. ...
Acetylation and methylation of histones and their possible role in the regulation of RNA synthesis
1
1964
... 以酰基化为代表的蛋白质翻译后修饰一直是广受追捧的研究热点.1964年Allfrey和同事首次在真核细胞中,发现了组蛋白的赖氨酸存在乙酰化修饰,并指出这种乙酰化修饰具有重要的转录调控功能[31-32];1997年非组蛋白(如肿瘤抑制蛋白p53)中也发现了赖氨酸乙酰化修饰的存在[33];2002年更进一步发现了原核细胞中可逆赖氨酸乙酰化(reversible lysine acylation,RLA)对乙酰CoA合成酶活性的调控机制 [34].随着高分辨率质谱技术的发展,越来越多的研究证实RLA是一种真核细胞及原核细胞中都广泛存在的蛋白质功能调控模式[34-36]. ...
Structural modifications of histones and their possible role in the regulation of RNA synthesis
1
1964
... 以酰基化为代表的蛋白质翻译后修饰一直是广受追捧的研究热点.1964年Allfrey和同事首次在真核细胞中,发现了组蛋白的赖氨酸存在乙酰化修饰,并指出这种乙酰化修饰具有重要的转录调控功能[31-32];1997年非组蛋白(如肿瘤抑制蛋白p53)中也发现了赖氨酸乙酰化修饰的存在[33];2002年更进一步发现了原核细胞中可逆赖氨酸乙酰化(reversible lysine acylation,RLA)对乙酰CoA合成酶活性的调控机制 [34].随着高分辨率质谱技术的发展,越来越多的研究证实RLA是一种真核细胞及原核细胞中都广泛存在的蛋白质功能调控模式[34-36]. ...
Acetylation of p53 augments its site-specific DNA binding both in vitro and in vivo
1
2004
... 以酰基化为代表的蛋白质翻译后修饰一直是广受追捧的研究热点.1964年Allfrey和同事首次在真核细胞中,发现了组蛋白的赖氨酸存在乙酰化修饰,并指出这种乙酰化修饰具有重要的转录调控功能[31-32];1997年非组蛋白(如肿瘤抑制蛋白p53)中也发现了赖氨酸乙酰化修饰的存在[33];2002年更进一步发现了原核细胞中可逆赖氨酸乙酰化(reversible lysine acylation,RLA)对乙酰CoA合成酶活性的调控机制 [34].随着高分辨率质谱技术的发展,越来越多的研究证实RLA是一种真核细胞及原核细胞中都广泛存在的蛋白质功能调控模式[34-36]. ...
Sir2-dependent activation of acetyl-CoA synthetase by deacetylation of active lysine
2
2002
... 以酰基化为代表的蛋白质翻译后修饰一直是广受追捧的研究热点.1964年Allfrey和同事首次在真核细胞中,发现了组蛋白的赖氨酸存在乙酰化修饰,并指出这种乙酰化修饰具有重要的转录调控功能[31-32];1997年非组蛋白(如肿瘤抑制蛋白p53)中也发现了赖氨酸乙酰化修饰的存在[33];2002年更进一步发现了原核细胞中可逆赖氨酸乙酰化(reversible lysine acylation,RLA)对乙酰CoA合成酶活性的调控机制 [34].随着高分辨率质谱技术的发展,越来越多的研究证实RLA是一种真核细胞及原核细胞中都广泛存在的蛋白质功能调控模式[34-36]. ...
... [34-36]. ...
The growing landscape of lysine acetylation links metabolism and cell signalling
0
2014
Metabolic regulation of gene expression through histone acylations
2
2017
... 以酰基化为代表的蛋白质翻译后修饰一直是广受追捧的研究热点.1964年Allfrey和同事首次在真核细胞中,发现了组蛋白的赖氨酸存在乙酰化修饰,并指出这种乙酰化修饰具有重要的转录调控功能[31-32];1997年非组蛋白(如肿瘤抑制蛋白p53)中也发现了赖氨酸乙酰化修饰的存在[33];2002年更进一步发现了原核细胞中可逆赖氨酸乙酰化(reversible lysine acylation,RLA)对乙酰CoA合成酶活性的调控机制 [34].随着高分辨率质谱技术的发展,越来越多的研究证实RLA是一种真核细胞及原核细胞中都广泛存在的蛋白质功能调控模式[34-36]. ...
... 乙酰化中和了赖氨酸ε-氨基的正电荷,提高其疏水性的同时增大赖氨酸侧链体积.因此,赖氨酸的乙酰化会抑制其侧链形成氢键,及其与负电荷残基发生静电相互作用的能力,却能增加与其他蛋白相互作用的范德华力.除了乙酰基基团之外,其他酰基基团也可以酰基化赖氨酸的侧链氨基,如丙酰化[39]、丁酰化[40]、琥珀酰化[41]、丙二酰化[42]、戊二酰化[43]、巴豆酰化[44]、β-羟基丁酰化[45],以及最新发现的苯甲酰化[46]、乳酸化[47]等.不同的酰基化修饰造成了蛋白质结构和性质的多元性,以调节酶催化活性、蛋白质稳定性或与其他分子间相互作用的方式影响细胞的代谢过程.根据酰基基团性质的不同,酰基化修饰可分为3类:①疏水非极性酰基化,例如丙酰化、丁酰化和巴豆酰化,它们在乙酰化赖氨酸残基的基础上,延伸了烃链,进一步增加其疏水性;②极性酰基化,例如β-羟基丁酰化和2-羟基异丁酰化,其特点是包含一个可与其他分子形成氢键的羟基;③酸性酰基化,例如丙二酰化、琥珀酰化和戊二酰化,这种类型的酰基化修饰能使赖氨酸电荷由+1变为-1,电荷改变程度与磷酸化相当(由0到-2),因此,这类酰基化修饰与前两类差异显著.这些修饰基团结构和功能的多样性无疑增加了蛋白质修饰机制与调控研究的复杂性[36]. ...
Widespread and enzyme-independent nepsilon-acetylation and nepsilon-succinylation of proteins in the chemical conditions of the mitochondrial matrix
1
2013
... 蛋白质的乙酰化是一个动态可逆的过程,生物体存在两种蛋白质乙酰化机制:①酶催化机制,通过乙酰转移酶将乙酰CoA上的乙酰基团转移到赖氨酸侧链氨基;②非酶乙酰化机制,酰基化反应是高放热反应,且形成的酰胺键非常稳定,细胞内高浓度的乙酰CoA或乙酰磷酸(AcP)在碱性pH条件下可自发乙酰化蛋白质赖氨酸的侧链氨基[37-38].由于两种乙酰化机制(酶催化和非酶催化)在细胞中同时存在,目前尚无有效方法区分底物蛋白的乙酰化修饰是由哪种机制产生.去乙酰化反应是蛋白质乙酰化的逆向反应,在酶催化和非酶催化的乙酰化反应中,有部分能通过去乙酰化酶的催化脱去乙酰化,另一部分则不能发生去乙酰化,细胞如何处理这些不能脱去乙酰化的蛋白质的机理尚不明确. ...
Acetylphosphate is a critical determinant of lysine acetylation in E. coli
2
2013
... 蛋白质的乙酰化是一个动态可逆的过程,生物体存在两种蛋白质乙酰化机制:①酶催化机制,通过乙酰转移酶将乙酰CoA上的乙酰基团转移到赖氨酸侧链氨基;②非酶乙酰化机制,酰基化反应是高放热反应,且形成的酰胺键非常稳定,细胞内高浓度的乙酰CoA或乙酰磷酸(AcP)在碱性pH条件下可自发乙酰化蛋白质赖氨酸的侧链氨基[37-38].由于两种乙酰化机制(酶催化和非酶催化)在细胞中同时存在,目前尚无有效方法区分底物蛋白的乙酰化修饰是由哪种机制产生.去乙酰化反应是蛋白质乙酰化的逆向反应,在酶催化和非酶催化的乙酰化反应中,有部分能通过去乙酰化酶的催化脱去乙酰化,另一部分则不能发生去乙酰化,细胞如何处理这些不能脱去乙酰化的蛋白质的机理尚不明确. ...
... 酰基化修饰的发生与基础营养代谢的失衡紧密相关.微生物细胞内氮源匮乏或碳流溢出导致胞内AcP和乙酰CoA积累,继而引发高水平的蛋白质乙酰化,这些乙酰化蛋白多为代谢酶并且大量分布于TCA循环、糖酵解、脂肪酸代谢、丙酮酸代谢等多种中心代谢途径,缓冲碳流过量带来的压力,反馈影响中心代谢,葡萄糖、乙酸、乳酸等碳源的过量均能导致这种乙酰化反馈效应[38,48-49]. ...
N-lysine propionylation controls the activity of propionyl-CoA synthetase
1
2007
... 乙酰化中和了赖氨酸ε-氨基的正电荷,提高其疏水性的同时增大赖氨酸侧链体积.因此,赖氨酸的乙酰化会抑制其侧链形成氢键,及其与负电荷残基发生静电相互作用的能力,却能增加与其他蛋白相互作用的范德华力.除了乙酰基基团之外,其他酰基基团也可以酰基化赖氨酸的侧链氨基,如丙酰化[39]、丁酰化[40]、琥珀酰化[41]、丙二酰化[42]、戊二酰化[43]、巴豆酰化[44]、β-羟基丁酰化[45],以及最新发现的苯甲酰化[46]、乳酸化[47]等.不同的酰基化修饰造成了蛋白质结构和性质的多元性,以调节酶催化活性、蛋白质稳定性或与其他分子间相互作用的方式影响细胞的代谢过程.根据酰基基团性质的不同,酰基化修饰可分为3类:①疏水非极性酰基化,例如丙酰化、丁酰化和巴豆酰化,它们在乙酰化赖氨酸残基的基础上,延伸了烃链,进一步增加其疏水性;②极性酰基化,例如β-羟基丁酰化和2-羟基异丁酰化,其特点是包含一个可与其他分子形成氢键的羟基;③酸性酰基化,例如丙二酰化、琥珀酰化和戊二酰化,这种类型的酰基化修饰能使赖氨酸电荷由+1变为-1,电荷改变程度与磷酸化相当(由0到-2),因此,这类酰基化修饰与前两类差异显著.这些修饰基团结构和功能的多样性无疑增加了蛋白质修饰机制与调控研究的复杂性[36]. ...
Lysine propionylation and butyrylation are novel post-translational modifications in histones
1
2007
... 乙酰化中和了赖氨酸ε-氨基的正电荷,提高其疏水性的同时增大赖氨酸侧链体积.因此,赖氨酸的乙酰化会抑制其侧链形成氢键,及其与负电荷残基发生静电相互作用的能力,却能增加与其他蛋白相互作用的范德华力.除了乙酰基基团之外,其他酰基基团也可以酰基化赖氨酸的侧链氨基,如丙酰化[39]、丁酰化[40]、琥珀酰化[41]、丙二酰化[42]、戊二酰化[43]、巴豆酰化[44]、β-羟基丁酰化[45],以及最新发现的苯甲酰化[46]、乳酸化[47]等.不同的酰基化修饰造成了蛋白质结构和性质的多元性,以调节酶催化活性、蛋白质稳定性或与其他分子间相互作用的方式影响细胞的代谢过程.根据酰基基团性质的不同,酰基化修饰可分为3类:①疏水非极性酰基化,例如丙酰化、丁酰化和巴豆酰化,它们在乙酰化赖氨酸残基的基础上,延伸了烃链,进一步增加其疏水性;②极性酰基化,例如β-羟基丁酰化和2-羟基异丁酰化,其特点是包含一个可与其他分子形成氢键的羟基;③酸性酰基化,例如丙二酰化、琥珀酰化和戊二酰化,这种类型的酰基化修饰能使赖氨酸电荷由+1变为-1,电荷改变程度与磷酸化相当(由0到-2),因此,这类酰基化修饰与前两类差异显著.这些修饰基团结构和功能的多样性无疑增加了蛋白质修饰机制与调控研究的复杂性[36]. ...
Identification of lysine succinylation as a new post-translational modification
1
2011
... 乙酰化中和了赖氨酸ε-氨基的正电荷,提高其疏水性的同时增大赖氨酸侧链体积.因此,赖氨酸的乙酰化会抑制其侧链形成氢键,及其与负电荷残基发生静电相互作用的能力,却能增加与其他蛋白相互作用的范德华力.除了乙酰基基团之外,其他酰基基团也可以酰基化赖氨酸的侧链氨基,如丙酰化[39]、丁酰化[40]、琥珀酰化[41]、丙二酰化[42]、戊二酰化[43]、巴豆酰化[44]、β-羟基丁酰化[45],以及最新发现的苯甲酰化[46]、乳酸化[47]等.不同的酰基化修饰造成了蛋白质结构和性质的多元性,以调节酶催化活性、蛋白质稳定性或与其他分子间相互作用的方式影响细胞的代谢过程.根据酰基基团性质的不同,酰基化修饰可分为3类:①疏水非极性酰基化,例如丙酰化、丁酰化和巴豆酰化,它们在乙酰化赖氨酸残基的基础上,延伸了烃链,进一步增加其疏水性;②极性酰基化,例如β-羟基丁酰化和2-羟基异丁酰化,其特点是包含一个可与其他分子形成氢键的羟基;③酸性酰基化,例如丙二酰化、琥珀酰化和戊二酰化,这种类型的酰基化修饰能使赖氨酸电荷由+1变为-1,电荷改变程度与磷酸化相当(由0到-2),因此,这类酰基化修饰与前两类差异显著.这些修饰基团结构和功能的多样性无疑增加了蛋白质修饰机制与调控研究的复杂性[36]. ...
The first identification of lysine malonylation substrates and its regulatory enzyme
1
2011
... 乙酰化中和了赖氨酸ε-氨基的正电荷,提高其疏水性的同时增大赖氨酸侧链体积.因此,赖氨酸的乙酰化会抑制其侧链形成氢键,及其与负电荷残基发生静电相互作用的能力,却能增加与其他蛋白相互作用的范德华力.除了乙酰基基团之外,其他酰基基团也可以酰基化赖氨酸的侧链氨基,如丙酰化[39]、丁酰化[40]、琥珀酰化[41]、丙二酰化[42]、戊二酰化[43]、巴豆酰化[44]、β-羟基丁酰化[45],以及最新发现的苯甲酰化[46]、乳酸化[47]等.不同的酰基化修饰造成了蛋白质结构和性质的多元性,以调节酶催化活性、蛋白质稳定性或与其他分子间相互作用的方式影响细胞的代谢过程.根据酰基基团性质的不同,酰基化修饰可分为3类:①疏水非极性酰基化,例如丙酰化、丁酰化和巴豆酰化,它们在乙酰化赖氨酸残基的基础上,延伸了烃链,进一步增加其疏水性;②极性酰基化,例如β-羟基丁酰化和2-羟基异丁酰化,其特点是包含一个可与其他分子形成氢键的羟基;③酸性酰基化,例如丙二酰化、琥珀酰化和戊二酰化,这种类型的酰基化修饰能使赖氨酸电荷由+1变为-1,电荷改变程度与磷酸化相当(由0到-2),因此,这类酰基化修饰与前两类差异显著.这些修饰基团结构和功能的多样性无疑增加了蛋白质修饰机制与调控研究的复杂性[36]. ...
Lysine glutarylation is a protein posttranslational modification regulated by Sirt5
1
2014
... 乙酰化中和了赖氨酸ε-氨基的正电荷,提高其疏水性的同时增大赖氨酸侧链体积.因此,赖氨酸的乙酰化会抑制其侧链形成氢键,及其与负电荷残基发生静电相互作用的能力,却能增加与其他蛋白相互作用的范德华力.除了乙酰基基团之外,其他酰基基团也可以酰基化赖氨酸的侧链氨基,如丙酰化[39]、丁酰化[40]、琥珀酰化[41]、丙二酰化[42]、戊二酰化[43]、巴豆酰化[44]、β-羟基丁酰化[45],以及最新发现的苯甲酰化[46]、乳酸化[47]等.不同的酰基化修饰造成了蛋白质结构和性质的多元性,以调节酶催化活性、蛋白质稳定性或与其他分子间相互作用的方式影响细胞的代谢过程.根据酰基基团性质的不同,酰基化修饰可分为3类:①疏水非极性酰基化,例如丙酰化、丁酰化和巴豆酰化,它们在乙酰化赖氨酸残基的基础上,延伸了烃链,进一步增加其疏水性;②极性酰基化,例如β-羟基丁酰化和2-羟基异丁酰化,其特点是包含一个可与其他分子形成氢键的羟基;③酸性酰基化,例如丙二酰化、琥珀酰化和戊二酰化,这种类型的酰基化修饰能使赖氨酸电荷由+1变为-1,电荷改变程度与磷酸化相当(由0到-2),因此,这类酰基化修饰与前两类差异显著.这些修饰基团结构和功能的多样性无疑增加了蛋白质修饰机制与调控研究的复杂性[36]. ...
Identification of 67 histone marks and histone lysine crotonylation as a new type of histone modification
1
2011
... 乙酰化中和了赖氨酸ε-氨基的正电荷,提高其疏水性的同时增大赖氨酸侧链体积.因此,赖氨酸的乙酰化会抑制其侧链形成氢键,及其与负电荷残基发生静电相互作用的能力,却能增加与其他蛋白相互作用的范德华力.除了乙酰基基团之外,其他酰基基团也可以酰基化赖氨酸的侧链氨基,如丙酰化[39]、丁酰化[40]、琥珀酰化[41]、丙二酰化[42]、戊二酰化[43]、巴豆酰化[44]、β-羟基丁酰化[45],以及最新发现的苯甲酰化[46]、乳酸化[47]等.不同的酰基化修饰造成了蛋白质结构和性质的多元性,以调节酶催化活性、蛋白质稳定性或与其他分子间相互作用的方式影响细胞的代谢过程.根据酰基基团性质的不同,酰基化修饰可分为3类:①疏水非极性酰基化,例如丙酰化、丁酰化和巴豆酰化,它们在乙酰化赖氨酸残基的基础上,延伸了烃链,进一步增加其疏水性;②极性酰基化,例如β-羟基丁酰化和2-羟基异丁酰化,其特点是包含一个可与其他分子形成氢键的羟基;③酸性酰基化,例如丙二酰化、琥珀酰化和戊二酰化,这种类型的酰基化修饰能使赖氨酸电荷由+1变为-1,电荷改变程度与磷酸化相当(由0到-2),因此,这类酰基化修饰与前两类差异显著.这些修饰基团结构和功能的多样性无疑增加了蛋白质修饰机制与调控研究的复杂性[36]. ...
Metabolic regulation of gene expression by histone lysine beta-hydroxybutyrylation
1
2016
... 乙酰化中和了赖氨酸ε-氨基的正电荷,提高其疏水性的同时增大赖氨酸侧链体积.因此,赖氨酸的乙酰化会抑制其侧链形成氢键,及其与负电荷残基发生静电相互作用的能力,却能增加与其他蛋白相互作用的范德华力.除了乙酰基基团之外,其他酰基基团也可以酰基化赖氨酸的侧链氨基,如丙酰化[39]、丁酰化[40]、琥珀酰化[41]、丙二酰化[42]、戊二酰化[43]、巴豆酰化[44]、β-羟基丁酰化[45],以及最新发现的苯甲酰化[46]、乳酸化[47]等.不同的酰基化修饰造成了蛋白质结构和性质的多元性,以调节酶催化活性、蛋白质稳定性或与其他分子间相互作用的方式影响细胞的代谢过程.根据酰基基团性质的不同,酰基化修饰可分为3类:①疏水非极性酰基化,例如丙酰化、丁酰化和巴豆酰化,它们在乙酰化赖氨酸残基的基础上,延伸了烃链,进一步增加其疏水性;②极性酰基化,例如β-羟基丁酰化和2-羟基异丁酰化,其特点是包含一个可与其他分子形成氢键的羟基;③酸性酰基化,例如丙二酰化、琥珀酰化和戊二酰化,这种类型的酰基化修饰能使赖氨酸电荷由+1变为-1,电荷改变程度与磷酸化相当(由0到-2),因此,这类酰基化修饰与前两类差异显著.这些修饰基团结构和功能的多样性无疑增加了蛋白质修饰机制与调控研究的复杂性[36]. ...
Lysine benzoylation is a histone mark regulated by Sirt2
1
2018
... 乙酰化中和了赖氨酸ε-氨基的正电荷,提高其疏水性的同时增大赖氨酸侧链体积.因此,赖氨酸的乙酰化会抑制其侧链形成氢键,及其与负电荷残基发生静电相互作用的能力,却能增加与其他蛋白相互作用的范德华力.除了乙酰基基团之外,其他酰基基团也可以酰基化赖氨酸的侧链氨基,如丙酰化[39]、丁酰化[40]、琥珀酰化[41]、丙二酰化[42]、戊二酰化[43]、巴豆酰化[44]、β-羟基丁酰化[45],以及最新发现的苯甲酰化[46]、乳酸化[47]等.不同的酰基化修饰造成了蛋白质结构和性质的多元性,以调节酶催化活性、蛋白质稳定性或与其他分子间相互作用的方式影响细胞的代谢过程.根据酰基基团性质的不同,酰基化修饰可分为3类:①疏水非极性酰基化,例如丙酰化、丁酰化和巴豆酰化,它们在乙酰化赖氨酸残基的基础上,延伸了烃链,进一步增加其疏水性;②极性酰基化,例如β-羟基丁酰化和2-羟基异丁酰化,其特点是包含一个可与其他分子形成氢键的羟基;③酸性酰基化,例如丙二酰化、琥珀酰化和戊二酰化,这种类型的酰基化修饰能使赖氨酸电荷由+1变为-1,电荷改变程度与磷酸化相当(由0到-2),因此,这类酰基化修饰与前两类差异显著.这些修饰基团结构和功能的多样性无疑增加了蛋白质修饰机制与调控研究的复杂性[36]. ...
Metabolic regulation of gene expression by histone lactylation
1
2019
... 乙酰化中和了赖氨酸ε-氨基的正电荷,提高其疏水性的同时增大赖氨酸侧链体积.因此,赖氨酸的乙酰化会抑制其侧链形成氢键,及其与负电荷残基发生静电相互作用的能力,却能增加与其他蛋白相互作用的范德华力.除了乙酰基基团之外,其他酰基基团也可以酰基化赖氨酸的侧链氨基,如丙酰化[39]、丁酰化[40]、琥珀酰化[41]、丙二酰化[42]、戊二酰化[43]、巴豆酰化[44]、β-羟基丁酰化[45],以及最新发现的苯甲酰化[46]、乳酸化[47]等.不同的酰基化修饰造成了蛋白质结构和性质的多元性,以调节酶催化活性、蛋白质稳定性或与其他分子间相互作用的方式影响细胞的代谢过程.根据酰基基团性质的不同,酰基化修饰可分为3类:①疏水非极性酰基化,例如丙酰化、丁酰化和巴豆酰化,它们在乙酰化赖氨酸残基的基础上,延伸了烃链,进一步增加其疏水性;②极性酰基化,例如β-羟基丁酰化和2-羟基异丁酰化,其特点是包含一个可与其他分子形成氢键的羟基;③酸性酰基化,例如丙二酰化、琥珀酰化和戊二酰化,这种类型的酰基化修饰能使赖氨酸电荷由+1变为-1,电荷改变程度与磷酸化相当(由0到-2),因此,这类酰基化修饰与前两类差异显著.这些修饰基团结构和功能的多样性无疑增加了蛋白质修饰机制与调控研究的复杂性[36]. ...
Structural, kinetic and proteomic characterization of acetyl phosphate-dependent bacterial protein acetylation
1
2014
... 酰基化修饰的发生与基础营养代谢的失衡紧密相关.微生物细胞内氮源匮乏或碳流溢出导致胞内AcP和乙酰CoA积累,继而引发高水平的蛋白质乙酰化,这些乙酰化蛋白多为代谢酶并且大量分布于TCA循环、糖酵解、脂肪酸代谢、丙酮酸代谢等多种中心代谢途径,缓冲碳流过量带来的压力,反馈影响中心代谢,葡萄糖、乙酸、乳酸等碳源的过量均能导致这种乙酰化反馈效应[38,48-49]. ...
Protein acetylation dynamics in response to carbon overflow in Escherichia coli
1
2015
... 酰基化修饰的发生与基础营养代谢的失衡紧密相关.微生物细胞内氮源匮乏或碳流溢出导致胞内AcP和乙酰CoA积累,继而引发高水平的蛋白质乙酰化,这些乙酰化蛋白多为代谢酶并且大量分布于TCA循环、糖酵解、脂肪酸代谢、丙酮酸代谢等多种中心代谢途径,缓冲碳流过量带来的压力,反馈影响中心代谢,葡萄糖、乙酸、乳酸等碳源的过量均能导致这种乙酰化反馈效应[38,48-49]. ...
Identification of lysine succinylation substrates and the succinylation regulatory enzyme CobB in Escherichia coli
1
2013
... 随着翻译后修饰蛋白质组学技术的发展,越来越多的研究证实,蛋白质酰基化水平的改变依赖于与之对应的酰基CoA浓度.微生物中不同的酰基CoA来源也不尽相同,例如,乙酰CoA和琥珀酰CoA主要来源于TCA循环,丙二酰CoA主要来源于乙酰CoA羧化酶催化的乙酰CoA羧化反应(脂肪酸合成的第一步反应).因此,乙酰化和琥珀酰化可能与能量代谢关联,丙二酰化修饰则可能与脂肪酸代谢相关.这种推测在随后的研究中得到证实,由葡萄糖/丙酮酸添加引起的糖酵解及TCA循环增强,细胞内乙酰化和琥珀酰化修饰水平也随之提升[50];抑制脂肪酸合成酶的情况下,丙二酰CoA累积,细胞内蛋白质丙二酰化水平也随之升高[51].此外,外源脂肪酸盐的添加同样会引起细胞内酰基化水平的波动,乙酸盐、丙酸盐、琥珀酸盐或丁酸盐的添加均能通过增加胞内相应酰基CoA积累引起酰基化修饰水平的显著提高[52]. ...
Global profiling of protein lysine malonylation in Escherichia coli reveals its role in energy metabolism
1
2016
... 随着翻译后修饰蛋白质组学技术的发展,越来越多的研究证实,蛋白质酰基化水平的改变依赖于与之对应的酰基CoA浓度.微生物中不同的酰基CoA来源也不尽相同,例如,乙酰CoA和琥珀酰CoA主要来源于TCA循环,丙二酰CoA主要来源于乙酰CoA羧化酶催化的乙酰CoA羧化反应(脂肪酸合成的第一步反应).因此,乙酰化和琥珀酰化可能与能量代谢关联,丙二酰化修饰则可能与脂肪酸代谢相关.这种推测在随后的研究中得到证实,由葡萄糖/丙酮酸添加引起的糖酵解及TCA循环增强,细胞内乙酰化和琥珀酰化修饰水平也随之提升[50];抑制脂肪酸合成酶的情况下,丙二酰CoA累积,细胞内蛋白质丙二酰化水平也随之升高[51].此外,外源脂肪酸盐的添加同样会引起细胞内酰基化水平的波动,乙酸盐、丙酸盐、琥珀酸盐或丁酸盐的添加均能通过增加胞内相应酰基CoA积累引起酰基化修饰水平的显著提高[52]. ...
Characterization of protein lysine propionylation in Escherichia coli: global profiling, dynamic change, and enzymatic regulation
1
2016
... 随着翻译后修饰蛋白质组学技术的发展,越来越多的研究证实,蛋白质酰基化水平的改变依赖于与之对应的酰基CoA浓度.微生物中不同的酰基CoA来源也不尽相同,例如,乙酰CoA和琥珀酰CoA主要来源于TCA循环,丙二酰CoA主要来源于乙酰CoA羧化酶催化的乙酰CoA羧化反应(脂肪酸合成的第一步反应).因此,乙酰化和琥珀酰化可能与能量代谢关联,丙二酰化修饰则可能与脂肪酸代谢相关.这种推测在随后的研究中得到证实,由葡萄糖/丙酮酸添加引起的糖酵解及TCA循环增强,细胞内乙酰化和琥珀酰化修饰水平也随之提升[50];抑制脂肪酸合成酶的情况下,丙二酰CoA累积,细胞内蛋白质丙二酰化水平也随之升高[51].此外,外源脂肪酸盐的添加同样会引起细胞内酰基化水平的波动,乙酸盐、丙酸盐、琥珀酸盐或丁酸盐的添加均能通过增加胞内相应酰基CoA积累引起酰基化修饰水平的显著提高[52]. ...
Controlling the feed rate of glucose and propanol for the enhancement of erythromycin production and exploration of propanol metabolism fate by quantitative metabolic flux analysis
1
2013
... 通过代谢工程及合成生物学手段强化酰基CoA前体的供应,是提高产物合成效率的常用策略.例如,在黄酮类物质的生物合成中,通过过表达异源乙酰CoA羧化酶和敲除酰基CoA:甘油二酯酰基转移酶的方式,优化丙二酰CoA合成途径,增强丙二酰CoA供应,显著促进泥质链霉菌中光神霉素合成[18].在委内瑞拉链霉菌中,敲除前体(2S)-丙二酸乙酯酰CoA代谢相关基因meaA,共表达泰乐菌素聚酮合酶与途径特异型调控因子PikD,增强前体供应,使泰乐酮产量提高了10倍[19].在红霉素的工业生产中,利用适量浓度正丙醇的添加,增强丙酰CoA供应,激活丙酰CoA羧化酶,加速甲基丙二酰CoA的转化率,可提高红霉素的产量[53-54];通过敲除丙酰CoA羧化酶的负调控蛋白PccD,提高丙酰CoA的同化效率和甲基丙二酰CoA供应,实现了红霉素产量的翻倍[55].在天蓝色链霉菌中,敲除G6P脱氢酶和过表达乙酰CoA羧化酶,增强丙二酰CoA的供应,最终使放线菌素的产量提高了近5倍[56]. ...
Improvement of erythromycin production by Saccharopolyspora erythraea in molasses based medium through cultivation medium optimization
1
2008
... 通过代谢工程及合成生物学手段强化酰基CoA前体的供应,是提高产物合成效率的常用策略.例如,在黄酮类物质的生物合成中,通过过表达异源乙酰CoA羧化酶和敲除酰基CoA:甘油二酯酰基转移酶的方式,优化丙二酰CoA合成途径,增强丙二酰CoA供应,显著促进泥质链霉菌中光神霉素合成[18].在委内瑞拉链霉菌中,敲除前体(2S)-丙二酸乙酯酰CoA代谢相关基因meaA,共表达泰乐菌素聚酮合酶与途径特异型调控因子PikD,增强前体供应,使泰乐酮产量提高了10倍[19].在红霉素的工业生产中,利用适量浓度正丙醇的添加,增强丙酰CoA供应,激活丙酰CoA羧化酶,加速甲基丙二酰CoA的转化率,可提高红霉素的产量[53-54];通过敲除丙酰CoA羧化酶的负调控蛋白PccD,提高丙酰CoA的同化效率和甲基丙二酰CoA供应,实现了红霉素产量的翻倍[55].在天蓝色链霉菌中,敲除G6P脱氢酶和过表达乙酰CoA羧化酶,增强丙二酰CoA的供应,最终使放线菌素的产量提高了近5倍[56]. ...
PccD regulates branched-chain amino acid degradation and exerts a negative effect on erythromycin production in Saccharopolyspora erythraea
1
2018
... 通过代谢工程及合成生物学手段强化酰基CoA前体的供应,是提高产物合成效率的常用策略.例如,在黄酮类物质的生物合成中,通过过表达异源乙酰CoA羧化酶和敲除酰基CoA:甘油二酯酰基转移酶的方式,优化丙二酰CoA合成途径,增强丙二酰CoA供应,显著促进泥质链霉菌中光神霉素合成[18].在委内瑞拉链霉菌中,敲除前体(2S)-丙二酸乙酯酰CoA代谢相关基因meaA,共表达泰乐菌素聚酮合酶与途径特异型调控因子PikD,增强前体供应,使泰乐酮产量提高了10倍[19].在红霉素的工业生产中,利用适量浓度正丙醇的添加,增强丙酰CoA供应,激活丙酰CoA羧化酶,加速甲基丙二酰CoA的转化率,可提高红霉素的产量[53-54];通过敲除丙酰CoA羧化酶的负调控蛋白PccD,提高丙酰CoA的同化效率和甲基丙二酰CoA供应,实现了红霉素产量的翻倍[55].在天蓝色链霉菌中,敲除G6P脱氢酶和过表达乙酰CoA羧化酶,增强丙二酰CoA的供应,最终使放线菌素的产量提高了近5倍[56]. ...
Engineering of primary carbohydrate metabolism for increased production of actinorhodin in Streptomyces coelicolor
1
2006
... 通过代谢工程及合成生物学手段强化酰基CoA前体的供应,是提高产物合成效率的常用策略.例如,在黄酮类物质的生物合成中,通过过表达异源乙酰CoA羧化酶和敲除酰基CoA:甘油二酯酰基转移酶的方式,优化丙二酰CoA合成途径,增强丙二酰CoA供应,显著促进泥质链霉菌中光神霉素合成[18].在委内瑞拉链霉菌中,敲除前体(2S)-丙二酸乙酯酰CoA代谢相关基因meaA,共表达泰乐菌素聚酮合酶与途径特异型调控因子PikD,增强前体供应,使泰乐酮产量提高了10倍[19].在红霉素的工业生产中,利用适量浓度正丙醇的添加,增强丙酰CoA供应,激活丙酰CoA羧化酶,加速甲基丙二酰CoA的转化率,可提高红霉素的产量[53-54];通过敲除丙酰CoA羧化酶的负调控蛋白PccD,提高丙酰CoA的同化效率和甲基丙二酰CoA供应,实现了红霉素产量的翻倍[55].在天蓝色链霉菌中,敲除G6P脱氢酶和过表达乙酰CoA羧化酶,增强丙二酰CoA的供应,最终使放线菌素的产量提高了近5倍[56]. ...
High-yield resveratrol production in engineered Escherichia coli
1
2011
... 在芪类物质的合成中,通过增加丙二酰CoA供应,同样可以实现白藜芦醇和赤松素生物合成的显著提高[57-58].在倍半萜青蒿素的前体紫穗槐二烯的生物合成中,通过过表达乙醛脱氢酶和乙酰CoA合成酶,增强乙酰CoA代谢流,使得紫穗槐二烯产量提高了一倍[59].通过重塑中心代谢的方式,提高胞内乙酰CoA供应,实现倍半萜烯类化合物法呢烯 (β-farnesene)发酵单位达130g/L[60].在生物能源类物质的生物合成中,提高乙酰CoA供应,可使正丁醇产量提升2倍,在此基础上继续敲除乙醇脱氢酶ADH1-5和过表达乙醛脱氢酶突变体adeEA267T/E568K,强化乙酰CoA供应,正丁醇产量进一步增加了40%[61]. ...
Metabolic engineering of Escherichia coli for the synthesis of the plant polyphenol pinosylvin
2
2015
... 在芪类物质的合成中,通过增加丙二酰CoA供应,同样可以实现白藜芦醇和赤松素生物合成的显著提高[57-58].在倍半萜青蒿素的前体紫穗槐二烯的生物合成中,通过过表达乙醛脱氢酶和乙酰CoA合成酶,增强乙酰CoA代谢流,使得紫穗槐二烯产量提高了一倍[59].通过重塑中心代谢的方式,提高胞内乙酰CoA供应,实现倍半萜烯类化合物法呢烯 (β-farnesene)发酵单位达130g/L[60].在生物能源类物质的生物合成中,提高乙酰CoA供应,可使正丁醇产量提升2倍,在此基础上继续敲除乙醇脱氢酶ADH1-5和过表达乙醛脱氢酶突变体adeEA267T/E568K,强化乙酰CoA供应,正丁醇产量进一步增加了40%[61]. ...
... 在人工构建的赤松素合成过程中,由于丙二酰CoA前体的供应是赤松素合成的限速步骤,因此添加丙二酰CoA激活剂浅蓝霉素,能有效提高丙二酰CoA前体的供应和赤松素产量[58].在随后的浅蓝霉素添加过程中,研究者再次发现了由于酰基化抑制导致的产物合成下降的现象,过量的浅蓝霉素添加诱发了三个合成元件催化酶的丙二酰化修饰,通过抑制4CL和STS的活性,阻碍赤松素的合成.对此,研究者利用PTM-ME策略,对酰基化敏感的4CL和STS丙二酰化位点进行改造,采取将赖氨酸替换为精氨酸的方式,将其改变为对酰基化不敏感的状态,在一定程度上消除了酰基化抑制效应,使得赤松素产量提高了近两倍(图5)[16].这些研究表明,PTM-ME策略对于解除内源性及外源性产物合成途径中酰基CoA诱发的酰基化反馈抑制、强化产物合成,都具有十分可观的成效. ...
Engineering of the pyruvate dehydrogenase bypass in Saccharomyces cerevisiae for high-level production of isoprenoids
1
2007
... 在芪类物质的合成中,通过增加丙二酰CoA供应,同样可以实现白藜芦醇和赤松素生物合成的显著提高[57-58].在倍半萜青蒿素的前体紫穗槐二烯的生物合成中,通过过表达乙醛脱氢酶和乙酰CoA合成酶,增强乙酰CoA代谢流,使得紫穗槐二烯产量提高了一倍[59].通过重塑中心代谢的方式,提高胞内乙酰CoA供应,实现倍半萜烯类化合物法呢烯 (β-farnesene)发酵单位达130g/L[60].在生物能源类物质的生物合成中,提高乙酰CoA供应,可使正丁醇产量提升2倍,在此基础上继续敲除乙醇脱氢酶ADH1-5和过表达乙醛脱氢酶突变体adeEA267T/E568K,强化乙酰CoA供应,正丁醇产量进一步增加了40%[61]. ...
Rewriting yeast central carbon metabolism for industrial isoprenoid production
1
2016
... 在芪类物质的合成中,通过增加丙二酰CoA供应,同样可以实现白藜芦醇和赤松素生物合成的显著提高[57-58].在倍半萜青蒿素的前体紫穗槐二烯的生物合成中,通过过表达乙醛脱氢酶和乙酰CoA合成酶,增强乙酰CoA代谢流,使得紫穗槐二烯产量提高了一倍[59].通过重塑中心代谢的方式,提高胞内乙酰CoA供应,实现倍半萜烯类化合物法呢烯 (β-farnesene)发酵单位达130g/L[60].在生物能源类物质的生物合成中,提高乙酰CoA供应,可使正丁醇产量提升2倍,在此基础上继续敲除乙醇脱氢酶ADH1-5和过表达乙醛脱氢酶突变体adeEA267T/E568K,强化乙酰CoA供应,正丁醇产量进一步增加了40%[61]. ...
N-butanol production in Saccharomyces cerevisiae is limited by the availability of coenzyme A and cytosolic acetyl-CoA
1
2016
... 在芪类物质的合成中,通过增加丙二酰CoA供应,同样可以实现白藜芦醇和赤松素生物合成的显著提高[57-58].在倍半萜青蒿素的前体紫穗槐二烯的生物合成中,通过过表达乙醛脱氢酶和乙酰CoA合成酶,增强乙酰CoA代谢流,使得紫穗槐二烯产量提高了一倍[59].通过重塑中心代谢的方式,提高胞内乙酰CoA供应,实现倍半萜烯类化合物法呢烯 (β-farnesene)发酵单位达130g/L[60].在生物能源类物质的生物合成中,提高乙酰CoA供应,可使正丁醇产量提升2倍,在此基础上继续敲除乙醇脱氢酶ADH1-5和过表达乙醛脱氢酶突变体adeEA267T/E568K,强化乙酰CoA供应,正丁醇产量进一步增加了40%[61]. ...
Minimizing acetate formation in E.coli fermentations
1
2007
... 除了提高前体酰基CoA的供应之外,消除与产物合成无关的酰基CoA消耗也是强化前体供应的有效手段.以常用的底盘细胞大肠杆菌为例,高速生长期代谢溢出产生的乙酸是有氧发酵的主要副产物,乙酸积累对细胞生长和产物合成都有负面影响,是一种碳源的损耗[62].因此,针对这种碳源损耗的代谢工程改造有利于提高产物的合成. ...
Characterization of the acetate-producing pathways in Escherichia coli
1
2005
... 乙酸主要来源于两个途径:磷酸转乙酰基酶/乙酸激酶(Pta/AckA)途径和丙酮酸氧化酶(PoxB)途径[63].在大肠杆菌中,敲除pta能够有效减少乙酸生成,同时增加产物白介素-2和脂肪酶的合成[64-65];敲除pta同样能使脂肪酸产量提高20%[66];同时敲除pta和ackA可使乙酸异戊酯产量增加一倍[67],在此基础上继续敲除poxB虽然能进一步降低乙酸生成,但产物产量却没有随之增加[68].在真氧产碱杆菌和棕色固氮菌中采用相同的策略,同样实现聚羟基丁酸酯(PHB)产量提高2.5倍[69-71].Mccleary等[72]认为,敲除Pta/AckA途径能有效减少乙酸的生成,但也会造成ATP和AcP合成受限,可能在一定程度上影响细胞的生长代谢.对此,Kim等[73]采用反义RNA技术降低Pta/AckA表达水平,也可实现产物产量2倍的增长. ...
Improved expression of human interleukin-2 in high-cell-density fermentor cultures of Escherichia coli K-12 by a phosphotransacetylase mutant
1
1990
... 乙酸主要来源于两个途径:磷酸转乙酰基酶/乙酸激酶(Pta/AckA)途径和丙酮酸氧化酶(PoxB)途径[63].在大肠杆菌中,敲除pta能够有效减少乙酸生成,同时增加产物白介素-2和脂肪酶的合成[64-65];敲除pta同样能使脂肪酸产量提高20%[66];同时敲除pta和ackA可使乙酸异戊酯产量增加一倍[67],在此基础上继续敲除poxB虽然能进一步降低乙酸生成,但产物产量却没有随之增加[68].在真氧产碱杆菌和棕色固氮菌中采用相同的策略,同样实现聚羟基丁酸酯(PHB)产量提高2.5倍[69-71].Mccleary等[72]认为,敲除Pta/AckA途径能有效减少乙酸的生成,但也会造成ATP和AcP合成受限,可能在一定程度上影响细胞的生长代谢.对此,Kim等[73]采用反义RNA技术降低Pta/AckA表达水平,也可实现产物产量2倍的增长. ...
Characterization and evaluation of a pta (phosphotransacetylase) negative mutant of Escherichia coli HB101 as production host of foreign lipase
1
1994
... 乙酸主要来源于两个途径:磷酸转乙酰基酶/乙酸激酶(Pta/AckA)途径和丙酮酸氧化酶(PoxB)途径[63].在大肠杆菌中,敲除pta能够有效减少乙酸生成,同时增加产物白介素-2和脂肪酶的合成[64-65];敲除pta同样能使脂肪酸产量提高20%[66];同时敲除pta和ackA可使乙酸异戊酯产量增加一倍[67],在此基础上继续敲除poxB虽然能进一步降低乙酸生成,但产物产量却没有随之增加[68].在真氧产碱杆菌和棕色固氮菌中采用相同的策略,同样实现聚羟基丁酸酯(PHB)产量提高2.5倍[69-71].Mccleary等[72]认为,敲除Pta/AckA途径能有效减少乙酸的生成,但也会造成ATP和AcP合成受限,可能在一定程度上影响细胞的生长代谢.对此,Kim等[73]采用反义RNA技术降低Pta/AckA表达水平,也可实现产物产量2倍的增长. ...
Acetyl-CoA synthetase overexpression in Escherichia coli demonstrates more efficient acetate assimilation and lower acetate accumulation: a potential tool in metabolic engineering
1
2006
... 乙酸主要来源于两个途径:磷酸转乙酰基酶/乙酸激酶(Pta/AckA)途径和丙酮酸氧化酶(PoxB)途径[63].在大肠杆菌中,敲除pta能够有效减少乙酸生成,同时增加产物白介素-2和脂肪酶的合成[64-65];敲除pta同样能使脂肪酸产量提高20%[66];同时敲除pta和ackA可使乙酸异戊酯产量增加一倍[67],在此基础上继续敲除poxB虽然能进一步降低乙酸生成,但产物产量却没有随之增加[68].在真氧产碱杆菌和棕色固氮菌中采用相同的策略,同样实现聚羟基丁酸酯(PHB)产量提高2.5倍[69-71].Mccleary等[72]认为,敲除Pta/AckA途径能有效减少乙酸的生成,但也会造成ATP和AcP合成受限,可能在一定程度上影响细胞的生长代谢.对此,Kim等[73]采用反义RNA技术降低Pta/AckA表达水平,也可实现产物产量2倍的增长. ...
Production of isoamyl acetate in ackA-pta and/or ldh mutants of Escherichia coli with overexpression of yeast AFT2
1
2004
... 乙酸主要来源于两个途径:磷酸转乙酰基酶/乙酸激酶(Pta/AckA)途径和丙酮酸氧化酶(PoxB)途径[63].在大肠杆菌中,敲除pta能够有效减少乙酸生成,同时增加产物白介素-2和脂肪酶的合成[64-65];敲除pta同样能使脂肪酸产量提高20%[66];同时敲除pta和ackA可使乙酸异戊酯产量增加一倍[67],在此基础上继续敲除poxB虽然能进一步降低乙酸生成,但产物产量却没有随之增加[68].在真氧产碱杆菌和棕色固氮菌中采用相同的策略,同样实现聚羟基丁酸酯(PHB)产量提高2.5倍[69-71].Mccleary等[72]认为,敲除Pta/AckA途径能有效减少乙酸的生成,但也会造成ATP和AcP合成受限,可能在一定程度上影响细胞的生长代谢.对此,Kim等[73]采用反义RNA技术降低Pta/AckA表达水平,也可实现产物产量2倍的增长. ...
Redistribution of metabolic fluxes in the central aerobic metabolic pathway of E. coli mutant strains with deletion of the ackA-pta and poxb pathways for the synthesis of isoamyl acetate
1
2005
... 乙酸主要来源于两个途径:磷酸转乙酰基酶/乙酸激酶(Pta/AckA)途径和丙酮酸氧化酶(PoxB)途径[63].在大肠杆菌中,敲除pta能够有效减少乙酸生成,同时增加产物白介素-2和脂肪酶的合成[64-65];敲除pta同样能使脂肪酸产量提高20%[66];同时敲除pta和ackA可使乙酸异戊酯产量增加一倍[67],在此基础上继续敲除poxB虽然能进一步降低乙酸生成,但产物产量却没有随之增加[68].在真氧产碱杆菌和棕色固氮菌中采用相同的策略,同样实现聚羟基丁酸酯(PHB)产量提高2.5倍[69-71].Mccleary等[72]认为,敲除Pta/AckA途径能有效减少乙酸的生成,但也会造成ATP和AcP合成受限,可能在一定程度上影响细胞的生长代谢.对此,Kim等[73]采用反义RNA技术降低Pta/AckA表达水平,也可实现产物产量2倍的增长. ...
Improving poly-3-hydroxybutyrate production in Escherichia coli by combining the increase in the NADPH pool and acetyl-CoA availability
1
2014
... 乙酸主要来源于两个途径:磷酸转乙酰基酶/乙酸激酶(Pta/AckA)途径和丙酮酸氧化酶(PoxB)途径[63].在大肠杆菌中,敲除pta能够有效减少乙酸生成,同时增加产物白介素-2和脂肪酶的合成[64-65];敲除pta同样能使脂肪酸产量提高20%[66];同时敲除pta和ackA可使乙酸异戊酯产量增加一倍[67],在此基础上继续敲除poxB虽然能进一步降低乙酸生成,但产物产量却没有随之增加[68].在真氧产碱杆菌和棕色固氮菌中采用相同的策略,同样实现聚羟基丁酸酯(PHB)产量提高2.5倍[69-71].Mccleary等[72]认为,敲除Pta/AckA途径能有效减少乙酸的生成,但也会造成ATP和AcP合成受限,可能在一定程度上影响细胞的生长代谢.对此,Kim等[73]采用反义RNA技术降低Pta/AckA表达水平,也可实现产物产量2倍的增长. ...
Acetate metabolism in a pta mutant of Escherichia coli W3110: Importance of maintaining acetyl coenzyme a flux for growth and survival
0
1999
Phosphotransacetylase as a key factor in biological production of polyhydroxybutyrate
1
2000
... 乙酸主要来源于两个途径:磷酸转乙酰基酶/乙酸激酶(Pta/AckA)途径和丙酮酸氧化酶(PoxB)途径[63].在大肠杆菌中,敲除pta能够有效减少乙酸生成,同时增加产物白介素-2和脂肪酶的合成[64-65];敲除pta同样能使脂肪酸产量提高20%[66];同时敲除pta和ackA可使乙酸异戊酯产量增加一倍[67],在此基础上继续敲除poxB虽然能进一步降低乙酸生成,但产物产量却没有随之增加[68].在真氧产碱杆菌和棕色固氮菌中采用相同的策略,同样实现聚羟基丁酸酯(PHB)产量提高2.5倍[69-71].Mccleary等[72]认为,敲除Pta/AckA途径能有效减少乙酸的生成,但也会造成ATP和AcP合成受限,可能在一定程度上影响细胞的生长代谢.对此,Kim等[73]采用反义RNA技术降低Pta/AckA表达水平,也可实现产物产量2倍的增长. ...
Is acetyl phosphate a global signal in Escherichia coli?
1
1993
... 乙酸主要来源于两个途径:磷酸转乙酰基酶/乙酸激酶(Pta/AckA)途径和丙酮酸氧化酶(PoxB)途径[63].在大肠杆菌中,敲除pta能够有效减少乙酸生成,同时增加产物白介素-2和脂肪酶的合成[64-65];敲除pta同样能使脂肪酸产量提高20%[66];同时敲除pta和ackA可使乙酸异戊酯产量增加一倍[67],在此基础上继续敲除poxB虽然能进一步降低乙酸生成,但产物产量却没有随之增加[68].在真氧产碱杆菌和棕色固氮菌中采用相同的策略,同样实现聚羟基丁酸酯(PHB)产量提高2.5倍[69-71].Mccleary等[72]认为,敲除Pta/AckA途径能有效减少乙酸的生成,但也会造成ATP和AcP合成受限,可能在一定程度上影响细胞的生长代谢.对此,Kim等[73]采用反义RNA技术降低Pta/AckA表达水平,也可实现产物产量2倍的增长. ...
Down-regulation of acetate pathway through antisense strategy in Escherichia coli: improved foreign protein production
1
2003
... 乙酸主要来源于两个途径:磷酸转乙酰基酶/乙酸激酶(Pta/AckA)途径和丙酮酸氧化酶(PoxB)途径[63].在大肠杆菌中,敲除pta能够有效减少乙酸生成,同时增加产物白介素-2和脂肪酶的合成[64-65];敲除pta同样能使脂肪酸产量提高20%[66];同时敲除pta和ackA可使乙酸异戊酯产量增加一倍[67],在此基础上继续敲除poxB虽然能进一步降低乙酸生成,但产物产量却没有随之增加[68].在真氧产碱杆菌和棕色固氮菌中采用相同的策略,同样实现聚羟基丁酸酯(PHB)产量提高2.5倍[69-71].Mccleary等[72]认为,敲除Pta/AckA途径能有效减少乙酸的生成,但也会造成ATP和AcP合成受限,可能在一定程度上影响细胞的生长代谢.对此,Kim等[73]采用反义RNA技术降低Pta/AckA表达水平,也可实现产物产量2倍的增长. ...
Engineering a native homoethanol pathway in Escherichia coli B for ethanol production
1
2008
... 为了实现产物合成的最优化,除了针对Pta/AckA途径和PoxB途径的敲除/敲低之外,也需要配合其他竞争途径关键酶的敲除改造.例如,组合敲除ackA、乳酸脱氢酶和富马酸还原酶,可使乙醇产量提高2倍[74];组合敲除乳酸脱氢酶、乙醇脱氢酶和富马酸还原酶,可使正丁醇产量提高1倍[75];组合敲除pta、富马酸还原酶、乳酸脱氢酶和乙醇脱氢酶,结合培养条件的优化,可使丁酸盐终产量提高近10倍[76]. ...
Metabolic engineering of Escherichia coli for 1-butanol production
1
2008
... 为了实现产物合成的最优化,除了针对Pta/AckA途径和PoxB途径的敲除/敲低之外,也需要配合其他竞争途径关键酶的敲除改造.例如,组合敲除ackA、乳酸脱氢酶和富马酸还原酶,可使乙醇产量提高2倍[74];组合敲除乳酸脱氢酶、乙醇脱氢酶和富马酸还原酶,可使正丁醇产量提高1倍[75];组合敲除pta、富马酸还原酶、乳酸脱氢酶和乙醇脱氢酶,结合培养条件的优化,可使丁酸盐终产量提高近10倍[76]. ...
Butyrate production in engineered Escherichia coli with synthetic scaffolds
1
2013
... 为了实现产物合成的最优化,除了针对Pta/AckA途径和PoxB途径的敲除/敲低之外,也需要配合其他竞争途径关键酶的敲除改造.例如,组合敲除ackA、乳酸脱氢酶和富马酸还原酶,可使乙醇产量提高2倍[74];组合敲除乳酸脱氢酶、乙醇脱氢酶和富马酸还原酶,可使正丁醇产量提高1倍[75];组合敲除pta、富马酸还原酶、乳酸脱氢酶和乙醇脱氢酶,结合培养条件的优化,可使丁酸盐终产量提高近10倍[76]. ...
Post-translational protein acetylation: an elegant mechanism for bacteria to dynamically regulate metabolic functions
1
2019
... 转录层面的调控主要通过调节相关转录调控因子的酰基化水平实现.微生物的生长过程往往伴随着碳、氮、磷等营养物质的供给波动,由不同转录因子介导的转录调控能够消除营养物质剧烈波动引起的代谢紊乱,以及由此产生的对细胞生长、分化、繁殖和次级代谢产物合成的不良影响.大量的研究发现,胞内许多转录调控因子是酰基化的修饰底物,其修饰位点多位于DNA结合结构域,通过改变赖氨酸的电荷,抑制与DNA的结合活性的方式影响靶基因的转录[77-79].例如,类球红细菌中氧敏调控因子FnrL的乙酰化抑制其与靶标DNA的相互作用[80];沙门氏菌中亮氨酸响应调控因子Lrp的乙酰化导致其DNA结合活性的显著降低[81],毒力调控因子PhoP的乙酰化能降低其毒性[82],毒力调控因子HilD的乙酰化能增强其稳定性[83];天蓝色链霉菌中氮调控因子GlnR的多位点乙酰化显著抑制其DNA结合能力和协同调控能力[84];红霉糖多孢菌中磷调控因子PhoP的丙酰化强烈抑制其PHO结构域的DNA结合活性,削弱对靶基因的调控能力[85].微生物的生长和次级代谢产物合成过程并非依赖某一调控因子的单线调控,而是涉及更为复杂的包括全局调控因子和特异性调控因子在内的多线交互调控[86-87],这些调控因子的酰基化修饰,在影响靶基因转录的同时,也可能对初级代谢和次级代谢产生其他重要的影响. ...
Protein acetylation in bacteria
0
2019
The balance metabolism safety net: Integration of stress signals by interacting transcriptional factors in streptomyces and related actinobacteria
1
2020
... 转录层面的调控主要通过调节相关转录调控因子的酰基化水平实现.微生物的生长过程往往伴随着碳、氮、磷等营养物质的供给波动,由不同转录因子介导的转录调控能够消除营养物质剧烈波动引起的代谢紊乱,以及由此产生的对细胞生长、分化、繁殖和次级代谢产物合成的不良影响.大量的研究发现,胞内许多转录调控因子是酰基化的修饰底物,其修饰位点多位于DNA结合结构域,通过改变赖氨酸的电荷,抑制与DNA的结合活性的方式影响靶基因的转录[77-79].例如,类球红细菌中氧敏调控因子FnrL的乙酰化抑制其与靶标DNA的相互作用[80];沙门氏菌中亮氨酸响应调控因子Lrp的乙酰化导致其DNA结合活性的显著降低[81],毒力调控因子PhoP的乙酰化能降低其毒性[82],毒力调控因子HilD的乙酰化能增强其稳定性[83];天蓝色链霉菌中氮调控因子GlnR的多位点乙酰化显著抑制其DNA结合能力和协同调控能力[84];红霉糖多孢菌中磷调控因子PhoP的丙酰化强烈抑制其PHO结构域的DNA结合活性,削弱对靶基因的调控能力[85].微生物的生长和次级代谢产物合成过程并非依赖某一调控因子的单线调控,而是涉及更为复杂的包括全局调控因子和特异性调控因子在内的多线交互调控[86-87],这些调控因子的酰基化修饰,在影响靶基因转录的同时,也可能对初级代谢和次级代谢产生其他重要的影响. ...
Lysine acetylation regulates the function of the global anaerobic transcription factor FnrL in Rhodobacter sphaeroides
1
2017
... 转录层面的调控主要通过调节相关转录调控因子的酰基化水平实现.微生物的生长过程往往伴随着碳、氮、磷等营养物质的供给波动,由不同转录因子介导的转录调控能够消除营养物质剧烈波动引起的代谢紊乱,以及由此产生的对细胞生长、分化、繁殖和次级代谢产物合成的不良影响.大量的研究发现,胞内许多转录调控因子是酰基化的修饰底物,其修饰位点多位于DNA结合结构域,通过改变赖氨酸的电荷,抑制与DNA的结合活性的方式影响靶基因的转录[77-79].例如,类球红细菌中氧敏调控因子FnrL的乙酰化抑制其与靶标DNA的相互作用[80];沙门氏菌中亮氨酸响应调控因子Lrp的乙酰化导致其DNA结合活性的显著降低[81],毒力调控因子PhoP的乙酰化能降低其毒性[82],毒力调控因子HilD的乙酰化能增强其稳定性[83];天蓝色链霉菌中氮调控因子GlnR的多位点乙酰化显著抑制其DNA结合能力和协同调控能力[84];红霉糖多孢菌中磷调控因子PhoP的丙酰化强烈抑制其PHO结构域的DNA结合活性,削弱对靶基因的调控能力[85].微生物的生长和次级代谢产物合成过程并非依赖某一调控因子的单线调控,而是涉及更为复杂的包括全局调控因子和特异性调控因子在内的多线交互调控[86-87],这些调控因子的酰基化修饰,在影响靶基因转录的同时,也可能对初级代谢和次级代谢产生其他重要的影响. ...
The bacterial two-hybrid system uncovers the involvement of acetylation in regulating of Lrp activity in Salmonella typhimurium
2
2016
... 转录层面的调控主要通过调节相关转录调控因子的酰基化水平实现.微生物的生长过程往往伴随着碳、氮、磷等营养物质的供给波动,由不同转录因子介导的转录调控能够消除营养物质剧烈波动引起的代谢紊乱,以及由此产生的对细胞生长、分化、繁殖和次级代谢产物合成的不良影响.大量的研究发现,胞内许多转录调控因子是酰基化的修饰底物,其修饰位点多位于DNA结合结构域,通过改变赖氨酸的电荷,抑制与DNA的结合活性的方式影响靶基因的转录[77-79].例如,类球红细菌中氧敏调控因子FnrL的乙酰化抑制其与靶标DNA的相互作用[80];沙门氏菌中亮氨酸响应调控因子Lrp的乙酰化导致其DNA结合活性的显著降低[81],毒力调控因子PhoP的乙酰化能降低其毒性[82],毒力调控因子HilD的乙酰化能增强其稳定性[83];天蓝色链霉菌中氮调控因子GlnR的多位点乙酰化显著抑制其DNA结合能力和协同调控能力[84];红霉糖多孢菌中磷调控因子PhoP的丙酰化强烈抑制其PHO结构域的DNA结合活性,削弱对靶基因的调控能力[85].微生物的生长和次级代谢产物合成过程并非依赖某一调控因子的单线调控,而是涉及更为复杂的包括全局调控因子和特异性调控因子在内的多线交互调控[86-87],这些调控因子的酰基化修饰,在影响靶基因转录的同时,也可能对初级代谢和次级代谢产生其他重要的影响. ...
... 红霉素是医药和畜牧业中常用的大环内酯类抗生素.在红霉素的发酵生产过程中,研究者发现蛋白质丙二酰化和丙酰化会影响菌体生长及红霉素的合成,且胞内丙二酰化/丙酰化水平与产物合成效率呈负相关[17,85,100-101].红霉素合成前体丙二酰CoA/丙酰CoA的适量供应有利于产物合成,当前体丙二酰CoA/丙酰CoA积累过量时,又会产生酰基化效应,抑制产物合成.Xu等[85]运用丙二酰化修饰组学技术,从132个蛋白上共鉴定到192个丙二酰化修饰位点,结合生物信息学分析发现丙二酰化修饰蛋白在核糖体及中心代谢途径中显著富集,其中,乙酰CoA合成酶(Acs)和谷氨酰胺合成酶的活性受到丙二酰化的显著抑制.由于正丙醇或丙酸盐添加是提高红霉素发酵单位的常用手段,研究者随后对丙酰化组学的研究证实,酰基CoA浓度的动态改变会引起蛋白质酰基化水平与红霉素产量随之改变的连锁反应.利用定量酰基化组学技术,酶学特征分析和酰基化模拟分析,研究者确定了丙酰化修饰是影响红霉素产量的关键修饰,从两个层面负调控红霉素的合成:一是通过抑制丙二酸半醛脱氢酶(MmsA2)、丙醛脱氢酶(Adh)、SAM合成酶(SAMS)和丙酰CoA合成酶(PrpE)的活性阻碍丙酰CoA的合成;二是通过对全局调控因子PhoP的抑制,降低其PHO结构域的DNA结合活性,削弱靶基因红霉素合成基因簇的转录[13]以及细胞对碳源的利用.在此基础上,研究者利用PTM-ME策略,对酰基化酶和酰基化修饰系统分别进行了脱敏和优化改造.通过敲除丙酰转移酶(GNAT)、过表达去丙酰化酶(SrtN)和酰基化不敏感酶(SACE_1780)等方式,消除丙酰化对红霉素合成的抑制作用,最终实现工业高产菌中红霉素的产量翻番[81,96-97,99](图4). ...
Acetylation of lysine 201 inhibits the DNA-binding ability of PhoP to regulate Salmonella virulence
1
2016
... 转录层面的调控主要通过调节相关转录调控因子的酰基化水平实现.微生物的生长过程往往伴随着碳、氮、磷等营养物质的供给波动,由不同转录因子介导的转录调控能够消除营养物质剧烈波动引起的代谢紊乱,以及由此产生的对细胞生长、分化、繁殖和次级代谢产物合成的不良影响.大量的研究发现,胞内许多转录调控因子是酰基化的修饰底物,其修饰位点多位于DNA结合结构域,通过改变赖氨酸的电荷,抑制与DNA的结合活性的方式影响靶基因的转录[77-79].例如,类球红细菌中氧敏调控因子FnrL的乙酰化抑制其与靶标DNA的相互作用[80];沙门氏菌中亮氨酸响应调控因子Lrp的乙酰化导致其DNA结合活性的显著降低[81],毒力调控因子PhoP的乙酰化能降低其毒性[82],毒力调控因子HilD的乙酰化能增强其稳定性[83];天蓝色链霉菌中氮调控因子GlnR的多位点乙酰化显著抑制其DNA结合能力和协同调控能力[84];红霉糖多孢菌中磷调控因子PhoP的丙酰化强烈抑制其PHO结构域的DNA结合活性,削弱对靶基因的调控能力[85].微生物的生长和次级代谢产物合成过程并非依赖某一调控因子的单线调控,而是涉及更为复杂的包括全局调控因子和特异性调控因子在内的多线交互调控[86-87],这些调控因子的酰基化修饰,在影响靶基因转录的同时,也可能对初级代谢和次级代谢产生其他重要的影响. ...
Protein acetylation is involved in Salmonella enterica serovar typhimurium virulence
1
2016
... 转录层面的调控主要通过调节相关转录调控因子的酰基化水平实现.微生物的生长过程往往伴随着碳、氮、磷等营养物质的供给波动,由不同转录因子介导的转录调控能够消除营养物质剧烈波动引起的代谢紊乱,以及由此产生的对细胞生长、分化、繁殖和次级代谢产物合成的不良影响.大量的研究发现,胞内许多转录调控因子是酰基化的修饰底物,其修饰位点多位于DNA结合结构域,通过改变赖氨酸的电荷,抑制与DNA的结合活性的方式影响靶基因的转录[77-79].例如,类球红细菌中氧敏调控因子FnrL的乙酰化抑制其与靶标DNA的相互作用[80];沙门氏菌中亮氨酸响应调控因子Lrp的乙酰化导致其DNA结合活性的显著降低[81],毒力调控因子PhoP的乙酰化能降低其毒性[82],毒力调控因子HilD的乙酰化能增强其稳定性[83];天蓝色链霉菌中氮调控因子GlnR的多位点乙酰化显著抑制其DNA结合能力和协同调控能力[84];红霉糖多孢菌中磷调控因子PhoP的丙酰化强烈抑制其PHO结构域的DNA结合活性,削弱对靶基因的调控能力[85].微生物的生长和次级代谢产物合成过程并非依赖某一调控因子的单线调控,而是涉及更为复杂的包括全局调控因子和特异性调控因子在内的多线交互调控[86-87],这些调控因子的酰基化修饰,在影响靶基因转录的同时,也可能对初级代谢和次级代谢产生其他重要的影响. ...
Post-translational serine/threonine phosphorylation and lysine acetylation: a novel regulatory aspect of the global nitrogen response regulator GlnR in S. coelicolor M145
1
2016
... 转录层面的调控主要通过调节相关转录调控因子的酰基化水平实现.微生物的生长过程往往伴随着碳、氮、磷等营养物质的供给波动,由不同转录因子介导的转录调控能够消除营养物质剧烈波动引起的代谢紊乱,以及由此产生的对细胞生长、分化、繁殖和次级代谢产物合成的不良影响.大量的研究发现,胞内许多转录调控因子是酰基化的修饰底物,其修饰位点多位于DNA结合结构域,通过改变赖氨酸的电荷,抑制与DNA的结合活性的方式影响靶基因的转录[77-79].例如,类球红细菌中氧敏调控因子FnrL的乙酰化抑制其与靶标DNA的相互作用[80];沙门氏菌中亮氨酸响应调控因子Lrp的乙酰化导致其DNA结合活性的显著降低[81],毒力调控因子PhoP的乙酰化能降低其毒性[82],毒力调控因子HilD的乙酰化能增强其稳定性[83];天蓝色链霉菌中氮调控因子GlnR的多位点乙酰化显著抑制其DNA结合能力和协同调控能力[84];红霉糖多孢菌中磷调控因子PhoP的丙酰化强烈抑制其PHO结构域的DNA结合活性,削弱对靶基因的调控能力[85].微生物的生长和次级代谢产物合成过程并非依赖某一调控因子的单线调控,而是涉及更为复杂的包括全局调控因子和特异性调控因子在内的多线交互调控[86-87],这些调控因子的酰基化修饰,在影响靶基因转录的同时,也可能对初级代谢和次级代谢产生其他重要的影响. ...
Lysine propionylation modulates the transcriptional activity of phosphate regulator PhoP in Saccharopolyspora erythraea
3
2018
... 转录层面的调控主要通过调节相关转录调控因子的酰基化水平实现.微生物的生长过程往往伴随着碳、氮、磷等营养物质的供给波动,由不同转录因子介导的转录调控能够消除营养物质剧烈波动引起的代谢紊乱,以及由此产生的对细胞生长、分化、繁殖和次级代谢产物合成的不良影响.大量的研究发现,胞内许多转录调控因子是酰基化的修饰底物,其修饰位点多位于DNA结合结构域,通过改变赖氨酸的电荷,抑制与DNA的结合活性的方式影响靶基因的转录[77-79].例如,类球红细菌中氧敏调控因子FnrL的乙酰化抑制其与靶标DNA的相互作用[80];沙门氏菌中亮氨酸响应调控因子Lrp的乙酰化导致其DNA结合活性的显著降低[81],毒力调控因子PhoP的乙酰化能降低其毒性[82],毒力调控因子HilD的乙酰化能增强其稳定性[83];天蓝色链霉菌中氮调控因子GlnR的多位点乙酰化显著抑制其DNA结合能力和协同调控能力[84];红霉糖多孢菌中磷调控因子PhoP的丙酰化强烈抑制其PHO结构域的DNA结合活性,削弱对靶基因的调控能力[85].微生物的生长和次级代谢产物合成过程并非依赖某一调控因子的单线调控,而是涉及更为复杂的包括全局调控因子和特异性调控因子在内的多线交互调控[86-87],这些调控因子的酰基化修饰,在影响靶基因转录的同时,也可能对初级代谢和次级代谢产生其他重要的影响. ...
... 红霉素是医药和畜牧业中常用的大环内酯类抗生素.在红霉素的发酵生产过程中,研究者发现蛋白质丙二酰化和丙酰化会影响菌体生长及红霉素的合成,且胞内丙二酰化/丙酰化水平与产物合成效率呈负相关[17,85,100-101].红霉素合成前体丙二酰CoA/丙酰CoA的适量供应有利于产物合成,当前体丙二酰CoA/丙酰CoA积累过量时,又会产生酰基化效应,抑制产物合成.Xu等[85]运用丙二酰化修饰组学技术,从132个蛋白上共鉴定到192个丙二酰化修饰位点,结合生物信息学分析发现丙二酰化修饰蛋白在核糖体及中心代谢途径中显著富集,其中,乙酰CoA合成酶(Acs)和谷氨酰胺合成酶的活性受到丙二酰化的显著抑制.由于正丙醇或丙酸盐添加是提高红霉素发酵单位的常用手段,研究者随后对丙酰化组学的研究证实,酰基CoA浓度的动态改变会引起蛋白质酰基化水平与红霉素产量随之改变的连锁反应.利用定量酰基化组学技术,酶学特征分析和酰基化模拟分析,研究者确定了丙酰化修饰是影响红霉素产量的关键修饰,从两个层面负调控红霉素的合成:一是通过抑制丙二酸半醛脱氢酶(MmsA2)、丙醛脱氢酶(Adh)、SAM合成酶(SAMS)和丙酰CoA合成酶(PrpE)的活性阻碍丙酰CoA的合成;二是通过对全局调控因子PhoP的抑制,降低其PHO结构域的DNA结合活性,削弱靶基因红霉素合成基因簇的转录[13]以及细胞对碳源的利用.在此基础上,研究者利用PTM-ME策略,对酰基化酶和酰基化修饰系统分别进行了脱敏和优化改造.通过敲除丙酰转移酶(GNAT)、过表达去丙酰化酶(SrtN)和酰基化不敏感酶(SACE_1780)等方式,消除丙酰化对红霉素合成的抑制作用,最终实现工业高产菌中红霉素的产量翻番[81,96-97,99](图4). ...
... [85]运用丙二酰化修饰组学技术,从132个蛋白上共鉴定到192个丙二酰化修饰位点,结合生物信息学分析发现丙二酰化修饰蛋白在核糖体及中心代谢途径中显著富集,其中,乙酰CoA合成酶(Acs)和谷氨酰胺合成酶的活性受到丙二酰化的显著抑制.由于正丙醇或丙酸盐添加是提高红霉素发酵单位的常用手段,研究者随后对丙酰化组学的研究证实,酰基CoA浓度的动态改变会引起蛋白质酰基化水平与红霉素产量随之改变的连锁反应.利用定量酰基化组学技术,酶学特征分析和酰基化模拟分析,研究者确定了丙酰化修饰是影响红霉素产量的关键修饰,从两个层面负调控红霉素的合成:一是通过抑制丙二酸半醛脱氢酶(MmsA2)、丙醛脱氢酶(Adh)、SAM合成酶(SAMS)和丙酰CoA合成酶(PrpE)的活性阻碍丙酰CoA的合成;二是通过对全局调控因子PhoP的抑制,降低其PHO结构域的DNA结合活性,削弱靶基因红霉素合成基因簇的转录[13]以及细胞对碳源的利用.在此基础上,研究者利用PTM-ME策略,对酰基化酶和酰基化修饰系统分别进行了脱敏和优化改造.通过敲除丙酰转移酶(GNAT)、过表达去丙酰化酶(SrtN)和酰基化不敏感酶(SACE_1780)等方式,消除丙酰化对红霉素合成的抑制作用,最终实现工业高产菌中红霉素的产量翻番[81,96-97,99](图4). ...
Three genes encoding citrate synthases in Saccharopolyspora erythraea are regulated by the global nutrient-sensing regulators GlnR, DasR, and CRP
1
2014
... 转录层面的调控主要通过调节相关转录调控因子的酰基化水平实现.微生物的生长过程往往伴随着碳、氮、磷等营养物质的供给波动,由不同转录因子介导的转录调控能够消除营养物质剧烈波动引起的代谢紊乱,以及由此产生的对细胞生长、分化、繁殖和次级代谢产物合成的不良影响.大量的研究发现,胞内许多转录调控因子是酰基化的修饰底物,其修饰位点多位于DNA结合结构域,通过改变赖氨酸的电荷,抑制与DNA的结合活性的方式影响靶基因的转录[77-79].例如,类球红细菌中氧敏调控因子FnrL的乙酰化抑制其与靶标DNA的相互作用[80];沙门氏菌中亮氨酸响应调控因子Lrp的乙酰化导致其DNA结合活性的显著降低[81],毒力调控因子PhoP的乙酰化能降低其毒性[82],毒力调控因子HilD的乙酰化能增强其稳定性[83];天蓝色链霉菌中氮调控因子GlnR的多位点乙酰化显著抑制其DNA结合能力和协同调控能力[84];红霉糖多孢菌中磷调控因子PhoP的丙酰化强烈抑制其PHO结构域的DNA结合活性,削弱对靶基因的调控能力[85].微生物的生长和次级代谢产物合成过程并非依赖某一调控因子的单线调控,而是涉及更为复杂的包括全局调控因子和特异性调控因子在内的多线交互调控[86-87],这些调控因子的酰基化修饰,在影响靶基因转录的同时,也可能对初级代谢和次级代谢产生其他重要的影响. ...
GntR family regulator DasR controls acetate assimilation by directly repressing the acsa gene in Saccharopolyspora erythraea
1
2018
... 转录层面的调控主要通过调节相关转录调控因子的酰基化水平实现.微生物的生长过程往往伴随着碳、氮、磷等营养物质的供给波动,由不同转录因子介导的转录调控能够消除营养物质剧烈波动引起的代谢紊乱,以及由此产生的对细胞生长、分化、繁殖和次级代谢产物合成的不良影响.大量的研究发现,胞内许多转录调控因子是酰基化的修饰底物,其修饰位点多位于DNA结合结构域,通过改变赖氨酸的电荷,抑制与DNA的结合活性的方式影响靶基因的转录[77-79].例如,类球红细菌中氧敏调控因子FnrL的乙酰化抑制其与靶标DNA的相互作用[80];沙门氏菌中亮氨酸响应调控因子Lrp的乙酰化导致其DNA结合活性的显著降低[81],毒力调控因子PhoP的乙酰化能降低其毒性[82],毒力调控因子HilD的乙酰化能增强其稳定性[83];天蓝色链霉菌中氮调控因子GlnR的多位点乙酰化显著抑制其DNA结合能力和协同调控能力[84];红霉糖多孢菌中磷调控因子PhoP的丙酰化强烈抑制其PHO结构域的DNA结合活性,削弱对靶基因的调控能力[85].微生物的生长和次级代谢产物合成过程并非依赖某一调控因子的单线调控,而是涉及更为复杂的包括全局调控因子和特异性调控因子在内的多线交互调控[86-87],这些调控因子的酰基化修饰,在影响靶基因转录的同时,也可能对初级代谢和次级代谢产生其他重要的影响. ...
In Salmonella enterica, the sirtuin-dependent protein acylation/deacylation system (SDPADS) maintains energy homeostasis during growth on low concentrations of acetate
1
2011
... 翻译后修饰层面的调控则是通过酰基化酰基CoA合成的催化酶,调节其酶活性实现.虽然不同酰基CoA的来源有所不同,但是内/外源的脂肪酸同化是其共通的来源途径.微生物细胞脂肪酸的同化途径有三种:酰基CoA合成酶途径,酰基AcP合成酶途径和脂肪酸激酶途径.其中,酰基CoA合成酶途径的催化酶是最为典型的酰基化修饰底物.以乙酰CoA合成酶(Acs)为例,其活性受到关键位点的可逆乙酰化调控,乙酰化能够直接抑制有机酸的腺苷化和乙酰CoA的合成[88],已有的研究报道涉及大肠杆菌[89-90]、假单胞菌[91]、枯草芽孢杆菌[92]、链霉菌[93-96]和分枝杆菌[97]等多种微生物.除了Acs以外,其他酰基CoA合成酶也存在类似的翻译后修饰调控,酰基CoA合成酶的活性对于细胞生长和次级代谢产物合成尤为重要,其活性异常不仅会导致酰基CoA供应异常、胞内能量失衡、严重时甚至还会引发细胞的生长缺陷[98-99]. ...
cAMP-CRP co-ordinates the expression of the protein acetylation pathway with central metabolism in Escherichia coli
1
2011
... 翻译后修饰层面的调控则是通过酰基化酰基CoA合成的催化酶,调节其酶活性实现.虽然不同酰基CoA的来源有所不同,但是内/外源的脂肪酸同化是其共通的来源途径.微生物细胞脂肪酸的同化途径有三种:酰基CoA合成酶途径,酰基AcP合成酶途径和脂肪酸激酶途径.其中,酰基CoA合成酶途径的催化酶是最为典型的酰基化修饰底物.以乙酰CoA合成酶(Acs)为例,其活性受到关键位点的可逆乙酰化调控,乙酰化能够直接抑制有机酸的腺苷化和乙酰CoA的合成[88],已有的研究报道涉及大肠杆菌[89-90]、假单胞菌[91]、枯草芽孢杆菌[92]、链霉菌[93-96]和分枝杆菌[97]等多种微生物.除了Acs以外,其他酰基CoA合成酶也存在类似的翻译后修饰调控,酰基CoA合成酶的活性对于细胞生长和次级代谢产物合成尤为重要,其活性异常不仅会导致酰基CoA供应异常、胞内能量失衡、严重时甚至还会引发细胞的生长缺陷[98-99]. ...
Reversible acetylation and inactivation of Mycobacterium tuberculosis acetyl-CoA synthetase is dependent on cAMP
1
2011
... 翻译后修饰层面的调控则是通过酰基化酰基CoA合成的催化酶,调节其酶活性实现.虽然不同酰基CoA的来源有所不同,但是内/外源的脂肪酸同化是其共通的来源途径.微生物细胞脂肪酸的同化途径有三种:酰基CoA合成酶途径,酰基AcP合成酶途径和脂肪酸激酶途径.其中,酰基CoA合成酶途径的催化酶是最为典型的酰基化修饰底物.以乙酰CoA合成酶(Acs)为例,其活性受到关键位点的可逆乙酰化调控,乙酰化能够直接抑制有机酸的腺苷化和乙酰CoA的合成[88],已有的研究报道涉及大肠杆菌[89-90]、假单胞菌[91]、枯草芽孢杆菌[92]、链霉菌[93-96]和分枝杆菌[97]等多种微生物.除了Acs以外,其他酰基CoA合成酶也存在类似的翻译后修饰调控,酰基CoA合成酶的活性对于细胞生长和次级代谢产物合成尤为重要,其活性异常不仅会导致酰基CoA供应异常、胞内能量失衡、严重时甚至还会引发细胞的生长缺陷[98-99]. ...
Reversible N-lysine acetylation regulates the activity of acyl-CoA synthetases involved in anaerobic benzoate catabolism in Rhodopseudomonas palustris
1
2010
... 翻译后修饰层面的调控则是通过酰基化酰基CoA合成的催化酶,调节其酶活性实现.虽然不同酰基CoA的来源有所不同,但是内/外源的脂肪酸同化是其共通的来源途径.微生物细胞脂肪酸的同化途径有三种:酰基CoA合成酶途径,酰基AcP合成酶途径和脂肪酸激酶途径.其中,酰基CoA合成酶途径的催化酶是最为典型的酰基化修饰底物.以乙酰CoA合成酶(Acs)为例,其活性受到关键位点的可逆乙酰化调控,乙酰化能够直接抑制有机酸的腺苷化和乙酰CoA的合成[88],已有的研究报道涉及大肠杆菌[89-90]、假单胞菌[91]、枯草芽孢杆菌[92]、链霉菌[93-96]和分枝杆菌[97]等多种微生物.除了Acs以外,其他酰基CoA合成酶也存在类似的翻译后修饰调控,酰基CoA合成酶的活性对于细胞生长和次级代谢产物合成尤为重要,其活性异常不仅会导致酰基CoA供应异常、胞内能量失衡、严重时甚至还会引发细胞的生长缺陷[98-99]. ...
Control of acetyl-coenzyme a synthetase (AcsA) activity by acetylation/deacetylation without NAD(+) involvement in Bacillus subtilis
1
2006
... 翻译后修饰层面的调控则是通过酰基化酰基CoA合成的催化酶,调节其酶活性实现.虽然不同酰基CoA的来源有所不同,但是内/外源的脂肪酸同化是其共通的来源途径.微生物细胞脂肪酸的同化途径有三种:酰基CoA合成酶途径,酰基AcP合成酶途径和脂肪酸激酶途径.其中,酰基CoA合成酶途径的催化酶是最为典型的酰基化修饰底物.以乙酰CoA合成酶(Acs)为例,其活性受到关键位点的可逆乙酰化调控,乙酰化能够直接抑制有机酸的腺苷化和乙酰CoA的合成[88],已有的研究报道涉及大肠杆菌[89-90]、假单胞菌[91]、枯草芽孢杆菌[92]、链霉菌[93-96]和分枝杆菌[97]等多种微生物.除了Acs以外,其他酰基CoA合成酶也存在类似的翻译后修饰调控,酰基CoA合成酶的活性对于细胞生长和次级代谢产物合成尤为重要,其活性异常不仅会导致酰基CoA供应异常、胞内能量失衡、严重时甚至还会引发细胞的生长缺陷[98-99]. ...
Regulation of a protein acetyltransferase in Myxococcus xanthus by the coenzyme NADP
1
2015
... 翻译后修饰层面的调控则是通过酰基化酰基CoA合成的催化酶,调节其酶活性实现.虽然不同酰基CoA的来源有所不同,但是内/外源的脂肪酸同化是其共通的来源途径.微生物细胞脂肪酸的同化途径有三种:酰基CoA合成酶途径,酰基AcP合成酶途径和脂肪酸激酶途径.其中,酰基CoA合成酶途径的催化酶是最为典型的酰基化修饰底物.以乙酰CoA合成酶(Acs)为例,其活性受到关键位点的可逆乙酰化调控,乙酰化能够直接抑制有机酸的腺苷化和乙酰CoA的合成[88],已有的研究报道涉及大肠杆菌[89-90]、假单胞菌[91]、枯草芽孢杆菌[92]、链霉菌[93-96]和分枝杆菌[97]等多种微生物.除了Acs以外,其他酰基CoA合成酶也存在类似的翻译后修饰调控,酰基CoA合成酶的活性对于细胞生长和次级代谢产物合成尤为重要,其活性异常不仅会导致酰基CoA供应异常、胞内能量失衡、严重时甚至还会引发细胞的生长缺陷[98-99]. ...
Acetyl-CoA synthetases of Saccharopolyspora erythraea are regulated by the nitrogen response regulator GlnR at both transcriptional and post-translational levels
0
2017
Acetyl coenzyme A synthetase is acetylated on multiple lysine residues by a protein acetyltransferase with a single Gcn5-type N-acetyltransferase (GNAT) domain in Saccharopolyspora erythraea
0
2014
Allosteric regulation of a protein acetyltransferase in Micromonospora aurantiaca by the amino acids cysteine and arginine
2
2014
... 翻译后修饰层面的调控则是通过酰基化酰基CoA合成的催化酶,调节其酶活性实现.虽然不同酰基CoA的来源有所不同,但是内/外源的脂肪酸同化是其共通的来源途径.微生物细胞脂肪酸的同化途径有三种:酰基CoA合成酶途径,酰基AcP合成酶途径和脂肪酸激酶途径.其中,酰基CoA合成酶途径的催化酶是最为典型的酰基化修饰底物.以乙酰CoA合成酶(Acs)为例,其活性受到关键位点的可逆乙酰化调控,乙酰化能够直接抑制有机酸的腺苷化和乙酰CoA的合成[88],已有的研究报道涉及大肠杆菌[89-90]、假单胞菌[91]、枯草芽孢杆菌[92]、链霉菌[93-96]和分枝杆菌[97]等多种微生物.除了Acs以外,其他酰基CoA合成酶也存在类似的翻译后修饰调控,酰基CoA合成酶的活性对于细胞生长和次级代谢产物合成尤为重要,其活性异常不仅会导致酰基CoA供应异常、胞内能量失衡、严重时甚至还会引发细胞的生长缺陷[98-99]. ...
... 红霉素是医药和畜牧业中常用的大环内酯类抗生素.在红霉素的发酵生产过程中,研究者发现蛋白质丙二酰化和丙酰化会影响菌体生长及红霉素的合成,且胞内丙二酰化/丙酰化水平与产物合成效率呈负相关[17,85,100-101].红霉素合成前体丙二酰CoA/丙酰CoA的适量供应有利于产物合成,当前体丙二酰CoA/丙酰CoA积累过量时,又会产生酰基化效应,抑制产物合成.Xu等[85]运用丙二酰化修饰组学技术,从132个蛋白上共鉴定到192个丙二酰化修饰位点,结合生物信息学分析发现丙二酰化修饰蛋白在核糖体及中心代谢途径中显著富集,其中,乙酰CoA合成酶(Acs)和谷氨酰胺合成酶的活性受到丙二酰化的显著抑制.由于正丙醇或丙酸盐添加是提高红霉素发酵单位的常用手段,研究者随后对丙酰化组学的研究证实,酰基CoA浓度的动态改变会引起蛋白质酰基化水平与红霉素产量随之改变的连锁反应.利用定量酰基化组学技术,酶学特征分析和酰基化模拟分析,研究者确定了丙酰化修饰是影响红霉素产量的关键修饰,从两个层面负调控红霉素的合成:一是通过抑制丙二酸半醛脱氢酶(MmsA2)、丙醛脱氢酶(Adh)、SAM合成酶(SAMS)和丙酰CoA合成酶(PrpE)的活性阻碍丙酰CoA的合成;二是通过对全局调控因子PhoP的抑制,降低其PHO结构域的DNA结合活性,削弱靶基因红霉素合成基因簇的转录[13]以及细胞对碳源的利用.在此基础上,研究者利用PTM-ME策略,对酰基化酶和酰基化修饰系统分别进行了脱敏和优化改造.通过敲除丙酰转移酶(GNAT)、过表达去丙酰化酶(SrtN)和酰基化不敏感酶(SACE_1780)等方式,消除丙酰化对红霉素合成的抑制作用,最终实现工业高产菌中红霉素的产量翻番[81,96-97,99](图4). ...
Glnr-mediated regulation of short-chain fatty acid assimilation in Mycobacterium smegmatis
3
2018
... 翻译后修饰层面的调控则是通过酰基化酰基CoA合成的催化酶,调节其酶活性实现.虽然不同酰基CoA的来源有所不同,但是内/外源的脂肪酸同化是其共通的来源途径.微生物细胞脂肪酸的同化途径有三种:酰基CoA合成酶途径,酰基AcP合成酶途径和脂肪酸激酶途径.其中,酰基CoA合成酶途径的催化酶是最为典型的酰基化修饰底物.以乙酰CoA合成酶(Acs)为例,其活性受到关键位点的可逆乙酰化调控,乙酰化能够直接抑制有机酸的腺苷化和乙酰CoA的合成[88],已有的研究报道涉及大肠杆菌[89-90]、假单胞菌[91]、枯草芽孢杆菌[92]、链霉菌[93-96]和分枝杆菌[97]等多种微生物.除了Acs以外,其他酰基CoA合成酶也存在类似的翻译后修饰调控,酰基CoA合成酶的活性对于细胞生长和次级代谢产物合成尤为重要,其活性异常不仅会导致酰基CoA供应异常、胞内能量失衡、严重时甚至还会引发细胞的生长缺陷[98-99]. ...
... 红霉素是医药和畜牧业中常用的大环内酯类抗生素.在红霉素的发酵生产过程中,研究者发现蛋白质丙二酰化和丙酰化会影响菌体生长及红霉素的合成,且胞内丙二酰化/丙酰化水平与产物合成效率呈负相关[17,85,100-101].红霉素合成前体丙二酰CoA/丙酰CoA的适量供应有利于产物合成,当前体丙二酰CoA/丙酰CoA积累过量时,又会产生酰基化效应,抑制产物合成.Xu等[85]运用丙二酰化修饰组学技术,从132个蛋白上共鉴定到192个丙二酰化修饰位点,结合生物信息学分析发现丙二酰化修饰蛋白在核糖体及中心代谢途径中显著富集,其中,乙酰CoA合成酶(Acs)和谷氨酰胺合成酶的活性受到丙二酰化的显著抑制.由于正丙醇或丙酸盐添加是提高红霉素发酵单位的常用手段,研究者随后对丙酰化组学的研究证实,酰基CoA浓度的动态改变会引起蛋白质酰基化水平与红霉素产量随之改变的连锁反应.利用定量酰基化组学技术,酶学特征分析和酰基化模拟分析,研究者确定了丙酰化修饰是影响红霉素产量的关键修饰,从两个层面负调控红霉素的合成:一是通过抑制丙二酸半醛脱氢酶(MmsA2)、丙醛脱氢酶(Adh)、SAM合成酶(SAMS)和丙酰CoA合成酶(PrpE)的活性阻碍丙酰CoA的合成;二是通过对全局调控因子PhoP的抑制,降低其PHO结构域的DNA结合活性,削弱靶基因红霉素合成基因簇的转录[13]以及细胞对碳源的利用.在此基础上,研究者利用PTM-ME策略,对酰基化酶和酰基化修饰系统分别进行了脱敏和优化改造.通过敲除丙酰转移酶(GNAT)、过表达去丙酰化酶(SrtN)和酰基化不敏感酶(SACE_1780)等方式,消除丙酰化对红霉素合成的抑制作用,最终实现工业高产菌中红霉素的产量翻番[81,96-97,99](图4). ...
... 在生物能源类物质丁醇的生物合成中,丙酮丁醇梭菌由产酸期到产醇期的过渡伴随着由生长状态到孢子状态的转变,以及胞内AcP和丁酰磷酸(BuP)含量的升高,从而导致对数中后期胞内乙酰化和丁酰化水平的升高[97].研究者通过定量酰基化组学分析,一共鉴定到458个乙酰化位点和1109个丁酰化位点,显著富集于丁醇合成相关的丙酮酸途径、丁酸盐途径和丁酰CoA合成途径.结合深入的分析挖掘,筛选出了由于活性受到乙酰化/丁酰化抑制而影响菌体产醇的代谢酶,包括醇/醛脱氢酶AdhE1、丁醛脱氢酶BdhA、乙酰CoA酰基转移酶(CA_C2873)、3-羟基丁酰CoA脱氢酶(Hbd)、3-羟基丁酰CoA脱氢酶(Crt)、丁基CoA脱氢酶(Bcd)等[101].利用PTM-ME策略对这些代谢酶的进行改造,也能够一定程度上消除丁酰化的反馈抑制,提高丁醇产量(本文作者团队未发表的数据). ...
Short-chain fatty acid activation by acyl-coenzyme A synthetases requires Sir2 protein function in Salmonella enterica and Saccharomyces cerevisiae
1
2003
... 翻译后修饰层面的调控则是通过酰基化酰基CoA合成的催化酶,调节其酶活性实现.虽然不同酰基CoA的来源有所不同,但是内/外源的脂肪酸同化是其共通的来源途径.微生物细胞脂肪酸的同化途径有三种:酰基CoA合成酶途径,酰基AcP合成酶途径和脂肪酸激酶途径.其中,酰基CoA合成酶途径的催化酶是最为典型的酰基化修饰底物.以乙酰CoA合成酶(Acs)为例,其活性受到关键位点的可逆乙酰化调控,乙酰化能够直接抑制有机酸的腺苷化和乙酰CoA的合成[88],已有的研究报道涉及大肠杆菌[89-90]、假单胞菌[91]、枯草芽孢杆菌[92]、链霉菌[93-96]和分枝杆菌[97]等多种微生物.除了Acs以外,其他酰基CoA合成酶也存在类似的翻译后修饰调控,酰基CoA合成酶的活性对于细胞生长和次级代谢产物合成尤为重要,其活性异常不仅会导致酰基CoA供应异常、胞内能量失衡、严重时甚至还会引发细胞的生长缺陷[98-99]. ...
The diversity of lysine-acetylated proteins in Escherichia coli
2
2008
... 翻译后修饰层面的调控则是通过酰基化酰基CoA合成的催化酶,调节其酶活性实现.虽然不同酰基CoA的来源有所不同,但是内/外源的脂肪酸同化是其共通的来源途径.微生物细胞脂肪酸的同化途径有三种:酰基CoA合成酶途径,酰基AcP合成酶途径和脂肪酸激酶途径.其中,酰基CoA合成酶途径的催化酶是最为典型的酰基化修饰底物.以乙酰CoA合成酶(Acs)为例,其活性受到关键位点的可逆乙酰化调控,乙酰化能够直接抑制有机酸的腺苷化和乙酰CoA的合成[88],已有的研究报道涉及大肠杆菌[89-90]、假单胞菌[91]、枯草芽孢杆菌[92]、链霉菌[93-96]和分枝杆菌[97]等多种微生物.除了Acs以外,其他酰基CoA合成酶也存在类似的翻译后修饰调控,酰基CoA合成酶的活性对于细胞生长和次级代谢产物合成尤为重要,其活性异常不仅会导致酰基CoA供应异常、胞内能量失衡、严重时甚至还会引发细胞的生长缺陷[98-99]. ...
... 红霉素是医药和畜牧业中常用的大环内酯类抗生素.在红霉素的发酵生产过程中,研究者发现蛋白质丙二酰化和丙酰化会影响菌体生长及红霉素的合成,且胞内丙二酰化/丙酰化水平与产物合成效率呈负相关[17,85,100-101].红霉素合成前体丙二酰CoA/丙酰CoA的适量供应有利于产物合成,当前体丙二酰CoA/丙酰CoA积累过量时,又会产生酰基化效应,抑制产物合成.Xu等[85]运用丙二酰化修饰组学技术,从132个蛋白上共鉴定到192个丙二酰化修饰位点,结合生物信息学分析发现丙二酰化修饰蛋白在核糖体及中心代谢途径中显著富集,其中,乙酰CoA合成酶(Acs)和谷氨酰胺合成酶的活性受到丙二酰化的显著抑制.由于正丙醇或丙酸盐添加是提高红霉素发酵单位的常用手段,研究者随后对丙酰化组学的研究证实,酰基CoA浓度的动态改变会引起蛋白质酰基化水平与红霉素产量随之改变的连锁反应.利用定量酰基化组学技术,酶学特征分析和酰基化模拟分析,研究者确定了丙酰化修饰是影响红霉素产量的关键修饰,从两个层面负调控红霉素的合成:一是通过抑制丙二酸半醛脱氢酶(MmsA2)、丙醛脱氢酶(Adh)、SAM合成酶(SAMS)和丙酰CoA合成酶(PrpE)的活性阻碍丙酰CoA的合成;二是通过对全局调控因子PhoP的抑制,降低其PHO结构域的DNA结合活性,削弱靶基因红霉素合成基因簇的转录[13]以及细胞对碳源的利用.在此基础上,研究者利用PTM-ME策略,对酰基化酶和酰基化修饰系统分别进行了脱敏和优化改造.通过敲除丙酰转移酶(GNAT)、过表达去丙酰化酶(SrtN)和酰基化不敏感酶(SACE_1780)等方式,消除丙酰化对红霉素合成的抑制作用,最终实现工业高产菌中红霉素的产量翻番[81,96-97,99](图4). ...
Lysine malonylome may affect the central metabolism and erythromycin biosynthesis pathway in Saccharopolyspora erythraea
2
2016
... 酰基化修饰对代谢酶或调控因子转录水平和翻译后修饰水平的双层调控会直接影响酰基CoA类前体的有效供应和次级代谢产物的合成.例如,以丙酰CoA为前体的红霉素合成途径中,外源添加正丙醇或丙酸盐会诱发全局调控因子PhoP以及红霉素合成途径催化酶丙二酸半醛脱氢酶、丙醛脱氢酶、SAM合成酶和丙酰CoA合成酶的丙酰化,抑制红霉素合成基因簇的转录、前体丙酰CoA的利用和红霉素合成[100];以丙二酰CoA为前体的十一烷基灵菌红素生物合成中,丙二酸盐添加引起高水平的蛋白质丙二酰化,抑制产物的合成[101];以丁酰CoA为前体的丁醇合成过程中,丁醇合成途径代谢酶的丁酰化也抑制了终产物的合成[101];在人工构建的大肠杆菌细胞工厂用于赤松素的合成过程中,同样存在由于产物合成途径催化酶(4-对香豆酸连接酶和芪合成酶)的丙二酰化抑制了催化活性,从而导致赤松素的产率下降[16]. ...
... 红霉素是医药和畜牧业中常用的大环内酯类抗生素.在红霉素的发酵生产过程中,研究者发现蛋白质丙二酰化和丙酰化会影响菌体生长及红霉素的合成,且胞内丙二酰化/丙酰化水平与产物合成效率呈负相关[17,85,100-101].红霉素合成前体丙二酰CoA/丙酰CoA的适量供应有利于产物合成,当前体丙二酰CoA/丙酰CoA积累过量时,又会产生酰基化效应,抑制产物合成.Xu等[85]运用丙二酰化修饰组学技术,从132个蛋白上共鉴定到192个丙二酰化修饰位点,结合生物信息学分析发现丙二酰化修饰蛋白在核糖体及中心代谢途径中显著富集,其中,乙酰CoA合成酶(Acs)和谷氨酰胺合成酶的活性受到丙二酰化的显著抑制.由于正丙醇或丙酸盐添加是提高红霉素发酵单位的常用手段,研究者随后对丙酰化组学的研究证实,酰基CoA浓度的动态改变会引起蛋白质酰基化水平与红霉素产量随之改变的连锁反应.利用定量酰基化组学技术,酶学特征分析和酰基化模拟分析,研究者确定了丙酰化修饰是影响红霉素产量的关键修饰,从两个层面负调控红霉素的合成:一是通过抑制丙二酸半醛脱氢酶(MmsA2)、丙醛脱氢酶(Adh)、SAM合成酶(SAMS)和丙酰CoA合成酶(PrpE)的活性阻碍丙酰CoA的合成;二是通过对全局调控因子PhoP的抑制,降低其PHO结构域的DNA结合活性,削弱靶基因红霉素合成基因簇的转录[13]以及细胞对碳源的利用.在此基础上,研究者利用PTM-ME策略,对酰基化酶和酰基化修饰系统分别进行了脱敏和优化改造.通过敲除丙酰转移酶(GNAT)、过表达去丙酰化酶(SrtN)和酰基化不敏感酶(SACE_1780)等方式,消除丙酰化对红霉素合成的抑制作用,最终实现工业高产菌中红霉素的产量翻番[81,96-97,99](图4). ...
Protein acylation is a general regulatory mechanism in biosynthetic pathway of acyl-CoA-derived natural products
4
2018
... 酰基化修饰对代谢酶或调控因子转录水平和翻译后修饰水平的双层调控会直接影响酰基CoA类前体的有效供应和次级代谢产物的合成.例如,以丙酰CoA为前体的红霉素合成途径中,外源添加正丙醇或丙酸盐会诱发全局调控因子PhoP以及红霉素合成途径催化酶丙二酸半醛脱氢酶、丙醛脱氢酶、SAM合成酶和丙酰CoA合成酶的丙酰化,抑制红霉素合成基因簇的转录、前体丙酰CoA的利用和红霉素合成[100];以丙二酰CoA为前体的十一烷基灵菌红素生物合成中,丙二酸盐添加引起高水平的蛋白质丙二酰化,抑制产物的合成[101];以丁酰CoA为前体的丁醇合成过程中,丁醇合成途径代谢酶的丁酰化也抑制了终产物的合成[101];在人工构建的大肠杆菌细胞工厂用于赤松素的合成过程中,同样存在由于产物合成途径催化酶(4-对香豆酸连接酶和芪合成酶)的丙二酰化抑制了催化活性,从而导致赤松素的产率下降[16]. ...
... [101];在人工构建的大肠杆菌细胞工厂用于赤松素的合成过程中,同样存在由于产物合成途径催化酶(4-对香豆酸连接酶和芪合成酶)的丙二酰化抑制了催化活性,从而导致赤松素的产率下降[16]. ...
... 红霉素是医药和畜牧业中常用的大环内酯类抗生素.在红霉素的发酵生产过程中,研究者发现蛋白质丙二酰化和丙酰化会影响菌体生长及红霉素的合成,且胞内丙二酰化/丙酰化水平与产物合成效率呈负相关[17,85,100-101].红霉素合成前体丙二酰CoA/丙酰CoA的适量供应有利于产物合成,当前体丙二酰CoA/丙酰CoA积累过量时,又会产生酰基化效应,抑制产物合成.Xu等[85]运用丙二酰化修饰组学技术,从132个蛋白上共鉴定到192个丙二酰化修饰位点,结合生物信息学分析发现丙二酰化修饰蛋白在核糖体及中心代谢途径中显著富集,其中,乙酰CoA合成酶(Acs)和谷氨酰胺合成酶的活性受到丙二酰化的显著抑制.由于正丙醇或丙酸盐添加是提高红霉素发酵单位的常用手段,研究者随后对丙酰化组学的研究证实,酰基CoA浓度的动态改变会引起蛋白质酰基化水平与红霉素产量随之改变的连锁反应.利用定量酰基化组学技术,酶学特征分析和酰基化模拟分析,研究者确定了丙酰化修饰是影响红霉素产量的关键修饰,从两个层面负调控红霉素的合成:一是通过抑制丙二酸半醛脱氢酶(MmsA2)、丙醛脱氢酶(Adh)、SAM合成酶(SAMS)和丙酰CoA合成酶(PrpE)的活性阻碍丙酰CoA的合成;二是通过对全局调控因子PhoP的抑制,降低其PHO结构域的DNA结合活性,削弱靶基因红霉素合成基因簇的转录[13]以及细胞对碳源的利用.在此基础上,研究者利用PTM-ME策略,对酰基化酶和酰基化修饰系统分别进行了脱敏和优化改造.通过敲除丙酰转移酶(GNAT)、过表达去丙酰化酶(SrtN)和酰基化不敏感酶(SACE_1780)等方式,消除丙酰化对红霉素合成的抑制作用,最终实现工业高产菌中红霉素的产量翻番[81,96-97,99](图4). ...
... 在生物能源类物质丁醇的生物合成中,丙酮丁醇梭菌由产酸期到产醇期的过渡伴随着由生长状态到孢子状态的转变,以及胞内AcP和丁酰磷酸(BuP)含量的升高,从而导致对数中后期胞内乙酰化和丁酰化水平的升高[97].研究者通过定量酰基化组学分析,一共鉴定到458个乙酰化位点和1109个丁酰化位点,显著富集于丁醇合成相关的丙酮酸途径、丁酸盐途径和丁酰CoA合成途径.结合深入的分析挖掘,筛选出了由于活性受到乙酰化/丁酰化抑制而影响菌体产醇的代谢酶,包括醇/醛脱氢酶AdhE1、丁醛脱氢酶BdhA、乙酰CoA酰基转移酶(CA_C2873)、3-羟基丁酰CoA脱氢酶(Hbd)、3-羟基丁酰CoA脱氢酶(Crt)、丁基CoA脱氢酶(Bcd)等[101].利用PTM-ME策略对这些代谢酶的进行改造,也能够一定程度上消除丁酰化的反馈抑制,提高丁醇产量(本文作者团队未发表的数据). ...