Efficacy and safety of Mulberry twig alkaloids tablet for the treatment of type 2 diabetes: a multicenter, randomized, double-blind, double-dummy, and parallel controlled clinical trial
1
2021
... 中医药是中华民族的瑰宝,经过上千年的临床实践,形成了独特的理论体系.时至今日,基于中医药的新药创制仍然具有显著的优势.例如:2020年,用于治疗Ⅱ型糖尿病的“桑枝总生物碱片”被批准上市,是我国近十年来首个获批的糖尿病中药新药[1-2];“银杏叶提取物”在国内外被广泛应用于心脑血管疾病等的治疗[3];以甾体总皂苷为主要药效成分的“地奥心血康胶囊”是我国第一个通过欧盟GMP认证而进入欧盟市场的中成药品种,用于治疗冠心病、心绞痛等疾病[4].随着中医药与现代科学技术的不断融合和发展,中药的药效物质不断被阐明,为基于中医药的新药创制研究奠定了更加坚实的基础. ...
Ramulus mori (Sangzhi) alkaloids alleviate high-fat diet-induced obesity and nonalcoholic fatty liver disease in mice
1
2022
... 中医药是中华民族的瑰宝,经过上千年的临床实践,形成了独特的理论体系.时至今日,基于中医药的新药创制仍然具有显著的优势.例如:2020年,用于治疗Ⅱ型糖尿病的“桑枝总生物碱片”被批准上市,是我国近十年来首个获批的糖尿病中药新药[1-2];“银杏叶提取物”在国内外被广泛应用于心脑血管疾病等的治疗[3];以甾体总皂苷为主要药效成分的“地奥心血康胶囊”是我国第一个通过欧盟GMP认证而进入欧盟市场的中成药品种,用于治疗冠心病、心绞痛等疾病[4].随着中医药与现代科学技术的不断融合和发展,中药的药效物质不断被阐明,为基于中医药的新药创制研究奠定了更加坚实的基础. ...
Long-term use of standardised Ginkgo biloba extract for the prevention of Alzheimer’s disease (GuidAge): a randomised placebo-controlled trial
1
2012
... 中医药是中华民族的瑰宝,经过上千年的临床实践,形成了独特的理论体系.时至今日,基于中医药的新药创制仍然具有显著的优势.例如:2020年,用于治疗Ⅱ型糖尿病的“桑枝总生物碱片”被批准上市,是我国近十年来首个获批的糖尿病中药新药[1-2];“银杏叶提取物”在国内外被广泛应用于心脑血管疾病等的治疗[3];以甾体总皂苷为主要药效成分的“地奥心血康胶囊”是我国第一个通过欧盟GMP认证而进入欧盟市场的中成药品种,用于治疗冠心病、心绞痛等疾病[4].随着中医药与现代科学技术的不断融合和发展,中药的药效物质不断被阐明,为基于中医药的新药创制研究奠定了更加坚实的基础. ...
Dynamic changes in phenotypic groups in patients with stable angina pectoris after treatment with Xinxuekang capsule: a randomized controlled trial
1
2015
... 中医药是中华民族的瑰宝,经过上千年的临床实践,形成了独特的理论体系.时至今日,基于中医药的新药创制仍然具有显著的优势.例如:2020年,用于治疗Ⅱ型糖尿病的“桑枝总生物碱片”被批准上市,是我国近十年来首个获批的糖尿病中药新药[1-2];“银杏叶提取物”在国内外被广泛应用于心脑血管疾病等的治疗[3];以甾体总皂苷为主要药效成分的“地奥心血康胶囊”是我国第一个通过欧盟GMP认证而进入欧盟市场的中成药品种,用于治疗冠心病、心绞痛等疾病[4].随着中医药与现代科学技术的不断融合和发展,中药的药效物质不断被阐明,为基于中医药的新药创制研究奠定了更加坚实的基础. ...
濒危民族药新疆阿魏分布的环境需求及适生区研究
1
2019
... (1)中药药效成分的供给过分依赖植物资源.①目前,中药药效成分主要通过植物提取的方式获得,由于相当一部分药效成分的含量低或药材资源稀缺,造成药效成分供给不足;②虽然人工种植在很大程度上解决了部分药材的供给,但仍有许多药材尚未实现人工种植,如阿魏的人工栽培品种存在不开花的问题[5-6];③中药材强调道地性,道地产区土地资源不足,甚至存在与粮争地的现象[7];④许多药材(如檀香、沉香等)的基原植物生长周期过长并且品质形成条件苛刻(如结香的条件)[8-9],限制了其产量;⑤连作障碍等问题严重影响部分药材的品质和种植规模[10-11]. ...
WEI Y R
1
2019
... (1)中药药效成分的供给过分依赖植物资源.①目前,中药药效成分主要通过植物提取的方式获得,由于相当一部分药效成分的含量低或药材资源稀缺,造成药效成分供给不足;②虽然人工种植在很大程度上解决了部分药材的供给,但仍有许多药材尚未实现人工种植,如阿魏的人工栽培品种存在不开花的问题[5-6];③中药材强调道地性,道地产区土地资源不足,甚至存在与粮争地的现象[7];④许多药材(如檀香、沉香等)的基原植物生长周期过长并且品质形成条件苛刻(如结香的条件)[8-9],限制了其产量;⑤连作障碍等问题严重影响部分药材的品质和种植规模[10-11]. ...
一种药用阿魏人工种植栽培的方法
1
... (1)中药药效成分的供给过分依赖植物资源.①目前,中药药效成分主要通过植物提取的方式获得,由于相当一部分药效成分的含量低或药材资源稀缺,造成药效成分供给不足;②虽然人工种植在很大程度上解决了部分药材的供给,但仍有许多药材尚未实现人工种植,如阿魏的人工栽培品种存在不开花的问题[5-6];③中药材强调道地性,道地产区土地资源不足,甚至存在与粮争地的现象[7];④许多药材(如檀香、沉香等)的基原植物生长周期过长并且品质形成条件苛刻(如结香的条件)[8-9],限制了其产量;⑤连作障碍等问题严重影响部分药材的品质和种植规模[10-11]. ...
A method for artificial planting and cultivation of Ferula sinkiangensis
1
... (1)中药药效成分的供给过分依赖植物资源.①目前,中药药效成分主要通过植物提取的方式获得,由于相当一部分药效成分的含量低或药材资源稀缺,造成药效成分供给不足;②虽然人工种植在很大程度上解决了部分药材的供给,但仍有许多药材尚未实现人工种植,如阿魏的人工栽培品种存在不开花的问题[5-6];③中药材强调道地性,道地产区土地资源不足,甚至存在与粮争地的现象[7];④许多药材(如檀香、沉香等)的基原植物生长周期过长并且品质形成条件苛刻(如结香的条件)[8-9],限制了其产量;⑤连作障碍等问题严重影响部分药材的品质和种植规模[10-11]. ...
Research progress on quality assurance of genuine Chinese medicinal in Sichuan
1
2021
... (1)中药药效成分的供给过分依赖植物资源.①目前,中药药效成分主要通过植物提取的方式获得,由于相当一部分药效成分的含量低或药材资源稀缺,造成药效成分供给不足;②虽然人工种植在很大程度上解决了部分药材的供给,但仍有许多药材尚未实现人工种植,如阿魏的人工栽培品种存在不开花的问题[5-6];③中药材强调道地性,道地产区土地资源不足,甚至存在与粮争地的现象[7];④许多药材(如檀香、沉香等)的基原植物生长周期过长并且品质形成条件苛刻(如结香的条件)[8-9],限制了其产量;⑤连作障碍等问题严重影响部分药材的品质和种植规模[10-11]. ...
Sandalwood: basic biology, tissue culture, and genetic transformation
1
2016
... (1)中药药效成分的供给过分依赖植物资源.①目前,中药药效成分主要通过植物提取的方式获得,由于相当一部分药效成分的含量低或药材资源稀缺,造成药效成分供给不足;②虽然人工种植在很大程度上解决了部分药材的供给,但仍有许多药材尚未实现人工种植,如阿魏的人工栽培品种存在不开花的问题[5-6];③中药材强调道地性,道地产区土地资源不足,甚至存在与粮争地的现象[7];④许多药材(如檀香、沉香等)的基原植物生长周期过长并且品质形成条件苛刻(如结香的条件)[8-9],限制了其产量;⑤连作障碍等问题严重影响部分药材的品质和种植规模[10-11]. ...
Temporal characteristics of agarwood formation in Aquilaria sinensis after applying whole-tree agarwood-inducing technique
1
2023
... (1)中药药效成分的供给过分依赖植物资源.①目前,中药药效成分主要通过植物提取的方式获得,由于相当一部分药效成分的含量低或药材资源稀缺,造成药效成分供给不足;②虽然人工种植在很大程度上解决了部分药材的供给,但仍有许多药材尚未实现人工种植,如阿魏的人工栽培品种存在不开花的问题[5-6];③中药材强调道地性,道地产区土地资源不足,甚至存在与粮争地的现象[7];④许多药材(如檀香、沉香等)的基原植物生长周期过长并且品质形成条件苛刻(如结香的条件)[8-9],限制了其产量;⑤连作障碍等问题严重影响部分药材的品质和种植规模[10-11]. ...
Impact of continuous Panax notoginseng plantation on soil microbial and biochemical properties
1
2019
... (1)中药药效成分的供给过分依赖植物资源.①目前,中药药效成分主要通过植物提取的方式获得,由于相当一部分药效成分的含量低或药材资源稀缺,造成药效成分供给不足;②虽然人工种植在很大程度上解决了部分药材的供给,但仍有许多药材尚未实现人工种植,如阿魏的人工栽培品种存在不开花的问题[5-6];③中药材强调道地性,道地产区土地资源不足,甚至存在与粮争地的现象[7];④许多药材(如檀香、沉香等)的基原植物生长周期过长并且品质形成条件苛刻(如结香的条件)[8-9],限制了其产量;⑤连作障碍等问题严重影响部分药材的品质和种植规模[10-11]. ...
Analysis of exposure to pesticide residues from traditional Chinese medicine
1
2019
... (1)中药药效成分的供给过分依赖植物资源.①目前,中药药效成分主要通过植物提取的方式获得,由于相当一部分药效成分的含量低或药材资源稀缺,造成药效成分供给不足;②虽然人工种植在很大程度上解决了部分药材的供给,但仍有许多药材尚未实现人工种植,如阿魏的人工栽培品种存在不开花的问题[5-6];③中药材强调道地性,道地产区土地资源不足,甚至存在与粮争地的现象[7];④许多药材(如檀香、沉香等)的基原植物生长周期过长并且品质形成条件苛刻(如结香的条件)[8-9],限制了其产量;⑤连作障碍等问题严重影响部分药材的品质和种植规模[10-11]. ...
Health benefits of Silybum marianum: phytochemistry, pharmacology, and applications
2
2020
... (3)药材所含成分复杂,有效成分富集困难.例如,黄酮木脂素类化合物水飞蓟宾和异水飞蓟宾是水飞蓟的主要药效成分,然而除这两种成分外,该药材还含有结构相似的19种黄酮木脂素类成分,因此难以富集水飞蓟宾和异水飞蓟宾[12]. ...
... 《中国药典》收录的药材水飞蓟为菊科植物水飞蓟Silybum marianum(L.)Gaertn的干燥成熟果实,具有清热解毒、疏肝利胆的功效.水飞蓟宾类成分是水飞蓟的药效物质,对肝炎等多种肝脏疾病具有显著疗效,其中主要药效成分为水飞蓟宾(silybin)A、水飞蓟宾B以及异水飞蓟宾(isosilybin)A、异水飞蓟宾B.除这四种药效成分外,水飞蓟还含有其他19种结构类似的化合物,致使四种药效成分的定向富集十分困难[12].水飞蓟宾类化合物的两个生物合成前体紫杉叶素(taxifolin)和松柏醇(coniferyl alcohol)分别属于黄酮和苯丙素.因此,水飞蓟宾类化合物属于黄酮与苯丙素的杂合化合物,其生物合成途径包含了典型的黄酮和苯丙素途径(图11).水飞蓟中的过氧化物酶(APX1)负责催化紫杉叶素和松柏醇偶联,生成水飞蓟宾A、水飞蓟宾B以及异水飞蓟宾A、异水飞蓟宾B(图11)[124].因此,APX1是实现水飞蓟宾A、水飞蓟宾B以及异水飞蓟宾A、异水飞蓟宾B四种药效成分定向合成的关键酶. ...
Discovery and engineering of colchicine alkaloid biosynthesis
2
2020
... 合成生物技术具有高度的过程可控特征,能确保成分稳定的中药药效物质的可持续供给.药效成分生物合成途径和调控机制的完整解析,是建立其合成生物学制备方法的前提条件.近年来,国内外学者在复杂药效成分的形成机制研究中取得了重要进展,例如:完整揭示了秋水仙碱、吗啡的生物合成途径[13-14],以及阐明了丹参酮[15-20]和托品烷生物碱[21-26]的关键生物合成步骤和调控机制.并且已经实现许多重要单分子中药药效成分的高效制备,例如:建立青蒿酸的细胞工厂,每升产量达25 g,再通过化学转化高产青蒿素[27].中药药效主要源于多成分作用的叠加或协同,因此药效成分群是中药药效物质的主要形式(本文所指“中药药效成分群”为:符合药材的某种传统药效并且与药材提取物相比等效或基本等效的成分组合).中药药效成分群主要包括挥发油、总皂苷、总黄酮、总木脂素和总生物碱等类型.目前,中药药效成分群的合成生物学研究主要是解析生物合成途径、阐明调控机制以及建立其中某个单个分子的生物制备方法.以药效成分群作为整体研究对象的合成生物技术鲜有报道,其难点是如何优化成分群中各个成员分子的比例.由于分子比例决定了药效成分群的药效,因此实现分子比例的精准调控是建立高品质药效成分群的关键. ...
... 阐明药效物质的生物合成机制是建立其合成生物学制备方法的前提,然而大多数中药材的药效成分群的形成机制尚未完整解析.2020版《中国药典》收录了600多种中药材.这些药材中,药效成分的形成机制被完全阐明的属凤毛麟角.即使对于人参皂苷等研究最广泛的药效成分群,其生物合成途径也尚未完整揭示.而且,目前途径解析研究主要集中在萜类、黄酮、木脂素等类型的化合物,这些类型化合物的生物合成过程具有较强的规律性,相对容易被揭示.而对于生物碱类化合物,结构类型多样,相应的生物合成过程大相径庭,难有规律可循,因此研究难度较大,目前仅在苄基异喹啉类[125-126]、秋水仙碱类[13]、托品烷类[21-26]等少数几种生物碱的途径解析中取得了突破性进展,未来需要加强该方面的研究.此外,成分群生物合成研究不仅要表征生物合成酶,还要准确锁定真正控制成分比例的关键酶并揭示其控制产物多样性的机制.对于存在多种同工酶的情况,需要揭示各个同工酶在产物类型和比例上的精细差别. ...
Dioxygenases catalyze the O-demethylation steps of morphine biosynthesis in opium poppy
1
2010
... 合成生物技术具有高度的过程可控特征,能确保成分稳定的中药药效物质的可持续供给.药效成分生物合成途径和调控机制的完整解析,是建立其合成生物学制备方法的前提条件.近年来,国内外学者在复杂药效成分的形成机制研究中取得了重要进展,例如:完整揭示了秋水仙碱、吗啡的生物合成途径[13-14],以及阐明了丹参酮[15-20]和托品烷生物碱[21-26]的关键生物合成步骤和调控机制.并且已经实现许多重要单分子中药药效成分的高效制备,例如:建立青蒿酸的细胞工厂,每升产量达25 g,再通过化学转化高产青蒿素[27].中药药效主要源于多成分作用的叠加或协同,因此药效成分群是中药药效物质的主要形式(本文所指“中药药效成分群”为:符合药材的某种传统药效并且与药材提取物相比等效或基本等效的成分组合).中药药效成分群主要包括挥发油、总皂苷、总黄酮、总木脂素和总生物碱等类型.目前,中药药效成分群的合成生物学研究主要是解析生物合成途径、阐明调控机制以及建立其中某个单个分子的生物制备方法.以药效成分群作为整体研究对象的合成生物技术鲜有报道,其难点是如何优化成分群中各个成员分子的比例.由于分子比例决定了药效成分群的药效,因此实现分子比例的精准调控是建立高品质药效成分群的关键. ...
A functional genomics approach to tanshinone biosynthesis provides stereochemical insights
1
2009
... 合成生物技术具有高度的过程可控特征,能确保成分稳定的中药药效物质的可持续供给.药效成分生物合成途径和调控机制的完整解析,是建立其合成生物学制备方法的前提条件.近年来,国内外学者在复杂药效成分的形成机制研究中取得了重要进展,例如:完整揭示了秋水仙碱、吗啡的生物合成途径[13-14],以及阐明了丹参酮[15-20]和托品烷生物碱[21-26]的关键生物合成步骤和调控机制.并且已经实现许多重要单分子中药药效成分的高效制备,例如:建立青蒿酸的细胞工厂,每升产量达25 g,再通过化学转化高产青蒿素[27].中药药效主要源于多成分作用的叠加或协同,因此药效成分群是中药药效物质的主要形式(本文所指“中药药效成分群”为:符合药材的某种传统药效并且与药材提取物相比等效或基本等效的成分组合).中药药效成分群主要包括挥发油、总皂苷、总黄酮、总木脂素和总生物碱等类型.目前,中药药效成分群的合成生物学研究主要是解析生物合成途径、阐明调控机制以及建立其中某个单个分子的生物制备方法.以药效成分群作为整体研究对象的合成生物技术鲜有报道,其难点是如何优化成分群中各个成员分子的比例.由于分子比例决定了药效成分群的药效,因此实现分子比例的精准调控是建立高品质药效成分群的关键. ...
CYP76AH1 catalyzes turnover of miltiradiene in tanshinones biosynthesis and enables heterologous production of ferruginol in yeasts
0
2013
Cytochrome P450 promiscuity leads to a bifurcating biosynthetic pathway for tanshinones
0
2016
Expansion within the CYP71D subfamily drives the heterocyclization of tanshinones synthesis in Salvia miltiorrhiza
0
2021
A 2-oxoglutarate-dependent dioxygenase converts dihydrofuran to furan in Salvia diterpenoids
0
2022
Functional characterization of CYP81C16 involved in the tanshinone biosynthetic pathway in Salvia miltiorrhiza
1
2023
... 合成生物技术具有高度的过程可控特征,能确保成分稳定的中药药效物质的可持续供给.药效成分生物合成途径和调控机制的完整解析,是建立其合成生物学制备方法的前提条件.近年来,国内外学者在复杂药效成分的形成机制研究中取得了重要进展,例如:完整揭示了秋水仙碱、吗啡的生物合成途径[13-14],以及阐明了丹参酮[15-20]和托品烷生物碱[21-26]的关键生物合成步骤和调控机制.并且已经实现许多重要单分子中药药效成分的高效制备,例如:建立青蒿酸的细胞工厂,每升产量达25 g,再通过化学转化高产青蒿素[27].中药药效主要源于多成分作用的叠加或协同,因此药效成分群是中药药效物质的主要形式(本文所指“中药药效成分群”为:符合药材的某种传统药效并且与药材提取物相比等效或基本等效的成分组合).中药药效成分群主要包括挥发油、总皂苷、总黄酮、总木脂素和总生物碱等类型.目前,中药药效成分群的合成生物学研究主要是解析生物合成途径、阐明调控机制以及建立其中某个单个分子的生物制备方法.以药效成分群作为整体研究对象的合成生物技术鲜有报道,其难点是如何优化成分群中各个成员分子的比例.由于分子比例决定了药效成分群的药效,因此实现分子比例的精准调控是建立高品质药效成分群的关键. ...
Engineering tropane alkaloid production based on metabolic characterization of ornithine decarboxylase in Atropa belladonna
4
2020
... 合成生物技术具有高度的过程可控特征,能确保成分稳定的中药药效物质的可持续供给.药效成分生物合成途径和调控机制的完整解析,是建立其合成生物学制备方法的前提条件.近年来,国内外学者在复杂药效成分的形成机制研究中取得了重要进展,例如:完整揭示了秋水仙碱、吗啡的生物合成途径[13-14],以及阐明了丹参酮[15-20]和托品烷生物碱[21-26]的关键生物合成步骤和调控机制.并且已经实现许多重要单分子中药药效成分的高效制备,例如:建立青蒿酸的细胞工厂,每升产量达25 g,再通过化学转化高产青蒿素[27].中药药效主要源于多成分作用的叠加或协同,因此药效成分群是中药药效物质的主要形式(本文所指“中药药效成分群”为:符合药材的某种传统药效并且与药材提取物相比等效或基本等效的成分组合).中药药效成分群主要包括挥发油、总皂苷、总黄酮、总木脂素和总生物碱等类型.目前,中药药效成分群的合成生物学研究主要是解析生物合成途径、阐明调控机制以及建立其中某个单个分子的生物制备方法.以药效成分群作为整体研究对象的合成生物技术鲜有报道,其难点是如何优化成分群中各个成员分子的比例.由于分子比例决定了药效成分群的药效,因此实现分子比例的精准调控是建立高品质药效成分群的关键. ...
... 通过在颠茄毛状根中饲喂鸟氨酸脱羧酶(ODC)或精氨酸脱羧酶(ADC)的特异性抑制剂,以及分析ODC和ADC基因的表达水平与托品烷生物碱含量的关联性,证明AbODC在托品的生物合成中起主要作用[21].AbODC催化鸟氨酸脱羧生成腐胺(putrescine)[21];腐胺经腐胺N-甲基转移酶(AbPMT)和N-甲基腐胺氧化酶(AbMPO)顺序催化,一个氨基被甲基化,另一个氨基被氧化成醛基,从而生成4-氨甲基正丁醛(4-aminomethylbutanal)(图9)[22-23].在颠茄中发现了两个AbMPO(AbMPO1和AbMPO2),AbMPO1主要在根中表达,而AbMPO2主要在地上部分表达,并且抑制AbMPO1的表达会显著降低莨菪碱和东莨菪碱的含量,因此AbMPO1是托品烷生物碱生物合成的主要功能性N-甲基腐胺氧化酶.4-氨甲基正丁醛通过自发环化,形成N-甲基吡咯啉正离子(N-methylpyrrolinium cation)(图9)[24].N-甲基吡咯啉正离子和丙二酰辅酶A在非典型Ⅲ型聚酮合酶AbPYKS的催化下生成4-(1-甲基-2-吡咯烷基)-3-氧丁酸[4-(1-methyl-2-pyrrolidinyl)-3-oxobutanoic acid](图9)[25].4-(1-甲基-2-吡咯烷基)-3-氧丁酸在托品酮合酶AbCYP82M3的介导下发生氧化和环化反应生成托品酮(tropinone)(图9)[25].最后,托品酮在托品酮还原酶I(AbTRI)的催化下生成托品(tropine)(图9)[23].通过解析AbPYKS的同工酶AaPYKS(源于三分三,Anisodus acutangulus)的蛋白晶体结构,阐明了该类非典型Ⅲ型聚酮合酶的催化机制.AaPYKS活性口袋内的保守三联体Cys166-His305-Asn338负责产生关键中间体3-羰基戊二酸;3-羰基戊二酸与N-甲基吡咯啉正离子通过自发缩合产生4-(1-甲基-2-吡咯烷基)-3-氧丁酸[26]. ...
... [21];腐胺经腐胺N-甲基转移酶(AbPMT)和N-甲基腐胺氧化酶(AbMPO)顺序催化,一个氨基被甲基化,另一个氨基被氧化成醛基,从而生成4-氨甲基正丁醛(4-aminomethylbutanal)(图9)[22-23].在颠茄中发现了两个AbMPO(AbMPO1和AbMPO2),AbMPO1主要在根中表达,而AbMPO2主要在地上部分表达,并且抑制AbMPO1的表达会显著降低莨菪碱和东莨菪碱的含量,因此AbMPO1是托品烷生物碱生物合成的主要功能性N-甲基腐胺氧化酶.4-氨甲基正丁醛通过自发环化,形成N-甲基吡咯啉正离子(N-methylpyrrolinium cation)(图9)[24].N-甲基吡咯啉正离子和丙二酰辅酶A在非典型Ⅲ型聚酮合酶AbPYKS的催化下生成4-(1-甲基-2-吡咯烷基)-3-氧丁酸[4-(1-methyl-2-pyrrolidinyl)-3-oxobutanoic acid](图9)[25].4-(1-甲基-2-吡咯烷基)-3-氧丁酸在托品酮合酶AbCYP82M3的介导下发生氧化和环化反应生成托品酮(tropinone)(图9)[25].最后,托品酮在托品酮还原酶I(AbTRI)的催化下生成托品(tropine)(图9)[23].通过解析AbPYKS的同工酶AaPYKS(源于三分三,Anisodus acutangulus)的蛋白晶体结构,阐明了该类非典型Ⅲ型聚酮合酶的催化机制.AaPYKS活性口袋内的保守三联体Cys166-His305-Asn338负责产生关键中间体3-羰基戊二酸;3-羰基戊二酸与N-甲基吡咯啉正离子通过自发缩合产生4-(1-甲基-2-吡咯烷基)-3-氧丁酸[26]. ...
... 阐明药效物质的生物合成机制是建立其合成生物学制备方法的前提,然而大多数中药材的药效成分群的形成机制尚未完整解析.2020版《中国药典》收录了600多种中药材.这些药材中,药效成分的形成机制被完全阐明的属凤毛麟角.即使对于人参皂苷等研究最广泛的药效成分群,其生物合成途径也尚未完整揭示.而且,目前途径解析研究主要集中在萜类、黄酮、木脂素等类型的化合物,这些类型化合物的生物合成过程具有较强的规律性,相对容易被揭示.而对于生物碱类化合物,结构类型多样,相应的生物合成过程大相径庭,难有规律可循,因此研究难度较大,目前仅在苄基异喹啉类[125-126]、秋水仙碱类[13]、托品烷类[21-26]等少数几种生物碱的途径解析中取得了突破性进展,未来需要加强该方面的研究.此外,成分群生物合成研究不仅要表征生物合成酶,还要准确锁定真正控制成分比例的关键酶并揭示其控制产物多样性的机制.对于存在多种同工酶的情况,需要揭示各个同工酶在产物类型和比例上的精细差别. ...
Expression of Atropa belladonna putrescine N-methyltransferase gene in root pericycle
1
1999
... 通过在颠茄毛状根中饲喂鸟氨酸脱羧酶(ODC)或精氨酸脱羧酶(ADC)的特异性抑制剂,以及分析ODC和ADC基因的表达水平与托品烷生物碱含量的关联性,证明AbODC在托品的生物合成中起主要作用[21].AbODC催化鸟氨酸脱羧生成腐胺(putrescine)[21];腐胺经腐胺N-甲基转移酶(AbPMT)和N-甲基腐胺氧化酶(AbMPO)顺序催化,一个氨基被甲基化,另一个氨基被氧化成醛基,从而生成4-氨甲基正丁醛(4-aminomethylbutanal)(图9)[22-23].在颠茄中发现了两个AbMPO(AbMPO1和AbMPO2),AbMPO1主要在根中表达,而AbMPO2主要在地上部分表达,并且抑制AbMPO1的表达会显著降低莨菪碱和东莨菪碱的含量,因此AbMPO1是托品烷生物碱生物合成的主要功能性N-甲基腐胺氧化酶.4-氨甲基正丁醛通过自发环化,形成N-甲基吡咯啉正离子(N-methylpyrrolinium cation)(图9)[24].N-甲基吡咯啉正离子和丙二酰辅酶A在非典型Ⅲ型聚酮合酶AbPYKS的催化下生成4-(1-甲基-2-吡咯烷基)-3-氧丁酸[4-(1-methyl-2-pyrrolidinyl)-3-oxobutanoic acid](图9)[25].4-(1-甲基-2-吡咯烷基)-3-氧丁酸在托品酮合酶AbCYP82M3的介导下发生氧化和环化反应生成托品酮(tropinone)(图9)[25].最后,托品酮在托品酮还原酶I(AbTRI)的催化下生成托品(tropine)(图9)[23].通过解析AbPYKS的同工酶AaPYKS(源于三分三,Anisodus acutangulus)的蛋白晶体结构,阐明了该类非典型Ⅲ型聚酮合酶的催化机制.AaPYKS活性口袋内的保守三联体Cys166-His305-Asn338负责产生关键中间体3-羰基戊二酸;3-羰基戊二酸与N-甲基吡咯啉正离子通过自发缩合产生4-(1-甲基-2-吡咯烷基)-3-氧丁酸[26]. ...
Revealing evolution of tropane alkaloid biosynthesis by analyzing two genomes in the Solanaceae family
3
2023
... 通过在颠茄毛状根中饲喂鸟氨酸脱羧酶(ODC)或精氨酸脱羧酶(ADC)的特异性抑制剂,以及分析ODC和ADC基因的表达水平与托品烷生物碱含量的关联性,证明AbODC在托品的生物合成中起主要作用[21].AbODC催化鸟氨酸脱羧生成腐胺(putrescine)[21];腐胺经腐胺N-甲基转移酶(AbPMT)和N-甲基腐胺氧化酶(AbMPO)顺序催化,一个氨基被甲基化,另一个氨基被氧化成醛基,从而生成4-氨甲基正丁醛(4-aminomethylbutanal)(图9)[22-23].在颠茄中发现了两个AbMPO(AbMPO1和AbMPO2),AbMPO1主要在根中表达,而AbMPO2主要在地上部分表达,并且抑制AbMPO1的表达会显著降低莨菪碱和东莨菪碱的含量,因此AbMPO1是托品烷生物碱生物合成的主要功能性N-甲基腐胺氧化酶.4-氨甲基正丁醛通过自发环化,形成N-甲基吡咯啉正离子(N-methylpyrrolinium cation)(图9)[24].N-甲基吡咯啉正离子和丙二酰辅酶A在非典型Ⅲ型聚酮合酶AbPYKS的催化下生成4-(1-甲基-2-吡咯烷基)-3-氧丁酸[4-(1-methyl-2-pyrrolidinyl)-3-oxobutanoic acid](图9)[25].4-(1-甲基-2-吡咯烷基)-3-氧丁酸在托品酮合酶AbCYP82M3的介导下发生氧化和环化反应生成托品酮(tropinone)(图9)[25].最后,托品酮在托品酮还原酶I(AbTRI)的催化下生成托品(tropine)(图9)[23].通过解析AbPYKS的同工酶AaPYKS(源于三分三,Anisodus acutangulus)的蛋白晶体结构,阐明了该类非典型Ⅲ型聚酮合酶的催化机制.AaPYKS活性口袋内的保守三联体Cys166-His305-Asn338负责产生关键中间体3-羰基戊二酸;3-羰基戊二酸与N-甲基吡咯啉正离子通过自发缩合产生4-(1-甲基-2-吡咯烷基)-3-氧丁酸[26]. ...
... [23].通过解析AbPYKS的同工酶AaPYKS(源于三分三,Anisodus acutangulus)的蛋白晶体结构,阐明了该类非典型Ⅲ型聚酮合酶的催化机制.AaPYKS活性口袋内的保守三联体Cys166-His305-Asn338负责产生关键中间体3-羰基戊二酸;3-羰基戊二酸与N-甲基吡咯啉正离子通过自发缩合产生4-(1-甲基-2-吡咯烷基)-3-氧丁酸[26]. ...
... 托品和苯乳酰葡萄糖在海螺碱合成酶(AbLS)催化下生成海螺碱(littorine)[114];海螺碱变位酶(AbCYP80F1)催化重排和氧化反应,生成莨菪醛(hyoscyamine aldehyde)[23,115-116];莨菪碱-6β-羟化酶(AbH6H)立体选择性地羟基化C6,生成山莨菪碱(anisodamine),并进一步形成三元氧环生成东莨菪碱(图9)[117-118].通过解析AbHDH的蛋白晶体结构,揭示了其催化机制.AbHDH首先发生变构使锌离子与莨菪醛的醛基产生静电作用;NADPH C4位的pro-R氢负离子转移到莨菪醛的醛基碳上;Ser54的羟基作为广义酸,为与锌离子相互作用的氧提供质子,从而生成莨菪碱[119](图9).AbHDH催化的还原反应是可逆的,其还原效率是氧化效率的23.36倍[119]. ...
The cell and developmental biology of alkaloid biosynthesis
1
2000
... 通过在颠茄毛状根中饲喂鸟氨酸脱羧酶(ODC)或精氨酸脱羧酶(ADC)的特异性抑制剂,以及分析ODC和ADC基因的表达水平与托品烷生物碱含量的关联性,证明AbODC在托品的生物合成中起主要作用[21].AbODC催化鸟氨酸脱羧生成腐胺(putrescine)[21];腐胺经腐胺N-甲基转移酶(AbPMT)和N-甲基腐胺氧化酶(AbMPO)顺序催化,一个氨基被甲基化,另一个氨基被氧化成醛基,从而生成4-氨甲基正丁醛(4-aminomethylbutanal)(图9)[22-23].在颠茄中发现了两个AbMPO(AbMPO1和AbMPO2),AbMPO1主要在根中表达,而AbMPO2主要在地上部分表达,并且抑制AbMPO1的表达会显著降低莨菪碱和东莨菪碱的含量,因此AbMPO1是托品烷生物碱生物合成的主要功能性N-甲基腐胺氧化酶.4-氨甲基正丁醛通过自发环化,形成N-甲基吡咯啉正离子(N-methylpyrrolinium cation)(图9)[24].N-甲基吡咯啉正离子和丙二酰辅酶A在非典型Ⅲ型聚酮合酶AbPYKS的催化下生成4-(1-甲基-2-吡咯烷基)-3-氧丁酸[4-(1-methyl-2-pyrrolidinyl)-3-oxobutanoic acid](图9)[25].4-(1-甲基-2-吡咯烷基)-3-氧丁酸在托品酮合酶AbCYP82M3的介导下发生氧化和环化反应生成托品酮(tropinone)(图9)[25].最后,托品酮在托品酮还原酶I(AbTRI)的催化下生成托品(tropine)(图9)[23].通过解析AbPYKS的同工酶AaPYKS(源于三分三,Anisodus acutangulus)的蛋白晶体结构,阐明了该类非典型Ⅲ型聚酮合酶的催化机制.AaPYKS活性口袋内的保守三联体Cys166-His305-Asn338负责产生关键中间体3-羰基戊二酸;3-羰基戊二酸与N-甲基吡咯啉正离子通过自发缩合产生4-(1-甲基-2-吡咯烷基)-3-氧丁酸[26]. ...
Tropinone synthesis via an atypical polyketide synthase and P450-mediated cyclization
2
2018
... 通过在颠茄毛状根中饲喂鸟氨酸脱羧酶(ODC)或精氨酸脱羧酶(ADC)的特异性抑制剂,以及分析ODC和ADC基因的表达水平与托品烷生物碱含量的关联性,证明AbODC在托品的生物合成中起主要作用[21].AbODC催化鸟氨酸脱羧生成腐胺(putrescine)[21];腐胺经腐胺N-甲基转移酶(AbPMT)和N-甲基腐胺氧化酶(AbMPO)顺序催化,一个氨基被甲基化,另一个氨基被氧化成醛基,从而生成4-氨甲基正丁醛(4-aminomethylbutanal)(图9)[22-23].在颠茄中发现了两个AbMPO(AbMPO1和AbMPO2),AbMPO1主要在根中表达,而AbMPO2主要在地上部分表达,并且抑制AbMPO1的表达会显著降低莨菪碱和东莨菪碱的含量,因此AbMPO1是托品烷生物碱生物合成的主要功能性N-甲基腐胺氧化酶.4-氨甲基正丁醛通过自发环化,形成N-甲基吡咯啉正离子(N-methylpyrrolinium cation)(图9)[24].N-甲基吡咯啉正离子和丙二酰辅酶A在非典型Ⅲ型聚酮合酶AbPYKS的催化下生成4-(1-甲基-2-吡咯烷基)-3-氧丁酸[4-(1-methyl-2-pyrrolidinyl)-3-oxobutanoic acid](图9)[25].4-(1-甲基-2-吡咯烷基)-3-氧丁酸在托品酮合酶AbCYP82M3的介导下发生氧化和环化反应生成托品酮(tropinone)(图9)[25].最后,托品酮在托品酮还原酶I(AbTRI)的催化下生成托品(tropine)(图9)[23].通过解析AbPYKS的同工酶AaPYKS(源于三分三,Anisodus acutangulus)的蛋白晶体结构,阐明了该类非典型Ⅲ型聚酮合酶的催化机制.AaPYKS活性口袋内的保守三联体Cys166-His305-Asn338负责产生关键中间体3-羰基戊二酸;3-羰基戊二酸与N-甲基吡咯啉正离子通过自发缩合产生4-(1-甲基-2-吡咯烷基)-3-氧丁酸[26]. ...
... [25].最后,托品酮在托品酮还原酶I(AbTRI)的催化下生成托品(tropine)(图9)[23].通过解析AbPYKS的同工酶AaPYKS(源于三分三,Anisodus acutangulus)的蛋白晶体结构,阐明了该类非典型Ⅲ型聚酮合酶的催化机制.AaPYKS活性口袋内的保守三联体Cys166-His305-Asn338负责产生关键中间体3-羰基戊二酸;3-羰基戊二酸与N-甲基吡咯啉正离子通过自发缩合产生4-(1-甲基-2-吡咯烷基)-3-氧丁酸[26]. ...
Tropane alkaloids biosynthesis involves an unusual type Ⅲ polyketide synthase and non-enzymatic condensation
3
2019
... 合成生物技术具有高度的过程可控特征,能确保成分稳定的中药药效物质的可持续供给.药效成分生物合成途径和调控机制的完整解析,是建立其合成生物学制备方法的前提条件.近年来,国内外学者在复杂药效成分的形成机制研究中取得了重要进展,例如:完整揭示了秋水仙碱、吗啡的生物合成途径[13-14],以及阐明了丹参酮[15-20]和托品烷生物碱[21-26]的关键生物合成步骤和调控机制.并且已经实现许多重要单分子中药药效成分的高效制备,例如:建立青蒿酸的细胞工厂,每升产量达25 g,再通过化学转化高产青蒿素[27].中药药效主要源于多成分作用的叠加或协同,因此药效成分群是中药药效物质的主要形式(本文所指“中药药效成分群”为:符合药材的某种传统药效并且与药材提取物相比等效或基本等效的成分组合).中药药效成分群主要包括挥发油、总皂苷、总黄酮、总木脂素和总生物碱等类型.目前,中药药效成分群的合成生物学研究主要是解析生物合成途径、阐明调控机制以及建立其中某个单个分子的生物制备方法.以药效成分群作为整体研究对象的合成生物技术鲜有报道,其难点是如何优化成分群中各个成员分子的比例.由于分子比例决定了药效成分群的药效,因此实现分子比例的精准调控是建立高品质药效成分群的关键. ...
... 通过在颠茄毛状根中饲喂鸟氨酸脱羧酶(ODC)或精氨酸脱羧酶(ADC)的特异性抑制剂,以及分析ODC和ADC基因的表达水平与托品烷生物碱含量的关联性,证明AbODC在托品的生物合成中起主要作用[21].AbODC催化鸟氨酸脱羧生成腐胺(putrescine)[21];腐胺经腐胺N-甲基转移酶(AbPMT)和N-甲基腐胺氧化酶(AbMPO)顺序催化,一个氨基被甲基化,另一个氨基被氧化成醛基,从而生成4-氨甲基正丁醛(4-aminomethylbutanal)(图9)[22-23].在颠茄中发现了两个AbMPO(AbMPO1和AbMPO2),AbMPO1主要在根中表达,而AbMPO2主要在地上部分表达,并且抑制AbMPO1的表达会显著降低莨菪碱和东莨菪碱的含量,因此AbMPO1是托品烷生物碱生物合成的主要功能性N-甲基腐胺氧化酶.4-氨甲基正丁醛通过自发环化,形成N-甲基吡咯啉正离子(N-methylpyrrolinium cation)(图9)[24].N-甲基吡咯啉正离子和丙二酰辅酶A在非典型Ⅲ型聚酮合酶AbPYKS的催化下生成4-(1-甲基-2-吡咯烷基)-3-氧丁酸[4-(1-methyl-2-pyrrolidinyl)-3-oxobutanoic acid](图9)[25].4-(1-甲基-2-吡咯烷基)-3-氧丁酸在托品酮合酶AbCYP82M3的介导下发生氧化和环化反应生成托品酮(tropinone)(图9)[25].最后,托品酮在托品酮还原酶I(AbTRI)的催化下生成托品(tropine)(图9)[23].通过解析AbPYKS的同工酶AaPYKS(源于三分三,Anisodus acutangulus)的蛋白晶体结构,阐明了该类非典型Ⅲ型聚酮合酶的催化机制.AaPYKS活性口袋内的保守三联体Cys166-His305-Asn338负责产生关键中间体3-羰基戊二酸;3-羰基戊二酸与N-甲基吡咯啉正离子通过自发缩合产生4-(1-甲基-2-吡咯烷基)-3-氧丁酸[26]. ...
... 阐明药效物质的生物合成机制是建立其合成生物学制备方法的前提,然而大多数中药材的药效成分群的形成机制尚未完整解析.2020版《中国药典》收录了600多种中药材.这些药材中,药效成分的形成机制被完全阐明的属凤毛麟角.即使对于人参皂苷等研究最广泛的药效成分群,其生物合成途径也尚未完整揭示.而且,目前途径解析研究主要集中在萜类、黄酮、木脂素等类型的化合物,这些类型化合物的生物合成过程具有较强的规律性,相对容易被揭示.而对于生物碱类化合物,结构类型多样,相应的生物合成过程大相径庭,难有规律可循,因此研究难度较大,目前仅在苄基异喹啉类[125-126]、秋水仙碱类[13]、托品烷类[21-26]等少数几种生物碱的途径解析中取得了突破性进展,未来需要加强该方面的研究.此外,成分群生物合成研究不仅要表征生物合成酶,还要准确锁定真正控制成分比例的关键酶并揭示其控制产物多样性的机制.对于存在多种同工酶的情况,需要揭示各个同工酶在产物类型和比例上的精细差别. ...
High-level semi-synthetic production of the potent antimalarial artemisinin
2
2013
... 合成生物技术具有高度的过程可控特征,能确保成分稳定的中药药效物质的可持续供给.药效成分生物合成途径和调控机制的完整解析,是建立其合成生物学制备方法的前提条件.近年来,国内外学者在复杂药效成分的形成机制研究中取得了重要进展,例如:完整揭示了秋水仙碱、吗啡的生物合成途径[13-14],以及阐明了丹参酮[15-20]和托品烷生物碱[21-26]的关键生物合成步骤和调控机制.并且已经实现许多重要单分子中药药效成分的高效制备,例如:建立青蒿酸的细胞工厂,每升产量达25 g,再通过化学转化高产青蒿素[27].中药药效主要源于多成分作用的叠加或协同,因此药效成分群是中药药效物质的主要形式(本文所指“中药药效成分群”为:符合药材的某种传统药效并且与药材提取物相比等效或基本等效的成分组合).中药药效成分群主要包括挥发油、总皂苷、总黄酮、总木脂素和总生物碱等类型.目前,中药药效成分群的合成生物学研究主要是解析生物合成途径、阐明调控机制以及建立其中某个单个分子的生物制备方法.以药效成分群作为整体研究对象的合成生物技术鲜有报道,其难点是如何优化成分群中各个成员分子的比例.由于分子比例决定了药效成分群的药效,因此实现分子比例的精准调控是建立高品质药效成分群的关键. ...
... 中药的药效主要源于多成分作用的叠加或协同,极少源于单一成分(例如青蒿素)的活性.目前,中药药效物质的合成生物学研究主要集中在单一药效成分或药效成分群中某一单个成分的生物制备方法的构建.例如:通过联合运用细胞工厂和化学合成实现青蒿素的高效制备[27];分别构建了几种单一人参皂苷成分(包括人参皂苷CK、Rg3、Rh1、Rh2和F1)的细胞工厂[66,68,70-71].成分群的生物合成过程可分为两种情况:①成分群中的组成分子分别由不同的分支路径合成,如前所述的人参皂苷类成分群和淫羊藿苷类成分群;②成分群中的组成分子均由同一路径合成,如檀香挥发油.对于前一种情况,可以分别建立各种成员分子的生物制备方法,然后按照特定的比例进行组合;对于后一种情况,只能通过改造关键生物合成酶(即同时产生多种重要分子的生物合成酶),重塑其产物比例,从而达到精准调控目标成分群配比的目的.近年来,本课题组聚焦上述第二种中药药效成分群的合成生物学方法研究,建立了优质檀香挥发油的细胞工厂[28],实现了水飞蓟药效成分群的“从头”生物制备[120]. ...
Rationally engineering santalene synthase to readjust the component ratio of sandalwood oil
9
2022
... 近期,本课题组运用“酶工程联合代谢工程”的策略,实现了分子比例和产量的双重优化,构建了高效檀香挥发油细胞工厂,所产挥发油的品质可媲美高品质的印度檀香挥发油[28].本文对中药药效成分群的形成机制以及合成生物技术研究进展进行了综述. ...
... 中药的药效主要源于多成分作用的叠加或协同,极少源于单一成分(例如青蒿素)的活性.目前,中药药效物质的合成生物学研究主要集中在单一药效成分或药效成分群中某一单个成分的生物制备方法的构建.例如:通过联合运用细胞工厂和化学合成实现青蒿素的高效制备[27];分别构建了几种单一人参皂苷成分(包括人参皂苷CK、Rg3、Rh1、Rh2和F1)的细胞工厂[66,68,70-71].成分群的生物合成过程可分为两种情况:①成分群中的组成分子分别由不同的分支路径合成,如前所述的人参皂苷类成分群和淫羊藿苷类成分群;②成分群中的组成分子均由同一路径合成,如檀香挥发油.对于前一种情况,可以分别建立各种成员分子的生物制备方法,然后按照特定的比例进行组合;对于后一种情况,只能通过改造关键生物合成酶(即同时产生多种重要分子的生物合成酶),重塑其产物比例,从而达到精准调控目标成分群配比的目的.近年来,本课题组聚焦上述第二种中药药效成分群的合成生物学方法研究,建立了优质檀香挥发油的细胞工厂[28],实现了水飞蓟药效成分群的“从头”生物制备[120]. ...
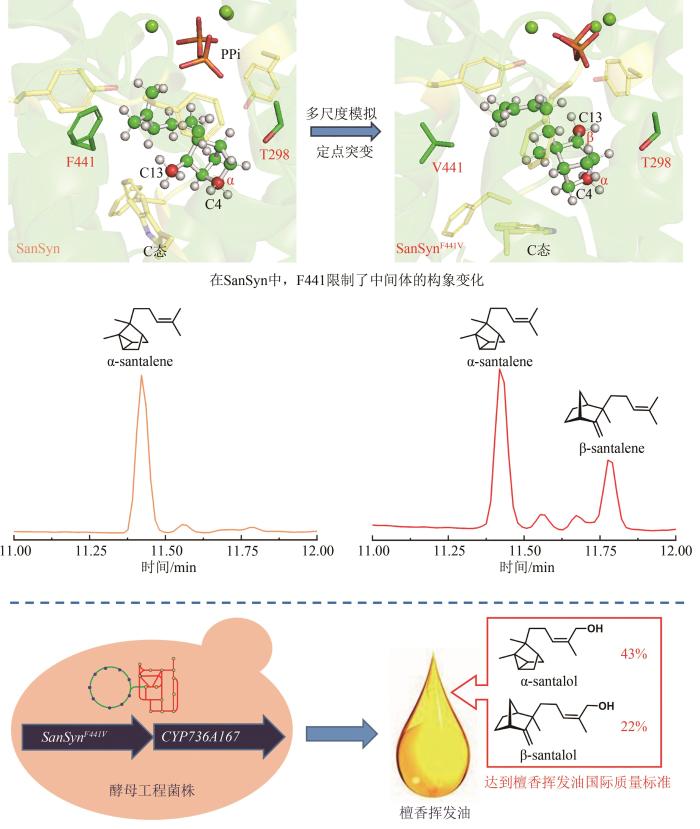
... 在檀香挥发油生物合成途径中,首先檀香烯合酶SaSSy环化E,E-FPP,得到四种檀香烯分子(α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯);然后细胞色素P450酶CYP736A167氧化四种檀香烯分子,生成四种檀香醇分子(α-檀香醇、β-檀香醇、epi-β-檀香醇和exo-α-香柠檬醇).因此,檀香挥发油中的所有成分均来源于同一路径,无法通过分别合成各成分再组合的方式得到理想配比的挥发油.所以,精准调控分子配比是建立高品质檀香挥发油生物制备方法的关键难点.由于CYP736A167对四种檀香烯分子的选择性无差别,因此四种檀香醇分子之间的比例与四种檀香烯分子的比例高度一致.所以,檀香挥发油中成分的比例主要由SaSSy决定.而黄皮树中的檀香烯合酶SanSyn仅专一性地产生α-檀香烯[39].SaSSy中的T318作为广义碱,负责从中间体C的C4和C13位脱质子,分别生成α-檀香烯和β-檀香烯(图10);而在SanSyn中,T298作为广义碱,仅能从中间体C的C4位脱质子,生成α-檀香烯(图10)[28].进一步发现SanSyn中的F441阻碍了中间体C的构象动态变化,尤其限制了C6-C7-C8-C9二面角的波动,致使T298仅能接近C4,而无法接近C13位,因此只能在C4位脱质子,生成α-檀香烯(图10).用体积较小的氨基酸取代F441后,突变酶可同时产生α-檀香烯和β-檀香烯,说明解除了F441对中间体C构象变化的限制[28].在突变酶SanSynF441V的产物中,α-檀香烯和β-檀香烯的占比最为理想,分别为57.2%和28.6%[28].利用SanSynF441V和CYP736A167,构建了檀香挥发油的酿酒酵母细胞工程,所产挥发油中α-檀香醇和β-檀香醇的含量比例分别为43.4%和22%,达到高品质印度檀香挥发油的标准[28]. ...
... [28].在突变酶SanSynF441V的产物中,α-檀香烯和β-檀香烯的占比最为理想,分别为57.2%和28.6%[28].利用SanSynF441V和CYP736A167,构建了檀香挥发油的酿酒酵母细胞工程,所产挥发油中α-檀香醇和β-檀香醇的含量比例分别为43.4%和22%,达到高品质印度檀香挥发油的标准[28]. ...
... [28].利用SanSynF441V和CYP736A167,构建了檀香挥发油的酿酒酵母细胞工程,所产挥发油中α-檀香醇和β-檀香醇的含量比例分别为43.4%和22%,达到高品质印度檀香挥发油的标准[28]. ...
... [28]. ...
... 系统的代谢工程研究,显著提高了檀香挥发油的产量[28,122-123].主要策略包括:通过优化甲羟戊酸途径,促进前体化合物DMAPP和IPP的合成;通过抑制酵母角鲨烯合酶(ERG9)以及敲除酵母二酰基焦磷酸磷酸酶(DPP1)和脂质磷酸磷酸酶(LPP1),降低三萜和法尼醇合成通路对FPP的消耗;优化从乙醇到乙酰辅酶A的转化途径,提高乙酰辅酶A的供给;敲除两种老黄酶(OYE2和OYE3)和两种酰基转移酶(ATF1和ATF2),阻止檀香醇向二氢檀香醇和乙酰二氢檀香醇的转化;通过敲除转录抑制因子ROX1,上调萜类生物合成基因的表达水平等[28,122].在研究中,首次发现RNA m6A修饰对萜类等化合物代谢途径的调控作用,并通过过表达RNA m6A甲基转移酶IME4,进一步提高檀香烯和檀香醇的产量,最终产量达到2.9 g/L[123]. ...
... [28,122].在研究中,首次发现RNA m6A修饰对萜类等化合物代谢途径的调控作用,并通过过表达RNA m6A甲基转移酶IME4,进一步提高檀香烯和檀香醇的产量,最终产量达到2.9 g/L[123]. ...
... 如前所述,成分的比例决定了成分群的药效,所以有效地控制成分比例对于制造高品质的药效成分群至关重要.成分的比例往往由关键生物合成酶控制,如檀香挥发油的成分比例由檀香烯合酶控制[28].因此,通过改造关键酶,可优化成分比例.前面采用理性设计对檀香烯合酶进行改造,起到了优化效果.然而,理性设计要求揭示目标酶的结构和机制,并且往往仅能针对活性口袋内的氨基酸进行改造[135].活性口袋外部的氨基酸可能与酶的构象等特征相关联,因此也可能影响酶的催化功能(如产物的类型和比例等).定向进化可以在未揭示酶的结构和催化机制的情况下,对酶进行系统的改造(既包括活性口袋内部的氨基酸,也包括活性口袋外部的氨基酸),但是需要筛选大量的突变酶[136].因此,未来需要联合理性设计和定向进化两种方法,充分发挥两种方法的优势,通过更有效地改造关键酶,优化成分比例.此外,人工智能辅助的设计技术[137]和新型高通量筛选技术[138]也将推动酶工程领域的高速发展. ...
Isoprenoid biosynthesis in plants: carbon partitioning within the cytoplasmic pathway
1
1999
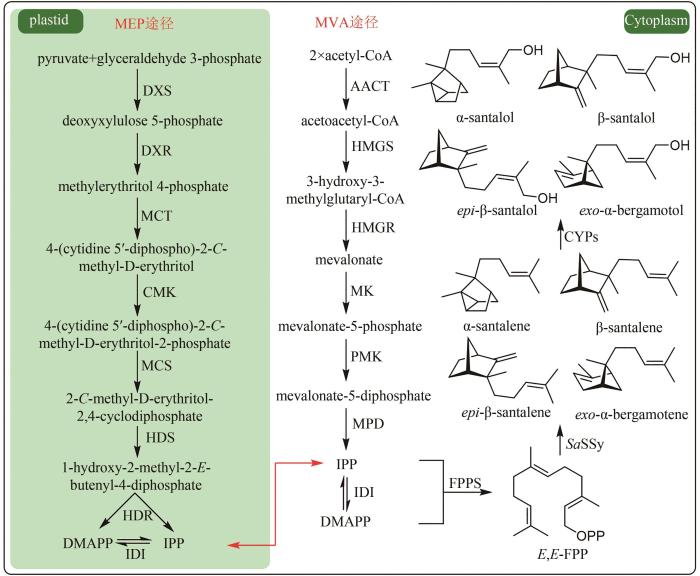
... 《中华人民共和国药典》(2020年版)收录了46种以挥发油为主要药效物质的中药材.这些挥发油多为单萜和倍半萜类成分.在植物中,萜类化合物的共同前体异戊烯基焦磷酸(IPP)来源于两条生物合成途径:位于细胞质中的甲羟戊酸途径(MVA途径)[29]和位于质体中的磷酸甲基赤藓糖途径(MEP途径)[30].在异戊烯基焦磷酸异构酶(IDI)的催化下,IPP与其异构体二甲基丙烯基焦磷酸(DMAPP)相互转化.IPP与DMAPP在香叶基焦磷酸合酶(GPPS)和法尼烯基焦磷酸合酶(FPPS)的催化下分别生成单萜化合物的前体香叶基焦磷酸(GPP)和倍半萜化合物的前体法尼烯基焦磷酸(FPP),然后分别在单萜和倍半萜合酶的催化下生成各种单萜和倍半萜骨架.最后在细胞色素P450酶(CYP)等后修饰酶的作用下形成结构多样的萜类化合物[31].除萜类成分外,植物挥发油也常含有聚酮等挥发性成分.本文分别以檀香挥发油和广藿香挥发油为例,介绍单纯萜类成分挥发油以及萜/聚酮类成分挥发油的生物合成研究. ...
Isoprenoid biosynthesis in bacteria: a novel pathway for the early steps leading to isopentenyl diphosphate
1
1993
... 《中华人民共和国药典》(2020年版)收录了46种以挥发油为主要药效物质的中药材.这些挥发油多为单萜和倍半萜类成分.在植物中,萜类化合物的共同前体异戊烯基焦磷酸(IPP)来源于两条生物合成途径:位于细胞质中的甲羟戊酸途径(MVA途径)[29]和位于质体中的磷酸甲基赤藓糖途径(MEP途径)[30].在异戊烯基焦磷酸异构酶(IDI)的催化下,IPP与其异构体二甲基丙烯基焦磷酸(DMAPP)相互转化.IPP与DMAPP在香叶基焦磷酸合酶(GPPS)和法尼烯基焦磷酸合酶(FPPS)的催化下分别生成单萜化合物的前体香叶基焦磷酸(GPP)和倍半萜化合物的前体法尼烯基焦磷酸(FPP),然后分别在单萜和倍半萜合酶的催化下生成各种单萜和倍半萜骨架.最后在细胞色素P450酶(CYP)等后修饰酶的作用下形成结构多样的萜类化合物[31].除萜类成分外,植物挥发油也常含有聚酮等挥发性成分.本文分别以檀香挥发油和广藿香挥发油为例,介绍单纯萜类成分挥发油以及萜/聚酮类成分挥发油的生物合成研究. ...
Biosynthesis of plant isoprenoids: perspectives for microbial engineering
1
2009
... 《中华人民共和国药典》(2020年版)收录了46种以挥发油为主要药效物质的中药材.这些挥发油多为单萜和倍半萜类成分.在植物中,萜类化合物的共同前体异戊烯基焦磷酸(IPP)来源于两条生物合成途径:位于细胞质中的甲羟戊酸途径(MVA途径)[29]和位于质体中的磷酸甲基赤藓糖途径(MEP途径)[30].在异戊烯基焦磷酸异构酶(IDI)的催化下,IPP与其异构体二甲基丙烯基焦磷酸(DMAPP)相互转化.IPP与DMAPP在香叶基焦磷酸合酶(GPPS)和法尼烯基焦磷酸合酶(FPPS)的催化下分别生成单萜化合物的前体香叶基焦磷酸(GPP)和倍半萜化合物的前体法尼烯基焦磷酸(FPP),然后分别在单萜和倍半萜合酶的催化下生成各种单萜和倍半萜骨架.最后在细胞色素P450酶(CYP)等后修饰酶的作用下形成结构多样的萜类化合物[31].除萜类成分外,植物挥发油也常含有聚酮等挥发性成分.本文分别以檀香挥发油和广藿香挥发油为例,介绍单纯萜类成分挥发油以及萜/聚酮类成分挥发油的生物合成研究. ...
East Indian sandalwood (Santalum album L.) oil confers neuroprotection and geroprotection in Caenorhabditis elegans via activating SKN-1/Nrf2 signaling pathway
1
2018
... 檀香(Santali Albi Lignum)为檀香科植物檀香(Santalum album L.)的干燥心材;挥发油是其药效物质,具有神经保护、抗炎、抗病毒、抗菌、抗氧化、抗癌以及调节胃肠道功能等药理活性[32-34].檀香生长缓慢,而且只有树龄达到25年以上,才能从成熟的心材中提取出高品质挥发油.檀香挥发油中的药效成分为倍半萜类化合物,主要包括:Z/E-α-檀香醇(Z/E-α-santalol)、Z/E-β-檀香醇(Z/E-β-santalol)、Z/E-epi-β-檀香醇(Z/E-epi-β-santalol)、Z/E-exo-α-香柠檬醇(Z/E-exo-α-bergamotol)、α-檀香烯(α- santalene)、β-檀香烯(β-santalene)、epi-β-檀香烯(epi-β-santalene)和exo-α-香柠檬烯(exo-α- bergamotene)[35].其中,Z-α-檀香醇和Z-β-檀香醇是药效指标成分[36]. ...
Anti-diarrhoeal activity of methanol extract of Santalum album L. in mice and gastrointestinal effect on the contraction of isolated jejunum in rats
0
2014
Safety assessment of sandalwood oil (Santalum album L.)
1
2008
... 檀香(Santali Albi Lignum)为檀香科植物檀香(Santalum album L.)的干燥心材;挥发油是其药效物质,具有神经保护、抗炎、抗病毒、抗菌、抗氧化、抗癌以及调节胃肠道功能等药理活性[32-34].檀香生长缓慢,而且只有树龄达到25年以上,才能从成熟的心材中提取出高品质挥发油.檀香挥发油中的药效成分为倍半萜类化合物,主要包括:Z/E-α-檀香醇(Z/E-α-santalol)、Z/E-β-檀香醇(Z/E-β-santalol)、Z/E-epi-β-檀香醇(Z/E-epi-β-santalol)、Z/E-exo-α-香柠檬醇(Z/E-exo-α-bergamotol)、α-檀香烯(α- santalene)、β-檀香烯(β-santalene)、epi-β-檀香烯(epi-β-santalene)和exo-α-香柠檬烯(exo-α- bergamotene)[35].其中,Z-α-檀香醇和Z-β-檀香醇是药效指标成分[36]. ...
A comparison of the composition of selected commercial sandalwood oils with the international standard
1
2021
... 檀香(Santali Albi Lignum)为檀香科植物檀香(Santalum album L.)的干燥心材;挥发油是其药效物质,具有神经保护、抗炎、抗病毒、抗菌、抗氧化、抗癌以及调节胃肠道功能等药理活性[32-34].檀香生长缓慢,而且只有树龄达到25年以上,才能从成熟的心材中提取出高品质挥发油.檀香挥发油中的药效成分为倍半萜类化合物,主要包括:Z/E-α-檀香醇(Z/E-α-santalol)、Z/E-β-檀香醇(Z/E-β-santalol)、Z/E-epi-β-檀香醇(Z/E-epi-β-santalol)、Z/E-exo-α-香柠檬醇(Z/E-exo-α-bergamotol)、α-檀香烯(α- santalene)、β-檀香烯(β-santalene)、epi-β-檀香烯(epi-β-santalene)和exo-α-香柠檬烯(exo-α- bergamotene)[35].其中,Z-α-檀香醇和Z-β-檀香醇是药效指标成分[36]. ...
Preparative separation of α- and β-santalenes and (Z)-α- and (Z)-β-santalols using silver nitrate-impregnated silica gel medium pressure liquid chromatography and analysis of sandalwood oil
2
2012
... 檀香(Santali Albi Lignum)为檀香科植物檀香(Santalum album L.)的干燥心材;挥发油是其药效物质,具有神经保护、抗炎、抗病毒、抗菌、抗氧化、抗癌以及调节胃肠道功能等药理活性[32-34].檀香生长缓慢,而且只有树龄达到25年以上,才能从成熟的心材中提取出高品质挥发油.檀香挥发油中的药效成分为倍半萜类化合物,主要包括:Z/E-α-檀香醇(Z/E-α-santalol)、Z/E-β-檀香醇(Z/E-β-santalol)、Z/E-epi-β-檀香醇(Z/E-epi-β-santalol)、Z/E-exo-α-香柠檬醇(Z/E-exo-α-bergamotol)、α-檀香烯(α- santalene)、β-檀香烯(β-santalene)、epi-β-檀香烯(epi-β-santalene)和exo-α-香柠檬烯(exo-α- bergamotene)[35].其中,Z-α-檀香醇和Z-β-檀香醇是药效指标成分[36]. ...
... 檀香及檀香挥发油被用于23种《中国药典》收录的成方制剂.如前所述,檀香挥发油包含八种主要药效分子:α-檀香醇、β-檀香醇、epi-β-檀香醇、exo-α-香柠檬醇、α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯.其中,α-檀香醇和β-檀香醇是药效指标成分,也是质控成分[36].只有20~30年树龄的印度产檀香的心材为优质药材,其挥发油中α-檀香醇和β-檀香醇的含量分别为41%~55%和16%~24%,然而由于过度开采,印度檀香资源已功能性灭绝,被列入《世界自然保护联盟濒危物种红色名录》[121]. ...
Sandalwood fragrance biosynthesis involves sesquiterpene synthases of both the terpene synthase (TPS)-a and TPS-b subfamilies, including santalene synthases
2
2011
... 第一步:E,E-FPP在檀香烯合酶(STS)的催化下生成α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯.目前已表征了多种来源的STS.其中,檀香中的SaSSy、新喀里多尼亚檀香(S. austrocaledonicum)中的SauSSy、大果澳洲檀香(S. spicatum)中的SspiSSy[37]以及樟树(Cinnamomum camphora)中的CiCaSSy[38]均可催化E,E-FPP生成α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯;而黄皮树(Clausena lansium)中的SanSyn则可特异性地环化E,E-FPP得到α-檀香烯以及微量的exo-α-香柠檬烯[39].除以E,E-FPP为前体的生物合成途径外,从野生西红柿(Solanum habrochaites)中发现了以其几何异构体Z,Z-FPP为前体的檀香烯生物合成基因簇.该基因簇中的Sh-CPT1为首次发现的Z,Z-FPP合酶,与其相邻的Sh-TPS45(SBS)可催化Z,Z-FPP环化生成α-檀香烯、epi-β-檀香烯、endo-α-香柠檬烯、exo-α-香柠檬烯和endo-β-香柠檬烯[40-41].有趣的是,SaSSy也可接受Z,Z-FPP为底物,产物包括:α-檀香烯、β-檀香烯、epi-β-檀香烯、endo-α-香柠檬烯和Z-β-法尼烯[37]. ...
... [37]. ...
Santalene synthase
1
... 第一步:E,E-FPP在檀香烯合酶(STS)的催化下生成α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯.目前已表征了多种来源的STS.其中,檀香中的SaSSy、新喀里多尼亚檀香(S. austrocaledonicum)中的SauSSy、大果澳洲檀香(S. spicatum)中的SspiSSy[37]以及樟树(Cinnamomum camphora)中的CiCaSSy[38]均可催化E,E-FPP生成α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯;而黄皮树(Clausena lansium)中的SanSyn则可特异性地环化E,E-FPP得到α-檀香烯以及微量的exo-α-香柠檬烯[39].除以E,E-FPP为前体的生物合成途径外,从野生西红柿(Solanum habrochaites)中发现了以其几何异构体Z,Z-FPP为前体的檀香烯生物合成基因簇.该基因簇中的Sh-CPT1为首次发现的Z,Z-FPP合酶,与其相邻的Sh-TPS45(SBS)可催化Z,Z-FPP环化生成α-檀香烯、epi-β-檀香烯、endo-α-香柠檬烯、exo-α-香柠檬烯和endo-β-香柠檬烯[40-41].有趣的是,SaSSy也可接受Z,Z-FPP为底物,产物包括:α-檀香烯、β-檀香烯、epi-β-檀香烯、endo-α-香柠檬烯和Z-β-法尼烯[37]. ...
Method for producing alpha-santalene
2
... 第一步:E,E-FPP在檀香烯合酶(STS)的催化下生成α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯.目前已表征了多种来源的STS.其中,檀香中的SaSSy、新喀里多尼亚檀香(S. austrocaledonicum)中的SauSSy、大果澳洲檀香(S. spicatum)中的SspiSSy[37]以及樟树(Cinnamomum camphora)中的CiCaSSy[38]均可催化E,E-FPP生成α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯;而黄皮树(Clausena lansium)中的SanSyn则可特异性地环化E,E-FPP得到α-檀香烯以及微量的exo-α-香柠檬烯[39].除以E,E-FPP为前体的生物合成途径外,从野生西红柿(Solanum habrochaites)中发现了以其几何异构体Z,Z-FPP为前体的檀香烯生物合成基因簇.该基因簇中的Sh-CPT1为首次发现的Z,Z-FPP合酶,与其相邻的Sh-TPS45(SBS)可催化Z,Z-FPP环化生成α-檀香烯、epi-β-檀香烯、endo-α-香柠檬烯、exo-α-香柠檬烯和endo-β-香柠檬烯[40-41].有趣的是,SaSSy也可接受Z,Z-FPP为底物,产物包括:α-檀香烯、β-檀香烯、epi-β-檀香烯、endo-α-香柠檬烯和Z-β-法尼烯[37]. ...
... 在檀香挥发油生物合成途径中,首先檀香烯合酶SaSSy环化E,E-FPP,得到四种檀香烯分子(α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯);然后细胞色素P450酶CYP736A167氧化四种檀香烯分子,生成四种檀香醇分子(α-檀香醇、β-檀香醇、epi-β-檀香醇和exo-α-香柠檬醇).因此,檀香挥发油中的所有成分均来源于同一路径,无法通过分别合成各成分再组合的方式得到理想配比的挥发油.所以,精准调控分子配比是建立高品质檀香挥发油生物制备方法的关键难点.由于CYP736A167对四种檀香烯分子的选择性无差别,因此四种檀香醇分子之间的比例与四种檀香烯分子的比例高度一致.所以,檀香挥发油中成分的比例主要由SaSSy决定.而黄皮树中的檀香烯合酶SanSyn仅专一性地产生α-檀香烯[39].SaSSy中的T318作为广义碱,负责从中间体C的C4和C13位脱质子,分别生成α-檀香烯和β-檀香烯(图10);而在SanSyn中,T298作为广义碱,仅能从中间体C的C4位脱质子,生成α-檀香烯(图10)[28].进一步发现SanSyn中的F441阻碍了中间体C的构象动态变化,尤其限制了C6-C7-C8-C9二面角的波动,致使T298仅能接近C4,而无法接近C13位,因此只能在C4位脱质子,生成α-檀香烯(图10).用体积较小的氨基酸取代F441后,突变酶可同时产生α-檀香烯和β-檀香烯,说明解除了F441对中间体C构象变化的限制[28].在突变酶SanSynF441V的产物中,α-檀香烯和β-檀香烯的占比最为理想,分别为57.2%和28.6%[28].利用SanSynF441V和CYP736A167,构建了檀香挥发油的酿酒酵母细胞工程,所产挥发油中α-檀香醇和β-檀香醇的含量比例分别为43.4%和22%,达到高品质印度檀香挥发油的标准[28]. ...
A novel pathway for sesquiterpene biosynthesis from Z,Z-farnesyl pyrophosphate in the wild tomato Solanum habrochaites
1
2009
... 第一步:E,E-FPP在檀香烯合酶(STS)的催化下生成α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯.目前已表征了多种来源的STS.其中,檀香中的SaSSy、新喀里多尼亚檀香(S. austrocaledonicum)中的SauSSy、大果澳洲檀香(S. spicatum)中的SspiSSy[37]以及樟树(Cinnamomum camphora)中的CiCaSSy[38]均可催化E,E-FPP生成α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯;而黄皮树(Clausena lansium)中的SanSyn则可特异性地环化E,E-FPP得到α-檀香烯以及微量的exo-α-香柠檬烯[39].除以E,E-FPP为前体的生物合成途径外,从野生西红柿(Solanum habrochaites)中发现了以其几何异构体Z,Z-FPP为前体的檀香烯生物合成基因簇.该基因簇中的Sh-CPT1为首次发现的Z,Z-FPP合酶,与其相邻的Sh-TPS45(SBS)可催化Z,Z-FPP环化生成α-檀香烯、epi-β-檀香烯、endo-α-香柠檬烯、exo-α-香柠檬烯和endo-β-香柠檬烯[40-41].有趣的是,SaSSy也可接受Z,Z-FPP为底物,产物包括:α-檀香烯、β-檀香烯、epi-β-檀香烯、endo-α-香柠檬烯和Z-β-法尼烯[37]. ...
Evolution of a complex locus for terpene biosynthesis in Solanum
1
2013
... 第一步:E,E-FPP在檀香烯合酶(STS)的催化下生成α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯.目前已表征了多种来源的STS.其中,檀香中的SaSSy、新喀里多尼亚檀香(S. austrocaledonicum)中的SauSSy、大果澳洲檀香(S. spicatum)中的SspiSSy[37]以及樟树(Cinnamomum camphora)中的CiCaSSy[38]均可催化E,E-FPP生成α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯;而黄皮树(Clausena lansium)中的SanSyn则可特异性地环化E,E-FPP得到α-檀香烯以及微量的exo-α-香柠檬烯[39].除以E,E-FPP为前体的生物合成途径外,从野生西红柿(Solanum habrochaites)中发现了以其几何异构体Z,Z-FPP为前体的檀香烯生物合成基因簇.该基因簇中的Sh-CPT1为首次发现的Z,Z-FPP合酶,与其相邻的Sh-TPS45(SBS)可催化Z,Z-FPP环化生成α-檀香烯、epi-β-檀香烯、endo-α-香柠檬烯、exo-α-香柠檬烯和endo-β-香柠檬烯[40-41].有趣的是,SaSSy也可接受Z,Z-FPP为底物,产物包括:α-檀香烯、β-檀香烯、epi-β-檀香烯、endo-α-香柠檬烯和Z-β-法尼烯[37]. ...
Biosynthesis of sandalwood oil: Santalum album CYP76F cytochromes P450 produce santalols and bergamotol
3
2013
... 第二步:α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯在CYP的催化下,发生C12位羟基化,生成α-檀香醇、β-檀香醇、epi-β-檀香醇和exo-α-香柠檬醇[42].目前,已经从檀香中表征了10个催化上述反应的CYP(表1).其中,CYP76F41、CYP76F42和CYP76F39v1能够产生全部Z型和E型的α-檀香醇、β-檀香醇、exo-α-香柠檬醇和epi-β-檀香醇;CYP76F39v2能够生成除Z-epi-β-檀香醇外的7种产物;CYP76F40仅能够产生Z-α-檀香醇、E-β-檀香醇和E-exo-α-香柠檬醇;CYP76F37v1、CYP76F37v2、CYP76F38v1和CYP76F38v2只产生E型的α-檀香醇、β-檀香醇和exo-α-香柠檬醇[42];CYP736A167特异性地生成Z型的α-檀香醇、β-檀香醇、exo-α-香柠檬醇和epi-β-檀香醇[43]. ...
... [42];CYP736A167特异性地生成Z型的α-檀香醇、β-檀香醇、exo-α-香柠檬醇和epi-β-檀香醇[43]. ...
...
Z/
E-
exo-α-香柠檬醇
[42] | | CYP76F39v2 | Z/E-α-檀香醇、 ...
Heartwood-specific transcriptome and metabolite signatures of tropical sandalwood (Santalum album) reveal the final step of (Z)- santalol fragrance biosynthesis
2
2016
... 第二步:α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯在CYP的催化下,发生C12位羟基化,生成α-檀香醇、β-檀香醇、epi-β-檀香醇和exo-α-香柠檬醇[42].目前,已经从檀香中表征了10个催化上述反应的CYP(表1).其中,CYP76F41、CYP76F42和CYP76F39v1能够产生全部Z型和E型的α-檀香醇、β-檀香醇、exo-α-香柠檬醇和epi-β-檀香醇;CYP76F39v2能够生成除Z-epi-β-檀香醇外的7种产物;CYP76F40仅能够产生Z-α-檀香醇、E-β-檀香醇和E-exo-α-香柠檬醇;CYP76F37v1、CYP76F37v2、CYP76F38v1和CYP76F38v2只产生E型的α-檀香醇、β-檀香醇和exo-α-香柠檬醇[42];CYP736A167特异性地生成Z型的α-檀香醇、β-檀香醇、exo-α-香柠檬醇和epi-β-檀香醇[43]. ...
... Z-exo-α-香柠檬醇 | [43] |
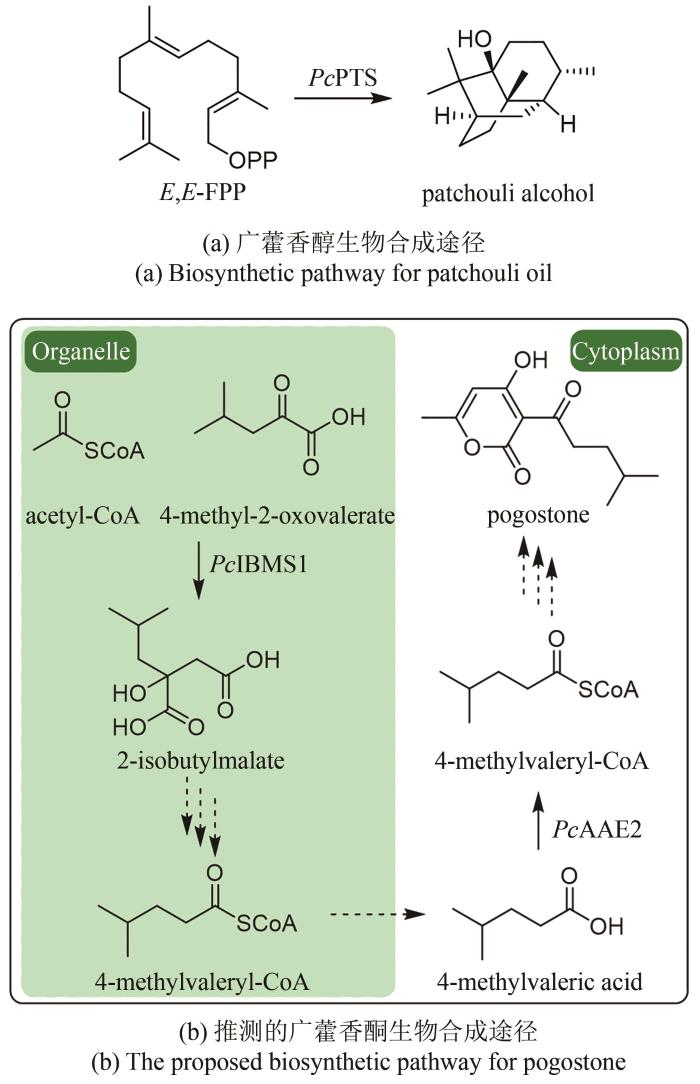
1.1.2 广藿香挥发油成分群的生物合成途径广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[44],也是多种中成药的重要药效成分,例如藿香正气口服液等.药理研究表明,广藿香挥发油还具有抗菌、抗炎以及抗肿瘤等作用[45],主要含有倍半萜化合物广藿香醇(patchouli alcohol)和聚酮化合物广藿香酮(pogostone).广藿香醇生物合成机制已被阐明.广藿香醇合酶PcPTS催化E,E-FPP生成主产物广藿香醇以及其他13个微量倍半萜化合物[图2(a)],包括β-广藿香烯、(+)-吉马烯A、E-β-石竹烯、α-愈创木烯、西车烯、α-蛇麻烯、α-广藿香烯以及γ-广藿香烯等[46].PcPTS的表达受多个转录因子调控.例如,Chen等[47]发现MYB转录因子家族的PatMYB46可与PatJAZ4结合,显著上调PcPTS的表达;Yu等[48]发现SPL家族的SPL10也可上调PcPTS的表达,从而促进广藿香醇的合成.广藿香酮的生物合成途径目前尚未被完全解析.Wang等[49]采用同位素标记法,证实了4-甲基戊酸是广藿香酮生物合成的前体化合物,并发现PcIBMS1酶在线粒体中可催化4-甲基-2-氧戊酸(4-methyl-2-oxovalerate)和乙酰辅酶A发生aldol缩合,生成2-异丁基苹果酸(2-isobutylmalate),2-异丁基苹果酸通过异构化、脱酸以及与辅酶A相连,生成4-甲基戊酰辅酶A,4-甲基戊酰辅酶A被转运至细胞质,同时失去辅酶A,生成4-甲基戊酸[图2(b)][49].广藿香酮的生物合成具有时空特异性,主要在幼苗期和7周以下植株的主茎和顶叶中生成,并且发现细胞质中的酰基激活酶基因PcAAE2和Ⅲ型聚酮合酶基因PcPKS3的表达模式与广藿香酮的分布模式具有显著相关性[50].PcAAE2可以把4-甲基戊酸重新转化为4-甲基戊酰辅酶A,PcPKS3可催化4-甲基戊酰辅酶A和异戊酰辅酶A(推测为广藿香酮B的前体)与丙二酸单酰辅酶A发生反应,但产物不是广藿香酮和广藿香酮B[51].因此,鉴定广藿香酮生物合成途径中的聚酮合酶是完整解析广藿香挥发油生物合成机制的关键所在. ...
Patchouli oil ameliorates 5-fluorouracil-induced intestinal mucositis in rats via protecting intestinal barrier and regulating water transport
1
2020
... 广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[44],也是多种中成药的重要药效成分,例如藿香正气口服液等.药理研究表明,广藿香挥发油还具有抗菌、抗炎以及抗肿瘤等作用[45],主要含有倍半萜化合物广藿香醇(patchouli alcohol)和聚酮化合物广藿香酮(pogostone).广藿香醇生物合成机制已被阐明.广藿香醇合酶PcPTS催化E,E-FPP生成主产物广藿香醇以及其他13个微量倍半萜化合物[图2(a)],包括β-广藿香烯、(+)-吉马烯A、E-β-石竹烯、α-愈创木烯、西车烯、α-蛇麻烯、α-广藿香烯以及γ-广藿香烯等[46].PcPTS的表达受多个转录因子调控.例如,Chen等[47]发现MYB转录因子家族的PatMYB46可与PatJAZ4结合,显著上调PcPTS的表达;Yu等[48]发现SPL家族的SPL10也可上调PcPTS的表达,从而促进广藿香醇的合成.广藿香酮的生物合成途径目前尚未被完全解析.Wang等[49]采用同位素标记法,证实了4-甲基戊酸是广藿香酮生物合成的前体化合物,并发现PcIBMS1酶在线粒体中可催化4-甲基-2-氧戊酸(4-methyl-2-oxovalerate)和乙酰辅酶A发生aldol缩合,生成2-异丁基苹果酸(2-isobutylmalate),2-异丁基苹果酸通过异构化、脱酸以及与辅酶A相连,生成4-甲基戊酰辅酶A,4-甲基戊酰辅酶A被转运至细胞质,同时失去辅酶A,生成4-甲基戊酸[图2(b)][49].广藿香酮的生物合成具有时空特异性,主要在幼苗期和7周以下植株的主茎和顶叶中生成,并且发现细胞质中的酰基激活酶基因PcAAE2和Ⅲ型聚酮合酶基因PcPKS3的表达模式与广藿香酮的分布模式具有显著相关性[50].PcAAE2可以把4-甲基戊酸重新转化为4-甲基戊酰辅酶A,PcPKS3可催化4-甲基戊酰辅酶A和异戊酰辅酶A(推测为广藿香酮B的前体)与丙二酸单酰辅酶A发生反应,但产物不是广藿香酮和广藿香酮B[51].因此,鉴定广藿香酮生物合成途径中的聚酮合酶是完整解析广藿香挥发油生物合成机制的关键所在. ...
A comprehensive review on pharmacological activities of pachypodol: a bioactive compound of an aromatic medicinal plant Pogostemon cablin Benth
1
2023
... 广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[44],也是多种中成药的重要药效成分,例如藿香正气口服液等.药理研究表明,广藿香挥发油还具有抗菌、抗炎以及抗肿瘤等作用[45],主要含有倍半萜化合物广藿香醇(patchouli alcohol)和聚酮化合物广藿香酮(pogostone).广藿香醇生物合成机制已被阐明.广藿香醇合酶PcPTS催化E,E-FPP生成主产物广藿香醇以及其他13个微量倍半萜化合物[图2(a)],包括β-广藿香烯、(+)-吉马烯A、E-β-石竹烯、α-愈创木烯、西车烯、α-蛇麻烯、α-广藿香烯以及γ-广藿香烯等[46].PcPTS的表达受多个转录因子调控.例如,Chen等[47]发现MYB转录因子家族的PatMYB46可与PatJAZ4结合,显著上调PcPTS的表达;Yu等[48]发现SPL家族的SPL10也可上调PcPTS的表达,从而促进广藿香醇的合成.广藿香酮的生物合成途径目前尚未被完全解析.Wang等[49]采用同位素标记法,证实了4-甲基戊酸是广藿香酮生物合成的前体化合物,并发现PcIBMS1酶在线粒体中可催化4-甲基-2-氧戊酸(4-methyl-2-oxovalerate)和乙酰辅酶A发生aldol缩合,生成2-异丁基苹果酸(2-isobutylmalate),2-异丁基苹果酸通过异构化、脱酸以及与辅酶A相连,生成4-甲基戊酰辅酶A,4-甲基戊酰辅酶A被转运至细胞质,同时失去辅酶A,生成4-甲基戊酸[图2(b)][49].广藿香酮的生物合成具有时空特异性,主要在幼苗期和7周以下植株的主茎和顶叶中生成,并且发现细胞质中的酰基激活酶基因PcAAE2和Ⅲ型聚酮合酶基因PcPKS3的表达模式与广藿香酮的分布模式具有显著相关性[50].PcAAE2可以把4-甲基戊酸重新转化为4-甲基戊酰辅酶A,PcPKS3可催化4-甲基戊酰辅酶A和异戊酰辅酶A(推测为广藿香酮B的前体)与丙二酸单酰辅酶A发生反应,但产物不是广藿香酮和广藿香酮B[51].因此,鉴定广藿香酮生物合成途径中的聚酮合酶是完整解析广藿香挥发油生物合成机制的关键所在. ...
The diverse sesquiterpene profile of patchouli, Pogostemon cablin, is correlated with a limited number of sesquiterpene synthases
1
2006
... 广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[44],也是多种中成药的重要药效成分,例如藿香正气口服液等.药理研究表明,广藿香挥发油还具有抗菌、抗炎以及抗肿瘤等作用[45],主要含有倍半萜化合物广藿香醇(patchouli alcohol)和聚酮化合物广藿香酮(pogostone).广藿香醇生物合成机制已被阐明.广藿香醇合酶PcPTS催化E,E-FPP生成主产物广藿香醇以及其他13个微量倍半萜化合物[图2(a)],包括β-广藿香烯、(+)-吉马烯A、E-β-石竹烯、α-愈创木烯、西车烯、α-蛇麻烯、α-广藿香烯以及γ-广藿香烯等[46].PcPTS的表达受多个转录因子调控.例如,Chen等[47]发现MYB转录因子家族的PatMYB46可与PatJAZ4结合,显著上调PcPTS的表达;Yu等[48]发现SPL家族的SPL10也可上调PcPTS的表达,从而促进广藿香醇的合成.广藿香酮的生物合成途径目前尚未被完全解析.Wang等[49]采用同位素标记法,证实了4-甲基戊酸是广藿香酮生物合成的前体化合物,并发现PcIBMS1酶在线粒体中可催化4-甲基-2-氧戊酸(4-methyl-2-oxovalerate)和乙酰辅酶A发生aldol缩合,生成2-异丁基苹果酸(2-isobutylmalate),2-异丁基苹果酸通过异构化、脱酸以及与辅酶A相连,生成4-甲基戊酰辅酶A,4-甲基戊酰辅酶A被转运至细胞质,同时失去辅酶A,生成4-甲基戊酸[图2(b)][49].广藿香酮的生物合成具有时空特异性,主要在幼苗期和7周以下植株的主茎和顶叶中生成,并且发现细胞质中的酰基激活酶基因PcAAE2和Ⅲ型聚酮合酶基因PcPKS3的表达模式与广藿香酮的分布模式具有显著相关性[50].PcAAE2可以把4-甲基戊酸重新转化为4-甲基戊酰辅酶A,PcPKS3可催化4-甲基戊酰辅酶A和异戊酰辅酶A(推测为广藿香酮B的前体)与丙二酸单酰辅酶A发生反应,但产物不是广藿香酮和广藿香酮B[51].因此,鉴定广藿香酮生物合成途径中的聚酮合酶是完整解析广藿香挥发油生物合成机制的关键所在. ...
PatDREB transcription factor activates patchoulol synthase gene promoter and positively regulates jasmonate-induced patchoulol biosynthesis
1
2022
... 广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[44],也是多种中成药的重要药效成分,例如藿香正气口服液等.药理研究表明,广藿香挥发油还具有抗菌、抗炎以及抗肿瘤等作用[45],主要含有倍半萜化合物广藿香醇(patchouli alcohol)和聚酮化合物广藿香酮(pogostone).广藿香醇生物合成机制已被阐明.广藿香醇合酶PcPTS催化E,E-FPP生成主产物广藿香醇以及其他13个微量倍半萜化合物[图2(a)],包括β-广藿香烯、(+)-吉马烯A、E-β-石竹烯、α-愈创木烯、西车烯、α-蛇麻烯、α-广藿香烯以及γ-广藿香烯等[46].PcPTS的表达受多个转录因子调控.例如,Chen等[47]发现MYB转录因子家族的PatMYB46可与PatJAZ4结合,显著上调PcPTS的表达;Yu等[48]发现SPL家族的SPL10也可上调PcPTS的表达,从而促进广藿香醇的合成.广藿香酮的生物合成途径目前尚未被完全解析.Wang等[49]采用同位素标记法,证实了4-甲基戊酸是广藿香酮生物合成的前体化合物,并发现PcIBMS1酶在线粒体中可催化4-甲基-2-氧戊酸(4-methyl-2-oxovalerate)和乙酰辅酶A发生aldol缩合,生成2-异丁基苹果酸(2-isobutylmalate),2-异丁基苹果酸通过异构化、脱酸以及与辅酶A相连,生成4-甲基戊酰辅酶A,4-甲基戊酰辅酶A被转运至细胞质,同时失去辅酶A,生成4-甲基戊酸[图2(b)][49].广藿香酮的生物合成具有时空特异性,主要在幼苗期和7周以下植株的主茎和顶叶中生成,并且发现细胞质中的酰基激活酶基因PcAAE2和Ⅲ型聚酮合酶基因PcPKS3的表达模式与广藿香酮的分布模式具有显著相关性[50].PcAAE2可以把4-甲基戊酸重新转化为4-甲基戊酰辅酶A,PcPKS3可催化4-甲基戊酰辅酶A和异戊酰辅酶A(推测为广藿香酮B的前体)与丙二酸单酰辅酶A发生反应,但产物不是广藿香酮和广藿香酮B[51].因此,鉴定广藿香酮生物合成途径中的聚酮合酶是完整解析广藿香挥发油生物合成机制的关键所在. ...
Progressive regulation of sesquiterpene biosynthesis in Arabidopsis and Patchouli (Pogostemon cablin) by the miR156-targeted SPL transcription factors
1
2015
... 广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[44],也是多种中成药的重要药效成分,例如藿香正气口服液等.药理研究表明,广藿香挥发油还具有抗菌、抗炎以及抗肿瘤等作用[45],主要含有倍半萜化合物广藿香醇(patchouli alcohol)和聚酮化合物广藿香酮(pogostone).广藿香醇生物合成机制已被阐明.广藿香醇合酶PcPTS催化E,E-FPP生成主产物广藿香醇以及其他13个微量倍半萜化合物[图2(a)],包括β-广藿香烯、(+)-吉马烯A、E-β-石竹烯、α-愈创木烯、西车烯、α-蛇麻烯、α-广藿香烯以及γ-广藿香烯等[46].PcPTS的表达受多个转录因子调控.例如,Chen等[47]发现MYB转录因子家族的PatMYB46可与PatJAZ4结合,显著上调PcPTS的表达;Yu等[48]发现SPL家族的SPL10也可上调PcPTS的表达,从而促进广藿香醇的合成.广藿香酮的生物合成途径目前尚未被完全解析.Wang等[49]采用同位素标记法,证实了4-甲基戊酸是广藿香酮生物合成的前体化合物,并发现PcIBMS1酶在线粒体中可催化4-甲基-2-氧戊酸(4-methyl-2-oxovalerate)和乙酰辅酶A发生aldol缩合,生成2-异丁基苹果酸(2-isobutylmalate),2-异丁基苹果酸通过异构化、脱酸以及与辅酶A相连,生成4-甲基戊酰辅酶A,4-甲基戊酰辅酶A被转运至细胞质,同时失去辅酶A,生成4-甲基戊酸[图2(b)][49].广藿香酮的生物合成具有时空特异性,主要在幼苗期和7周以下植株的主茎和顶叶中生成,并且发现细胞质中的酰基激活酶基因PcAAE2和Ⅲ型聚酮合酶基因PcPKS3的表达模式与广藿香酮的分布模式具有显著相关性[50].PcAAE2可以把4-甲基戊酸重新转化为4-甲基戊酰辅酶A,PcPKS3可催化4-甲基戊酰辅酶A和异戊酰辅酶A(推测为广藿香酮B的前体)与丙二酸单酰辅酶A发生反应,但产物不是广藿香酮和广藿香酮B[51].因此,鉴定广藿香酮生物合成途径中的聚酮合酶是完整解析广藿香挥发油生物合成机制的关键所在. ...
Synthesis of 4-methylvaleric acid, a precursor of pogostone, involves a 2-isobutylmalate synthase related to 2-isopropylmalate synthase of leucine biosynthesis
2
2022
... 广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[44],也是多种中成药的重要药效成分,例如藿香正气口服液等.药理研究表明,广藿香挥发油还具有抗菌、抗炎以及抗肿瘤等作用[45],主要含有倍半萜化合物广藿香醇(patchouli alcohol)和聚酮化合物广藿香酮(pogostone).广藿香醇生物合成机制已被阐明.广藿香醇合酶PcPTS催化E,E-FPP生成主产物广藿香醇以及其他13个微量倍半萜化合物[图2(a)],包括β-广藿香烯、(+)-吉马烯A、E-β-石竹烯、α-愈创木烯、西车烯、α-蛇麻烯、α-广藿香烯以及γ-广藿香烯等[46].PcPTS的表达受多个转录因子调控.例如,Chen等[47]发现MYB转录因子家族的PatMYB46可与PatJAZ4结合,显著上调PcPTS的表达;Yu等[48]发现SPL家族的SPL10也可上调PcPTS的表达,从而促进广藿香醇的合成.广藿香酮的生物合成途径目前尚未被完全解析.Wang等[49]采用同位素标记法,证实了4-甲基戊酸是广藿香酮生物合成的前体化合物,并发现PcIBMS1酶在线粒体中可催化4-甲基-2-氧戊酸(4-methyl-2-oxovalerate)和乙酰辅酶A发生aldol缩合,生成2-异丁基苹果酸(2-isobutylmalate),2-异丁基苹果酸通过异构化、脱酸以及与辅酶A相连,生成4-甲基戊酰辅酶A,4-甲基戊酰辅酶A被转运至细胞质,同时失去辅酶A,生成4-甲基戊酸[图2(b)][49].广藿香酮的生物合成具有时空特异性,主要在幼苗期和7周以下植株的主茎和顶叶中生成,并且发现细胞质中的酰基激活酶基因PcAAE2和Ⅲ型聚酮合酶基因PcPKS3的表达模式与广藿香酮的分布模式具有显著相关性[50].PcAAE2可以把4-甲基戊酸重新转化为4-甲基戊酰辅酶A,PcPKS3可催化4-甲基戊酰辅酶A和异戊酰辅酶A(推测为广藿香酮B的前体)与丙二酸单酰辅酶A发生反应,但产物不是广藿香酮和广藿香酮B[51].因此,鉴定广藿香酮生物合成途径中的聚酮合酶是完整解析广藿香挥发油生物合成机制的关键所在. ...
... [49].广藿香酮的生物合成具有时空特异性,主要在幼苗期和7周以下植株的主茎和顶叶中生成,并且发现细胞质中的酰基激活酶基因PcAAE2和Ⅲ型聚酮合酶基因PcPKS3的表达模式与广藿香酮的分布模式具有显著相关性[50].PcAAE2可以把4-甲基戊酸重新转化为4-甲基戊酰辅酶A,PcPKS3可催化4-甲基戊酰辅酶A和异戊酰辅酶A(推测为广藿香酮B的前体)与丙二酸单酰辅酶A发生反应,但产物不是广藿香酮和广藿香酮B[51].因此,鉴定广藿香酮生物合成途径中的聚酮合酶是完整解析广藿香挥发油生物合成机制的关键所在. ...
广藿香酮生物合成关键基因的鉴定
1
2022
... 广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[44],也是多种中成药的重要药效成分,例如藿香正气口服液等.药理研究表明,广藿香挥发油还具有抗菌、抗炎以及抗肿瘤等作用[45],主要含有倍半萜化合物广藿香醇(patchouli alcohol)和聚酮化合物广藿香酮(pogostone).广藿香醇生物合成机制已被阐明.广藿香醇合酶PcPTS催化E,E-FPP生成主产物广藿香醇以及其他13个微量倍半萜化合物[图2(a)],包括β-广藿香烯、(+)-吉马烯A、E-β-石竹烯、α-愈创木烯、西车烯、α-蛇麻烯、α-广藿香烯以及γ-广藿香烯等[46].PcPTS的表达受多个转录因子调控.例如,Chen等[47]发现MYB转录因子家族的PatMYB46可与PatJAZ4结合,显著上调PcPTS的表达;Yu等[48]发现SPL家族的SPL10也可上调PcPTS的表达,从而促进广藿香醇的合成.广藿香酮的生物合成途径目前尚未被完全解析.Wang等[49]采用同位素标记法,证实了4-甲基戊酸是广藿香酮生物合成的前体化合物,并发现PcIBMS1酶在线粒体中可催化4-甲基-2-氧戊酸(4-methyl-2-oxovalerate)和乙酰辅酶A发生aldol缩合,生成2-异丁基苹果酸(2-isobutylmalate),2-异丁基苹果酸通过异构化、脱酸以及与辅酶A相连,生成4-甲基戊酰辅酶A,4-甲基戊酰辅酶A被转运至细胞质,同时失去辅酶A,生成4-甲基戊酸[图2(b)][49].广藿香酮的生物合成具有时空特异性,主要在幼苗期和7周以下植株的主茎和顶叶中生成,并且发现细胞质中的酰基激活酶基因PcAAE2和Ⅲ型聚酮合酶基因PcPKS3的表达模式与广藿香酮的分布模式具有显著相关性[50].PcAAE2可以把4-甲基戊酸重新转化为4-甲基戊酰辅酶A,PcPKS3可催化4-甲基戊酰辅酶A和异戊酰辅酶A(推测为广藿香酮B的前体)与丙二酸单酰辅酶A发生反应,但产物不是广藿香酮和广藿香酮B[51].因此,鉴定广藿香酮生物合成途径中的聚酮合酶是完整解析广藿香挥发油生物合成机制的关键所在. ...
Identification of key genes that catalyze pogostone biosynthesis
1
2022
... 广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[44],也是多种中成药的重要药效成分,例如藿香正气口服液等.药理研究表明,广藿香挥发油还具有抗菌、抗炎以及抗肿瘤等作用[45],主要含有倍半萜化合物广藿香醇(patchouli alcohol)和聚酮化合物广藿香酮(pogostone).广藿香醇生物合成机制已被阐明.广藿香醇合酶PcPTS催化E,E-FPP生成主产物广藿香醇以及其他13个微量倍半萜化合物[图2(a)],包括β-广藿香烯、(+)-吉马烯A、E-β-石竹烯、α-愈创木烯、西车烯、α-蛇麻烯、α-广藿香烯以及γ-广藿香烯等[46].PcPTS的表达受多个转录因子调控.例如,Chen等[47]发现MYB转录因子家族的PatMYB46可与PatJAZ4结合,显著上调PcPTS的表达;Yu等[48]发现SPL家族的SPL10也可上调PcPTS的表达,从而促进广藿香醇的合成.广藿香酮的生物合成途径目前尚未被完全解析.Wang等[49]采用同位素标记法,证实了4-甲基戊酸是广藿香酮生物合成的前体化合物,并发现PcIBMS1酶在线粒体中可催化4-甲基-2-氧戊酸(4-methyl-2-oxovalerate)和乙酰辅酶A发生aldol缩合,生成2-异丁基苹果酸(2-isobutylmalate),2-异丁基苹果酸通过异构化、脱酸以及与辅酶A相连,生成4-甲基戊酰辅酶A,4-甲基戊酰辅酶A被转运至细胞质,同时失去辅酶A,生成4-甲基戊酸[图2(b)][49].广藿香酮的生物合成具有时空特异性,主要在幼苗期和7周以下植株的主茎和顶叶中生成,并且发现细胞质中的酰基激活酶基因PcAAE2和Ⅲ型聚酮合酶基因PcPKS3的表达模式与广藿香酮的分布模式具有显著相关性[50].PcAAE2可以把4-甲基戊酸重新转化为4-甲基戊酰辅酶A,PcPKS3可催化4-甲基戊酰辅酶A和异戊酰辅酶A(推测为广藿香酮B的前体)与丙二酸单酰辅酶A发生反应,但产物不是广藿香酮和广藿香酮B[51].因此,鉴定广藿香酮生物合成途径中的聚酮合酶是完整解析广藿香挥发油生物合成机制的关键所在. ...
The type Ⅲ polyketide synthase supergene family in plants: complex evolutionary history and functional divergence
1
2022
... 广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[44],也是多种中成药的重要药效成分,例如藿香正气口服液等.药理研究表明,广藿香挥发油还具有抗菌、抗炎以及抗肿瘤等作用[45],主要含有倍半萜化合物广藿香醇(patchouli alcohol)和聚酮化合物广藿香酮(pogostone).广藿香醇生物合成机制已被阐明.广藿香醇合酶PcPTS催化E,E-FPP生成主产物广藿香醇以及其他13个微量倍半萜化合物[图2(a)],包括β-广藿香烯、(+)-吉马烯A、E-β-石竹烯、α-愈创木烯、西车烯、α-蛇麻烯、α-广藿香烯以及γ-广藿香烯等[46].PcPTS的表达受多个转录因子调控.例如,Chen等[47]发现MYB转录因子家族的PatMYB46可与PatJAZ4结合,显著上调PcPTS的表达;Yu等[48]发现SPL家族的SPL10也可上调PcPTS的表达,从而促进广藿香醇的合成.广藿香酮的生物合成途径目前尚未被完全解析.Wang等[49]采用同位素标记法,证实了4-甲基戊酸是广藿香酮生物合成的前体化合物,并发现PcIBMS1酶在线粒体中可催化4-甲基-2-氧戊酸(4-methyl-2-oxovalerate)和乙酰辅酶A发生aldol缩合,生成2-异丁基苹果酸(2-isobutylmalate),2-异丁基苹果酸通过异构化、脱酸以及与辅酶A相连,生成4-甲基戊酰辅酶A,4-甲基戊酰辅酶A被转运至细胞质,同时失去辅酶A,生成4-甲基戊酸[图2(b)][49].广藿香酮的生物合成具有时空特异性,主要在幼苗期和7周以下植株的主茎和顶叶中生成,并且发现细胞质中的酰基激活酶基因PcAAE2和Ⅲ型聚酮合酶基因PcPKS3的表达模式与广藿香酮的分布模式具有显著相关性[50].PcAAE2可以把4-甲基戊酸重新转化为4-甲基戊酰辅酶A,PcPKS3可催化4-甲基戊酰辅酶A和异戊酰辅酶A(推测为广藿香酮B的前体)与丙二酸单酰辅酶A发生反应,但产物不是广藿香酮和广藿香酮B[51].因此,鉴定广藿香酮生物合成途径中的聚酮合酶是完整解析广藿香挥发油生物合成机制的关键所在. ...
Triterpene structural diversification by plant cytochrome P450 enzymes
1
2017
... 根据苷元的结构类型,皂苷可分为甾体皂苷和三萜皂苷,其中植物来源的三萜皂苷主要包括四环三萜皂苷和五环三萜皂苷.目前的生物合成研究主要集中在三萜皂苷.在三萜皂苷的生物合成途径中,2分子E,E-FPP在角鲨烯合酶(SQS)的催化下生成角鲨烯(squalene),进一步在鲨烯环氧化酶(SQE)的催化下生成三萜化合物的重要前体2,3-环氧鲨烯(2,3-oxidosqualene),之后在环氧鲨烯环化酶(OSC)的催化下经环化、重排得到各种三萜骨架,最后经氧化、糖基化等后修饰生成结构多样的三萜皂苷[52-53].本文分别以人参皂苷(ginsenoside)和黄芪皂苷(astragaloside)为例,介绍四环三萜皂苷和五环三萜皂苷的生物合成研究进展. ...
Evolution of structural diversity of triterpenoids
1
2019
... 根据苷元的结构类型,皂苷可分为甾体皂苷和三萜皂苷,其中植物来源的三萜皂苷主要包括四环三萜皂苷和五环三萜皂苷.目前的生物合成研究主要集中在三萜皂苷.在三萜皂苷的生物合成途径中,2分子E,E-FPP在角鲨烯合酶(SQS)的催化下生成角鲨烯(squalene),进一步在鲨烯环氧化酶(SQE)的催化下生成三萜化合物的重要前体2,3-环氧鲨烯(2,3-oxidosqualene),之后在环氧鲨烯环化酶(OSC)的催化下经环化、重排得到各种三萜骨架,最后经氧化、糖基化等后修饰生成结构多样的三萜皂苷[52-53].本文分别以人参皂苷(ginsenoside)和黄芪皂苷(astragaloside)为例,介绍四环三萜皂苷和五环三萜皂苷的生物合成研究进展. ...
Review of ginseng anti-diabetic studies
1
2019
... 人参、三七和西洋参均是来自于五加科人参属的中药材.人参皂苷是这三种药材的共同药效成分,具有抗氧化、抗炎、血管舒张、抗过敏以及抗糖尿病等多种药理作用[54-56].人参皂苷为达玛烷型四环三萜皂苷,分为原人参二醇(PPD)型和原人参三醇(PPT)型.PPD型人参皂苷在C3和C20位的羟基上引入一个或多个糖基,而PPT型人参皂苷是C6和C20位的羟基被糖基化[57].糖基的类型、数量和位置决定了人参皂苷的多样性,主要包括:人参皂苷Rb1、Rb2、Rc、Rd、Re、Rf和Rg1. ...
Antioxidant, anti-inflammatory and antithrombotic effects of ginsenoside compound K enriched extract derived from ginseng sprouts
0
2021
Ginsenoside Rb1 as an anti-diabetic agent and its underlying mechanism analysis
1
2019
... 人参、三七和西洋参均是来自于五加科人参属的中药材.人参皂苷是这三种药材的共同药效成分,具有抗氧化、抗炎、血管舒张、抗过敏以及抗糖尿病等多种药理作用[54-56].人参皂苷为达玛烷型四环三萜皂苷,分为原人参二醇(PPD)型和原人参三醇(PPT)型.PPD型人参皂苷在C3和C20位的羟基上引入一个或多个糖基,而PPT型人参皂苷是C6和C20位的羟基被糖基化[57].糖基的类型、数量和位置决定了人参皂苷的多样性,主要包括:人参皂苷Rb1、Rb2、Rc、Rd、Re、Rf和Rg1. ...
Ginsenosides in Panax genus and their biosynthesis
1
2021
... 人参、三七和西洋参均是来自于五加科人参属的中药材.人参皂苷是这三种药材的共同药效成分,具有抗氧化、抗炎、血管舒张、抗过敏以及抗糖尿病等多种药理作用[54-56].人参皂苷为达玛烷型四环三萜皂苷,分为原人参二醇(PPD)型和原人参三醇(PPT)型.PPD型人参皂苷在C3和C20位的羟基上引入一个或多个糖基,而PPT型人参皂苷是C6和C20位的羟基被糖基化[57].糖基的类型、数量和位置决定了人参皂苷的多样性,主要包括:人参皂苷Rb1、Rb2、Rc、Rd、Re、Rf和Rg1. ...
Dammarenediol-Ⅱ synthase, the first dedicated enzyme for ginsenoside biosynthesis, in Panax ginseng
1
2006
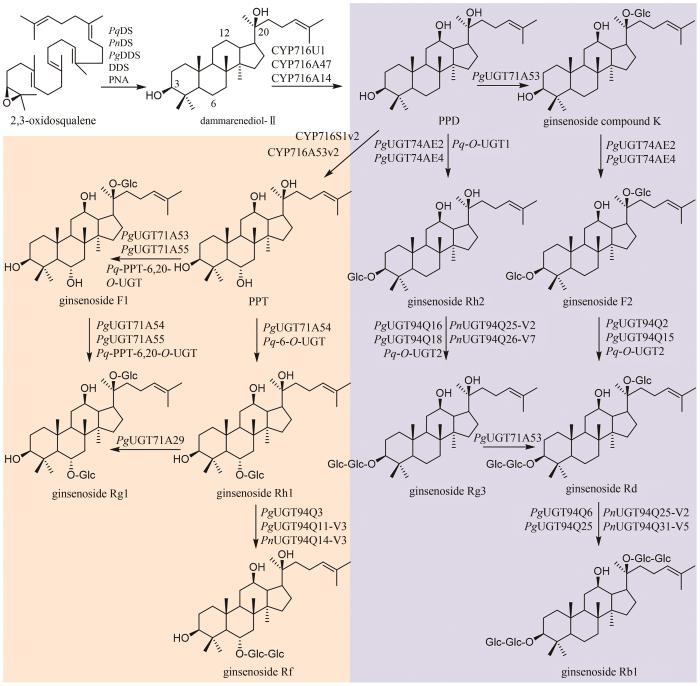
... 国内外学者对人参皂苷的生物合成进行了深入的研究(图3).首先,达玛烯二醇-Ⅱ合酶(DS)环化2,3-环氧鲨烯,生成达玛烯二醇(dammarenediol-Ⅱ).目前,已鉴定多个DS酶,如:人参(Panax ginseng C. A. Mey.)中的PNA[58]、DDS[59]和PgDDS[60]以及三七[Panax notoginseng (Burk.) F. H. Chen]中的PnDS[61]和西洋参(Panax quinquefolium L.)中的PqDS[62].人参中的三个CYP酶CYP716U1、CYP716A47和CYP716A14负责催化达玛烯二醇C12位的羟基化,生成PPD;然后,CYP716S1v2和CYP716A53v2催化C6位羟基化,生成PPT(图3)[63-65]. ...
Expression and RNA interference-induced silencing of the dammarenediol synthase gene in Panax ginseng
1
2006
... 国内外学者对人参皂苷的生物合成进行了深入的研究(图3).首先,达玛烯二醇-Ⅱ合酶(DS)环化2,3-环氧鲨烯,生成达玛烯二醇(dammarenediol-Ⅱ).目前,已鉴定多个DS酶,如:人参(Panax ginseng C. A. Mey.)中的PNA[58]、DDS[59]和PgDDS[60]以及三七[Panax notoginseng (Burk.) F. H. Chen]中的PnDS[61]和西洋参(Panax quinquefolium L.)中的PqDS[62].人参中的三个CYP酶CYP716U1、CYP716A47和CYP716A14负责催化达玛烯二醇C12位的羟基化,生成PPD;然后,CYP716S1v2和CYP716A53v2催化C6位羟基化,生成PPT(图3)[63-65]. ...
Dammarenediol-Ⅱ production confers TMV tolerance in transgenic tobacco expressing Panax ginseng dammarenediol-Ⅱ synthase
1
2012
... 国内外学者对人参皂苷的生物合成进行了深入的研究(图3).首先,达玛烯二醇-Ⅱ合酶(DS)环化2,3-环氧鲨烯,生成达玛烯二醇(dammarenediol-Ⅱ).目前,已鉴定多个DS酶,如:人参(Panax ginseng C. A. Mey.)中的PNA[58]、DDS[59]和PgDDS[60]以及三七[Panax notoginseng (Burk.) F. H. Chen]中的PnDS[61]和西洋参(Panax quinquefolium L.)中的PqDS[62].人参中的三个CYP酶CYP716U1、CYP716A47和CYP716A14负责催化达玛烯二醇C12位的羟基化,生成PPD;然后,CYP716S1v2和CYP716A53v2催化C6位羟基化,生成PPT(图3)[63-65]. ...
Expression profiling of the triterpene saponin biosynthesis genes FPS, SS, SE, and DS in the medicinal plant Panax notoginseng
1
2014
... 国内外学者对人参皂苷的生物合成进行了深入的研究(图3).首先,达玛烯二醇-Ⅱ合酶(DS)环化2,3-环氧鲨烯,生成达玛烯二醇(dammarenediol-Ⅱ).目前,已鉴定多个DS酶,如:人参(Panax ginseng C. A. Mey.)中的PNA[58]、DDS[59]和PgDDS[60]以及三七[Panax notoginseng (Burk.) F. H. Chen]中的PnDS[61]和西洋参(Panax quinquefolium L.)中的PqDS[62].人参中的三个CYP酶CYP716U1、CYP716A47和CYP716A14负责催化达玛烯二醇C12位的羟基化,生成PPD;然后,CYP716S1v2和CYP716A53v2催化C6位羟基化,生成PPT(图3)[63-65]. ...
The isolation and characterization of dammarenediol synthase gene from Panax quinquefolius and its heterologous co-expression with cytochrome P450 gene PqD12H in yeast
1
2014
... 国内外学者对人参皂苷的生物合成进行了深入的研究(图3).首先,达玛烯二醇-Ⅱ合酶(DS)环化2,3-环氧鲨烯,生成达玛烯二醇(dammarenediol-Ⅱ).目前,已鉴定多个DS酶,如:人参(Panax ginseng C. A. Mey.)中的PNA[58]、DDS[59]和PgDDS[60]以及三七[Panax notoginseng (Burk.) F. H. Chen]中的PnDS[61]和西洋参(Panax quinquefolium L.)中的PqDS[62].人参中的三个CYP酶CYP716U1、CYP716A47和CYP716A14负责催化达玛烯二醇C12位的羟基化,生成PPD;然后,CYP716S1v2和CYP716A53v2催化C6位羟基化,生成PPT(图3)[63-65]. ...
Cytochrome P450 CYP716A53v2 catalyzes the formation of protopanaxatriol from protopanaxadiol during ginsenoside biosynthesis in Panax ginseng
1
2012
... 国内外学者对人参皂苷的生物合成进行了深入的研究(图3).首先,达玛烯二醇-Ⅱ合酶(DS)环化2,3-环氧鲨烯,生成达玛烯二醇(dammarenediol-Ⅱ).目前,已鉴定多个DS酶,如:人参(Panax ginseng C. A. Mey.)中的PNA[58]、DDS[59]和PgDDS[60]以及三七[Panax notoginseng (Burk.) F. H. Chen]中的PnDS[61]和西洋参(Panax quinquefolium L.)中的PqDS[62].人参中的三个CYP酶CYP716U1、CYP716A47和CYP716A14负责催化达玛烯二醇C12位的羟基化,生成PPD;然后,CYP716S1v2和CYP716A53v2催化C6位羟基化,生成PPT(图3)[63-65]. ...
The Cyt P450 enzyme CYP716A47 catalyzes the formation of protopanaxadiol from dammarenediol-Ⅱ during ginsenoside biosynthesis in Panax ginseng
0
2011
The involvement of β-amyrin 28-oxidase (CYP716A52v2) in oleanane-type ginsenoside biosynthesis in Panax ginseng
1
2013
... 国内外学者对人参皂苷的生物合成进行了深入的研究(图3).首先,达玛烯二醇-Ⅱ合酶(DS)环化2,3-环氧鲨烯,生成达玛烯二醇(dammarenediol-Ⅱ).目前,已鉴定多个DS酶,如:人参(Panax ginseng C. A. Mey.)中的PNA[58]、DDS[59]和PgDDS[60]以及三七[Panax notoginseng (Burk.) F. H. Chen]中的PnDS[61]和西洋参(Panax quinquefolium L.)中的PqDS[62].人参中的三个CYP酶CYP716U1、CYP716A47和CYP716A14负责催化达玛烯二醇C12位的羟基化,生成PPD;然后,CYP716S1v2和CYP716A53v2催化C6位羟基化,生成PPT(图3)[63-65]. ...
Two ginseng UDP-glycosyltransferases synthesize ginsenoside Rg3 and Rd
4
2014
... 人参皂苷生物合成的糖基化过程十分复杂,同一步骤往往可被数种甚至几十种糖基转移酶催化,而一种糖基转移酶也常常可以接受多个底物或者催化不同位点的糖基化.因此,对于每步糖基化反应,这里仅列举催化效率较高的糖基转移酶.PPD通过两条途径生成人参皂苷Rd(图3).在第一条途径中,PPD可在PgUGT71A53和PgUGT74AE2/PgUGT74AE4的连续催化下,发生C20位和C3位羟基的糖基化,生成人参皂苷F2;之后,在PgUGT94Q2/PgUGT94Q15/Pq-O-UGT2的催化下,C3位糖链被进一步延长,得到人参皂苷Rd[66-68].在第二条途径中,PgUGT74AE2/PgUGT74AE4/Pq-O-UGT1催化PPD的C3位羟基的糖基化,生成人参皂苷Rh2[66,68-70];进一步在PgUGT94Q16/PgUGT94Q18/PnUGT94Q25-V2/PnUGT94Q26-V7/Pq-O-UGT2的催化下,延长C3位糖链,生成人参皂苷Rg3[66-69];最后,PgUGT71A53糖基化人参皂苷Rg3的C20位羟基,生成人参皂苷Rd[71].人参皂苷Rd在PgUGT94Q6/PgUGT94Q25/PnUGT94Q25-V2/PnUGT94Q31-V5的催化下,延长C20位糖链,得到人参皂苷Rb1[71]. ...
... [66,68-70];进一步在PgUGT94Q16/PgUGT94Q18/PnUGT94Q25-V2/PnUGT94Q26-V7/Pq-O-UGT2的催化下,延长C3位糖链,生成人参皂苷Rg3[66-69];最后,PgUGT71A53糖基化人参皂苷Rg3的C20位羟基,生成人参皂苷Rd[71].人参皂苷Rd在PgUGT94Q6/PgUGT94Q25/PnUGT94Q25-V2/PnUGT94Q31-V5的催化下,延长C20位糖链,得到人参皂苷Rb1[71]. ...
... [66-69];最后,PgUGT71A53糖基化人参皂苷Rg3的C20位羟基,生成人参皂苷Rd[71].人参皂苷Rd在PgUGT94Q6/PgUGT94Q25/PnUGT94Q25-V2/PnUGT94Q31-V5的催化下,延长C20位糖链,得到人参皂苷Rb1[71]. ...
... 中药的药效主要源于多成分作用的叠加或协同,极少源于单一成分(例如青蒿素)的活性.目前,中药药效物质的合成生物学研究主要集中在单一药效成分或药效成分群中某一单个成分的生物制备方法的构建.例如:通过联合运用细胞工厂和化学合成实现青蒿素的高效制备[27];分别构建了几种单一人参皂苷成分(包括人参皂苷CK、Rg3、Rh1、Rh2和F1)的细胞工厂[66,68,70-71].成分群的生物合成过程可分为两种情况:①成分群中的组成分子分别由不同的分支路径合成,如前所述的人参皂苷类成分群和淫羊藿苷类成分群;②成分群中的组成分子均由同一路径合成,如檀香挥发油.对于前一种情况,可以分别建立各种成员分子的生物制备方法,然后按照特定的比例进行组合;对于后一种情况,只能通过改造关键生物合成酶(即同时产生多种重要分子的生物合成酶),重塑其产物比例,从而达到精准调控目标成分群配比的目的.近年来,本课题组聚焦上述第二种中药药效成分群的合成生物学方法研究,建立了优质檀香挥发油的细胞工厂[28],实现了水飞蓟药效成分群的“从头”生物制备[120]. ...
Functional regulation of ginsenoside biosynthesis by RNA interferences of a UDP-glycosyltransferase gene in Panax ginseng and Panax quinquefolius
0
2017
The unprecedented diversity of UGT94-family UDP-glycosyltransferases in Panax plants and their contribution to ginsenoside biosynthesis
6
2020
... 人参皂苷生物合成的糖基化过程十分复杂,同一步骤往往可被数种甚至几十种糖基转移酶催化,而一种糖基转移酶也常常可以接受多个底物或者催化不同位点的糖基化.因此,对于每步糖基化反应,这里仅列举催化效率较高的糖基转移酶.PPD通过两条途径生成人参皂苷Rd(图3).在第一条途径中,PPD可在PgUGT71A53和PgUGT74AE2/PgUGT74AE4的连续催化下,发生C20位和C3位羟基的糖基化,生成人参皂苷F2;之后,在PgUGT94Q2/PgUGT94Q15/Pq-O-UGT2的催化下,C3位糖链被进一步延长,得到人参皂苷Rd[66-68].在第二条途径中,PgUGT74AE2/PgUGT74AE4/Pq-O-UGT1催化PPD的C3位羟基的糖基化,生成人参皂苷Rh2[66,68-70];进一步在PgUGT94Q16/PgUGT94Q18/PnUGT94Q25-V2/PnUGT94Q26-V7/Pq-O-UGT2的催化下,延长C3位糖链,生成人参皂苷Rg3[66-69];最后,PgUGT71A53糖基化人参皂苷Rg3的C20位羟基,生成人参皂苷Rd[71].人参皂苷Rd在PgUGT94Q6/PgUGT94Q25/PnUGT94Q25-V2/PnUGT94Q31-V5的催化下,延长C20位糖链,得到人参皂苷Rb1[71]. ...
... ,68-70];进一步在PgUGT94Q16/PgUGT94Q18/PnUGT94Q25-V2/PnUGT94Q26-V7/Pq-O-UGT2的催化下,延长C3位糖链,生成人参皂苷Rg3[66-69];最后,PgUGT71A53糖基化人参皂苷Rg3的C20位羟基,生成人参皂苷Rd[71].人参皂苷Rd在PgUGT94Q6/PgUGT94Q25/PnUGT94Q25-V2/PnUGT94Q31-V5的催化下,延长C20位糖链,得到人参皂苷Rb1[71]. ...
... 从PPT到人参皂苷Rg1的转化也有两条途径(图3).在第一条途径中,PgUGT71A53/PgUGT71A55/Pq-PPT-6,20-O-UGT催化PPT的C20位羟基糖基化,生成人参皂苷F1[71-73];随后,PgUGT71A54/PgUGT71A55/Pq-PPT-6,20-O-UGT糖基化人参皂苷F1的C6位羟基,得到人参皂苷Rg1[72].在第二条途径中,PgUGT71A54/Pq-6-O-UGT催化PPT的C6位羟基糖基化,生成人参皂苷Rh1;进一步在PgUGT71A29的催化下,发生C20位羟基糖基化,生成人参皂苷Rg1[74].此外,人参皂苷Rh1还可在PgUGT94Q3/PgUGT94Q11-V3/PnUGT94Q14-V3的催化下,发生C6位糖基化,生成人参皂苷Rf[68](图3). ...
... 在以上糖链延伸过程中,UGT94家族的糖基转移酶发挥了重要作用[68].这些糖基转移酶的编码基因在人参属植物的基因组中存在成簇分布的现象[68],推测可能来源于串联复制和新功能化(duplication and neofunctionalization). ...
... [68],推测可能来源于串联复制和新功能化(duplication and neofunctionalization). ...
... 中药的药效主要源于多成分作用的叠加或协同,极少源于单一成分(例如青蒿素)的活性.目前,中药药效物质的合成生物学研究主要集中在单一药效成分或药效成分群中某一单个成分的生物制备方法的构建.例如:通过联合运用细胞工厂和化学合成实现青蒿素的高效制备[27];分别构建了几种单一人参皂苷成分(包括人参皂苷CK、Rg3、Rh1、Rh2和F1)的细胞工厂[66,68,70-71].成分群的生物合成过程可分为两种情况:①成分群中的组成分子分别由不同的分支路径合成,如前所述的人参皂苷类成分群和淫羊藿苷类成分群;②成分群中的组成分子均由同一路径合成,如檀香挥发油.对于前一种情况,可以分别建立各种成员分子的生物制备方法,然后按照特定的比例进行组合;对于后一种情况,只能通过改造关键生物合成酶(即同时产生多种重要分子的生物合成酶),重塑其产物比例,从而达到精准调控目标成分群配比的目的.近年来,本课题组聚焦上述第二种中药药效成分群的合成生物学方法研究,建立了优质檀香挥发油的细胞工厂[28],实现了水飞蓟药效成分群的“从头”生物制备[120]. ...
Production of bioactive ginsenosides Rh2 and Rg3 by metabolically engineered yeasts
1
2015
... 人参皂苷生物合成的糖基化过程十分复杂,同一步骤往往可被数种甚至几十种糖基转移酶催化,而一种糖基转移酶也常常可以接受多个底物或者催化不同位点的糖基化.因此,对于每步糖基化反应,这里仅列举催化效率较高的糖基转移酶.PPD通过两条途径生成人参皂苷Rd(图3).在第一条途径中,PPD可在PgUGT71A53和PgUGT74AE2/PgUGT74AE4的连续催化下,发生C20位和C3位羟基的糖基化,生成人参皂苷F2;之后,在PgUGT94Q2/PgUGT94Q15/Pq-O-UGT2的催化下,C3位糖链被进一步延长,得到人参皂苷Rd[66-68].在第二条途径中,PgUGT74AE2/PgUGT74AE4/Pq-O-UGT1催化PPD的C3位羟基的糖基化,生成人参皂苷Rh2[66,68-70];进一步在PgUGT94Q16/PgUGT94Q18/PnUGT94Q25-V2/PnUGT94Q26-V7/Pq-O-UGT2的催化下,延长C3位糖链,生成人参皂苷Rg3[66-69];最后,PgUGT71A53糖基化人参皂苷Rg3的C20位羟基,生成人参皂苷Rd[71].人参皂苷Rd在PgUGT94Q6/PgUGT94Q25/PnUGT94Q25-V2/PnUGT94Q31-V5的催化下,延长C20位糖链,得到人参皂苷Rb1[71]. ...
Functional regulation of a UDP-glucosyltransferase gene (Pq3-O-UGT1) by RNA interference and overexpression in Panax quinquefolius
2
2017
... 人参皂苷生物合成的糖基化过程十分复杂,同一步骤往往可被数种甚至几十种糖基转移酶催化,而一种糖基转移酶也常常可以接受多个底物或者催化不同位点的糖基化.因此,对于每步糖基化反应,这里仅列举催化效率较高的糖基转移酶.PPD通过两条途径生成人参皂苷Rd(图3).在第一条途径中,PPD可在PgUGT71A53和PgUGT74AE2/PgUGT74AE4的连续催化下,发生C20位和C3位羟基的糖基化,生成人参皂苷F2;之后,在PgUGT94Q2/PgUGT94Q15/Pq-O-UGT2的催化下,C3位糖链被进一步延长,得到人参皂苷Rd[66-68].在第二条途径中,PgUGT74AE2/PgUGT74AE4/Pq-O-UGT1催化PPD的C3位羟基的糖基化,生成人参皂苷Rh2[66,68-70];进一步在PgUGT94Q16/PgUGT94Q18/PnUGT94Q25-V2/PnUGT94Q26-V7/Pq-O-UGT2的催化下,延长C3位糖链,生成人参皂苷Rg3[66-69];最后,PgUGT71A53糖基化人参皂苷Rg3的C20位羟基,生成人参皂苷Rd[71].人参皂苷Rd在PgUGT94Q6/PgUGT94Q25/PnUGT94Q25-V2/PnUGT94Q31-V5的催化下,延长C20位糖链,得到人参皂苷Rb1[71]. ...
... 中药的药效主要源于多成分作用的叠加或协同,极少源于单一成分(例如青蒿素)的活性.目前,中药药效物质的合成生物学研究主要集中在单一药效成分或药效成分群中某一单个成分的生物制备方法的构建.例如:通过联合运用细胞工厂和化学合成实现青蒿素的高效制备[27];分别构建了几种单一人参皂苷成分(包括人参皂苷CK、Rg3、Rh1、Rh2和F1)的细胞工厂[66,68,70-71].成分群的生物合成过程可分为两种情况:①成分群中的组成分子分别由不同的分支路径合成,如前所述的人参皂苷类成分群和淫羊藿苷类成分群;②成分群中的组成分子均由同一路径合成,如檀香挥发油.对于前一种情况,可以分别建立各种成员分子的生物制备方法,然后按照特定的比例进行组合;对于后一种情况,只能通过改造关键生物合成酶(即同时产生多种重要分子的生物合成酶),重塑其产物比例,从而达到精准调控目标成分群配比的目的.近年来,本课题组聚焦上述第二种中药药效成分群的合成生物学方法研究,建立了优质檀香挥发油的细胞工厂[28],实现了水飞蓟药效成分群的“从头”生物制备[120]. ...
Production of bioactive ginsenoside compound K in metabolically engineered yeast
4
2014
... 人参皂苷生物合成的糖基化过程十分复杂,同一步骤往往可被数种甚至几十种糖基转移酶催化,而一种糖基转移酶也常常可以接受多个底物或者催化不同位点的糖基化.因此,对于每步糖基化反应,这里仅列举催化效率较高的糖基转移酶.PPD通过两条途径生成人参皂苷Rd(图3).在第一条途径中,PPD可在PgUGT71A53和PgUGT74AE2/PgUGT74AE4的连续催化下,发生C20位和C3位羟基的糖基化,生成人参皂苷F2;之后,在PgUGT94Q2/PgUGT94Q15/Pq-O-UGT2的催化下,C3位糖链被进一步延长,得到人参皂苷Rd[66-68].在第二条途径中,PgUGT74AE2/PgUGT74AE4/Pq-O-UGT1催化PPD的C3位羟基的糖基化,生成人参皂苷Rh2[66,68-70];进一步在PgUGT94Q16/PgUGT94Q18/PnUGT94Q25-V2/PnUGT94Q26-V7/Pq-O-UGT2的催化下,延长C3位糖链,生成人参皂苷Rg3[66-69];最后,PgUGT71A53糖基化人参皂苷Rg3的C20位羟基,生成人参皂苷Rd[71].人参皂苷Rd在PgUGT94Q6/PgUGT94Q25/PnUGT94Q25-V2/PnUGT94Q31-V5的催化下,延长C20位糖链,得到人参皂苷Rb1[71]. ...
... [71]. ...
... 从PPT到人参皂苷Rg1的转化也有两条途径(图3).在第一条途径中,PgUGT71A53/PgUGT71A55/Pq-PPT-6,20-O-UGT催化PPT的C20位羟基糖基化,生成人参皂苷F1[71-73];随后,PgUGT71A54/PgUGT71A55/Pq-PPT-6,20-O-UGT糖基化人参皂苷F1的C6位羟基,得到人参皂苷Rg1[72].在第二条途径中,PgUGT71A54/Pq-6-O-UGT催化PPT的C6位羟基糖基化,生成人参皂苷Rh1;进一步在PgUGT71A29的催化下,发生C20位羟基糖基化,生成人参皂苷Rg1[74].此外,人参皂苷Rh1还可在PgUGT94Q3/PgUGT94Q11-V3/PnUGT94Q14-V3的催化下,发生C6位糖基化,生成人参皂苷Rf[68](图3). ...
... 中药的药效主要源于多成分作用的叠加或协同,极少源于单一成分(例如青蒿素)的活性.目前,中药药效物质的合成生物学研究主要集中在单一药效成分或药效成分群中某一单个成分的生物制备方法的构建.例如:通过联合运用细胞工厂和化学合成实现青蒿素的高效制备[27];分别构建了几种单一人参皂苷成分(包括人参皂苷CK、Rg3、Rh1、Rh2和F1)的细胞工厂[66,68,70-71].成分群的生物合成过程可分为两种情况:①成分群中的组成分子分别由不同的分支路径合成,如前所述的人参皂苷类成分群和淫羊藿苷类成分群;②成分群中的组成分子均由同一路径合成,如檀香挥发油.对于前一种情况,可以分别建立各种成员分子的生物制备方法,然后按照特定的比例进行组合;对于后一种情况,只能通过改造关键生物合成酶(即同时产生多种重要分子的生物合成酶),重塑其产物比例,从而达到精准调控目标成分群配比的目的.近年来,本课题组聚焦上述第二种中药药效成分群的合成生物学方法研究,建立了优质檀香挥发油的细胞工厂[28],实现了水飞蓟药效成分群的“从头”生物制备[120]. ...
Characterization of Panax ginseng UDP-glycosyltransferases catalyzing protopanaxatriol and biosyntheses of bioactive ginsenosides F1 and Rh1 in metabolically engineered yeasts
1
2015
... 从PPT到人参皂苷Rg1的转化也有两条途径(图3).在第一条途径中,PgUGT71A53/PgUGT71A55/Pq-PPT-6,20-O-UGT催化PPT的C20位羟基糖基化,生成人参皂苷F1[71-73];随后,PgUGT71A54/PgUGT71A55/Pq-PPT-6,20-O-UGT糖基化人参皂苷F1的C6位羟基,得到人参皂苷Rg1[72].在第二条途径中,PgUGT71A54/Pq-6-O-UGT催化PPT的C6位羟基糖基化,生成人参皂苷Rh1;进一步在PgUGT71A29的催化下,发生C20位羟基糖基化,生成人参皂苷Rg1[74].此外,人参皂苷Rh1还可在PgUGT94Q3/PgUGT94Q11-V3/PnUGT94Q14-V3的催化下,发生C6位糖基化,生成人参皂苷Rf[68](图3). ...
Identification and RNAi-based gene silencing of a novel UDP-glycosyltransferase from Panax quinquefolius
1
2021
... 从PPT到人参皂苷Rg1的转化也有两条途径(图3).在第一条途径中,PgUGT71A53/PgUGT71A55/Pq-PPT-6,20-O-UGT催化PPT的C20位羟基糖基化,生成人参皂苷F1[71-73];随后,PgUGT71A54/PgUGT71A55/Pq-PPT-6,20-O-UGT糖基化人参皂苷F1的C6位羟基,得到人参皂苷Rg1[72].在第二条途径中,PgUGT71A54/Pq-6-O-UGT催化PPT的C6位羟基糖基化,生成人参皂苷Rh1;进一步在PgUGT71A29的催化下,发生C20位羟基糖基化,生成人参皂苷Rg1[74].此外,人参皂苷Rh1还可在PgUGT94Q3/PgUGT94Q11-V3/PnUGT94Q14-V3的催化下,发生C6位糖基化,生成人参皂苷Rf[68](图3). ...
Characterization of UDP-glycosyltransferase involved in biosynthesis of ginsenosides Rg1 and Rb1 and identification of critical conserved amino acid residues for its function
1
2018
... 从PPT到人参皂苷Rg1的转化也有两条途径(图3).在第一条途径中,PgUGT71A53/PgUGT71A55/Pq-PPT-6,20-O-UGT催化PPT的C20位羟基糖基化,生成人参皂苷F1[71-73];随后,PgUGT71A54/PgUGT71A55/Pq-PPT-6,20-O-UGT糖基化人参皂苷F1的C6位羟基,得到人参皂苷Rg1[72].在第二条途径中,PgUGT71A54/Pq-6-O-UGT催化PPT的C6位羟基糖基化,生成人参皂苷Rh1;进一步在PgUGT71A29的催化下,发生C20位羟基糖基化,生成人参皂苷Rg1[74].此外,人参皂苷Rh1还可在PgUGT94Q3/PgUGT94Q11-V3/PnUGT94Q14-V3的催化下,发生C6位糖基化,生成人参皂苷Rf[68](图3). ...
Review of the botanical characteristics, phytochemistry, and pharmacology of Astragalus membranaceus (Huangqi)
1
2014
... 黄芪为豆科植物蒙古黄芪[Astragalus membranaceus var. mongholicus (Bunge)P.K.Hsiao]或膜荚黄芪[A. membranaceus (Fisch.) Bunge]的干燥根,具有补气升阳、益卫固表以及利水消肿等功效,是补气要药.黄芪的药效成分为环阿屯烷型三萜皂苷,主要包括黄芪皂苷Ⅰ~Ⅶ和异黄芪皂苷(isoastragaloside)Ⅰ、Ⅱ和Ⅳ等[75].叶敏/乔雪课题组[76]对黄芪三萜皂苷的生物合成途径进行了较系统的研究.通过在烟草和酵母中进行异源表达,从膜荚黄芪中鉴定了环氧鲨烯环化酶AmOSC3(环阿屯醇合酶)(图4),并采用过表达及RNA干扰(RNAi)实验进一步证实其参与了黄芪皂苷的生物合成.该酶具有一个关键功能基序VFN,将该基序突变为SIV后,酶活性降低.此外,VFN基序对其他环氧鲨烯环化酶同样重要,如百脉根的羽扇豆醇合酶LjOSC3和拟南芥的阿拉伯二醇合酶AtPEN1[77].从膜荚黄芪中已表征4个催化环黄芪醇(cycloastragenol)糖基化修饰的糖基转移酶.AmGT8顺序催化环黄芪醇C3和C2位羟基的糖基化,生成双糖产物.通过同源建模和底物对接,发现其活性口袋由4个区域构成:区域A(T19/V87/M126)、区域B(A394)、区域C(S156/P192)和区域D(S100/S129/T131/G203).通过半理性设计改造,获得了可分别催化C3、C6和C2′位羟基糖基化的突变酶P192E、A394F和T131V;并且利用T131V和A394F突变酶,实现了黄芪皂苷Ⅲ和黄芪皂苷Ⅳ的合成(图4)[78].AmGT1和AmGT5均为3-O-糖基转移酶(图4).AmGT1对UDP-Xyl有较好选择性,并且能同时利用UDP-Glc等10种糖基供体,是已知供体选择性最广泛的三萜糖基转移酶.AmGT5对UDP-Glc选择性更高.通过分析已知糖基转移酶的序列,发现以UDP-Glc作为糖供体的糖基转移酶中146位氨基酸为T/P/G,而以其他糖供体为底物的糖基转移酶在相应位置上的氨基酸是A/I/S.同源建模和分子对接分析显示AmGT1的G146可能会影响其对UDP-Xyl和UDP-Glc的选择性.通过定点突变,获得两个专一性的木糖糖基转移酶AmGT1G146V和AmGT1G146I,以及三个能接受UDP-Xyl和UDP-Glc的糖基转移酶AmGT1G146S、AmGT1G146P和AmGT1G146A.其中,AmGT1和AmGT1G146V/I以环黄芪醇为底物,而AmGT1G146S/P/A以环黄芪醇-6-O-β-D-葡萄糖苷(cycloastragenol-6-O-β-D-glucoside)为底物(图4)[79].AmGT9能催化环黄芪醇C25位羟基的糖基化(图4),是首个能糖基化环阿屯烷型三萜侧链羟基的糖基转移酶[79].组合运用AmGT1/9、AmGT1G146V/I、AmGT1G146S/P/A、AmGT8和AmGT8A394F,可合成13种环阿屯烷型黄芪皂苷[79].此外,戴均贵课题组[80]从蒙古黄芪中鉴定了环阿屯醇合酶AmCAS1以及4个糖基转移酶AmUGT15、AmUGT14、AmUGT13和AmUGT7(图4).这4个糖基转移酶可分别催化环黄芪醇苷元的3-O-木糖基化、3-O-葡萄糖基化、25-O-葡萄糖基化/木糖基化和2′-O-葡萄糖基化.组合运用这4种糖基转移酶,可将环黄芪醇转化为黄芪皂苷Ⅲ~Ⅴ和Ⅶ以及异黄芪皂苷Ⅳ(图4).除糖基化外,乙酰化也是皂苷的常见后修饰形式.叶敏/乔雪课题组[81]从膜荚黄芪中鉴定了首个四环三萜皂苷酰基转移酶AmAT7-3,可催化黄芪皂苷Ⅳ木糖的3′和4′位发生乙酰化,生成异黄芪皂苷Ⅱ、环黄芪苷Ⅱ(cyclocephaloside Ⅱ)和3-O-3′,4′-二乙酰基-β-D-吡喃木糖基-6-O-β-D-吡喃葡萄糖基-环黄芪醇(3-O-3′,4′-diacetyl-β-D-xylopyranosyl-6-O-β-D-glucopyranosyl-cycloastragenol)(图5).异黄芪皂苷Ⅱ和环黄芪苷Ⅱ会自发转化为黄芪皂苷Ⅱ(astragaloside Ⅱ)(图5).由于AmAT7-3活性口袋内部的特异性基序AADAG体积小,因此口袋空间较大,糖苷键可自由旋转形成两种构象,分别对应两个位点的乙酰化反应.基于该机制,通过理性设计获得两个突变酶A310G和A310W,分别能特异性催化黄芪皂苷Ⅳ的C3′-O和C4′-O乙酰化(图5).目前,尚未解析从环阿屯醇到环黄芪醇的转化过程,将是未来黄芪皂苷生物合成研究的重点. ...
叶敏/乔雪团队在黄芪皂苷生物合成研究中取得系列进展
1
2022
... 黄芪为豆科植物蒙古黄芪[Astragalus membranaceus var. mongholicus (Bunge)P.K.Hsiao]或膜荚黄芪[A. membranaceus (Fisch.) Bunge]的干燥根,具有补气升阳、益卫固表以及利水消肿等功效,是补气要药.黄芪的药效成分为环阿屯烷型三萜皂苷,主要包括黄芪皂苷Ⅰ~Ⅶ和异黄芪皂苷(isoastragaloside)Ⅰ、Ⅱ和Ⅳ等[75].叶敏/乔雪课题组[76]对黄芪三萜皂苷的生物合成途径进行了较系统的研究.通过在烟草和酵母中进行异源表达,从膜荚黄芪中鉴定了环氧鲨烯环化酶AmOSC3(环阿屯醇合酶)(图4),并采用过表达及RNA干扰(RNAi)实验进一步证实其参与了黄芪皂苷的生物合成.该酶具有一个关键功能基序VFN,将该基序突变为SIV后,酶活性降低.此外,VFN基序对其他环氧鲨烯环化酶同样重要,如百脉根的羽扇豆醇合酶LjOSC3和拟南芥的阿拉伯二醇合酶AtPEN1[77].从膜荚黄芪中已表征4个催化环黄芪醇(cycloastragenol)糖基化修饰的糖基转移酶.AmGT8顺序催化环黄芪醇C3和C2位羟基的糖基化,生成双糖产物.通过同源建模和底物对接,发现其活性口袋由4个区域构成:区域A(T19/V87/M126)、区域B(A394)、区域C(S156/P192)和区域D(S100/S129/T131/G203).通过半理性设计改造,获得了可分别催化C3、C6和C2′位羟基糖基化的突变酶P192E、A394F和T131V;并且利用T131V和A394F突变酶,实现了黄芪皂苷Ⅲ和黄芪皂苷Ⅳ的合成(图4)[78].AmGT1和AmGT5均为3-O-糖基转移酶(图4).AmGT1对UDP-Xyl有较好选择性,并且能同时利用UDP-Glc等10种糖基供体,是已知供体选择性最广泛的三萜糖基转移酶.AmGT5对UDP-Glc选择性更高.通过分析已知糖基转移酶的序列,发现以UDP-Glc作为糖供体的糖基转移酶中146位氨基酸为T/P/G,而以其他糖供体为底物的糖基转移酶在相应位置上的氨基酸是A/I/S.同源建模和分子对接分析显示AmGT1的G146可能会影响其对UDP-Xyl和UDP-Glc的选择性.通过定点突变,获得两个专一性的木糖糖基转移酶AmGT1G146V和AmGT1G146I,以及三个能接受UDP-Xyl和UDP-Glc的糖基转移酶AmGT1G146S、AmGT1G146P和AmGT1G146A.其中,AmGT1和AmGT1G146V/I以环黄芪醇为底物,而AmGT1G146S/P/A以环黄芪醇-6-O-β-D-葡萄糖苷(cycloastragenol-6-O-β-D-glucoside)为底物(图4)[79].AmGT9能催化环黄芪醇C25位羟基的糖基化(图4),是首个能糖基化环阿屯烷型三萜侧链羟基的糖基转移酶[79].组合运用AmGT1/9、AmGT1G146V/I、AmGT1G146S/P/A、AmGT8和AmGT8A394F,可合成13种环阿屯烷型黄芪皂苷[79].此外,戴均贵课题组[80]从蒙古黄芪中鉴定了环阿屯醇合酶AmCAS1以及4个糖基转移酶AmUGT15、AmUGT14、AmUGT13和AmUGT7(图4).这4个糖基转移酶可分别催化环黄芪醇苷元的3-O-木糖基化、3-O-葡萄糖基化、25-O-葡萄糖基化/木糖基化和2′-O-葡萄糖基化.组合运用这4种糖基转移酶,可将环黄芪醇转化为黄芪皂苷Ⅲ~Ⅴ和Ⅶ以及异黄芪皂苷Ⅳ(图4).除糖基化外,乙酰化也是皂苷的常见后修饰形式.叶敏/乔雪课题组[81]从膜荚黄芪中鉴定了首个四环三萜皂苷酰基转移酶AmAT7-3,可催化黄芪皂苷Ⅳ木糖的3′和4′位发生乙酰化,生成异黄芪皂苷Ⅱ、环黄芪苷Ⅱ(cyclocephaloside Ⅱ)和3-O-3′,4′-二乙酰基-β-D-吡喃木糖基-6-O-β-D-吡喃葡萄糖基-环黄芪醇(3-O-3′,4′-diacetyl-β-D-xylopyranosyl-6-O-β-D-glucopyranosyl-cycloastragenol)(图5).异黄芪皂苷Ⅱ和环黄芪苷Ⅱ会自发转化为黄芪皂苷Ⅱ(astragaloside Ⅱ)(图5).由于AmAT7-3活性口袋内部的特异性基序AADAG体积小,因此口袋空间较大,糖苷键可自由旋转形成两种构象,分别对应两个位点的乙酰化反应.基于该机制,通过理性设计获得两个突变酶A310G和A310W,分别能特异性催化黄芪皂苷Ⅳ的C3′-O和C4′-O乙酰化(图5).目前,尚未解析从环阿屯醇到环黄芪醇的转化过程,将是未来黄芪皂苷生物合成研究的重点. ...
The research group of Prof. Min Ye and Prof. Xue Qiao made a series of progress in the biosynthesis of Astragalus saponins
1
2022
... 黄芪为豆科植物蒙古黄芪[Astragalus membranaceus var. mongholicus (Bunge)P.K.Hsiao]或膜荚黄芪[A. membranaceus (Fisch.) Bunge]的干燥根,具有补气升阳、益卫固表以及利水消肿等功效,是补气要药.黄芪的药效成分为环阿屯烷型三萜皂苷,主要包括黄芪皂苷Ⅰ~Ⅶ和异黄芪皂苷(isoastragaloside)Ⅰ、Ⅱ和Ⅳ等[75].叶敏/乔雪课题组[76]对黄芪三萜皂苷的生物合成途径进行了较系统的研究.通过在烟草和酵母中进行异源表达,从膜荚黄芪中鉴定了环氧鲨烯环化酶AmOSC3(环阿屯醇合酶)(图4),并采用过表达及RNA干扰(RNAi)实验进一步证实其参与了黄芪皂苷的生物合成.该酶具有一个关键功能基序VFN,将该基序突变为SIV后,酶活性降低.此外,VFN基序对其他环氧鲨烯环化酶同样重要,如百脉根的羽扇豆醇合酶LjOSC3和拟南芥的阿拉伯二醇合酶AtPEN1[77].从膜荚黄芪中已表征4个催化环黄芪醇(cycloastragenol)糖基化修饰的糖基转移酶.AmGT8顺序催化环黄芪醇C3和C2位羟基的糖基化,生成双糖产物.通过同源建模和底物对接,发现其活性口袋由4个区域构成:区域A(T19/V87/M126)、区域B(A394)、区域C(S156/P192)和区域D(S100/S129/T131/G203).通过半理性设计改造,获得了可分别催化C3、C6和C2′位羟基糖基化的突变酶P192E、A394F和T131V;并且利用T131V和A394F突变酶,实现了黄芪皂苷Ⅲ和黄芪皂苷Ⅳ的合成(图4)[78].AmGT1和AmGT5均为3-O-糖基转移酶(图4).AmGT1对UDP-Xyl有较好选择性,并且能同时利用UDP-Glc等10种糖基供体,是已知供体选择性最广泛的三萜糖基转移酶.AmGT5对UDP-Glc选择性更高.通过分析已知糖基转移酶的序列,发现以UDP-Glc作为糖供体的糖基转移酶中146位氨基酸为T/P/G,而以其他糖供体为底物的糖基转移酶在相应位置上的氨基酸是A/I/S.同源建模和分子对接分析显示AmGT1的G146可能会影响其对UDP-Xyl和UDP-Glc的选择性.通过定点突变,获得两个专一性的木糖糖基转移酶AmGT1G146V和AmGT1G146I,以及三个能接受UDP-Xyl和UDP-Glc的糖基转移酶AmGT1G146S、AmGT1G146P和AmGT1G146A.其中,AmGT1和AmGT1G146V/I以环黄芪醇为底物,而AmGT1G146S/P/A以环黄芪醇-6-O-β-D-葡萄糖苷(cycloastragenol-6-O-β-D-glucoside)为底物(图4)[79].AmGT9能催化环黄芪醇C25位羟基的糖基化(图4),是首个能糖基化环阿屯烷型三萜侧链羟基的糖基转移酶[79].组合运用AmGT1/9、AmGT1G146V/I、AmGT1G146S/P/A、AmGT8和AmGT8A394F,可合成13种环阿屯烷型黄芪皂苷[79].此外,戴均贵课题组[80]从蒙古黄芪中鉴定了环阿屯醇合酶AmCAS1以及4个糖基转移酶AmUGT15、AmUGT14、AmUGT13和AmUGT7(图4).这4个糖基转移酶可分别催化环黄芪醇苷元的3-O-木糖基化、3-O-葡萄糖基化、25-O-葡萄糖基化/木糖基化和2′-O-葡萄糖基化.组合运用这4种糖基转移酶,可将环黄芪醇转化为黄芪皂苷Ⅲ~Ⅴ和Ⅶ以及异黄芪皂苷Ⅳ(图4).除糖基化外,乙酰化也是皂苷的常见后修饰形式.叶敏/乔雪课题组[81]从膜荚黄芪中鉴定了首个四环三萜皂苷酰基转移酶AmAT7-3,可催化黄芪皂苷Ⅳ木糖的3′和4′位发生乙酰化,生成异黄芪皂苷Ⅱ、环黄芪苷Ⅱ(cyclocephaloside Ⅱ)和3-O-3′,4′-二乙酰基-β-D-吡喃木糖基-6-O-β-D-吡喃葡萄糖基-环黄芪醇(3-O-3′,4′-diacetyl-β-D-xylopyranosyl-6-O-β-D-glucopyranosyl-cycloastragenol)(图5).异黄芪皂苷Ⅱ和环黄芪苷Ⅱ会自发转化为黄芪皂苷Ⅱ(astragaloside Ⅱ)(图5).由于AmAT7-3活性口袋内部的特异性基序AADAG体积小,因此口袋空间较大,糖苷键可自由旋转形成两种构象,分别对应两个位点的乙酰化反应.基于该机制,通过理性设计获得两个突变酶A310G和A310W,分别能特异性催化黄芪皂苷Ⅳ的C3′-O和C4′-O乙酰化(图5).目前,尚未解析从环阿屯醇到环黄芪醇的转化过程,将是未来黄芪皂苷生物合成研究的重点. ...
Identification of oxidosqualene cyclases associated with saponin biosynthesis from Astragalus membranaceus reveals a conserved motif important for catalytic function
1
2023
... 黄芪为豆科植物蒙古黄芪[Astragalus membranaceus var. mongholicus (Bunge)P.K.Hsiao]或膜荚黄芪[A. membranaceus (Fisch.) Bunge]的干燥根,具有补气升阳、益卫固表以及利水消肿等功效,是补气要药.黄芪的药效成分为环阿屯烷型三萜皂苷,主要包括黄芪皂苷Ⅰ~Ⅶ和异黄芪皂苷(isoastragaloside)Ⅰ、Ⅱ和Ⅳ等[75].叶敏/乔雪课题组[76]对黄芪三萜皂苷的生物合成途径进行了较系统的研究.通过在烟草和酵母中进行异源表达,从膜荚黄芪中鉴定了环氧鲨烯环化酶AmOSC3(环阿屯醇合酶)(图4),并采用过表达及RNA干扰(RNAi)实验进一步证实其参与了黄芪皂苷的生物合成.该酶具有一个关键功能基序VFN,将该基序突变为SIV后,酶活性降低.此外,VFN基序对其他环氧鲨烯环化酶同样重要,如百脉根的羽扇豆醇合酶LjOSC3和拟南芥的阿拉伯二醇合酶AtPEN1[77].从膜荚黄芪中已表征4个催化环黄芪醇(cycloastragenol)糖基化修饰的糖基转移酶.AmGT8顺序催化环黄芪醇C3和C2位羟基的糖基化,生成双糖产物.通过同源建模和底物对接,发现其活性口袋由4个区域构成:区域A(T19/V87/M126)、区域B(A394)、区域C(S156/P192)和区域D(S100/S129/T131/G203).通过半理性设计改造,获得了可分别催化C3、C6和C2′位羟基糖基化的突变酶P192E、A394F和T131V;并且利用T131V和A394F突变酶,实现了黄芪皂苷Ⅲ和黄芪皂苷Ⅳ的合成(图4)[78].AmGT1和AmGT5均为3-O-糖基转移酶(图4).AmGT1对UDP-Xyl有较好选择性,并且能同时利用UDP-Glc等10种糖基供体,是已知供体选择性最广泛的三萜糖基转移酶.AmGT5对UDP-Glc选择性更高.通过分析已知糖基转移酶的序列,发现以UDP-Glc作为糖供体的糖基转移酶中146位氨基酸为T/P/G,而以其他糖供体为底物的糖基转移酶在相应位置上的氨基酸是A/I/S.同源建模和分子对接分析显示AmGT1的G146可能会影响其对UDP-Xyl和UDP-Glc的选择性.通过定点突变,获得两个专一性的木糖糖基转移酶AmGT1G146V和AmGT1G146I,以及三个能接受UDP-Xyl和UDP-Glc的糖基转移酶AmGT1G146S、AmGT1G146P和AmGT1G146A.其中,AmGT1和AmGT1G146V/I以环黄芪醇为底物,而AmGT1G146S/P/A以环黄芪醇-6-O-β-D-葡萄糖苷(cycloastragenol-6-O-β-D-glucoside)为底物(图4)[79].AmGT9能催化环黄芪醇C25位羟基的糖基化(图4),是首个能糖基化环阿屯烷型三萜侧链羟基的糖基转移酶[79].组合运用AmGT1/9、AmGT1G146V/I、AmGT1G146S/P/A、AmGT8和AmGT8A394F,可合成13种环阿屯烷型黄芪皂苷[79].此外,戴均贵课题组[80]从蒙古黄芪中鉴定了环阿屯醇合酶AmCAS1以及4个糖基转移酶AmUGT15、AmUGT14、AmUGT13和AmUGT7(图4).这4个糖基转移酶可分别催化环黄芪醇苷元的3-O-木糖基化、3-O-葡萄糖基化、25-O-葡萄糖基化/木糖基化和2′-O-葡萄糖基化.组合运用这4种糖基转移酶,可将环黄芪醇转化为黄芪皂苷Ⅲ~Ⅴ和Ⅶ以及异黄芪皂苷Ⅳ(图4).除糖基化外,乙酰化也是皂苷的常见后修饰形式.叶敏/乔雪课题组[81]从膜荚黄芪中鉴定了首个四环三萜皂苷酰基转移酶AmAT7-3,可催化黄芪皂苷Ⅳ木糖的3′和4′位发生乙酰化,生成异黄芪皂苷Ⅱ、环黄芪苷Ⅱ(cyclocephaloside Ⅱ)和3-O-3′,4′-二乙酰基-β-D-吡喃木糖基-6-O-β-D-吡喃葡萄糖基-环黄芪醇(3-O-3′,4′-diacetyl-β-D-xylopyranosyl-6-O-β-D-glucopyranosyl-cycloastragenol)(图5).异黄芪皂苷Ⅱ和环黄芪苷Ⅱ会自发转化为黄芪皂苷Ⅱ(astragaloside Ⅱ)(图5).由于AmAT7-3活性口袋内部的特异性基序AADAG体积小,因此口袋空间较大,糖苷键可自由旋转形成两种构象,分别对应两个位点的乙酰化反应.基于该机制,通过理性设计获得两个突变酶A310G和A310W,分别能特异性催化黄芪皂苷Ⅳ的C3′-O和C4′-O乙酰化(图5).目前,尚未解析从环阿屯醇到环黄芪醇的转化过程,将是未来黄芪皂苷生物合成研究的重点. ...
Functional characterization and protein engineering of a triterpene 3-/6-/2'-O-glycosyltransferase reveal a conserved residue critical for the regiospecificity
1
2022
... 黄芪为豆科植物蒙古黄芪[Astragalus membranaceus var. mongholicus (Bunge)P.K.Hsiao]或膜荚黄芪[A. membranaceus (Fisch.) Bunge]的干燥根,具有补气升阳、益卫固表以及利水消肿等功效,是补气要药.黄芪的药效成分为环阿屯烷型三萜皂苷,主要包括黄芪皂苷Ⅰ~Ⅶ和异黄芪皂苷(isoastragaloside)Ⅰ、Ⅱ和Ⅳ等[75].叶敏/乔雪课题组[76]对黄芪三萜皂苷的生物合成途径进行了较系统的研究.通过在烟草和酵母中进行异源表达,从膜荚黄芪中鉴定了环氧鲨烯环化酶AmOSC3(环阿屯醇合酶)(图4),并采用过表达及RNA干扰(RNAi)实验进一步证实其参与了黄芪皂苷的生物合成.该酶具有一个关键功能基序VFN,将该基序突变为SIV后,酶活性降低.此外,VFN基序对其他环氧鲨烯环化酶同样重要,如百脉根的羽扇豆醇合酶LjOSC3和拟南芥的阿拉伯二醇合酶AtPEN1[77].从膜荚黄芪中已表征4个催化环黄芪醇(cycloastragenol)糖基化修饰的糖基转移酶.AmGT8顺序催化环黄芪醇C3和C2位羟基的糖基化,生成双糖产物.通过同源建模和底物对接,发现其活性口袋由4个区域构成:区域A(T19/V87/M126)、区域B(A394)、区域C(S156/P192)和区域D(S100/S129/T131/G203).通过半理性设计改造,获得了可分别催化C3、C6和C2′位羟基糖基化的突变酶P192E、A394F和T131V;并且利用T131V和A394F突变酶,实现了黄芪皂苷Ⅲ和黄芪皂苷Ⅳ的合成(图4)[78].AmGT1和AmGT5均为3-O-糖基转移酶(图4).AmGT1对UDP-Xyl有较好选择性,并且能同时利用UDP-Glc等10种糖基供体,是已知供体选择性最广泛的三萜糖基转移酶.AmGT5对UDP-Glc选择性更高.通过分析已知糖基转移酶的序列,发现以UDP-Glc作为糖供体的糖基转移酶中146位氨基酸为T/P/G,而以其他糖供体为底物的糖基转移酶在相应位置上的氨基酸是A/I/S.同源建模和分子对接分析显示AmGT1的G146可能会影响其对UDP-Xyl和UDP-Glc的选择性.通过定点突变,获得两个专一性的木糖糖基转移酶AmGT1G146V和AmGT1G146I,以及三个能接受UDP-Xyl和UDP-Glc的糖基转移酶AmGT1G146S、AmGT1G146P和AmGT1G146A.其中,AmGT1和AmGT1G146V/I以环黄芪醇为底物,而AmGT1G146S/P/A以环黄芪醇-6-O-β-D-葡萄糖苷(cycloastragenol-6-O-β-D-glucoside)为底物(图4)[79].AmGT9能催化环黄芪醇C25位羟基的糖基化(图4),是首个能糖基化环阿屯烷型三萜侧链羟基的糖基转移酶[79].组合运用AmGT1/9、AmGT1G146V/I、AmGT1G146S/P/A、AmGT8和AmGT8A394F,可合成13种环阿屯烷型黄芪皂苷[79].此外,戴均贵课题组[80]从蒙古黄芪中鉴定了环阿屯醇合酶AmCAS1以及4个糖基转移酶AmUGT15、AmUGT14、AmUGT13和AmUGT7(图4).这4个糖基转移酶可分别催化环黄芪醇苷元的3-O-木糖基化、3-O-葡萄糖基化、25-O-葡萄糖基化/木糖基化和2′-O-葡萄糖基化.组合运用这4种糖基转移酶,可将环黄芪醇转化为黄芪皂苷Ⅲ~Ⅴ和Ⅶ以及异黄芪皂苷Ⅳ(图4).除糖基化外,乙酰化也是皂苷的常见后修饰形式.叶敏/乔雪课题组[81]从膜荚黄芪中鉴定了首个四环三萜皂苷酰基转移酶AmAT7-3,可催化黄芪皂苷Ⅳ木糖的3′和4′位发生乙酰化,生成异黄芪皂苷Ⅱ、环黄芪苷Ⅱ(cyclocephaloside Ⅱ)和3-O-3′,4′-二乙酰基-β-D-吡喃木糖基-6-O-β-D-吡喃葡萄糖基-环黄芪醇(3-O-3′,4′-diacetyl-β-D-xylopyranosyl-6-O-β-D-glucopyranosyl-cycloastragenol)(图5).异黄芪皂苷Ⅱ和环黄芪苷Ⅱ会自发转化为黄芪皂苷Ⅱ(astragaloside Ⅱ)(图5).由于AmAT7-3活性口袋内部的特异性基序AADAG体积小,因此口袋空间较大,糖苷键可自由旋转形成两种构象,分别对应两个位点的乙酰化反应.基于该机制,通过理性设计获得两个突变酶A310G和A310W,分别能特异性催化黄芪皂苷Ⅳ的C3′-O和C4′-O乙酰化(图5).目前,尚未解析从环阿屯醇到环黄芪醇的转化过程,将是未来黄芪皂苷生物合成研究的重点. ...
Characterization and protein engineering of glycosyltransferases for the biosynthesis of diverse hepatoprotective cycloartane-type saponins in Astragalus membranaceus
3
2023
... 黄芪为豆科植物蒙古黄芪[Astragalus membranaceus var. mongholicus (Bunge)P.K.Hsiao]或膜荚黄芪[A. membranaceus (Fisch.) Bunge]的干燥根,具有补气升阳、益卫固表以及利水消肿等功效,是补气要药.黄芪的药效成分为环阿屯烷型三萜皂苷,主要包括黄芪皂苷Ⅰ~Ⅶ和异黄芪皂苷(isoastragaloside)Ⅰ、Ⅱ和Ⅳ等[75].叶敏/乔雪课题组[76]对黄芪三萜皂苷的生物合成途径进行了较系统的研究.通过在烟草和酵母中进行异源表达,从膜荚黄芪中鉴定了环氧鲨烯环化酶AmOSC3(环阿屯醇合酶)(图4),并采用过表达及RNA干扰(RNAi)实验进一步证实其参与了黄芪皂苷的生物合成.该酶具有一个关键功能基序VFN,将该基序突变为SIV后,酶活性降低.此外,VFN基序对其他环氧鲨烯环化酶同样重要,如百脉根的羽扇豆醇合酶LjOSC3和拟南芥的阿拉伯二醇合酶AtPEN1[77].从膜荚黄芪中已表征4个催化环黄芪醇(cycloastragenol)糖基化修饰的糖基转移酶.AmGT8顺序催化环黄芪醇C3和C2位羟基的糖基化,生成双糖产物.通过同源建模和底物对接,发现其活性口袋由4个区域构成:区域A(T19/V87/M126)、区域B(A394)、区域C(S156/P192)和区域D(S100/S129/T131/G203).通过半理性设计改造,获得了可分别催化C3、C6和C2′位羟基糖基化的突变酶P192E、A394F和T131V;并且利用T131V和A394F突变酶,实现了黄芪皂苷Ⅲ和黄芪皂苷Ⅳ的合成(图4)[78].AmGT1和AmGT5均为3-O-糖基转移酶(图4).AmGT1对UDP-Xyl有较好选择性,并且能同时利用UDP-Glc等10种糖基供体,是已知供体选择性最广泛的三萜糖基转移酶.AmGT5对UDP-Glc选择性更高.通过分析已知糖基转移酶的序列,发现以UDP-Glc作为糖供体的糖基转移酶中146位氨基酸为T/P/G,而以其他糖供体为底物的糖基转移酶在相应位置上的氨基酸是A/I/S.同源建模和分子对接分析显示AmGT1的G146可能会影响其对UDP-Xyl和UDP-Glc的选择性.通过定点突变,获得两个专一性的木糖糖基转移酶AmGT1G146V和AmGT1G146I,以及三个能接受UDP-Xyl和UDP-Glc的糖基转移酶AmGT1G146S、AmGT1G146P和AmGT1G146A.其中,AmGT1和AmGT1G146V/I以环黄芪醇为底物,而AmGT1G146S/P/A以环黄芪醇-6-O-β-D-葡萄糖苷(cycloastragenol-6-O-β-D-glucoside)为底物(图4)[79].AmGT9能催化环黄芪醇C25位羟基的糖基化(图4),是首个能糖基化环阿屯烷型三萜侧链羟基的糖基转移酶[79].组合运用AmGT1/9、AmGT1G146V/I、AmGT1G146S/P/A、AmGT8和AmGT8A394F,可合成13种环阿屯烷型黄芪皂苷[79].此外,戴均贵课题组[80]从蒙古黄芪中鉴定了环阿屯醇合酶AmCAS1以及4个糖基转移酶AmUGT15、AmUGT14、AmUGT13和AmUGT7(图4).这4个糖基转移酶可分别催化环黄芪醇苷元的3-O-木糖基化、3-O-葡萄糖基化、25-O-葡萄糖基化/木糖基化和2′-O-葡萄糖基化.组合运用这4种糖基转移酶,可将环黄芪醇转化为黄芪皂苷Ⅲ~Ⅴ和Ⅶ以及异黄芪皂苷Ⅳ(图4).除糖基化外,乙酰化也是皂苷的常见后修饰形式.叶敏/乔雪课题组[81]从膜荚黄芪中鉴定了首个四环三萜皂苷酰基转移酶AmAT7-3,可催化黄芪皂苷Ⅳ木糖的3′和4′位发生乙酰化,生成异黄芪皂苷Ⅱ、环黄芪苷Ⅱ(cyclocephaloside Ⅱ)和3-O-3′,4′-二乙酰基-β-D-吡喃木糖基-6-O-β-D-吡喃葡萄糖基-环黄芪醇(3-O-3′,4′-diacetyl-β-D-xylopyranosyl-6-O-β-D-glucopyranosyl-cycloastragenol)(图5).异黄芪皂苷Ⅱ和环黄芪苷Ⅱ会自发转化为黄芪皂苷Ⅱ(astragaloside Ⅱ)(图5).由于AmAT7-3活性口袋内部的特异性基序AADAG体积小,因此口袋空间较大,糖苷键可自由旋转形成两种构象,分别对应两个位点的乙酰化反应.基于该机制,通过理性设计获得两个突变酶A310G和A310W,分别能特异性催化黄芪皂苷Ⅳ的C3′-O和C4′-O乙酰化(图5).目前,尚未解析从环阿屯醇到环黄芪醇的转化过程,将是未来黄芪皂苷生物合成研究的重点. ...
... [79].组合运用AmGT1/9、AmGT1G146V/I、AmGT1G146S/P/A、AmGT8和AmGT8A394F,可合成13种环阿屯烷型黄芪皂苷[79].此外,戴均贵课题组[80]从蒙古黄芪中鉴定了环阿屯醇合酶AmCAS1以及4个糖基转移酶AmUGT15、AmUGT14、AmUGT13和AmUGT7(图4).这4个糖基转移酶可分别催化环黄芪醇苷元的3-O-木糖基化、3-O-葡萄糖基化、25-O-葡萄糖基化/木糖基化和2′-O-葡萄糖基化.组合运用这4种糖基转移酶,可将环黄芪醇转化为黄芪皂苷Ⅲ~Ⅴ和Ⅶ以及异黄芪皂苷Ⅳ(图4).除糖基化外,乙酰化也是皂苷的常见后修饰形式.叶敏/乔雪课题组[81]从膜荚黄芪中鉴定了首个四环三萜皂苷酰基转移酶AmAT7-3,可催化黄芪皂苷Ⅳ木糖的3′和4′位发生乙酰化,生成异黄芪皂苷Ⅱ、环黄芪苷Ⅱ(cyclocephaloside Ⅱ)和3-O-3′,4′-二乙酰基-β-D-吡喃木糖基-6-O-β-D-吡喃葡萄糖基-环黄芪醇(3-O-3′,4′-diacetyl-β-D-xylopyranosyl-6-O-β-D-glucopyranosyl-cycloastragenol)(图5).异黄芪皂苷Ⅱ和环黄芪苷Ⅱ会自发转化为黄芪皂苷Ⅱ(astragaloside Ⅱ)(图5).由于AmAT7-3活性口袋内部的特异性基序AADAG体积小,因此口袋空间较大,糖苷键可自由旋转形成两种构象,分别对应两个位点的乙酰化反应.基于该机制,通过理性设计获得两个突变酶A310G和A310W,分别能特异性催化黄芪皂苷Ⅳ的C3′-O和C4′-O乙酰化(图5).目前,尚未解析从环阿屯醇到环黄芪醇的转化过程,将是未来黄芪皂苷生物合成研究的重点. ...
... [79].此外,戴均贵课题组[80]从蒙古黄芪中鉴定了环阿屯醇合酶AmCAS1以及4个糖基转移酶AmUGT15、AmUGT14、AmUGT13和AmUGT7(图4).这4个糖基转移酶可分别催化环黄芪醇苷元的3-O-木糖基化、3-O-葡萄糖基化、25-O-葡萄糖基化/木糖基化和2′-O-葡萄糖基化.组合运用这4种糖基转移酶,可将环黄芪醇转化为黄芪皂苷Ⅲ~Ⅴ和Ⅶ以及异黄芪皂苷Ⅳ(图4).除糖基化外,乙酰化也是皂苷的常见后修饰形式.叶敏/乔雪课题组[81]从膜荚黄芪中鉴定了首个四环三萜皂苷酰基转移酶AmAT7-3,可催化黄芪皂苷Ⅳ木糖的3′和4′位发生乙酰化,生成异黄芪皂苷Ⅱ、环黄芪苷Ⅱ(cyclocephaloside Ⅱ)和3-O-3′,4′-二乙酰基-β-D-吡喃木糖基-6-O-β-D-吡喃葡萄糖基-环黄芪醇(3-O-3′,4′-diacetyl-β-D-xylopyranosyl-6-O-β-D-glucopyranosyl-cycloastragenol)(图5).异黄芪皂苷Ⅱ和环黄芪苷Ⅱ会自发转化为黄芪皂苷Ⅱ(astragaloside Ⅱ)(图5).由于AmAT7-3活性口袋内部的特异性基序AADAG体积小,因此口袋空间较大,糖苷键可自由旋转形成两种构象,分别对应两个位点的乙酰化反应.基于该机制,通过理性设计获得两个突变酶A310G和A310W,分别能特异性催化黄芪皂苷Ⅳ的C3′-O和C4′-O乙酰化(图5).目前,尚未解析从环阿屯醇到环黄芪醇的转化过程,将是未来黄芪皂苷生物合成研究的重点. ...
Functional characterization of a cycloartenol synthase and four glycosyltransferases in the biosynthesis of cycloastragenol-type astragalosides from Astragalus membranaceus
1
2023
... 黄芪为豆科植物蒙古黄芪[Astragalus membranaceus var. mongholicus (Bunge)P.K.Hsiao]或膜荚黄芪[A. membranaceus (Fisch.) Bunge]的干燥根,具有补气升阳、益卫固表以及利水消肿等功效,是补气要药.黄芪的药效成分为环阿屯烷型三萜皂苷,主要包括黄芪皂苷Ⅰ~Ⅶ和异黄芪皂苷(isoastragaloside)Ⅰ、Ⅱ和Ⅳ等[75].叶敏/乔雪课题组[76]对黄芪三萜皂苷的生物合成途径进行了较系统的研究.通过在烟草和酵母中进行异源表达,从膜荚黄芪中鉴定了环氧鲨烯环化酶AmOSC3(环阿屯醇合酶)(图4),并采用过表达及RNA干扰(RNAi)实验进一步证实其参与了黄芪皂苷的生物合成.该酶具有一个关键功能基序VFN,将该基序突变为SIV后,酶活性降低.此外,VFN基序对其他环氧鲨烯环化酶同样重要,如百脉根的羽扇豆醇合酶LjOSC3和拟南芥的阿拉伯二醇合酶AtPEN1[77].从膜荚黄芪中已表征4个催化环黄芪醇(cycloastragenol)糖基化修饰的糖基转移酶.AmGT8顺序催化环黄芪醇C3和C2位羟基的糖基化,生成双糖产物.通过同源建模和底物对接,发现其活性口袋由4个区域构成:区域A(T19/V87/M126)、区域B(A394)、区域C(S156/P192)和区域D(S100/S129/T131/G203).通过半理性设计改造,获得了可分别催化C3、C6和C2′位羟基糖基化的突变酶P192E、A394F和T131V;并且利用T131V和A394F突变酶,实现了黄芪皂苷Ⅲ和黄芪皂苷Ⅳ的合成(图4)[78].AmGT1和AmGT5均为3-O-糖基转移酶(图4).AmGT1对UDP-Xyl有较好选择性,并且能同时利用UDP-Glc等10种糖基供体,是已知供体选择性最广泛的三萜糖基转移酶.AmGT5对UDP-Glc选择性更高.通过分析已知糖基转移酶的序列,发现以UDP-Glc作为糖供体的糖基转移酶中146位氨基酸为T/P/G,而以其他糖供体为底物的糖基转移酶在相应位置上的氨基酸是A/I/S.同源建模和分子对接分析显示AmGT1的G146可能会影响其对UDP-Xyl和UDP-Glc的选择性.通过定点突变,获得两个专一性的木糖糖基转移酶AmGT1G146V和AmGT1G146I,以及三个能接受UDP-Xyl和UDP-Glc的糖基转移酶AmGT1G146S、AmGT1G146P和AmGT1G146A.其中,AmGT1和AmGT1G146V/I以环黄芪醇为底物,而AmGT1G146S/P/A以环黄芪醇-6-O-β-D-葡萄糖苷(cycloastragenol-6-O-β-D-glucoside)为底物(图4)[79].AmGT9能催化环黄芪醇C25位羟基的糖基化(图4),是首个能糖基化环阿屯烷型三萜侧链羟基的糖基转移酶[79].组合运用AmGT1/9、AmGT1G146V/I、AmGT1G146S/P/A、AmGT8和AmGT8A394F,可合成13种环阿屯烷型黄芪皂苷[79].此外,戴均贵课题组[80]从蒙古黄芪中鉴定了环阿屯醇合酶AmCAS1以及4个糖基转移酶AmUGT15、AmUGT14、AmUGT13和AmUGT7(图4).这4个糖基转移酶可分别催化环黄芪醇苷元的3-O-木糖基化、3-O-葡萄糖基化、25-O-葡萄糖基化/木糖基化和2′-O-葡萄糖基化.组合运用这4种糖基转移酶,可将环黄芪醇转化为黄芪皂苷Ⅲ~Ⅴ和Ⅶ以及异黄芪皂苷Ⅳ(图4).除糖基化外,乙酰化也是皂苷的常见后修饰形式.叶敏/乔雪课题组[81]从膜荚黄芪中鉴定了首个四环三萜皂苷酰基转移酶AmAT7-3,可催化黄芪皂苷Ⅳ木糖的3′和4′位发生乙酰化,生成异黄芪皂苷Ⅱ、环黄芪苷Ⅱ(cyclocephaloside Ⅱ)和3-O-3′,4′-二乙酰基-β-D-吡喃木糖基-6-O-β-D-吡喃葡萄糖基-环黄芪醇(3-O-3′,4′-diacetyl-β-D-xylopyranosyl-6-O-β-D-glucopyranosyl-cycloastragenol)(图5).异黄芪皂苷Ⅱ和环黄芪苷Ⅱ会自发转化为黄芪皂苷Ⅱ(astragaloside Ⅱ)(图5).由于AmAT7-3活性口袋内部的特异性基序AADAG体积小,因此口袋空间较大,糖苷键可自由旋转形成两种构象,分别对应两个位点的乙酰化反应.基于该机制,通过理性设计获得两个突变酶A310G和A310W,分别能特异性催化黄芪皂苷Ⅳ的C3′-O和C4′-O乙酰化(图5).目前,尚未解析从环阿屯醇到环黄芪醇的转化过程,将是未来黄芪皂苷生物合成研究的重点. ...
Characterization and structure-based protein engineering of a regiospecific saponin acetyltransferase from Astragalus membranaceus
1
2023
... 黄芪为豆科植物蒙古黄芪[Astragalus membranaceus var. mongholicus (Bunge)P.K.Hsiao]或膜荚黄芪[A. membranaceus (Fisch.) Bunge]的干燥根,具有补气升阳、益卫固表以及利水消肿等功效,是补气要药.黄芪的药效成分为环阿屯烷型三萜皂苷,主要包括黄芪皂苷Ⅰ~Ⅶ和异黄芪皂苷(isoastragaloside)Ⅰ、Ⅱ和Ⅳ等[75].叶敏/乔雪课题组[76]对黄芪三萜皂苷的生物合成途径进行了较系统的研究.通过在烟草和酵母中进行异源表达,从膜荚黄芪中鉴定了环氧鲨烯环化酶AmOSC3(环阿屯醇合酶)(图4),并采用过表达及RNA干扰(RNAi)实验进一步证实其参与了黄芪皂苷的生物合成.该酶具有一个关键功能基序VFN,将该基序突变为SIV后,酶活性降低.此外,VFN基序对其他环氧鲨烯环化酶同样重要,如百脉根的羽扇豆醇合酶LjOSC3和拟南芥的阿拉伯二醇合酶AtPEN1[77].从膜荚黄芪中已表征4个催化环黄芪醇(cycloastragenol)糖基化修饰的糖基转移酶.AmGT8顺序催化环黄芪醇C3和C2位羟基的糖基化,生成双糖产物.通过同源建模和底物对接,发现其活性口袋由4个区域构成:区域A(T19/V87/M126)、区域B(A394)、区域C(S156/P192)和区域D(S100/S129/T131/G203).通过半理性设计改造,获得了可分别催化C3、C6和C2′位羟基糖基化的突变酶P192E、A394F和T131V;并且利用T131V和A394F突变酶,实现了黄芪皂苷Ⅲ和黄芪皂苷Ⅳ的合成(图4)[78].AmGT1和AmGT5均为3-O-糖基转移酶(图4).AmGT1对UDP-Xyl有较好选择性,并且能同时利用UDP-Glc等10种糖基供体,是已知供体选择性最广泛的三萜糖基转移酶.AmGT5对UDP-Glc选择性更高.通过分析已知糖基转移酶的序列,发现以UDP-Glc作为糖供体的糖基转移酶中146位氨基酸为T/P/G,而以其他糖供体为底物的糖基转移酶在相应位置上的氨基酸是A/I/S.同源建模和分子对接分析显示AmGT1的G146可能会影响其对UDP-Xyl和UDP-Glc的选择性.通过定点突变,获得两个专一性的木糖糖基转移酶AmGT1G146V和AmGT1G146I,以及三个能接受UDP-Xyl和UDP-Glc的糖基转移酶AmGT1G146S、AmGT1G146P和AmGT1G146A.其中,AmGT1和AmGT1G146V/I以环黄芪醇为底物,而AmGT1G146S/P/A以环黄芪醇-6-O-β-D-葡萄糖苷(cycloastragenol-6-O-β-D-glucoside)为底物(图4)[79].AmGT9能催化环黄芪醇C25位羟基的糖基化(图4),是首个能糖基化环阿屯烷型三萜侧链羟基的糖基转移酶[79].组合运用AmGT1/9、AmGT1G146V/I、AmGT1G146S/P/A、AmGT8和AmGT8A394F,可合成13种环阿屯烷型黄芪皂苷[79].此外,戴均贵课题组[80]从蒙古黄芪中鉴定了环阿屯醇合酶AmCAS1以及4个糖基转移酶AmUGT15、AmUGT14、AmUGT13和AmUGT7(图4).这4个糖基转移酶可分别催化环黄芪醇苷元的3-O-木糖基化、3-O-葡萄糖基化、25-O-葡萄糖基化/木糖基化和2′-O-葡萄糖基化.组合运用这4种糖基转移酶,可将环黄芪醇转化为黄芪皂苷Ⅲ~Ⅴ和Ⅶ以及异黄芪皂苷Ⅳ(图4).除糖基化外,乙酰化也是皂苷的常见后修饰形式.叶敏/乔雪课题组[81]从膜荚黄芪中鉴定了首个四环三萜皂苷酰基转移酶AmAT7-3,可催化黄芪皂苷Ⅳ木糖的3′和4′位发生乙酰化,生成异黄芪皂苷Ⅱ、环黄芪苷Ⅱ(cyclocephaloside Ⅱ)和3-O-3′,4′-二乙酰基-β-D-吡喃木糖基-6-O-β-D-吡喃葡萄糖基-环黄芪醇(3-O-3′,4′-diacetyl-β-D-xylopyranosyl-6-O-β-D-glucopyranosyl-cycloastragenol)(图5).异黄芪皂苷Ⅱ和环黄芪苷Ⅱ会自发转化为黄芪皂苷Ⅱ(astragaloside Ⅱ)(图5).由于AmAT7-3活性口袋内部的特异性基序AADAG体积小,因此口袋空间较大,糖苷键可自由旋转形成两种构象,分别对应两个位点的乙酰化反应.基于该机制,通过理性设计获得两个突变酶A310G和A310W,分别能特异性催化黄芪皂苷Ⅳ的C3′-O和C4′-O乙酰化(图5).目前,尚未解析从环阿屯醇到环黄芪醇的转化过程,将是未来黄芪皂苷生物合成研究的重点. ...
Optimum chalcone synthase for flavonoid biosynthesis in microorganisms
1
2021
... 黄酮是许多常用中药的主要药效成分(如淫羊藿、黄芩以及葛根等).黄酮类化合物源于复合途径,包括聚酮途径和苯丙氨酸/酪氨酸途径.查尔酮合酶(CHS)催化两个前体丙二酸单酰辅酶A和4-香豆酰辅酶A生成查尔酮类化合物[82],再经查尔酮异构酶(CHI)催化查尔酮环合,生成各种黄酮类化合物的关键中间体二氢黄酮.二氢黄酮在黄酮合酶(FNS)、二氢黄酮-3-羟化酶(F3H)或异黄酮合成酶(IFS)催化下,分别转化成黄酮类化合物、二氢黄酮醇类化合物或异黄酮类化合物.其中,二氢黄酮醇类化合物在黄酮醇合成酶(FLS)的催化下生成黄酮醇. ...
Effectiveness of Scutellaria baicalensis Georgi root in pregnancy-related diseases: a review
1
2023
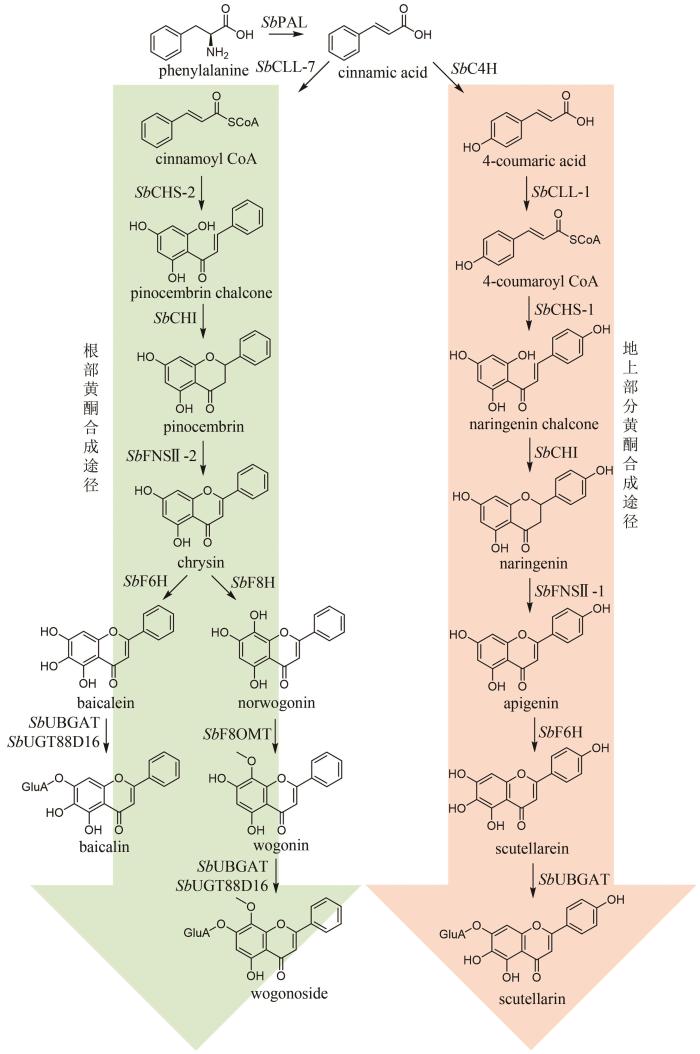
... 黄芩是临床常用中药,以唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥根入药,具有清热燥湿、泻火解毒、止血以及安胎等功效[83].现代药理研究表明,黄芩具有抗菌、抗流感病毒、抗炎以及镇静解热等作用[84].黄酮类成分被认为是黄芩的主要药效成分,其中包含一类黄芩属植物特有的4′-脱氧黄酮化合物.这类黄酮化合物的代表分子包括黄芩苷(baicalin)、黄芩素(baicalein)、汉黄芩苷(wogonoside)、汉黄芩素(wogonin)以及去甲汉黄芩素(norwogonin)等[85].黄芩采用两种不同的途径合成黄酮类成分,包括地上部分的典型黄酮生物合成途径以及根部的4′-脱氧黄酮生物合成途径(图6)[86].首先,苯丙氨酸在苯丙氨酸解氨酶(PAL)的催化下被转化为肉桂酸.目前,从黄芩中表征了SbPAL1、SbPAL2和SbPAL3三个PAL,分别在茎、叶和根中表达水平最高,说明在不同组织中黄芩采用不同的PAL酶完成肉桂酸的合成[87].在地上部分的典型途径中,肉桂酸在肉桂酸-4羟化酶(SbC4H)、4-香豆酰辅酶A连接酶(SbCLL-1)、查尔酮合成酶(SbCHS-1)、查尔酮异构酶(SbCHI)和黄酮合酶(SbFNSⅡ-1)的顺序催化下,依次经4-香豆酸(4-coumaric acid)、4-香豆酰辅酶A(4-coumaroyl CoA)、柚皮素查尔酮(naringenin chalcone)和柚皮素(naringenin),生成芹菜素(apigenin);之后,芹菜素被进一步羟基化和糖基化形成野黄芩素(scutellarein)和野黄芩苷(scutellarin)等化合物(图6)[88-89].在根中,肉桂酸不被氧化成4-香豆酸,而是在肉桂酰辅酶A连接酶(SbCLL-7)的催化下,直接与辅酶A连接生成肉桂酰辅酶A(cinnamoyl CoA);肉桂酰辅酶A在乔松素查尔酮合成酶(SbCHS-2)和SbCHI的连续催化下,生成4′-脱氧二氢黄酮乔松素(pinocembrin);乔松素在SbFNSⅡ-2的催化下,转化为4′-脱氧黄酮白杨素(chrysin);白杨素的C6和C8分别在黄酮6-羟化酶(SbF6H)和黄酮8-羟化酶(SbF8H)的作用下被羟基化,生成黄芩素和去甲汉黄芩素[85,89];黄酮8-O-甲基转移酶(SbF8OMT)在去甲汉黄芩素的C8位羟基引入甲基,生成汉黄芩素[90];葡萄糖醛酸转移酶SbUGT88D16/SbUBGAT催化黄芩素和汉黄芩素的7位O-葡萄糖醛酸化反应,分别生成黄芩苷和汉黄芩苷[91-92](图6).黄芩中黄酮类成分的生物合成是植物代谢产物生物合成空间差异分布的典型范例. ...
A comprehensive review on phytochemistry, pharmacology, and flavonoid biosynthesis of Scutellaria baicalensis
1
2018
... 黄芩是临床常用中药,以唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥根入药,具有清热燥湿、泻火解毒、止血以及安胎等功效[83].现代药理研究表明,黄芩具有抗菌、抗流感病毒、抗炎以及镇静解热等作用[84].黄酮类成分被认为是黄芩的主要药效成分,其中包含一类黄芩属植物特有的4′-脱氧黄酮化合物.这类黄酮化合物的代表分子包括黄芩苷(baicalin)、黄芩素(baicalein)、汉黄芩苷(wogonoside)、汉黄芩素(wogonin)以及去甲汉黄芩素(norwogonin)等[85].黄芩采用两种不同的途径合成黄酮类成分,包括地上部分的典型黄酮生物合成途径以及根部的4′-脱氧黄酮生物合成途径(图6)[86].首先,苯丙氨酸在苯丙氨酸解氨酶(PAL)的催化下被转化为肉桂酸.目前,从黄芩中表征了SbPAL1、SbPAL2和SbPAL3三个PAL,分别在茎、叶和根中表达水平最高,说明在不同组织中黄芩采用不同的PAL酶完成肉桂酸的合成[87].在地上部分的典型途径中,肉桂酸在肉桂酸-4羟化酶(SbC4H)、4-香豆酰辅酶A连接酶(SbCLL-1)、查尔酮合成酶(SbCHS-1)、查尔酮异构酶(SbCHI)和黄酮合酶(SbFNSⅡ-1)的顺序催化下,依次经4-香豆酸(4-coumaric acid)、4-香豆酰辅酶A(4-coumaroyl CoA)、柚皮素查尔酮(naringenin chalcone)和柚皮素(naringenin),生成芹菜素(apigenin);之后,芹菜素被进一步羟基化和糖基化形成野黄芩素(scutellarein)和野黄芩苷(scutellarin)等化合物(图6)[88-89].在根中,肉桂酸不被氧化成4-香豆酸,而是在肉桂酰辅酶A连接酶(SbCLL-7)的催化下,直接与辅酶A连接生成肉桂酰辅酶A(cinnamoyl CoA);肉桂酰辅酶A在乔松素查尔酮合成酶(SbCHS-2)和SbCHI的连续催化下,生成4′-脱氧二氢黄酮乔松素(pinocembrin);乔松素在SbFNSⅡ-2的催化下,转化为4′-脱氧黄酮白杨素(chrysin);白杨素的C6和C8分别在黄酮6-羟化酶(SbF6H)和黄酮8-羟化酶(SbF8H)的作用下被羟基化,生成黄芩素和去甲汉黄芩素[85,89];黄酮8-O-甲基转移酶(SbF8OMT)在去甲汉黄芩素的C8位羟基引入甲基,生成汉黄芩素[90];葡萄糖醛酸转移酶SbUGT88D16/SbUBGAT催化黄芩素和汉黄芩素的7位O-葡萄糖醛酸化反应,分别生成黄芩苷和汉黄芩苷[91-92](图6).黄芩中黄酮类成分的生物合成是植物代谢产物生物合成空间差异分布的典型范例. ...
Specific flavonoids and their biosynthetic pathway in Scutellaria baicalensis
2
2022
... 黄芩是临床常用中药,以唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥根入药,具有清热燥湿、泻火解毒、止血以及安胎等功效[83].现代药理研究表明,黄芩具有抗菌、抗流感病毒、抗炎以及镇静解热等作用[84].黄酮类成分被认为是黄芩的主要药效成分,其中包含一类黄芩属植物特有的4′-脱氧黄酮化合物.这类黄酮化合物的代表分子包括黄芩苷(baicalin)、黄芩素(baicalein)、汉黄芩苷(wogonoside)、汉黄芩素(wogonin)以及去甲汉黄芩素(norwogonin)等[85].黄芩采用两种不同的途径合成黄酮类成分,包括地上部分的典型黄酮生物合成途径以及根部的4′-脱氧黄酮生物合成途径(图6)[86].首先,苯丙氨酸在苯丙氨酸解氨酶(PAL)的催化下被转化为肉桂酸.目前,从黄芩中表征了SbPAL1、SbPAL2和SbPAL3三个PAL,分别在茎、叶和根中表达水平最高,说明在不同组织中黄芩采用不同的PAL酶完成肉桂酸的合成[87].在地上部分的典型途径中,肉桂酸在肉桂酸-4羟化酶(SbC4H)、4-香豆酰辅酶A连接酶(SbCLL-1)、查尔酮合成酶(SbCHS-1)、查尔酮异构酶(SbCHI)和黄酮合酶(SbFNSⅡ-1)的顺序催化下,依次经4-香豆酸(4-coumaric acid)、4-香豆酰辅酶A(4-coumaroyl CoA)、柚皮素查尔酮(naringenin chalcone)和柚皮素(naringenin),生成芹菜素(apigenin);之后,芹菜素被进一步羟基化和糖基化形成野黄芩素(scutellarein)和野黄芩苷(scutellarin)等化合物(图6)[88-89].在根中,肉桂酸不被氧化成4-香豆酸,而是在肉桂酰辅酶A连接酶(SbCLL-7)的催化下,直接与辅酶A连接生成肉桂酰辅酶A(cinnamoyl CoA);肉桂酰辅酶A在乔松素查尔酮合成酶(SbCHS-2)和SbCHI的连续催化下,生成4′-脱氧二氢黄酮乔松素(pinocembrin);乔松素在SbFNSⅡ-2的催化下,转化为4′-脱氧黄酮白杨素(chrysin);白杨素的C6和C8分别在黄酮6-羟化酶(SbF6H)和黄酮8-羟化酶(SbF8H)的作用下被羟基化,生成黄芩素和去甲汉黄芩素[85,89];黄酮8-O-甲基转移酶(SbF8OMT)在去甲汉黄芩素的C8位羟基引入甲基,生成汉黄芩素[90];葡萄糖醛酸转移酶SbUGT88D16/SbUBGAT催化黄芩素和汉黄芩素的7位O-葡萄糖醛酸化反应,分别生成黄芩苷和汉黄芩苷[91-92](图6).黄芩中黄酮类成分的生物合成是植物代谢产物生物合成空间差异分布的典型范例. ...
... [85,89];黄酮8-O-甲基转移酶(SbF8OMT)在去甲汉黄芩素的C8位羟基引入甲基,生成汉黄芩素[90];葡萄糖醛酸转移酶SbUGT88D16/SbUBGAT催化黄芩素和汉黄芩素的7位O-葡萄糖醛酸化反应,分别生成黄芩苷和汉黄芩苷[91-92](图6).黄芩中黄酮类成分的生物合成是植物代谢产物生物合成空间差异分布的典型范例. ...
The reference genome sequence of Scutellaria baicalensis provides insights into the evolution of wogonin biosynthesis
1
2019
... 黄芩是临床常用中药,以唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥根入药,具有清热燥湿、泻火解毒、止血以及安胎等功效[83].现代药理研究表明,黄芩具有抗菌、抗流感病毒、抗炎以及镇静解热等作用[84].黄酮类成分被认为是黄芩的主要药效成分,其中包含一类黄芩属植物特有的4′-脱氧黄酮化合物.这类黄酮化合物的代表分子包括黄芩苷(baicalin)、黄芩素(baicalein)、汉黄芩苷(wogonoside)、汉黄芩素(wogonin)以及去甲汉黄芩素(norwogonin)等[85].黄芩采用两种不同的途径合成黄酮类成分,包括地上部分的典型黄酮生物合成途径以及根部的4′-脱氧黄酮生物合成途径(图6)[86].首先,苯丙氨酸在苯丙氨酸解氨酶(PAL)的催化下被转化为肉桂酸.目前,从黄芩中表征了SbPAL1、SbPAL2和SbPAL3三个PAL,分别在茎、叶和根中表达水平最高,说明在不同组织中黄芩采用不同的PAL酶完成肉桂酸的合成[87].在地上部分的典型途径中,肉桂酸在肉桂酸-4羟化酶(SbC4H)、4-香豆酰辅酶A连接酶(SbCLL-1)、查尔酮合成酶(SbCHS-1)、查尔酮异构酶(SbCHI)和黄酮合酶(SbFNSⅡ-1)的顺序催化下,依次经4-香豆酸(4-coumaric acid)、4-香豆酰辅酶A(4-coumaroyl CoA)、柚皮素查尔酮(naringenin chalcone)和柚皮素(naringenin),生成芹菜素(apigenin);之后,芹菜素被进一步羟基化和糖基化形成野黄芩素(scutellarein)和野黄芩苷(scutellarin)等化合物(图6)[88-89].在根中,肉桂酸不被氧化成4-香豆酸,而是在肉桂酰辅酶A连接酶(SbCLL-7)的催化下,直接与辅酶A连接生成肉桂酰辅酶A(cinnamoyl CoA);肉桂酰辅酶A在乔松素查尔酮合成酶(SbCHS-2)和SbCHI的连续催化下,生成4′-脱氧二氢黄酮乔松素(pinocembrin);乔松素在SbFNSⅡ-2的催化下,转化为4′-脱氧黄酮白杨素(chrysin);白杨素的C6和C8分别在黄酮6-羟化酶(SbF6H)和黄酮8-羟化酶(SbF8H)的作用下被羟基化,生成黄芩素和去甲汉黄芩素[85,89];黄酮8-O-甲基转移酶(SbF8OMT)在去甲汉黄芩素的C8位羟基引入甲基,生成汉黄芩素[90];葡萄糖醛酸转移酶SbUGT88D16/SbUBGAT催化黄芩素和汉黄芩素的7位O-葡萄糖醛酸化反应,分别生成黄芩苷和汉黄芩苷[91-92](图6).黄芩中黄酮类成分的生物合成是植物代谢产物生物合成空间差异分布的典型范例. ...
Molecular cloning and characterization of phenylalanine ammonia-lyase, cinnamate 4-hydroxylase and genes involved in flavone biosynthesis in Scutellaria baicalensis
1
2010
... 黄芩是临床常用中药,以唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥根入药,具有清热燥湿、泻火解毒、止血以及安胎等功效[83].现代药理研究表明,黄芩具有抗菌、抗流感病毒、抗炎以及镇静解热等作用[84].黄酮类成分被认为是黄芩的主要药效成分,其中包含一类黄芩属植物特有的4′-脱氧黄酮化合物.这类黄酮化合物的代表分子包括黄芩苷(baicalin)、黄芩素(baicalein)、汉黄芩苷(wogonoside)、汉黄芩素(wogonin)以及去甲汉黄芩素(norwogonin)等[85].黄芩采用两种不同的途径合成黄酮类成分,包括地上部分的典型黄酮生物合成途径以及根部的4′-脱氧黄酮生物合成途径(图6)[86].首先,苯丙氨酸在苯丙氨酸解氨酶(PAL)的催化下被转化为肉桂酸.目前,从黄芩中表征了SbPAL1、SbPAL2和SbPAL3三个PAL,分别在茎、叶和根中表达水平最高,说明在不同组织中黄芩采用不同的PAL酶完成肉桂酸的合成[87].在地上部分的典型途径中,肉桂酸在肉桂酸-4羟化酶(SbC4H)、4-香豆酰辅酶A连接酶(SbCLL-1)、查尔酮合成酶(SbCHS-1)、查尔酮异构酶(SbCHI)和黄酮合酶(SbFNSⅡ-1)的顺序催化下,依次经4-香豆酸(4-coumaric acid)、4-香豆酰辅酶A(4-coumaroyl CoA)、柚皮素查尔酮(naringenin chalcone)和柚皮素(naringenin),生成芹菜素(apigenin);之后,芹菜素被进一步羟基化和糖基化形成野黄芩素(scutellarein)和野黄芩苷(scutellarin)等化合物(图6)[88-89].在根中,肉桂酸不被氧化成4-香豆酸,而是在肉桂酰辅酶A连接酶(SbCLL-7)的催化下,直接与辅酶A连接生成肉桂酰辅酶A(cinnamoyl CoA);肉桂酰辅酶A在乔松素查尔酮合成酶(SbCHS-2)和SbCHI的连续催化下,生成4′-脱氧二氢黄酮乔松素(pinocembrin);乔松素在SbFNSⅡ-2的催化下,转化为4′-脱氧黄酮白杨素(chrysin);白杨素的C6和C8分别在黄酮6-羟化酶(SbF6H)和黄酮8-羟化酶(SbF8H)的作用下被羟基化,生成黄芩素和去甲汉黄芩素[85,89];黄酮8-O-甲基转移酶(SbF8OMT)在去甲汉黄芩素的C8位羟基引入甲基,生成汉黄芩素[90];葡萄糖醛酸转移酶SbUGT88D16/SbUBGAT催化黄芩素和汉黄芩素的7位O-葡萄糖醛酸化反应,分别生成黄芩苷和汉黄芩苷[91-92](图6).黄芩中黄酮类成分的生物合成是植物代谢产物生物合成空间差异分布的典型范例. ...
A specialized flavone biosynthetic pathway has evolved in the medicinal plant, Scutellaria baicalensis
1
2016
... 黄芩是临床常用中药,以唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥根入药,具有清热燥湿、泻火解毒、止血以及安胎等功效[83].现代药理研究表明,黄芩具有抗菌、抗流感病毒、抗炎以及镇静解热等作用[84].黄酮类成分被认为是黄芩的主要药效成分,其中包含一类黄芩属植物特有的4′-脱氧黄酮化合物.这类黄酮化合物的代表分子包括黄芩苷(baicalin)、黄芩素(baicalein)、汉黄芩苷(wogonoside)、汉黄芩素(wogonin)以及去甲汉黄芩素(norwogonin)等[85].黄芩采用两种不同的途径合成黄酮类成分,包括地上部分的典型黄酮生物合成途径以及根部的4′-脱氧黄酮生物合成途径(图6)[86].首先,苯丙氨酸在苯丙氨酸解氨酶(PAL)的催化下被转化为肉桂酸.目前,从黄芩中表征了SbPAL1、SbPAL2和SbPAL3三个PAL,分别在茎、叶和根中表达水平最高,说明在不同组织中黄芩采用不同的PAL酶完成肉桂酸的合成[87].在地上部分的典型途径中,肉桂酸在肉桂酸-4羟化酶(SbC4H)、4-香豆酰辅酶A连接酶(SbCLL-1)、查尔酮合成酶(SbCHS-1)、查尔酮异构酶(SbCHI)和黄酮合酶(SbFNSⅡ-1)的顺序催化下,依次经4-香豆酸(4-coumaric acid)、4-香豆酰辅酶A(4-coumaroyl CoA)、柚皮素查尔酮(naringenin chalcone)和柚皮素(naringenin),生成芹菜素(apigenin);之后,芹菜素被进一步羟基化和糖基化形成野黄芩素(scutellarein)和野黄芩苷(scutellarin)等化合物(图6)[88-89].在根中,肉桂酸不被氧化成4-香豆酸,而是在肉桂酰辅酶A连接酶(SbCLL-7)的催化下,直接与辅酶A连接生成肉桂酰辅酶A(cinnamoyl CoA);肉桂酰辅酶A在乔松素查尔酮合成酶(SbCHS-2)和SbCHI的连续催化下,生成4′-脱氧二氢黄酮乔松素(pinocembrin);乔松素在SbFNSⅡ-2的催化下,转化为4′-脱氧黄酮白杨素(chrysin);白杨素的C6和C8分别在黄酮6-羟化酶(SbF6H)和黄酮8-羟化酶(SbF8H)的作用下被羟基化,生成黄芩素和去甲汉黄芩素[85,89];黄酮8-O-甲基转移酶(SbF8OMT)在去甲汉黄芩素的C8位羟基引入甲基,生成汉黄芩素[90];葡萄糖醛酸转移酶SbUGT88D16/SbUBGAT催化黄芩素和汉黄芩素的7位O-葡萄糖醛酸化反应,分别生成黄芩苷和汉黄芩苷[91-92](图6).黄芩中黄酮类成分的生物合成是植物代谢产物生物合成空间差异分布的典型范例. ...
Two CYP82D enzymes function as flavone hydroxylases in the biosynthesis of root-specific 4'-deoxyflavones in Scutellaria baicalensis
2
2018
... 黄芩是临床常用中药,以唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥根入药,具有清热燥湿、泻火解毒、止血以及安胎等功效[83].现代药理研究表明,黄芩具有抗菌、抗流感病毒、抗炎以及镇静解热等作用[84].黄酮类成分被认为是黄芩的主要药效成分,其中包含一类黄芩属植物特有的4′-脱氧黄酮化合物.这类黄酮化合物的代表分子包括黄芩苷(baicalin)、黄芩素(baicalein)、汉黄芩苷(wogonoside)、汉黄芩素(wogonin)以及去甲汉黄芩素(norwogonin)等[85].黄芩采用两种不同的途径合成黄酮类成分,包括地上部分的典型黄酮生物合成途径以及根部的4′-脱氧黄酮生物合成途径(图6)[86].首先,苯丙氨酸在苯丙氨酸解氨酶(PAL)的催化下被转化为肉桂酸.目前,从黄芩中表征了SbPAL1、SbPAL2和SbPAL3三个PAL,分别在茎、叶和根中表达水平最高,说明在不同组织中黄芩采用不同的PAL酶完成肉桂酸的合成[87].在地上部分的典型途径中,肉桂酸在肉桂酸-4羟化酶(SbC4H)、4-香豆酰辅酶A连接酶(SbCLL-1)、查尔酮合成酶(SbCHS-1)、查尔酮异构酶(SbCHI)和黄酮合酶(SbFNSⅡ-1)的顺序催化下,依次经4-香豆酸(4-coumaric acid)、4-香豆酰辅酶A(4-coumaroyl CoA)、柚皮素查尔酮(naringenin chalcone)和柚皮素(naringenin),生成芹菜素(apigenin);之后,芹菜素被进一步羟基化和糖基化形成野黄芩素(scutellarein)和野黄芩苷(scutellarin)等化合物(图6)[88-89].在根中,肉桂酸不被氧化成4-香豆酸,而是在肉桂酰辅酶A连接酶(SbCLL-7)的催化下,直接与辅酶A连接生成肉桂酰辅酶A(cinnamoyl CoA);肉桂酰辅酶A在乔松素查尔酮合成酶(SbCHS-2)和SbCHI的连续催化下,生成4′-脱氧二氢黄酮乔松素(pinocembrin);乔松素在SbFNSⅡ-2的催化下,转化为4′-脱氧黄酮白杨素(chrysin);白杨素的C6和C8分别在黄酮6-羟化酶(SbF6H)和黄酮8-羟化酶(SbF8H)的作用下被羟基化,生成黄芩素和去甲汉黄芩素[85,89];黄酮8-O-甲基转移酶(SbF8OMT)在去甲汉黄芩素的C8位羟基引入甲基,生成汉黄芩素[90];葡萄糖醛酸转移酶SbUGT88D16/SbUBGAT催化黄芩素和汉黄芩素的7位O-葡萄糖醛酸化反应,分别生成黄芩苷和汉黄芩苷[91-92](图6).黄芩中黄酮类成分的生物合成是植物代谢产物生物合成空间差异分布的典型范例. ...
... ,89];黄酮8-O-甲基转移酶(SbF8OMT)在去甲汉黄芩素的C8位羟基引入甲基,生成汉黄芩素[90];葡萄糖醛酸转移酶SbUGT88D16/SbUBGAT催化黄芩素和汉黄芩素的7位O-葡萄糖醛酸化反应,分别生成黄芩苷和汉黄芩苷[91-92](图6).黄芩中黄酮类成分的生物合成是植物代谢产物生物合成空间差异分布的典型范例. ...
De novo biosynthesis of multiple pinocembrin derivatives in Saccharomyces cerevisiae
1
2020
... 黄芩是临床常用中药,以唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥根入药,具有清热燥湿、泻火解毒、止血以及安胎等功效[83].现代药理研究表明,黄芩具有抗菌、抗流感病毒、抗炎以及镇静解热等作用[84].黄酮类成分被认为是黄芩的主要药效成分,其中包含一类黄芩属植物特有的4′-脱氧黄酮化合物.这类黄酮化合物的代表分子包括黄芩苷(baicalin)、黄芩素(baicalein)、汉黄芩苷(wogonoside)、汉黄芩素(wogonin)以及去甲汉黄芩素(norwogonin)等[85].黄芩采用两种不同的途径合成黄酮类成分,包括地上部分的典型黄酮生物合成途径以及根部的4′-脱氧黄酮生物合成途径(图6)[86].首先,苯丙氨酸在苯丙氨酸解氨酶(PAL)的催化下被转化为肉桂酸.目前,从黄芩中表征了SbPAL1、SbPAL2和SbPAL3三个PAL,分别在茎、叶和根中表达水平最高,说明在不同组织中黄芩采用不同的PAL酶完成肉桂酸的合成[87].在地上部分的典型途径中,肉桂酸在肉桂酸-4羟化酶(SbC4H)、4-香豆酰辅酶A连接酶(SbCLL-1)、查尔酮合成酶(SbCHS-1)、查尔酮异构酶(SbCHI)和黄酮合酶(SbFNSⅡ-1)的顺序催化下,依次经4-香豆酸(4-coumaric acid)、4-香豆酰辅酶A(4-coumaroyl CoA)、柚皮素查尔酮(naringenin chalcone)和柚皮素(naringenin),生成芹菜素(apigenin);之后,芹菜素被进一步羟基化和糖基化形成野黄芩素(scutellarein)和野黄芩苷(scutellarin)等化合物(图6)[88-89].在根中,肉桂酸不被氧化成4-香豆酸,而是在肉桂酰辅酶A连接酶(SbCLL-7)的催化下,直接与辅酶A连接生成肉桂酰辅酶A(cinnamoyl CoA);肉桂酰辅酶A在乔松素查尔酮合成酶(SbCHS-2)和SbCHI的连续催化下,生成4′-脱氧二氢黄酮乔松素(pinocembrin);乔松素在SbFNSⅡ-2的催化下,转化为4′-脱氧黄酮白杨素(chrysin);白杨素的C6和C8分别在黄酮6-羟化酶(SbF6H)和黄酮8-羟化酶(SbF8H)的作用下被羟基化,生成黄芩素和去甲汉黄芩素[85,89];黄酮8-O-甲基转移酶(SbF8OMT)在去甲汉黄芩素的C8位羟基引入甲基,生成汉黄芩素[90];葡萄糖醛酸转移酶SbUGT88D16/SbUBGAT催化黄芩素和汉黄芩素的7位O-葡萄糖醛酸化反应,分别生成黄芩苷和汉黄芩苷[91-92](图6).黄芩中黄酮类成分的生物合成是植物代谢产物生物合成空间差异分布的典型范例. ...
黄芩中黄酮O-糖基转移酶的发现及功能表征
1
2021
... 黄芩是临床常用中药,以唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥根入药,具有清热燥湿、泻火解毒、止血以及安胎等功效[83].现代药理研究表明,黄芩具有抗菌、抗流感病毒、抗炎以及镇静解热等作用[84].黄酮类成分被认为是黄芩的主要药效成分,其中包含一类黄芩属植物特有的4′-脱氧黄酮化合物.这类黄酮化合物的代表分子包括黄芩苷(baicalin)、黄芩素(baicalein)、汉黄芩苷(wogonoside)、汉黄芩素(wogonin)以及去甲汉黄芩素(norwogonin)等[85].黄芩采用两种不同的途径合成黄酮类成分,包括地上部分的典型黄酮生物合成途径以及根部的4′-脱氧黄酮生物合成途径(图6)[86].首先,苯丙氨酸在苯丙氨酸解氨酶(PAL)的催化下被转化为肉桂酸.目前,从黄芩中表征了SbPAL1、SbPAL2和SbPAL3三个PAL,分别在茎、叶和根中表达水平最高,说明在不同组织中黄芩采用不同的PAL酶完成肉桂酸的合成[87].在地上部分的典型途径中,肉桂酸在肉桂酸-4羟化酶(SbC4H)、4-香豆酰辅酶A连接酶(SbCLL-1)、查尔酮合成酶(SbCHS-1)、查尔酮异构酶(SbCHI)和黄酮合酶(SbFNSⅡ-1)的顺序催化下,依次经4-香豆酸(4-coumaric acid)、4-香豆酰辅酶A(4-coumaroyl CoA)、柚皮素查尔酮(naringenin chalcone)和柚皮素(naringenin),生成芹菜素(apigenin);之后,芹菜素被进一步羟基化和糖基化形成野黄芩素(scutellarein)和野黄芩苷(scutellarin)等化合物(图6)[88-89].在根中,肉桂酸不被氧化成4-香豆酸,而是在肉桂酰辅酶A连接酶(SbCLL-7)的催化下,直接与辅酶A连接生成肉桂酰辅酶A(cinnamoyl CoA);肉桂酰辅酶A在乔松素查尔酮合成酶(SbCHS-2)和SbCHI的连续催化下,生成4′-脱氧二氢黄酮乔松素(pinocembrin);乔松素在SbFNSⅡ-2的催化下,转化为4′-脱氧黄酮白杨素(chrysin);白杨素的C6和C8分别在黄酮6-羟化酶(SbF6H)和黄酮8-羟化酶(SbF8H)的作用下被羟基化,生成黄芩素和去甲汉黄芩素[85,89];黄酮8-O-甲基转移酶(SbF8OMT)在去甲汉黄芩素的C8位羟基引入甲基,生成汉黄芩素[90];葡萄糖醛酸转移酶SbUGT88D16/SbUBGAT催化黄芩素和汉黄芩素的7位O-葡萄糖醛酸化反应,分别生成黄芩苷和汉黄芩苷[91-92](图6).黄芩中黄酮类成分的生物合成是植物代谢产物生物合成空间差异分布的典型范例. ...
Discovery and functional characterization of flavone O-glycosyltransferases in Scutellaria baicalensis
1
2021
... 黄芩是临床常用中药,以唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥根入药,具有清热燥湿、泻火解毒、止血以及安胎等功效[83].现代药理研究表明,黄芩具有抗菌、抗流感病毒、抗炎以及镇静解热等作用[84].黄酮类成分被认为是黄芩的主要药效成分,其中包含一类黄芩属植物特有的4′-脱氧黄酮化合物.这类黄酮化合物的代表分子包括黄芩苷(baicalin)、黄芩素(baicalein)、汉黄芩苷(wogonoside)、汉黄芩素(wogonin)以及去甲汉黄芩素(norwogonin)等[85].黄芩采用两种不同的途径合成黄酮类成分,包括地上部分的典型黄酮生物合成途径以及根部的4′-脱氧黄酮生物合成途径(图6)[86].首先,苯丙氨酸在苯丙氨酸解氨酶(PAL)的催化下被转化为肉桂酸.目前,从黄芩中表征了SbPAL1、SbPAL2和SbPAL3三个PAL,分别在茎、叶和根中表达水平最高,说明在不同组织中黄芩采用不同的PAL酶完成肉桂酸的合成[87].在地上部分的典型途径中,肉桂酸在肉桂酸-4羟化酶(SbC4H)、4-香豆酰辅酶A连接酶(SbCLL-1)、查尔酮合成酶(SbCHS-1)、查尔酮异构酶(SbCHI)和黄酮合酶(SbFNSⅡ-1)的顺序催化下,依次经4-香豆酸(4-coumaric acid)、4-香豆酰辅酶A(4-coumaroyl CoA)、柚皮素查尔酮(naringenin chalcone)和柚皮素(naringenin),生成芹菜素(apigenin);之后,芹菜素被进一步羟基化和糖基化形成野黄芩素(scutellarein)和野黄芩苷(scutellarin)等化合物(图6)[88-89].在根中,肉桂酸不被氧化成4-香豆酸,而是在肉桂酰辅酶A连接酶(SbCLL-7)的催化下,直接与辅酶A连接生成肉桂酰辅酶A(cinnamoyl CoA);肉桂酰辅酶A在乔松素查尔酮合成酶(SbCHS-2)和SbCHI的连续催化下,生成4′-脱氧二氢黄酮乔松素(pinocembrin);乔松素在SbFNSⅡ-2的催化下,转化为4′-脱氧黄酮白杨素(chrysin);白杨素的C6和C8分别在黄酮6-羟化酶(SbF6H)和黄酮8-羟化酶(SbF8H)的作用下被羟基化,生成黄芩素和去甲汉黄芩素[85,89];黄酮8-O-甲基转移酶(SbF8OMT)在去甲汉黄芩素的C8位羟基引入甲基,生成汉黄芩素[90];葡萄糖醛酸转移酶SbUGT88D16/SbUBGAT催化黄芩素和汉黄芩素的7位O-葡萄糖醛酸化反应,分别生成黄芩苷和汉黄芩苷[91-92](图6).黄芩中黄酮类成分的生物合成是植物代谢产物生物合成空间差异分布的典型范例. ...
Purification and characterization of UDP-glucuronate: baicalein 7-O-glucuronosyltransferase from Scutellaria baicalensis Georgi. cell suspension cultures
1
2000
... 黄芩是临床常用中药,以唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥根入药,具有清热燥湿、泻火解毒、止血以及安胎等功效[83].现代药理研究表明,黄芩具有抗菌、抗流感病毒、抗炎以及镇静解热等作用[84].黄酮类成分被认为是黄芩的主要药效成分,其中包含一类黄芩属植物特有的4′-脱氧黄酮化合物.这类黄酮化合物的代表分子包括黄芩苷(baicalin)、黄芩素(baicalein)、汉黄芩苷(wogonoside)、汉黄芩素(wogonin)以及去甲汉黄芩素(norwogonin)等[85].黄芩采用两种不同的途径合成黄酮类成分,包括地上部分的典型黄酮生物合成途径以及根部的4′-脱氧黄酮生物合成途径(图6)[86].首先,苯丙氨酸在苯丙氨酸解氨酶(PAL)的催化下被转化为肉桂酸.目前,从黄芩中表征了SbPAL1、SbPAL2和SbPAL3三个PAL,分别在茎、叶和根中表达水平最高,说明在不同组织中黄芩采用不同的PAL酶完成肉桂酸的合成[87].在地上部分的典型途径中,肉桂酸在肉桂酸-4羟化酶(SbC4H)、4-香豆酰辅酶A连接酶(SbCLL-1)、查尔酮合成酶(SbCHS-1)、查尔酮异构酶(SbCHI)和黄酮合酶(SbFNSⅡ-1)的顺序催化下,依次经4-香豆酸(4-coumaric acid)、4-香豆酰辅酶A(4-coumaroyl CoA)、柚皮素查尔酮(naringenin chalcone)和柚皮素(naringenin),生成芹菜素(apigenin);之后,芹菜素被进一步羟基化和糖基化形成野黄芩素(scutellarein)和野黄芩苷(scutellarin)等化合物(图6)[88-89].在根中,肉桂酸不被氧化成4-香豆酸,而是在肉桂酰辅酶A连接酶(SbCLL-7)的催化下,直接与辅酶A连接生成肉桂酰辅酶A(cinnamoyl CoA);肉桂酰辅酶A在乔松素查尔酮合成酶(SbCHS-2)和SbCHI的连续催化下,生成4′-脱氧二氢黄酮乔松素(pinocembrin);乔松素在SbFNSⅡ-2的催化下,转化为4′-脱氧黄酮白杨素(chrysin);白杨素的C6和C8分别在黄酮6-羟化酶(SbF6H)和黄酮8-羟化酶(SbF8H)的作用下被羟基化,生成黄芩素和去甲汉黄芩素[85,89];黄酮8-O-甲基转移酶(SbF8OMT)在去甲汉黄芩素的C8位羟基引入甲基,生成汉黄芩素[90];葡萄糖醛酸转移酶SbUGT88D16/SbUBGAT催化黄芩素和汉黄芩素的7位O-葡萄糖醛酸化反应,分别生成黄芩苷和汉黄芩苷[91-92](图6).黄芩中黄酮类成分的生物合成是植物代谢产物生物合成空间差异分布的典型范例. ...
Simultaneous extraction of epimedin A, B, C and icariin from Herba Epimedii by ultrasonic technique
1
2008
... 除糖基化和羟基甲基化外,异戊烯基也是黄酮类化合物结构中常见的修饰基团.代表性的异戊烯基取代黄酮类药效成分如:淫羊藿中的淫羊藿素及其苷类化合物(朝藿定类黄酮苷) [93].淫羊藿的基原植物种类较多,《中国药典》(2020年版)收载的品种包括:小檗科植物淫羊藿(Epimedium brevicornu Maxim.)、柔毛淫羊藿(E. pubescens Maxim.)、箭叶淫羊藿(E. sagittatu Maxim.)和朝鲜淫羊藿(E. koreanum Nakai);巫山淫羊藿(E. wushanense T. S. Ying)单独列为一个品种.此外,拟巫山淫羊藿(E. pseudowushanense B. L. Guo)被用作喘可治注射液的主要原料药材(广州方正药业有限公司)[94]. ...
拟巫山淫羊藿生长地土壤理化性质调查分析
2
2017
... 除糖基化和羟基甲基化外,异戊烯基也是黄酮类化合物结构中常见的修饰基团.代表性的异戊烯基取代黄酮类药效成分如:淫羊藿中的淫羊藿素及其苷类化合物(朝藿定类黄酮苷) [93].淫羊藿的基原植物种类较多,《中国药典》(2020年版)收载的品种包括:小檗科植物淫羊藿(Epimedium brevicornu Maxim.)、柔毛淫羊藿(E. pubescens Maxim.)、箭叶淫羊藿(E. sagittatu Maxim.)和朝鲜淫羊藿(E. koreanum Nakai);巫山淫羊藿(E. wushanense T. S. Ying)单独列为一个品种.此外,拟巫山淫羊藿(E. pseudowushanense B. L. Guo)被用作喘可治注射液的主要原料药材(广州方正药业有限公司)[94]. ...
... 淫羊藿黄酮类药效成分群的生物合成途径基本被解析(图7).其中,从苯丙氨酸到柚皮素的转化过程与典型的黄酮生物合成途径完全一致.例如:在箭叶淫羊藿中鉴定了苯丙氨酸解氨酶(EsPAL3)、肉桂酸-4-羟化酶(EsC4H)、4-香豆酰辅酶A连接酶(Es4CL)、查尔酮合酶(EsCHS)和查尔酮异构酶(EsCHI1)[94].柚皮素经黄烷酮3-羟化酶(EsF3H)和黄酮醇合酶(EsFLS)顺序催化C3羟基化以及C2和C3脱氢,形成山柰酚(kaempferol)[95-96];异戊烯基转移酶EsPT2可高效催化山柰酚C8位的异戊烯基化,生成8-异戊烯基山柰酚(8-isopentenyl kaempferol),转化率达到65%[97](图7).EsPT2也可催化山柰素的异戊烯基化,生成淫羊藿素(icaritin),然而转化率仅为8.0%(图7).这个结果表明:从山柰酚到淫羊藿素的转化过程是先在C8位异戊烯基化,后发生C4′位羟基的甲基化[97].目前,尚未鉴定出淫羊藿中催化8-异戊烯基山柰酚C4′位羟基甲基化的甲基转移酶.但是,发现大豆[Glycine max (L.) Merr.]中的GmOMT2[97]以及胡椒薄荷(Mentha×piperita Linnaeus)中的MpOMT4[96]具有上述催化活性.前者在pH为8.5时转化率最高(81.1%)[97];而后者在酸性条件下具有优良的催化活性,在酿酒酵母(pH 5.0~5.6)中对8-异戊烯基山柰酚的转化率达到76%[96].最后,淫羊藿素在多种糖基转移酶作用下,发生糖苷化.拟巫山淫羊藿中的糖基转移酶EpPF3RT具有显著的区域特异性和糖基供体特异性,仅能特异性地在8-异戊烯基山柰酚和淫羊藿素的C3位羟基引入鼠李糖,分别生成宝藿苷(baohuoside)Ⅱ和宝藿苷Ⅰ(图7)[98].Ep7GT在宝藿苷Ⅰ的C-7位羟基引入葡萄糖,生成淫羊藿苷(icariin)(图7).Ep7GT具有糖基供体多样性:以宝藿苷Ⅰ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-木糖、UDP-N-乙酰氨基葡萄糖和TDP-葡萄糖;以宝藿苷Ⅱ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-葡萄糖、UDP-木糖和UDP-N-乙酰氨基葡萄糖[99].巫山淫羊藿中的两个糖基转移酶EwGGTa和EwGGTb可分别催化淫羊藿苷C3位鼠李糖基进一步发生葡萄糖基化和木糖基化,生成朝藿定(epimedin)A和朝藿定B(图7)[100].目前,尚未表征在淫羊藿苷C3位鼠李糖基上进一步引入鼠李糖的糖基转移酶,该酶的发现是未来这类化合物途径解析研究的重点. ...
Investigation and analysis of soil physicochemical properties of Epimedium pseudowushanense growing regions
2
2017
... 除糖基化和羟基甲基化外,异戊烯基也是黄酮类化合物结构中常见的修饰基团.代表性的异戊烯基取代黄酮类药效成分如:淫羊藿中的淫羊藿素及其苷类化合物(朝藿定类黄酮苷) [93].淫羊藿的基原植物种类较多,《中国药典》(2020年版)收载的品种包括:小檗科植物淫羊藿(Epimedium brevicornu Maxim.)、柔毛淫羊藿(E. pubescens Maxim.)、箭叶淫羊藿(E. sagittatu Maxim.)和朝鲜淫羊藿(E. koreanum Nakai);巫山淫羊藿(E. wushanense T. S. Ying)单独列为一个品种.此外,拟巫山淫羊藿(E. pseudowushanense B. L. Guo)被用作喘可治注射液的主要原料药材(广州方正药业有限公司)[94]. ...
... 淫羊藿黄酮类药效成分群的生物合成途径基本被解析(图7).其中,从苯丙氨酸到柚皮素的转化过程与典型的黄酮生物合成途径完全一致.例如:在箭叶淫羊藿中鉴定了苯丙氨酸解氨酶(EsPAL3)、肉桂酸-4-羟化酶(EsC4H)、4-香豆酰辅酶A连接酶(Es4CL)、查尔酮合酶(EsCHS)和查尔酮异构酶(EsCHI1)[94].柚皮素经黄烷酮3-羟化酶(EsF3H)和黄酮醇合酶(EsFLS)顺序催化C3羟基化以及C2和C3脱氢,形成山柰酚(kaempferol)[95-96];异戊烯基转移酶EsPT2可高效催化山柰酚C8位的异戊烯基化,生成8-异戊烯基山柰酚(8-isopentenyl kaempferol),转化率达到65%[97](图7).EsPT2也可催化山柰素的异戊烯基化,生成淫羊藿素(icaritin),然而转化率仅为8.0%(图7).这个结果表明:从山柰酚到淫羊藿素的转化过程是先在C8位异戊烯基化,后发生C4′位羟基的甲基化[97].目前,尚未鉴定出淫羊藿中催化8-异戊烯基山柰酚C4′位羟基甲基化的甲基转移酶.但是,发现大豆[Glycine max (L.) Merr.]中的GmOMT2[97]以及胡椒薄荷(Mentha×piperita Linnaeus)中的MpOMT4[96]具有上述催化活性.前者在pH为8.5时转化率最高(81.1%)[97];而后者在酸性条件下具有优良的催化活性,在酿酒酵母(pH 5.0~5.6)中对8-异戊烯基山柰酚的转化率达到76%[96].最后,淫羊藿素在多种糖基转移酶作用下,发生糖苷化.拟巫山淫羊藿中的糖基转移酶EpPF3RT具有显著的区域特异性和糖基供体特异性,仅能特异性地在8-异戊烯基山柰酚和淫羊藿素的C3位羟基引入鼠李糖,分别生成宝藿苷(baohuoside)Ⅱ和宝藿苷Ⅰ(图7)[98].Ep7GT在宝藿苷Ⅰ的C-7位羟基引入葡萄糖,生成淫羊藿苷(icariin)(图7).Ep7GT具有糖基供体多样性:以宝藿苷Ⅰ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-木糖、UDP-N-乙酰氨基葡萄糖和TDP-葡萄糖;以宝藿苷Ⅱ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-葡萄糖、UDP-木糖和UDP-N-乙酰氨基葡萄糖[99].巫山淫羊藿中的两个糖基转移酶EwGGTa和EwGGTb可分别催化淫羊藿苷C3位鼠李糖基进一步发生葡萄糖基化和木糖基化,生成朝藿定(epimedin)A和朝藿定B(图7)[100].目前,尚未表征在淫羊藿苷C3位鼠李糖基上进一步引入鼠李糖的糖基转移酶,该酶的发现是未来这类化合物途径解析研究的重点. ...
Elucidating the biosynthetic and regulatory mechanisms of flavonoid-derived bioactive components in Epimedium sagittatum
1
2015
... 淫羊藿黄酮类药效成分群的生物合成途径基本被解析(图7).其中,从苯丙氨酸到柚皮素的转化过程与典型的黄酮生物合成途径完全一致.例如:在箭叶淫羊藿中鉴定了苯丙氨酸解氨酶(EsPAL3)、肉桂酸-4-羟化酶(EsC4H)、4-香豆酰辅酶A连接酶(Es4CL)、查尔酮合酶(EsCHS)和查尔酮异构酶(EsCHI1)[94].柚皮素经黄烷酮3-羟化酶(EsF3H)和黄酮醇合酶(EsFLS)顺序催化C3羟基化以及C2和C3脱氢,形成山柰酚(kaempferol)[95-96];异戊烯基转移酶EsPT2可高效催化山柰酚C8位的异戊烯基化,生成8-异戊烯基山柰酚(8-isopentenyl kaempferol),转化率达到65%[97](图7).EsPT2也可催化山柰素的异戊烯基化,生成淫羊藿素(icaritin),然而转化率仅为8.0%(图7).这个结果表明:从山柰酚到淫羊藿素的转化过程是先在C8位异戊烯基化,后发生C4′位羟基的甲基化[97].目前,尚未鉴定出淫羊藿中催化8-异戊烯基山柰酚C4′位羟基甲基化的甲基转移酶.但是,发现大豆[Glycine max (L.) Merr.]中的GmOMT2[97]以及胡椒薄荷(Mentha×piperita Linnaeus)中的MpOMT4[96]具有上述催化活性.前者在pH为8.5时转化率最高(81.1%)[97];而后者在酸性条件下具有优良的催化活性,在酿酒酵母(pH 5.0~5.6)中对8-异戊烯基山柰酚的转化率达到76%[96].最后,淫羊藿素在多种糖基转移酶作用下,发生糖苷化.拟巫山淫羊藿中的糖基转移酶EpPF3RT具有显著的区域特异性和糖基供体特异性,仅能特异性地在8-异戊烯基山柰酚和淫羊藿素的C3位羟基引入鼠李糖,分别生成宝藿苷(baohuoside)Ⅱ和宝藿苷Ⅰ(图7)[98].Ep7GT在宝藿苷Ⅰ的C-7位羟基引入葡萄糖,生成淫羊藿苷(icariin)(图7).Ep7GT具有糖基供体多样性:以宝藿苷Ⅰ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-木糖、UDP-N-乙酰氨基葡萄糖和TDP-葡萄糖;以宝藿苷Ⅱ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-葡萄糖、UDP-木糖和UDP-N-乙酰氨基葡萄糖[99].巫山淫羊藿中的两个糖基转移酶EwGGTa和EwGGTb可分别催化淫羊藿苷C3位鼠李糖基进一步发生葡萄糖基化和木糖基化,生成朝藿定(epimedin)A和朝藿定B(图7)[100].目前,尚未表征在淫羊藿苷C3位鼠李糖基上进一步引入鼠李糖的糖基转移酶,该酶的发现是未来这类化合物途径解析研究的重点. ...
De novo biosynthesis of anticarcinogenic icariin in engineered yeast
3
2023
... 淫羊藿黄酮类药效成分群的生物合成途径基本被解析(图7).其中,从苯丙氨酸到柚皮素的转化过程与典型的黄酮生物合成途径完全一致.例如:在箭叶淫羊藿中鉴定了苯丙氨酸解氨酶(EsPAL3)、肉桂酸-4-羟化酶(EsC4H)、4-香豆酰辅酶A连接酶(Es4CL)、查尔酮合酶(EsCHS)和查尔酮异构酶(EsCHI1)[94].柚皮素经黄烷酮3-羟化酶(EsF3H)和黄酮醇合酶(EsFLS)顺序催化C3羟基化以及C2和C3脱氢,形成山柰酚(kaempferol)[95-96];异戊烯基转移酶EsPT2可高效催化山柰酚C8位的异戊烯基化,生成8-异戊烯基山柰酚(8-isopentenyl kaempferol),转化率达到65%[97](图7).EsPT2也可催化山柰素的异戊烯基化,生成淫羊藿素(icaritin),然而转化率仅为8.0%(图7).这个结果表明:从山柰酚到淫羊藿素的转化过程是先在C8位异戊烯基化,后发生C4′位羟基的甲基化[97].目前,尚未鉴定出淫羊藿中催化8-异戊烯基山柰酚C4′位羟基甲基化的甲基转移酶.但是,发现大豆[Glycine max (L.) Merr.]中的GmOMT2[97]以及胡椒薄荷(Mentha×piperita Linnaeus)中的MpOMT4[96]具有上述催化活性.前者在pH为8.5时转化率最高(81.1%)[97];而后者在酸性条件下具有优良的催化活性,在酿酒酵母(pH 5.0~5.6)中对8-异戊烯基山柰酚的转化率达到76%[96].最后,淫羊藿素在多种糖基转移酶作用下,发生糖苷化.拟巫山淫羊藿中的糖基转移酶EpPF3RT具有显著的区域特异性和糖基供体特异性,仅能特异性地在8-异戊烯基山柰酚和淫羊藿素的C3位羟基引入鼠李糖,分别生成宝藿苷(baohuoside)Ⅱ和宝藿苷Ⅰ(图7)[98].Ep7GT在宝藿苷Ⅰ的C-7位羟基引入葡萄糖,生成淫羊藿苷(icariin)(图7).Ep7GT具有糖基供体多样性:以宝藿苷Ⅰ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-木糖、UDP-N-乙酰氨基葡萄糖和TDP-葡萄糖;以宝藿苷Ⅱ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-葡萄糖、UDP-木糖和UDP-N-乙酰氨基葡萄糖[99].巫山淫羊藿中的两个糖基转移酶EwGGTa和EwGGTb可分别催化淫羊藿苷C3位鼠李糖基进一步发生葡萄糖基化和木糖基化,生成朝藿定(epimedin)A和朝藿定B(图7)[100].目前,尚未表征在淫羊藿苷C3位鼠李糖基上进一步引入鼠李糖的糖基转移酶,该酶的发现是未来这类化合物途径解析研究的重点. ...
... [96]具有上述催化活性.前者在pH为8.5时转化率最高(81.1%)[97];而后者在酸性条件下具有优良的催化活性,在酿酒酵母(pH 5.0~5.6)中对8-异戊烯基山柰酚的转化率达到76%[96].最后,淫羊藿素在多种糖基转移酶作用下,发生糖苷化.拟巫山淫羊藿中的糖基转移酶EpPF3RT具有显著的区域特异性和糖基供体特异性,仅能特异性地在8-异戊烯基山柰酚和淫羊藿素的C3位羟基引入鼠李糖,分别生成宝藿苷(baohuoside)Ⅱ和宝藿苷Ⅰ(图7)[98].Ep7GT在宝藿苷Ⅰ的C-7位羟基引入葡萄糖,生成淫羊藿苷(icariin)(图7).Ep7GT具有糖基供体多样性:以宝藿苷Ⅰ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-木糖、UDP-N-乙酰氨基葡萄糖和TDP-葡萄糖;以宝藿苷Ⅱ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-葡萄糖、UDP-木糖和UDP-N-乙酰氨基葡萄糖[99].巫山淫羊藿中的两个糖基转移酶EwGGTa和EwGGTb可分别催化淫羊藿苷C3位鼠李糖基进一步发生葡萄糖基化和木糖基化,生成朝藿定(epimedin)A和朝藿定B(图7)[100].目前,尚未表征在淫羊藿苷C3位鼠李糖基上进一步引入鼠李糖的糖基转移酶,该酶的发现是未来这类化合物途径解析研究的重点. ...
... [96].最后,淫羊藿素在多种糖基转移酶作用下,发生糖苷化.拟巫山淫羊藿中的糖基转移酶EpPF3RT具有显著的区域特异性和糖基供体特异性,仅能特异性地在8-异戊烯基山柰酚和淫羊藿素的C3位羟基引入鼠李糖,分别生成宝藿苷(baohuoside)Ⅱ和宝藿苷Ⅰ(图7)[98].Ep7GT在宝藿苷Ⅰ的C-7位羟基引入葡萄糖,生成淫羊藿苷(icariin)(图7).Ep7GT具有糖基供体多样性:以宝藿苷Ⅰ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-木糖、UDP-N-乙酰氨基葡萄糖和TDP-葡萄糖;以宝藿苷Ⅱ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-葡萄糖、UDP-木糖和UDP-N-乙酰氨基葡萄糖[99].巫山淫羊藿中的两个糖基转移酶EwGGTa和EwGGTb可分别催化淫羊藿苷C3位鼠李糖基进一步发生葡萄糖基化和木糖基化,生成朝藿定(epimedin)A和朝藿定B(图7)[100].目前,尚未表征在淫羊藿苷C3位鼠李糖基上进一步引入鼠李糖的糖基转移酶,该酶的发现是未来这类化合物途径解析研究的重点. ...
Complete biosynthesis of the potential medicine icaritin by engineered Saccharomyces cerevisiae and Escherichia coli
4
2021
... 淫羊藿黄酮类药效成分群的生物合成途径基本被解析(图7).其中,从苯丙氨酸到柚皮素的转化过程与典型的黄酮生物合成途径完全一致.例如:在箭叶淫羊藿中鉴定了苯丙氨酸解氨酶(EsPAL3)、肉桂酸-4-羟化酶(EsC4H)、4-香豆酰辅酶A连接酶(Es4CL)、查尔酮合酶(EsCHS)和查尔酮异构酶(EsCHI1)[94].柚皮素经黄烷酮3-羟化酶(EsF3H)和黄酮醇合酶(EsFLS)顺序催化C3羟基化以及C2和C3脱氢,形成山柰酚(kaempferol)[95-96];异戊烯基转移酶EsPT2可高效催化山柰酚C8位的异戊烯基化,生成8-异戊烯基山柰酚(8-isopentenyl kaempferol),转化率达到65%[97](图7).EsPT2也可催化山柰素的异戊烯基化,生成淫羊藿素(icaritin),然而转化率仅为8.0%(图7).这个结果表明:从山柰酚到淫羊藿素的转化过程是先在C8位异戊烯基化,后发生C4′位羟基的甲基化[97].目前,尚未鉴定出淫羊藿中催化8-异戊烯基山柰酚C4′位羟基甲基化的甲基转移酶.但是,发现大豆[Glycine max (L.) Merr.]中的GmOMT2[97]以及胡椒薄荷(Mentha×piperita Linnaeus)中的MpOMT4[96]具有上述催化活性.前者在pH为8.5时转化率最高(81.1%)[97];而后者在酸性条件下具有优良的催化活性,在酿酒酵母(pH 5.0~5.6)中对8-异戊烯基山柰酚的转化率达到76%[96].最后,淫羊藿素在多种糖基转移酶作用下,发生糖苷化.拟巫山淫羊藿中的糖基转移酶EpPF3RT具有显著的区域特异性和糖基供体特异性,仅能特异性地在8-异戊烯基山柰酚和淫羊藿素的C3位羟基引入鼠李糖,分别生成宝藿苷(baohuoside)Ⅱ和宝藿苷Ⅰ(图7)[98].Ep7GT在宝藿苷Ⅰ的C-7位羟基引入葡萄糖,生成淫羊藿苷(icariin)(图7).Ep7GT具有糖基供体多样性:以宝藿苷Ⅰ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-木糖、UDP-N-乙酰氨基葡萄糖和TDP-葡萄糖;以宝藿苷Ⅱ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-葡萄糖、UDP-木糖和UDP-N-乙酰氨基葡萄糖[99].巫山淫羊藿中的两个糖基转移酶EwGGTa和EwGGTb可分别催化淫羊藿苷C3位鼠李糖基进一步发生葡萄糖基化和木糖基化,生成朝藿定(epimedin)A和朝藿定B(图7)[100].目前,尚未表征在淫羊藿苷C3位鼠李糖基上进一步引入鼠李糖的糖基转移酶,该酶的发现是未来这类化合物途径解析研究的重点. ...
... [97].目前,尚未鉴定出淫羊藿中催化8-异戊烯基山柰酚C4′位羟基甲基化的甲基转移酶.但是,发现大豆[Glycine max (L.) Merr.]中的GmOMT2[97]以及胡椒薄荷(Mentha×piperita Linnaeus)中的MpOMT4[96]具有上述催化活性.前者在pH为8.5时转化率最高(81.1%)[97];而后者在酸性条件下具有优良的催化活性,在酿酒酵母(pH 5.0~5.6)中对8-异戊烯基山柰酚的转化率达到76%[96].最后,淫羊藿素在多种糖基转移酶作用下,发生糖苷化.拟巫山淫羊藿中的糖基转移酶EpPF3RT具有显著的区域特异性和糖基供体特异性,仅能特异性地在8-异戊烯基山柰酚和淫羊藿素的C3位羟基引入鼠李糖,分别生成宝藿苷(baohuoside)Ⅱ和宝藿苷Ⅰ(图7)[98].Ep7GT在宝藿苷Ⅰ的C-7位羟基引入葡萄糖,生成淫羊藿苷(icariin)(图7).Ep7GT具有糖基供体多样性:以宝藿苷Ⅰ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-木糖、UDP-N-乙酰氨基葡萄糖和TDP-葡萄糖;以宝藿苷Ⅱ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-葡萄糖、UDP-木糖和UDP-N-乙酰氨基葡萄糖[99].巫山淫羊藿中的两个糖基转移酶EwGGTa和EwGGTb可分别催化淫羊藿苷C3位鼠李糖基进一步发生葡萄糖基化和木糖基化,生成朝藿定(epimedin)A和朝藿定B(图7)[100].目前,尚未表征在淫羊藿苷C3位鼠李糖基上进一步引入鼠李糖的糖基转移酶,该酶的发现是未来这类化合物途径解析研究的重点. ...
... [97]以及胡椒薄荷(Mentha×piperita Linnaeus)中的MpOMT4[96]具有上述催化活性.前者在pH为8.5时转化率最高(81.1%)[97];而后者在酸性条件下具有优良的催化活性,在酿酒酵母(pH 5.0~5.6)中对8-异戊烯基山柰酚的转化率达到76%[96].最后,淫羊藿素在多种糖基转移酶作用下,发生糖苷化.拟巫山淫羊藿中的糖基转移酶EpPF3RT具有显著的区域特异性和糖基供体特异性,仅能特异性地在8-异戊烯基山柰酚和淫羊藿素的C3位羟基引入鼠李糖,分别生成宝藿苷(baohuoside)Ⅱ和宝藿苷Ⅰ(图7)[98].Ep7GT在宝藿苷Ⅰ的C-7位羟基引入葡萄糖,生成淫羊藿苷(icariin)(图7).Ep7GT具有糖基供体多样性:以宝藿苷Ⅰ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-木糖、UDP-N-乙酰氨基葡萄糖和TDP-葡萄糖;以宝藿苷Ⅱ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-葡萄糖、UDP-木糖和UDP-N-乙酰氨基葡萄糖[99].巫山淫羊藿中的两个糖基转移酶EwGGTa和EwGGTb可分别催化淫羊藿苷C3位鼠李糖基进一步发生葡萄糖基化和木糖基化,生成朝藿定(epimedin)A和朝藿定B(图7)[100].目前,尚未表征在淫羊藿苷C3位鼠李糖基上进一步引入鼠李糖的糖基转移酶,该酶的发现是未来这类化合物途径解析研究的重点. ...
... [97];而后者在酸性条件下具有优良的催化活性,在酿酒酵母(pH 5.0~5.6)中对8-异戊烯基山柰酚的转化率达到76%[96].最后,淫羊藿素在多种糖基转移酶作用下,发生糖苷化.拟巫山淫羊藿中的糖基转移酶EpPF3RT具有显著的区域特异性和糖基供体特异性,仅能特异性地在8-异戊烯基山柰酚和淫羊藿素的C3位羟基引入鼠李糖,分别生成宝藿苷(baohuoside)Ⅱ和宝藿苷Ⅰ(图7)[98].Ep7GT在宝藿苷Ⅰ的C-7位羟基引入葡萄糖,生成淫羊藿苷(icariin)(图7).Ep7GT具有糖基供体多样性:以宝藿苷Ⅰ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-木糖、UDP-N-乙酰氨基葡萄糖和TDP-葡萄糖;以宝藿苷Ⅱ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-葡萄糖、UDP-木糖和UDP-N-乙酰氨基葡萄糖[99].巫山淫羊藿中的两个糖基转移酶EwGGTa和EwGGTb可分别催化淫羊藿苷C3位鼠李糖基进一步发生葡萄糖基化和木糖基化,生成朝藿定(epimedin)A和朝藿定B(图7)[100].目前,尚未表征在淫羊藿苷C3位鼠李糖基上进一步引入鼠李糖的糖基转移酶,该酶的发现是未来这类化合物途径解析研究的重点. ...
A regiospecific rhamnosyltransferase from Epimedium pseudowushanense catalyzes the 3-O-rhamnosylation of prenylflavonols
1
2018
... 淫羊藿黄酮类药效成分群的生物合成途径基本被解析(图7).其中,从苯丙氨酸到柚皮素的转化过程与典型的黄酮生物合成途径完全一致.例如:在箭叶淫羊藿中鉴定了苯丙氨酸解氨酶(EsPAL3)、肉桂酸-4-羟化酶(EsC4H)、4-香豆酰辅酶A连接酶(Es4CL)、查尔酮合酶(EsCHS)和查尔酮异构酶(EsCHI1)[94].柚皮素经黄烷酮3-羟化酶(EsF3H)和黄酮醇合酶(EsFLS)顺序催化C3羟基化以及C2和C3脱氢,形成山柰酚(kaempferol)[95-96];异戊烯基转移酶EsPT2可高效催化山柰酚C8位的异戊烯基化,生成8-异戊烯基山柰酚(8-isopentenyl kaempferol),转化率达到65%[97](图7).EsPT2也可催化山柰素的异戊烯基化,生成淫羊藿素(icaritin),然而转化率仅为8.0%(图7).这个结果表明:从山柰酚到淫羊藿素的转化过程是先在C8位异戊烯基化,后发生C4′位羟基的甲基化[97].目前,尚未鉴定出淫羊藿中催化8-异戊烯基山柰酚C4′位羟基甲基化的甲基转移酶.但是,发现大豆[Glycine max (L.) Merr.]中的GmOMT2[97]以及胡椒薄荷(Mentha×piperita Linnaeus)中的MpOMT4[96]具有上述催化活性.前者在pH为8.5时转化率最高(81.1%)[97];而后者在酸性条件下具有优良的催化活性,在酿酒酵母(pH 5.0~5.6)中对8-异戊烯基山柰酚的转化率达到76%[96].最后,淫羊藿素在多种糖基转移酶作用下,发生糖苷化.拟巫山淫羊藿中的糖基转移酶EpPF3RT具有显著的区域特异性和糖基供体特异性,仅能特异性地在8-异戊烯基山柰酚和淫羊藿素的C3位羟基引入鼠李糖,分别生成宝藿苷(baohuoside)Ⅱ和宝藿苷Ⅰ(图7)[98].Ep7GT在宝藿苷Ⅰ的C-7位羟基引入葡萄糖,生成淫羊藿苷(icariin)(图7).Ep7GT具有糖基供体多样性:以宝藿苷Ⅰ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-木糖、UDP-N-乙酰氨基葡萄糖和TDP-葡萄糖;以宝藿苷Ⅱ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-葡萄糖、UDP-木糖和UDP-N-乙酰氨基葡萄糖[99].巫山淫羊藿中的两个糖基转移酶EwGGTa和EwGGTb可分别催化淫羊藿苷C3位鼠李糖基进一步发生葡萄糖基化和木糖基化,生成朝藿定(epimedin)A和朝藿定B(图7)[100].目前,尚未表征在淫羊藿苷C3位鼠李糖基上进一步引入鼠李糖的糖基转移酶,该酶的发现是未来这类化合物途径解析研究的重点. ...
Ep7GT, a glycosyltransferase with sugar donor flexibility from Epimedium pseudowushanense, catalyzes the 7-O-glycosylation of baohuoside
1
2019
... 淫羊藿黄酮类药效成分群的生物合成途径基本被解析(图7).其中,从苯丙氨酸到柚皮素的转化过程与典型的黄酮生物合成途径完全一致.例如:在箭叶淫羊藿中鉴定了苯丙氨酸解氨酶(EsPAL3)、肉桂酸-4-羟化酶(EsC4H)、4-香豆酰辅酶A连接酶(Es4CL)、查尔酮合酶(EsCHS)和查尔酮异构酶(EsCHI1)[94].柚皮素经黄烷酮3-羟化酶(EsF3H)和黄酮醇合酶(EsFLS)顺序催化C3羟基化以及C2和C3脱氢,形成山柰酚(kaempferol)[95-96];异戊烯基转移酶EsPT2可高效催化山柰酚C8位的异戊烯基化,生成8-异戊烯基山柰酚(8-isopentenyl kaempferol),转化率达到65%[97](图7).EsPT2也可催化山柰素的异戊烯基化,生成淫羊藿素(icaritin),然而转化率仅为8.0%(图7).这个结果表明:从山柰酚到淫羊藿素的转化过程是先在C8位异戊烯基化,后发生C4′位羟基的甲基化[97].目前,尚未鉴定出淫羊藿中催化8-异戊烯基山柰酚C4′位羟基甲基化的甲基转移酶.但是,发现大豆[Glycine max (L.) Merr.]中的GmOMT2[97]以及胡椒薄荷(Mentha×piperita Linnaeus)中的MpOMT4[96]具有上述催化活性.前者在pH为8.5时转化率最高(81.1%)[97];而后者在酸性条件下具有优良的催化活性,在酿酒酵母(pH 5.0~5.6)中对8-异戊烯基山柰酚的转化率达到76%[96].最后,淫羊藿素在多种糖基转移酶作用下,发生糖苷化.拟巫山淫羊藿中的糖基转移酶EpPF3RT具有显著的区域特异性和糖基供体特异性,仅能特异性地在8-异戊烯基山柰酚和淫羊藿素的C3位羟基引入鼠李糖,分别生成宝藿苷(baohuoside)Ⅱ和宝藿苷Ⅰ(图7)[98].Ep7GT在宝藿苷Ⅰ的C-7位羟基引入葡萄糖,生成淫羊藿苷(icariin)(图7).Ep7GT具有糖基供体多样性:以宝藿苷Ⅰ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-木糖、UDP-N-乙酰氨基葡萄糖和TDP-葡萄糖;以宝藿苷Ⅱ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-葡萄糖、UDP-木糖和UDP-N-乙酰氨基葡萄糖[99].巫山淫羊藿中的两个糖基转移酶EwGGTa和EwGGTb可分别催化淫羊藿苷C3位鼠李糖基进一步发生葡萄糖基化和木糖基化,生成朝藿定(epimedin)A和朝藿定B(图7)[100].目前,尚未表征在淫羊藿苷C3位鼠李糖基上进一步引入鼠李糖的糖基转移酶,该酶的发现是未来这类化合物途径解析研究的重点. ...
朝藿定合成用糖苷糖基转移酶及其编码基因和应用
1
... 淫羊藿黄酮类药效成分群的生物合成途径基本被解析(图7).其中,从苯丙氨酸到柚皮素的转化过程与典型的黄酮生物合成途径完全一致.例如:在箭叶淫羊藿中鉴定了苯丙氨酸解氨酶(EsPAL3)、肉桂酸-4-羟化酶(EsC4H)、4-香豆酰辅酶A连接酶(Es4CL)、查尔酮合酶(EsCHS)和查尔酮异构酶(EsCHI1)[94].柚皮素经黄烷酮3-羟化酶(EsF3H)和黄酮醇合酶(EsFLS)顺序催化C3羟基化以及C2和C3脱氢,形成山柰酚(kaempferol)[95-96];异戊烯基转移酶EsPT2可高效催化山柰酚C8位的异戊烯基化,生成8-异戊烯基山柰酚(8-isopentenyl kaempferol),转化率达到65%[97](图7).EsPT2也可催化山柰素的异戊烯基化,生成淫羊藿素(icaritin),然而转化率仅为8.0%(图7).这个结果表明:从山柰酚到淫羊藿素的转化过程是先在C8位异戊烯基化,后发生C4′位羟基的甲基化[97].目前,尚未鉴定出淫羊藿中催化8-异戊烯基山柰酚C4′位羟基甲基化的甲基转移酶.但是,发现大豆[Glycine max (L.) Merr.]中的GmOMT2[97]以及胡椒薄荷(Mentha×piperita Linnaeus)中的MpOMT4[96]具有上述催化活性.前者在pH为8.5时转化率最高(81.1%)[97];而后者在酸性条件下具有优良的催化活性,在酿酒酵母(pH 5.0~5.6)中对8-异戊烯基山柰酚的转化率达到76%[96].最后,淫羊藿素在多种糖基转移酶作用下,发生糖苷化.拟巫山淫羊藿中的糖基转移酶EpPF3RT具有显著的区域特异性和糖基供体特异性,仅能特异性地在8-异戊烯基山柰酚和淫羊藿素的C3位羟基引入鼠李糖,分别生成宝藿苷(baohuoside)Ⅱ和宝藿苷Ⅰ(图7)[98].Ep7GT在宝藿苷Ⅰ的C-7位羟基引入葡萄糖,生成淫羊藿苷(icariin)(图7).Ep7GT具有糖基供体多样性:以宝藿苷Ⅰ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-木糖、UDP-N-乙酰氨基葡萄糖和TDP-葡萄糖;以宝藿苷Ⅱ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-葡萄糖、UDP-木糖和UDP-N-乙酰氨基葡萄糖[99].巫山淫羊藿中的两个糖基转移酶EwGGTa和EwGGTb可分别催化淫羊藿苷C3位鼠李糖基进一步发生葡萄糖基化和木糖基化,生成朝藿定(epimedin)A和朝藿定B(图7)[100].目前,尚未表征在淫羊藿苷C3位鼠李糖基上进一步引入鼠李糖的糖基转移酶,该酶的发现是未来这类化合物途径解析研究的重点. ...
Glycoside glycosyltransferase and its coding gene for the synthesis of epimedins and its application
1
... 淫羊藿黄酮类药效成分群的生物合成途径基本被解析(图7).其中,从苯丙氨酸到柚皮素的转化过程与典型的黄酮生物合成途径完全一致.例如:在箭叶淫羊藿中鉴定了苯丙氨酸解氨酶(EsPAL3)、肉桂酸-4-羟化酶(EsC4H)、4-香豆酰辅酶A连接酶(Es4CL)、查尔酮合酶(EsCHS)和查尔酮异构酶(EsCHI1)[94].柚皮素经黄烷酮3-羟化酶(EsF3H)和黄酮醇合酶(EsFLS)顺序催化C3羟基化以及C2和C3脱氢,形成山柰酚(kaempferol)[95-96];异戊烯基转移酶EsPT2可高效催化山柰酚C8位的异戊烯基化,生成8-异戊烯基山柰酚(8-isopentenyl kaempferol),转化率达到65%[97](图7).EsPT2也可催化山柰素的异戊烯基化,生成淫羊藿素(icaritin),然而转化率仅为8.0%(图7).这个结果表明:从山柰酚到淫羊藿素的转化过程是先在C8位异戊烯基化,后发生C4′位羟基的甲基化[97].目前,尚未鉴定出淫羊藿中催化8-异戊烯基山柰酚C4′位羟基甲基化的甲基转移酶.但是,发现大豆[Glycine max (L.) Merr.]中的GmOMT2[97]以及胡椒薄荷(Mentha×piperita Linnaeus)中的MpOMT4[96]具有上述催化活性.前者在pH为8.5时转化率最高(81.1%)[97];而后者在酸性条件下具有优良的催化活性,在酿酒酵母(pH 5.0~5.6)中对8-异戊烯基山柰酚的转化率达到76%[96].最后,淫羊藿素在多种糖基转移酶作用下,发生糖苷化.拟巫山淫羊藿中的糖基转移酶EpPF3RT具有显著的区域特异性和糖基供体特异性,仅能特异性地在8-异戊烯基山柰酚和淫羊藿素的C3位羟基引入鼠李糖,分别生成宝藿苷(baohuoside)Ⅱ和宝藿苷Ⅰ(图7)[98].Ep7GT在宝藿苷Ⅰ的C-7位羟基引入葡萄糖,生成淫羊藿苷(icariin)(图7).Ep7GT具有糖基供体多样性:以宝藿苷Ⅰ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-木糖、UDP-N-乙酰氨基葡萄糖和TDP-葡萄糖;以宝藿苷Ⅱ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-葡萄糖、UDP-木糖和UDP-N-乙酰氨基葡萄糖[99].巫山淫羊藿中的两个糖基转移酶EwGGTa和EwGGTb可分别催化淫羊藿苷C3位鼠李糖基进一步发生葡萄糖基化和木糖基化,生成朝藿定(epimedin)A和朝藿定B(图7)[100].目前,尚未表征在淫羊藿苷C3位鼠李糖基上进一步引入鼠李糖的糖基转移酶,该酶的发现是未来这类化合物途径解析研究的重点. ...
Recent advances in research on lignans and neolignans
1
2016
... 木脂素是一类具有两个C6-C3单元的化合物,主要通过肉桂酸途径合成[101].两个单元多通过C8和C8′相连,也存在二聚体和三聚体等化合物.木脂素类化合物是板蓝根、连翘以及五味子等多种常见中药材的重要药效成分.其中,板蓝根木脂素类成分的生物合成研究较为深入. ...
Isatis indigotica: a review of phytochemistry, pharmacological activities and clinical applications
1
2021
... 板蓝根是菘蓝(Isatis indigotica Fortune)的干燥根,具有清热解毒、凉血利咽的功效,临床上常用于治疗流行性感冒和病毒性感染等[102].研究表明,板蓝根抗病毒的药效成分为木脂素类化合物,主要包括:落叶松脂醇(lariciresinol)、开环异落叶松脂醇(secoisolariciresinol)、落叶松脂醇苷以及直铁线莲宁B(clemastanin B)等.目前,已经基本解析了这些成分的生物合成途径(图8).与典型黄酮生物合成途径的前两步相同,苯丙氨酸在苯丙氨酸解氨酶(IiPAL1和IiPAL2)和肉桂酸-4-羟化酶(IiC4H)催化下生成4-香豆酸(图8)[103].在菘蓝中,4-香豆酸可经过两条路径生成松柏醛.第一条路径:在4-香豆酰辅酶A连接酶(Ii4CL2)催化下,得到4-香豆酰辅酶A;4-香豆酰辅酶A在羟基肉桂酰转移酶(IiHCT)和香豆酸-3-羟化酶(IiC3H)催化下,经中间体4-香豆酰莽草酸酯,生成咖啡酰辅酶A(caffeoyl CoA);咖啡酰辅酶A氧甲基转移酶(IiCCoAOMT)和肉桂酰辅酶A还原酶(IiCCR)顺序催化羟基甲基化和还原反应,生成松柏醛(coniferaldehyde)(图8)[103].在第二条途径中,首先IiC3H羟基化4-香豆酸,得到咖啡酸;然后在Ii4CL2/3以及IiCCoAOMT的催化下,与辅酶A连接并甲基化得到阿魏酰辅酶A;IiCCR催化阿魏酰辅酶A的还原,生成松柏醛(图8)[103].除以上两条途径外,在大多数植物中还存在第三条合成松柏醛的途径:首先在咖啡酸氧甲基转移酶(COMT)的催化下,咖啡酸转化为阿魏酸,进一步在4CL的催化下连接辅酶A生成阿魏酰辅酶A;最后CCR催化阿魏酰辅酶A还原,生成松柏醛[103-104].由于目前未从菘蓝中发现COMT,因此是否存在这条路径尚不确定.松柏醛经肉桂醇脱氢酶(IiCAD)氧化,生成木脂素的关键前体化合物松柏醇(coniferyl alcohol)[103].2分子松柏醇通过自由基偶联反应生成第一个具有木脂素骨架的化合物松脂醇(pinoresinol),这步反应被认为由过氧化物酶或漆酶催化完成,dirigent蛋白可保证反应的立体选择性[105].陈瑞兵等[106]从菘蓝转录组中鉴定了19条dirigent蛋白编码基因,在菘蓝毛状根中过表达这些基因,发现IiDIR1和IiDIR2的表达选择性地促进(-)-松脂醇合成,证明了这两个酶在立体选择性控制方面的重要作用.松脂醇/落叶松脂醇还原酶(IiPLR1)连续催化松脂醇的C7-O-C9′和C7′-O-C9醚键的开裂,生成落叶松脂醇(lariciresinol)和开环异落叶松脂醇(secoisolariciresinol)(图8).IiPLR1和AtPrR1(拟南芥的松脂醇还原酶)均为首尾连接的同源二聚体[107].通过两种酶结构的比较分析,揭示了IiPLR1的催化机制[107].IiPLR1催化松脂醇向开环异落叶松脂醇转化的过程包括:松脂醇的结合、落叶松脂醇的生成、落叶松脂醇的释放、落叶松脂醇的结合以及开环异落叶松脂醇的生成.即落叶松脂醇生成后并未立刻继续开环生成开环异落叶松脂醇,而是经历了释放-再结合的过程.相对于IiPLR1,AtPrR1的底物结合口袋空间更小并且底物的进入被更严格地控制,因此阻碍了释放出的落叶松脂醇再次进入活性口袋,不能进一步开环生成开环异落叶松脂醇.两种酶中的β4 loop在底物/产物以及辅因子NADPH/NADP+的结合与释放中发挥了关键作用.具体来讲,β4 loop负责招募NADPH,并且在底物结合后覆盖底物结合槽.β4 loop上的98位氨基酸残基显著影响β4 loop的摆动,从而与底物的选择性密切相关.当把AtPrR1中体积较大的N98突变为体积较小的S98(与IiPLR1相同)后,AtPrR1N98S可产生开环异落叶松脂醇.目前,从菘蓝中表征了四个与木脂素苷生物合成相关的糖基转移酶.其中,IiUGT1是糖基化松脂醇的主要糖基转移酶,可产生松脂醇-4-O-葡萄糖苷(pinoresinol-4-O-glucoside)和松脂醇-4,4′-O-二葡萄糖苷(pinoresinol-4,4′-O-diglucoside)(图8)[108];IiUGT71B5a和IiUGT71B5b同样具有糖基化松脂醇的功能,前者产生松脂醇-4-O-葡萄糖苷和松脂醇-4,4′-O-二葡萄糖苷,后者仅能产生松脂醇-4-O-葡萄糖苷(图8)[109];IiUGT4负责落叶松脂醇的糖基化,可产生落叶松脂醇-4-O-葡萄糖苷(lariciresinol-4-O-glucoside)、落叶松脂醇-4′-O-葡萄糖苷(lariciresinol-4′-O-glucoside)和直铁线莲宁B[108](图8). ...
Isatis indigotica: from (ethno) botany, biochemistry to synthetic biology
5
2021
... 板蓝根是菘蓝(Isatis indigotica Fortune)的干燥根,具有清热解毒、凉血利咽的功效,临床上常用于治疗流行性感冒和病毒性感染等[102].研究表明,板蓝根抗病毒的药效成分为木脂素类化合物,主要包括:落叶松脂醇(lariciresinol)、开环异落叶松脂醇(secoisolariciresinol)、落叶松脂醇苷以及直铁线莲宁B(clemastanin B)等.目前,已经基本解析了这些成分的生物合成途径(图8).与典型黄酮生物合成途径的前两步相同,苯丙氨酸在苯丙氨酸解氨酶(IiPAL1和IiPAL2)和肉桂酸-4-羟化酶(IiC4H)催化下生成4-香豆酸(图8)[103].在菘蓝中,4-香豆酸可经过两条路径生成松柏醛.第一条路径:在4-香豆酰辅酶A连接酶(Ii4CL2)催化下,得到4-香豆酰辅酶A;4-香豆酰辅酶A在羟基肉桂酰转移酶(IiHCT)和香豆酸-3-羟化酶(IiC3H)催化下,经中间体4-香豆酰莽草酸酯,生成咖啡酰辅酶A(caffeoyl CoA);咖啡酰辅酶A氧甲基转移酶(IiCCoAOMT)和肉桂酰辅酶A还原酶(IiCCR)顺序催化羟基甲基化和还原反应,生成松柏醛(coniferaldehyde)(图8)[103].在第二条途径中,首先IiC3H羟基化4-香豆酸,得到咖啡酸;然后在Ii4CL2/3以及IiCCoAOMT的催化下,与辅酶A连接并甲基化得到阿魏酰辅酶A;IiCCR催化阿魏酰辅酶A的还原,生成松柏醛(图8)[103].除以上两条途径外,在大多数植物中还存在第三条合成松柏醛的途径:首先在咖啡酸氧甲基转移酶(COMT)的催化下,咖啡酸转化为阿魏酸,进一步在4CL的催化下连接辅酶A生成阿魏酰辅酶A;最后CCR催化阿魏酰辅酶A还原,生成松柏醛[103-104].由于目前未从菘蓝中发现COMT,因此是否存在这条路径尚不确定.松柏醛经肉桂醇脱氢酶(IiCAD)氧化,生成木脂素的关键前体化合物松柏醇(coniferyl alcohol)[103].2分子松柏醇通过自由基偶联反应生成第一个具有木脂素骨架的化合物松脂醇(pinoresinol),这步反应被认为由过氧化物酶或漆酶催化完成,dirigent蛋白可保证反应的立体选择性[105].陈瑞兵等[106]从菘蓝转录组中鉴定了19条dirigent蛋白编码基因,在菘蓝毛状根中过表达这些基因,发现IiDIR1和IiDIR2的表达选择性地促进(-)-松脂醇合成,证明了这两个酶在立体选择性控制方面的重要作用.松脂醇/落叶松脂醇还原酶(IiPLR1)连续催化松脂醇的C7-O-C9′和C7′-O-C9醚键的开裂,生成落叶松脂醇(lariciresinol)和开环异落叶松脂醇(secoisolariciresinol)(图8).IiPLR1和AtPrR1(拟南芥的松脂醇还原酶)均为首尾连接的同源二聚体[107].通过两种酶结构的比较分析,揭示了IiPLR1的催化机制[107].IiPLR1催化松脂醇向开环异落叶松脂醇转化的过程包括:松脂醇的结合、落叶松脂醇的生成、落叶松脂醇的释放、落叶松脂醇的结合以及开环异落叶松脂醇的生成.即落叶松脂醇生成后并未立刻继续开环生成开环异落叶松脂醇,而是经历了释放-再结合的过程.相对于IiPLR1,AtPrR1的底物结合口袋空间更小并且底物的进入被更严格地控制,因此阻碍了释放出的落叶松脂醇再次进入活性口袋,不能进一步开环生成开环异落叶松脂醇.两种酶中的β4 loop在底物/产物以及辅因子NADPH/NADP+的结合与释放中发挥了关键作用.具体来讲,β4 loop负责招募NADPH,并且在底物结合后覆盖底物结合槽.β4 loop上的98位氨基酸残基显著影响β4 loop的摆动,从而与底物的选择性密切相关.当把AtPrR1中体积较大的N98突变为体积较小的S98(与IiPLR1相同)后,AtPrR1N98S可产生开环异落叶松脂醇.目前,从菘蓝中表征了四个与木脂素苷生物合成相关的糖基转移酶.其中,IiUGT1是糖基化松脂醇的主要糖基转移酶,可产生松脂醇-4-O-葡萄糖苷(pinoresinol-4-O-glucoside)和松脂醇-4,4′-O-二葡萄糖苷(pinoresinol-4,4′-O-diglucoside)(图8)[108];IiUGT71B5a和IiUGT71B5b同样具有糖基化松脂醇的功能,前者产生松脂醇-4-O-葡萄糖苷和松脂醇-4,4′-O-二葡萄糖苷,后者仅能产生松脂醇-4-O-葡萄糖苷(图8)[109];IiUGT4负责落叶松脂醇的糖基化,可产生落叶松脂醇-4-O-葡萄糖苷(lariciresinol-4-O-glucoside)、落叶松脂醇-4′-O-葡萄糖苷(lariciresinol-4′-O-glucoside)和直铁线莲宁B[108](图8). ...
... [103].在第二条途径中,首先IiC3H羟基化4-香豆酸,得到咖啡酸;然后在Ii4CL2/3以及IiCCoAOMT的催化下,与辅酶A连接并甲基化得到阿魏酰辅酶A;IiCCR催化阿魏酰辅酶A的还原,生成松柏醛(图8)[103].除以上两条途径外,在大多数植物中还存在第三条合成松柏醛的途径:首先在咖啡酸氧甲基转移酶(COMT)的催化下,咖啡酸转化为阿魏酸,进一步在4CL的催化下连接辅酶A生成阿魏酰辅酶A;最后CCR催化阿魏酰辅酶A还原,生成松柏醛[103-104].由于目前未从菘蓝中发现COMT,因此是否存在这条路径尚不确定.松柏醛经肉桂醇脱氢酶(IiCAD)氧化,生成木脂素的关键前体化合物松柏醇(coniferyl alcohol)[103].2分子松柏醇通过自由基偶联反应生成第一个具有木脂素骨架的化合物松脂醇(pinoresinol),这步反应被认为由过氧化物酶或漆酶催化完成,dirigent蛋白可保证反应的立体选择性[105].陈瑞兵等[106]从菘蓝转录组中鉴定了19条dirigent蛋白编码基因,在菘蓝毛状根中过表达这些基因,发现IiDIR1和IiDIR2的表达选择性地促进(-)-松脂醇合成,证明了这两个酶在立体选择性控制方面的重要作用.松脂醇/落叶松脂醇还原酶(IiPLR1)连续催化松脂醇的C7-O-C9′和C7′-O-C9醚键的开裂,生成落叶松脂醇(lariciresinol)和开环异落叶松脂醇(secoisolariciresinol)(图8).IiPLR1和AtPrR1(拟南芥的松脂醇还原酶)均为首尾连接的同源二聚体[107].通过两种酶结构的比较分析,揭示了IiPLR1的催化机制[107].IiPLR1催化松脂醇向开环异落叶松脂醇转化的过程包括:松脂醇的结合、落叶松脂醇的生成、落叶松脂醇的释放、落叶松脂醇的结合以及开环异落叶松脂醇的生成.即落叶松脂醇生成后并未立刻继续开环生成开环异落叶松脂醇,而是经历了释放-再结合的过程.相对于IiPLR1,AtPrR1的底物结合口袋空间更小并且底物的进入被更严格地控制,因此阻碍了释放出的落叶松脂醇再次进入活性口袋,不能进一步开环生成开环异落叶松脂醇.两种酶中的β4 loop在底物/产物以及辅因子NADPH/NADP+的结合与释放中发挥了关键作用.具体来讲,β4 loop负责招募NADPH,并且在底物结合后覆盖底物结合槽.β4 loop上的98位氨基酸残基显著影响β4 loop的摆动,从而与底物的选择性密切相关.当把AtPrR1中体积较大的N98突变为体积较小的S98(与IiPLR1相同)后,AtPrR1N98S可产生开环异落叶松脂醇.目前,从菘蓝中表征了四个与木脂素苷生物合成相关的糖基转移酶.其中,IiUGT1是糖基化松脂醇的主要糖基转移酶,可产生松脂醇-4-O-葡萄糖苷(pinoresinol-4-O-glucoside)和松脂醇-4,4′-O-二葡萄糖苷(pinoresinol-4,4′-O-diglucoside)(图8)[108];IiUGT71B5a和IiUGT71B5b同样具有糖基化松脂醇的功能,前者产生松脂醇-4-O-葡萄糖苷和松脂醇-4,4′-O-二葡萄糖苷,后者仅能产生松脂醇-4-O-葡萄糖苷(图8)[109];IiUGT4负责落叶松脂醇的糖基化,可产生落叶松脂醇-4-O-葡萄糖苷(lariciresinol-4-O-glucoside)、落叶松脂醇-4′-O-葡萄糖苷(lariciresinol-4′-O-glucoside)和直铁线莲宁B[108](图8). ...
... [103].除以上两条途径外,在大多数植物中还存在第三条合成松柏醛的途径:首先在咖啡酸氧甲基转移酶(COMT)的催化下,咖啡酸转化为阿魏酸,进一步在4CL的催化下连接辅酶A生成阿魏酰辅酶A;最后CCR催化阿魏酰辅酶A还原,生成松柏醛[103-104].由于目前未从菘蓝中发现COMT,因此是否存在这条路径尚不确定.松柏醛经肉桂醇脱氢酶(IiCAD)氧化,生成木脂素的关键前体化合物松柏醇(coniferyl alcohol)[103].2分子松柏醇通过自由基偶联反应生成第一个具有木脂素骨架的化合物松脂醇(pinoresinol),这步反应被认为由过氧化物酶或漆酶催化完成,dirigent蛋白可保证反应的立体选择性[105].陈瑞兵等[106]从菘蓝转录组中鉴定了19条dirigent蛋白编码基因,在菘蓝毛状根中过表达这些基因,发现IiDIR1和IiDIR2的表达选择性地促进(-)-松脂醇合成,证明了这两个酶在立体选择性控制方面的重要作用.松脂醇/落叶松脂醇还原酶(IiPLR1)连续催化松脂醇的C7-O-C9′和C7′-O-C9醚键的开裂,生成落叶松脂醇(lariciresinol)和开环异落叶松脂醇(secoisolariciresinol)(图8).IiPLR1和AtPrR1(拟南芥的松脂醇还原酶)均为首尾连接的同源二聚体[107].通过两种酶结构的比较分析,揭示了IiPLR1的催化机制[107].IiPLR1催化松脂醇向开环异落叶松脂醇转化的过程包括:松脂醇的结合、落叶松脂醇的生成、落叶松脂醇的释放、落叶松脂醇的结合以及开环异落叶松脂醇的生成.即落叶松脂醇生成后并未立刻继续开环生成开环异落叶松脂醇,而是经历了释放-再结合的过程.相对于IiPLR1,AtPrR1的底物结合口袋空间更小并且底物的进入被更严格地控制,因此阻碍了释放出的落叶松脂醇再次进入活性口袋,不能进一步开环生成开环异落叶松脂醇.两种酶中的β4 loop在底物/产物以及辅因子NADPH/NADP+的结合与释放中发挥了关键作用.具体来讲,β4 loop负责招募NADPH,并且在底物结合后覆盖底物结合槽.β4 loop上的98位氨基酸残基显著影响β4 loop的摆动,从而与底物的选择性密切相关.当把AtPrR1中体积较大的N98突变为体积较小的S98(与IiPLR1相同)后,AtPrR1N98S可产生开环异落叶松脂醇.目前,从菘蓝中表征了四个与木脂素苷生物合成相关的糖基转移酶.其中,IiUGT1是糖基化松脂醇的主要糖基转移酶,可产生松脂醇-4-O-葡萄糖苷(pinoresinol-4-O-glucoside)和松脂醇-4,4′-O-二葡萄糖苷(pinoresinol-4,4′-O-diglucoside)(图8)[108];IiUGT71B5a和IiUGT71B5b同样具有糖基化松脂醇的功能,前者产生松脂醇-4-O-葡萄糖苷和松脂醇-4,4′-O-二葡萄糖苷,后者仅能产生松脂醇-4-O-葡萄糖苷(图8)[109];IiUGT4负责落叶松脂醇的糖基化,可产生落叶松脂醇-4-O-葡萄糖苷(lariciresinol-4-O-glucoside)、落叶松脂醇-4′-O-葡萄糖苷(lariciresinol-4′-O-glucoside)和直铁线莲宁B[108](图8). ...
... [103-104].由于目前未从菘蓝中发现COMT,因此是否存在这条路径尚不确定.松柏醛经肉桂醇脱氢酶(IiCAD)氧化,生成木脂素的关键前体化合物松柏醇(coniferyl alcohol)[103].2分子松柏醇通过自由基偶联反应生成第一个具有木脂素骨架的化合物松脂醇(pinoresinol),这步反应被认为由过氧化物酶或漆酶催化完成,dirigent蛋白可保证反应的立体选择性[105].陈瑞兵等[106]从菘蓝转录组中鉴定了19条dirigent蛋白编码基因,在菘蓝毛状根中过表达这些基因,发现IiDIR1和IiDIR2的表达选择性地促进(-)-松脂醇合成,证明了这两个酶在立体选择性控制方面的重要作用.松脂醇/落叶松脂醇还原酶(IiPLR1)连续催化松脂醇的C7-O-C9′和C7′-O-C9醚键的开裂,生成落叶松脂醇(lariciresinol)和开环异落叶松脂醇(secoisolariciresinol)(图8).IiPLR1和AtPrR1(拟南芥的松脂醇还原酶)均为首尾连接的同源二聚体[107].通过两种酶结构的比较分析,揭示了IiPLR1的催化机制[107].IiPLR1催化松脂醇向开环异落叶松脂醇转化的过程包括:松脂醇的结合、落叶松脂醇的生成、落叶松脂醇的释放、落叶松脂醇的结合以及开环异落叶松脂醇的生成.即落叶松脂醇生成后并未立刻继续开环生成开环异落叶松脂醇,而是经历了释放-再结合的过程.相对于IiPLR1,AtPrR1的底物结合口袋空间更小并且底物的进入被更严格地控制,因此阻碍了释放出的落叶松脂醇再次进入活性口袋,不能进一步开环生成开环异落叶松脂醇.两种酶中的β4 loop在底物/产物以及辅因子NADPH/NADP+的结合与释放中发挥了关键作用.具体来讲,β4 loop负责招募NADPH,并且在底物结合后覆盖底物结合槽.β4 loop上的98位氨基酸残基显著影响β4 loop的摆动,从而与底物的选择性密切相关.当把AtPrR1中体积较大的N98突变为体积较小的S98(与IiPLR1相同)后,AtPrR1N98S可产生开环异落叶松脂醇.目前,从菘蓝中表征了四个与木脂素苷生物合成相关的糖基转移酶.其中,IiUGT1是糖基化松脂醇的主要糖基转移酶,可产生松脂醇-4-O-葡萄糖苷(pinoresinol-4-O-glucoside)和松脂醇-4,4′-O-二葡萄糖苷(pinoresinol-4,4′-O-diglucoside)(图8)[108];IiUGT71B5a和IiUGT71B5b同样具有糖基化松脂醇的功能,前者产生松脂醇-4-O-葡萄糖苷和松脂醇-4,4′-O-二葡萄糖苷,后者仅能产生松脂醇-4-O-葡萄糖苷(图8)[109];IiUGT4负责落叶松脂醇的糖基化,可产生落叶松脂醇-4-O-葡萄糖苷(lariciresinol-4-O-glucoside)、落叶松脂醇-4′-O-葡萄糖苷(lariciresinol-4′-O-glucoside)和直铁线莲宁B[108](图8). ...
... [103].2分子松柏醇通过自由基偶联反应生成第一个具有木脂素骨架的化合物松脂醇(pinoresinol),这步反应被认为由过氧化物酶或漆酶催化完成,dirigent蛋白可保证反应的立体选择性[105].陈瑞兵等[106]从菘蓝转录组中鉴定了19条dirigent蛋白编码基因,在菘蓝毛状根中过表达这些基因,发现IiDIR1和IiDIR2的表达选择性地促进(-)-松脂醇合成,证明了这两个酶在立体选择性控制方面的重要作用.松脂醇/落叶松脂醇还原酶(IiPLR1)连续催化松脂醇的C7-O-C9′和C7′-O-C9醚键的开裂,生成落叶松脂醇(lariciresinol)和开环异落叶松脂醇(secoisolariciresinol)(图8).IiPLR1和AtPrR1(拟南芥的松脂醇还原酶)均为首尾连接的同源二聚体[107].通过两种酶结构的比较分析,揭示了IiPLR1的催化机制[107].IiPLR1催化松脂醇向开环异落叶松脂醇转化的过程包括:松脂醇的结合、落叶松脂醇的生成、落叶松脂醇的释放、落叶松脂醇的结合以及开环异落叶松脂醇的生成.即落叶松脂醇生成后并未立刻继续开环生成开环异落叶松脂醇,而是经历了释放-再结合的过程.相对于IiPLR1,AtPrR1的底物结合口袋空间更小并且底物的进入被更严格地控制,因此阻碍了释放出的落叶松脂醇再次进入活性口袋,不能进一步开环生成开环异落叶松脂醇.两种酶中的β4 loop在底物/产物以及辅因子NADPH/NADP+的结合与释放中发挥了关键作用.具体来讲,β4 loop负责招募NADPH,并且在底物结合后覆盖底物结合槽.β4 loop上的98位氨基酸残基显著影响β4 loop的摆动,从而与底物的选择性密切相关.当把AtPrR1中体积较大的N98突变为体积较小的S98(与IiPLR1相同)后,AtPrR1N98S可产生开环异落叶松脂醇.目前,从菘蓝中表征了四个与木脂素苷生物合成相关的糖基转移酶.其中,IiUGT1是糖基化松脂醇的主要糖基转移酶,可产生松脂醇-4-O-葡萄糖苷(pinoresinol-4-O-glucoside)和松脂醇-4,4′-O-二葡萄糖苷(pinoresinol-4,4′-O-diglucoside)(图8)[108];IiUGT71B5a和IiUGT71B5b同样具有糖基化松脂醇的功能,前者产生松脂醇-4-O-葡萄糖苷和松脂醇-4,4′-O-二葡萄糖苷,后者仅能产生松脂醇-4-O-葡萄糖苷(图8)[109];IiUGT4负责落叶松脂醇的糖基化,可产生落叶松脂醇-4-O-葡萄糖苷(lariciresinol-4-O-glucoside)、落叶松脂醇-4′-O-葡萄糖苷(lariciresinol-4′-O-glucoside)和直铁线莲宁B[108](图8). ...
Lignin biosynthesis
1
2003
... 板蓝根是菘蓝(Isatis indigotica Fortune)的干燥根,具有清热解毒、凉血利咽的功效,临床上常用于治疗流行性感冒和病毒性感染等[102].研究表明,板蓝根抗病毒的药效成分为木脂素类化合物,主要包括:落叶松脂醇(lariciresinol)、开环异落叶松脂醇(secoisolariciresinol)、落叶松脂醇苷以及直铁线莲宁B(clemastanin B)等.目前,已经基本解析了这些成分的生物合成途径(图8).与典型黄酮生物合成途径的前两步相同,苯丙氨酸在苯丙氨酸解氨酶(IiPAL1和IiPAL2)和肉桂酸-4-羟化酶(IiC4H)催化下生成4-香豆酸(图8)[103].在菘蓝中,4-香豆酸可经过两条路径生成松柏醛.第一条路径:在4-香豆酰辅酶A连接酶(Ii4CL2)催化下,得到4-香豆酰辅酶A;4-香豆酰辅酶A在羟基肉桂酰转移酶(IiHCT)和香豆酸-3-羟化酶(IiC3H)催化下,经中间体4-香豆酰莽草酸酯,生成咖啡酰辅酶A(caffeoyl CoA);咖啡酰辅酶A氧甲基转移酶(IiCCoAOMT)和肉桂酰辅酶A还原酶(IiCCR)顺序催化羟基甲基化和还原反应,生成松柏醛(coniferaldehyde)(图8)[103].在第二条途径中,首先IiC3H羟基化4-香豆酸,得到咖啡酸;然后在Ii4CL2/3以及IiCCoAOMT的催化下,与辅酶A连接并甲基化得到阿魏酰辅酶A;IiCCR催化阿魏酰辅酶A的还原,生成松柏醛(图8)[103].除以上两条途径外,在大多数植物中还存在第三条合成松柏醛的途径:首先在咖啡酸氧甲基转移酶(COMT)的催化下,咖啡酸转化为阿魏酸,进一步在4CL的催化下连接辅酶A生成阿魏酰辅酶A;最后CCR催化阿魏酰辅酶A还原,生成松柏醛[103-104].由于目前未从菘蓝中发现COMT,因此是否存在这条路径尚不确定.松柏醛经肉桂醇脱氢酶(IiCAD)氧化,生成木脂素的关键前体化合物松柏醇(coniferyl alcohol)[103].2分子松柏醇通过自由基偶联反应生成第一个具有木脂素骨架的化合物松脂醇(pinoresinol),这步反应被认为由过氧化物酶或漆酶催化完成,dirigent蛋白可保证反应的立体选择性[105].陈瑞兵等[106]从菘蓝转录组中鉴定了19条dirigent蛋白编码基因,在菘蓝毛状根中过表达这些基因,发现IiDIR1和IiDIR2的表达选择性地促进(-)-松脂醇合成,证明了这两个酶在立体选择性控制方面的重要作用.松脂醇/落叶松脂醇还原酶(IiPLR1)连续催化松脂醇的C7-O-C9′和C7′-O-C9醚键的开裂,生成落叶松脂醇(lariciresinol)和开环异落叶松脂醇(secoisolariciresinol)(图8).IiPLR1和AtPrR1(拟南芥的松脂醇还原酶)均为首尾连接的同源二聚体[107].通过两种酶结构的比较分析,揭示了IiPLR1的催化机制[107].IiPLR1催化松脂醇向开环异落叶松脂醇转化的过程包括:松脂醇的结合、落叶松脂醇的生成、落叶松脂醇的释放、落叶松脂醇的结合以及开环异落叶松脂醇的生成.即落叶松脂醇生成后并未立刻继续开环生成开环异落叶松脂醇,而是经历了释放-再结合的过程.相对于IiPLR1,AtPrR1的底物结合口袋空间更小并且底物的进入被更严格地控制,因此阻碍了释放出的落叶松脂醇再次进入活性口袋,不能进一步开环生成开环异落叶松脂醇.两种酶中的β4 loop在底物/产物以及辅因子NADPH/NADP+的结合与释放中发挥了关键作用.具体来讲,β4 loop负责招募NADPH,并且在底物结合后覆盖底物结合槽.β4 loop上的98位氨基酸残基显著影响β4 loop的摆动,从而与底物的选择性密切相关.当把AtPrR1中体积较大的N98突变为体积较小的S98(与IiPLR1相同)后,AtPrR1N98S可产生开环异落叶松脂醇.目前,从菘蓝中表征了四个与木脂素苷生物合成相关的糖基转移酶.其中,IiUGT1是糖基化松脂醇的主要糖基转移酶,可产生松脂醇-4-O-葡萄糖苷(pinoresinol-4-O-glucoside)和松脂醇-4,4′-O-二葡萄糖苷(pinoresinol-4,4′-O-diglucoside)(图8)[108];IiUGT71B5a和IiUGT71B5b同样具有糖基化松脂醇的功能,前者产生松脂醇-4-O-葡萄糖苷和松脂醇-4,4′-O-二葡萄糖苷,后者仅能产生松脂醇-4-O-葡萄糖苷(图8)[109];IiUGT4负责落叶松脂醇的糖基化,可产生落叶松脂醇-4-O-葡萄糖苷(lariciresinol-4-O-glucoside)、落叶松脂醇-4′-O-葡萄糖苷(lariciresinol-4′-O-glucoside)和直铁线莲宁B[108](图8). ...
Dirigent proteins in plants: modulating cell wall metabolism during abiotic and biotic stress exposure
1
2017
... 板蓝根是菘蓝(Isatis indigotica Fortune)的干燥根,具有清热解毒、凉血利咽的功效,临床上常用于治疗流行性感冒和病毒性感染等[102].研究表明,板蓝根抗病毒的药效成分为木脂素类化合物,主要包括:落叶松脂醇(lariciresinol)、开环异落叶松脂醇(secoisolariciresinol)、落叶松脂醇苷以及直铁线莲宁B(clemastanin B)等.目前,已经基本解析了这些成分的生物合成途径(图8).与典型黄酮生物合成途径的前两步相同,苯丙氨酸在苯丙氨酸解氨酶(IiPAL1和IiPAL2)和肉桂酸-4-羟化酶(IiC4H)催化下生成4-香豆酸(图8)[103].在菘蓝中,4-香豆酸可经过两条路径生成松柏醛.第一条路径:在4-香豆酰辅酶A连接酶(Ii4CL2)催化下,得到4-香豆酰辅酶A;4-香豆酰辅酶A在羟基肉桂酰转移酶(IiHCT)和香豆酸-3-羟化酶(IiC3H)催化下,经中间体4-香豆酰莽草酸酯,生成咖啡酰辅酶A(caffeoyl CoA);咖啡酰辅酶A氧甲基转移酶(IiCCoAOMT)和肉桂酰辅酶A还原酶(IiCCR)顺序催化羟基甲基化和还原反应,生成松柏醛(coniferaldehyde)(图8)[103].在第二条途径中,首先IiC3H羟基化4-香豆酸,得到咖啡酸;然后在Ii4CL2/3以及IiCCoAOMT的催化下,与辅酶A连接并甲基化得到阿魏酰辅酶A;IiCCR催化阿魏酰辅酶A的还原,生成松柏醛(图8)[103].除以上两条途径外,在大多数植物中还存在第三条合成松柏醛的途径:首先在咖啡酸氧甲基转移酶(COMT)的催化下,咖啡酸转化为阿魏酸,进一步在4CL的催化下连接辅酶A生成阿魏酰辅酶A;最后CCR催化阿魏酰辅酶A还原,生成松柏醛[103-104].由于目前未从菘蓝中发现COMT,因此是否存在这条路径尚不确定.松柏醛经肉桂醇脱氢酶(IiCAD)氧化,生成木脂素的关键前体化合物松柏醇(coniferyl alcohol)[103].2分子松柏醇通过自由基偶联反应生成第一个具有木脂素骨架的化合物松脂醇(pinoresinol),这步反应被认为由过氧化物酶或漆酶催化完成,dirigent蛋白可保证反应的立体选择性[105].陈瑞兵等[106]从菘蓝转录组中鉴定了19条dirigent蛋白编码基因,在菘蓝毛状根中过表达这些基因,发现IiDIR1和IiDIR2的表达选择性地促进(-)-松脂醇合成,证明了这两个酶在立体选择性控制方面的重要作用.松脂醇/落叶松脂醇还原酶(IiPLR1)连续催化松脂醇的C7-O-C9′和C7′-O-C9醚键的开裂,生成落叶松脂醇(lariciresinol)和开环异落叶松脂醇(secoisolariciresinol)(图8).IiPLR1和AtPrR1(拟南芥的松脂醇还原酶)均为首尾连接的同源二聚体[107].通过两种酶结构的比较分析,揭示了IiPLR1的催化机制[107].IiPLR1催化松脂醇向开环异落叶松脂醇转化的过程包括:松脂醇的结合、落叶松脂醇的生成、落叶松脂醇的释放、落叶松脂醇的结合以及开环异落叶松脂醇的生成.即落叶松脂醇生成后并未立刻继续开环生成开环异落叶松脂醇,而是经历了释放-再结合的过程.相对于IiPLR1,AtPrR1的底物结合口袋空间更小并且底物的进入被更严格地控制,因此阻碍了释放出的落叶松脂醇再次进入活性口袋,不能进一步开环生成开环异落叶松脂醇.两种酶中的β4 loop在底物/产物以及辅因子NADPH/NADP+的结合与释放中发挥了关键作用.具体来讲,β4 loop负责招募NADPH,并且在底物结合后覆盖底物结合槽.β4 loop上的98位氨基酸残基显著影响β4 loop的摆动,从而与底物的选择性密切相关.当把AtPrR1中体积较大的N98突变为体积较小的S98(与IiPLR1相同)后,AtPrR1N98S可产生开环异落叶松脂醇.目前,从菘蓝中表征了四个与木脂素苷生物合成相关的糖基转移酶.其中,IiUGT1是糖基化松脂醇的主要糖基转移酶,可产生松脂醇-4-O-葡萄糖苷(pinoresinol-4-O-glucoside)和松脂醇-4,4′-O-二葡萄糖苷(pinoresinol-4,4′-O-diglucoside)(图8)[108];IiUGT71B5a和IiUGT71B5b同样具有糖基化松脂醇的功能,前者产生松脂醇-4-O-葡萄糖苷和松脂醇-4,4′-O-二葡萄糖苷,后者仅能产生松脂醇-4-O-葡萄糖苷(图8)[109];IiUGT4负责落叶松脂醇的糖基化,可产生落叶松脂醇-4-O-葡萄糖苷(lariciresinol-4-O-glucoside)、落叶松脂醇-4′-O-葡萄糖苷(lariciresinol-4′-O-glucoside)和直铁线莲宁B[108](图8). ...
The ERF transcription factor LTF1 activates DIR1 to control stereoselective synthesis of antiviral lignans and stress defense in Isatis indigotica roots
1
2024
... 板蓝根是菘蓝(Isatis indigotica Fortune)的干燥根,具有清热解毒、凉血利咽的功效,临床上常用于治疗流行性感冒和病毒性感染等[102].研究表明,板蓝根抗病毒的药效成分为木脂素类化合物,主要包括:落叶松脂醇(lariciresinol)、开环异落叶松脂醇(secoisolariciresinol)、落叶松脂醇苷以及直铁线莲宁B(clemastanin B)等.目前,已经基本解析了这些成分的生物合成途径(图8).与典型黄酮生物合成途径的前两步相同,苯丙氨酸在苯丙氨酸解氨酶(IiPAL1和IiPAL2)和肉桂酸-4-羟化酶(IiC4H)催化下生成4-香豆酸(图8)[103].在菘蓝中,4-香豆酸可经过两条路径生成松柏醛.第一条路径:在4-香豆酰辅酶A连接酶(Ii4CL2)催化下,得到4-香豆酰辅酶A;4-香豆酰辅酶A在羟基肉桂酰转移酶(IiHCT)和香豆酸-3-羟化酶(IiC3H)催化下,经中间体4-香豆酰莽草酸酯,生成咖啡酰辅酶A(caffeoyl CoA);咖啡酰辅酶A氧甲基转移酶(IiCCoAOMT)和肉桂酰辅酶A还原酶(IiCCR)顺序催化羟基甲基化和还原反应,生成松柏醛(coniferaldehyde)(图8)[103].在第二条途径中,首先IiC3H羟基化4-香豆酸,得到咖啡酸;然后在Ii4CL2/3以及IiCCoAOMT的催化下,与辅酶A连接并甲基化得到阿魏酰辅酶A;IiCCR催化阿魏酰辅酶A的还原,生成松柏醛(图8)[103].除以上两条途径外,在大多数植物中还存在第三条合成松柏醛的途径:首先在咖啡酸氧甲基转移酶(COMT)的催化下,咖啡酸转化为阿魏酸,进一步在4CL的催化下连接辅酶A生成阿魏酰辅酶A;最后CCR催化阿魏酰辅酶A还原,生成松柏醛[103-104].由于目前未从菘蓝中发现COMT,因此是否存在这条路径尚不确定.松柏醛经肉桂醇脱氢酶(IiCAD)氧化,生成木脂素的关键前体化合物松柏醇(coniferyl alcohol)[103].2分子松柏醇通过自由基偶联反应生成第一个具有木脂素骨架的化合物松脂醇(pinoresinol),这步反应被认为由过氧化物酶或漆酶催化完成,dirigent蛋白可保证反应的立体选择性[105].陈瑞兵等[106]从菘蓝转录组中鉴定了19条dirigent蛋白编码基因,在菘蓝毛状根中过表达这些基因,发现IiDIR1和IiDIR2的表达选择性地促进(-)-松脂醇合成,证明了这两个酶在立体选择性控制方面的重要作用.松脂醇/落叶松脂醇还原酶(IiPLR1)连续催化松脂醇的C7-O-C9′和C7′-O-C9醚键的开裂,生成落叶松脂醇(lariciresinol)和开环异落叶松脂醇(secoisolariciresinol)(图8).IiPLR1和AtPrR1(拟南芥的松脂醇还原酶)均为首尾连接的同源二聚体[107].通过两种酶结构的比较分析,揭示了IiPLR1的催化机制[107].IiPLR1催化松脂醇向开环异落叶松脂醇转化的过程包括:松脂醇的结合、落叶松脂醇的生成、落叶松脂醇的释放、落叶松脂醇的结合以及开环异落叶松脂醇的生成.即落叶松脂醇生成后并未立刻继续开环生成开环异落叶松脂醇,而是经历了释放-再结合的过程.相对于IiPLR1,AtPrR1的底物结合口袋空间更小并且底物的进入被更严格地控制,因此阻碍了释放出的落叶松脂醇再次进入活性口袋,不能进一步开环生成开环异落叶松脂醇.两种酶中的β4 loop在底物/产物以及辅因子NADPH/NADP+的结合与释放中发挥了关键作用.具体来讲,β4 loop负责招募NADPH,并且在底物结合后覆盖底物结合槽.β4 loop上的98位氨基酸残基显著影响β4 loop的摆动,从而与底物的选择性密切相关.当把AtPrR1中体积较大的N98突变为体积较小的S98(与IiPLR1相同)后,AtPrR1N98S可产生开环异落叶松脂醇.目前,从菘蓝中表征了四个与木脂素苷生物合成相关的糖基转移酶.其中,IiUGT1是糖基化松脂醇的主要糖基转移酶,可产生松脂醇-4-O-葡萄糖苷(pinoresinol-4-O-glucoside)和松脂醇-4,4′-O-二葡萄糖苷(pinoresinol-4,4′-O-diglucoside)(图8)[108];IiUGT71B5a和IiUGT71B5b同样具有糖基化松脂醇的功能,前者产生松脂醇-4-O-葡萄糖苷和松脂醇-4,4′-O-二葡萄糖苷,后者仅能产生松脂醇-4-O-葡萄糖苷(图8)[109];IiUGT4负责落叶松脂醇的糖基化,可产生落叶松脂醇-4-O-葡萄糖苷(lariciresinol-4-O-glucoside)、落叶松脂醇-4′-O-葡萄糖苷(lariciresinol-4′-O-glucoside)和直铁线莲宁B[108](图8). ...
Structure-based engineering of substrate specificity for pinoresinol-lariciresinol reductases
2
2021
... 板蓝根是菘蓝(Isatis indigotica Fortune)的干燥根,具有清热解毒、凉血利咽的功效,临床上常用于治疗流行性感冒和病毒性感染等[102].研究表明,板蓝根抗病毒的药效成分为木脂素类化合物,主要包括:落叶松脂醇(lariciresinol)、开环异落叶松脂醇(secoisolariciresinol)、落叶松脂醇苷以及直铁线莲宁B(clemastanin B)等.目前,已经基本解析了这些成分的生物合成途径(图8).与典型黄酮生物合成途径的前两步相同,苯丙氨酸在苯丙氨酸解氨酶(IiPAL1和IiPAL2)和肉桂酸-4-羟化酶(IiC4H)催化下生成4-香豆酸(图8)[103].在菘蓝中,4-香豆酸可经过两条路径生成松柏醛.第一条路径:在4-香豆酰辅酶A连接酶(Ii4CL2)催化下,得到4-香豆酰辅酶A;4-香豆酰辅酶A在羟基肉桂酰转移酶(IiHCT)和香豆酸-3-羟化酶(IiC3H)催化下,经中间体4-香豆酰莽草酸酯,生成咖啡酰辅酶A(caffeoyl CoA);咖啡酰辅酶A氧甲基转移酶(IiCCoAOMT)和肉桂酰辅酶A还原酶(IiCCR)顺序催化羟基甲基化和还原反应,生成松柏醛(coniferaldehyde)(图8)[103].在第二条途径中,首先IiC3H羟基化4-香豆酸,得到咖啡酸;然后在Ii4CL2/3以及IiCCoAOMT的催化下,与辅酶A连接并甲基化得到阿魏酰辅酶A;IiCCR催化阿魏酰辅酶A的还原,生成松柏醛(图8)[103].除以上两条途径外,在大多数植物中还存在第三条合成松柏醛的途径:首先在咖啡酸氧甲基转移酶(COMT)的催化下,咖啡酸转化为阿魏酸,进一步在4CL的催化下连接辅酶A生成阿魏酰辅酶A;最后CCR催化阿魏酰辅酶A还原,生成松柏醛[103-104].由于目前未从菘蓝中发现COMT,因此是否存在这条路径尚不确定.松柏醛经肉桂醇脱氢酶(IiCAD)氧化,生成木脂素的关键前体化合物松柏醇(coniferyl alcohol)[103].2分子松柏醇通过自由基偶联反应生成第一个具有木脂素骨架的化合物松脂醇(pinoresinol),这步反应被认为由过氧化物酶或漆酶催化完成,dirigent蛋白可保证反应的立体选择性[105].陈瑞兵等[106]从菘蓝转录组中鉴定了19条dirigent蛋白编码基因,在菘蓝毛状根中过表达这些基因,发现IiDIR1和IiDIR2的表达选择性地促进(-)-松脂醇合成,证明了这两个酶在立体选择性控制方面的重要作用.松脂醇/落叶松脂醇还原酶(IiPLR1)连续催化松脂醇的C7-O-C9′和C7′-O-C9醚键的开裂,生成落叶松脂醇(lariciresinol)和开环异落叶松脂醇(secoisolariciresinol)(图8).IiPLR1和AtPrR1(拟南芥的松脂醇还原酶)均为首尾连接的同源二聚体[107].通过两种酶结构的比较分析,揭示了IiPLR1的催化机制[107].IiPLR1催化松脂醇向开环异落叶松脂醇转化的过程包括:松脂醇的结合、落叶松脂醇的生成、落叶松脂醇的释放、落叶松脂醇的结合以及开环异落叶松脂醇的生成.即落叶松脂醇生成后并未立刻继续开环生成开环异落叶松脂醇,而是经历了释放-再结合的过程.相对于IiPLR1,AtPrR1的底物结合口袋空间更小并且底物的进入被更严格地控制,因此阻碍了释放出的落叶松脂醇再次进入活性口袋,不能进一步开环生成开环异落叶松脂醇.两种酶中的β4 loop在底物/产物以及辅因子NADPH/NADP+的结合与释放中发挥了关键作用.具体来讲,β4 loop负责招募NADPH,并且在底物结合后覆盖底物结合槽.β4 loop上的98位氨基酸残基显著影响β4 loop的摆动,从而与底物的选择性密切相关.当把AtPrR1中体积较大的N98突变为体积较小的S98(与IiPLR1相同)后,AtPrR1N98S可产生开环异落叶松脂醇.目前,从菘蓝中表征了四个与木脂素苷生物合成相关的糖基转移酶.其中,IiUGT1是糖基化松脂醇的主要糖基转移酶,可产生松脂醇-4-O-葡萄糖苷(pinoresinol-4-O-glucoside)和松脂醇-4,4′-O-二葡萄糖苷(pinoresinol-4,4′-O-diglucoside)(图8)[108];IiUGT71B5a和IiUGT71B5b同样具有糖基化松脂醇的功能,前者产生松脂醇-4-O-葡萄糖苷和松脂醇-4,4′-O-二葡萄糖苷,后者仅能产生松脂醇-4-O-葡萄糖苷(图8)[109];IiUGT4负责落叶松脂醇的糖基化,可产生落叶松脂醇-4-O-葡萄糖苷(lariciresinol-4-O-glucoside)、落叶松脂醇-4′-O-葡萄糖苷(lariciresinol-4′-O-glucoside)和直铁线莲宁B[108](图8). ...
... [107].IiPLR1催化松脂醇向开环异落叶松脂醇转化的过程包括:松脂醇的结合、落叶松脂醇的生成、落叶松脂醇的释放、落叶松脂醇的结合以及开环异落叶松脂醇的生成.即落叶松脂醇生成后并未立刻继续开环生成开环异落叶松脂醇,而是经历了释放-再结合的过程.相对于IiPLR1,AtPrR1的底物结合口袋空间更小并且底物的进入被更严格地控制,因此阻碍了释放出的落叶松脂醇再次进入活性口袋,不能进一步开环生成开环异落叶松脂醇.两种酶中的β4 loop在底物/产物以及辅因子NADPH/NADP+的结合与释放中发挥了关键作用.具体来讲,β4 loop负责招募NADPH,并且在底物结合后覆盖底物结合槽.β4 loop上的98位氨基酸残基显著影响β4 loop的摆动,从而与底物的选择性密切相关.当把AtPrR1中体积较大的N98突变为体积较小的S98(与IiPLR1相同)后,AtPrR1N98S可产生开环异落叶松脂醇.目前,从菘蓝中表征了四个与木脂素苷生物合成相关的糖基转移酶.其中,IiUGT1是糖基化松脂醇的主要糖基转移酶,可产生松脂醇-4-O-葡萄糖苷(pinoresinol-4-O-glucoside)和松脂醇-4,4′-O-二葡萄糖苷(pinoresinol-4,4′-O-diglucoside)(图8)[108];IiUGT71B5a和IiUGT71B5b同样具有糖基化松脂醇的功能,前者产生松脂醇-4-O-葡萄糖苷和松脂醇-4,4′-O-二葡萄糖苷,后者仅能产生松脂醇-4-O-葡萄糖苷(图8)[109];IiUGT4负责落叶松脂醇的糖基化,可产生落叶松脂醇-4-O-葡萄糖苷(lariciresinol-4-O-glucoside)、落叶松脂醇-4′-O-葡萄糖苷(lariciresinol-4′-O-glucoside)和直铁线莲宁B[108](图8). ...
Functional characterization of UDP-glycosyltransferases involved in anti-viral lignan glycosides biosynthesis in Isatis indigotica
2
2022
... 板蓝根是菘蓝(Isatis indigotica Fortune)的干燥根,具有清热解毒、凉血利咽的功效,临床上常用于治疗流行性感冒和病毒性感染等[102].研究表明,板蓝根抗病毒的药效成分为木脂素类化合物,主要包括:落叶松脂醇(lariciresinol)、开环异落叶松脂醇(secoisolariciresinol)、落叶松脂醇苷以及直铁线莲宁B(clemastanin B)等.目前,已经基本解析了这些成分的生物合成途径(图8).与典型黄酮生物合成途径的前两步相同,苯丙氨酸在苯丙氨酸解氨酶(IiPAL1和IiPAL2)和肉桂酸-4-羟化酶(IiC4H)催化下生成4-香豆酸(图8)[103].在菘蓝中,4-香豆酸可经过两条路径生成松柏醛.第一条路径:在4-香豆酰辅酶A连接酶(Ii4CL2)催化下,得到4-香豆酰辅酶A;4-香豆酰辅酶A在羟基肉桂酰转移酶(IiHCT)和香豆酸-3-羟化酶(IiC3H)催化下,经中间体4-香豆酰莽草酸酯,生成咖啡酰辅酶A(caffeoyl CoA);咖啡酰辅酶A氧甲基转移酶(IiCCoAOMT)和肉桂酰辅酶A还原酶(IiCCR)顺序催化羟基甲基化和还原反应,生成松柏醛(coniferaldehyde)(图8)[103].在第二条途径中,首先IiC3H羟基化4-香豆酸,得到咖啡酸;然后在Ii4CL2/3以及IiCCoAOMT的催化下,与辅酶A连接并甲基化得到阿魏酰辅酶A;IiCCR催化阿魏酰辅酶A的还原,生成松柏醛(图8)[103].除以上两条途径外,在大多数植物中还存在第三条合成松柏醛的途径:首先在咖啡酸氧甲基转移酶(COMT)的催化下,咖啡酸转化为阿魏酸,进一步在4CL的催化下连接辅酶A生成阿魏酰辅酶A;最后CCR催化阿魏酰辅酶A还原,生成松柏醛[103-104].由于目前未从菘蓝中发现COMT,因此是否存在这条路径尚不确定.松柏醛经肉桂醇脱氢酶(IiCAD)氧化,生成木脂素的关键前体化合物松柏醇(coniferyl alcohol)[103].2分子松柏醇通过自由基偶联反应生成第一个具有木脂素骨架的化合物松脂醇(pinoresinol),这步反应被认为由过氧化物酶或漆酶催化完成,dirigent蛋白可保证反应的立体选择性[105].陈瑞兵等[106]从菘蓝转录组中鉴定了19条dirigent蛋白编码基因,在菘蓝毛状根中过表达这些基因,发现IiDIR1和IiDIR2的表达选择性地促进(-)-松脂醇合成,证明了这两个酶在立体选择性控制方面的重要作用.松脂醇/落叶松脂醇还原酶(IiPLR1)连续催化松脂醇的C7-O-C9′和C7′-O-C9醚键的开裂,生成落叶松脂醇(lariciresinol)和开环异落叶松脂醇(secoisolariciresinol)(图8).IiPLR1和AtPrR1(拟南芥的松脂醇还原酶)均为首尾连接的同源二聚体[107].通过两种酶结构的比较分析,揭示了IiPLR1的催化机制[107].IiPLR1催化松脂醇向开环异落叶松脂醇转化的过程包括:松脂醇的结合、落叶松脂醇的生成、落叶松脂醇的释放、落叶松脂醇的结合以及开环异落叶松脂醇的生成.即落叶松脂醇生成后并未立刻继续开环生成开环异落叶松脂醇,而是经历了释放-再结合的过程.相对于IiPLR1,AtPrR1的底物结合口袋空间更小并且底物的进入被更严格地控制,因此阻碍了释放出的落叶松脂醇再次进入活性口袋,不能进一步开环生成开环异落叶松脂醇.两种酶中的β4 loop在底物/产物以及辅因子NADPH/NADP+的结合与释放中发挥了关键作用.具体来讲,β4 loop负责招募NADPH,并且在底物结合后覆盖底物结合槽.β4 loop上的98位氨基酸残基显著影响β4 loop的摆动,从而与底物的选择性密切相关.当把AtPrR1中体积较大的N98突变为体积较小的S98(与IiPLR1相同)后,AtPrR1N98S可产生开环异落叶松脂醇.目前,从菘蓝中表征了四个与木脂素苷生物合成相关的糖基转移酶.其中,IiUGT1是糖基化松脂醇的主要糖基转移酶,可产生松脂醇-4-O-葡萄糖苷(pinoresinol-4-O-glucoside)和松脂醇-4,4′-O-二葡萄糖苷(pinoresinol-4,4′-O-diglucoside)(图8)[108];IiUGT71B5a和IiUGT71B5b同样具有糖基化松脂醇的功能,前者产生松脂醇-4-O-葡萄糖苷和松脂醇-4,4′-O-二葡萄糖苷,后者仅能产生松脂醇-4-O-葡萄糖苷(图8)[109];IiUGT4负责落叶松脂醇的糖基化,可产生落叶松脂醇-4-O-葡萄糖苷(lariciresinol-4-O-glucoside)、落叶松脂醇-4′-O-葡萄糖苷(lariciresinol-4′-O-glucoside)和直铁线莲宁B[108](图8). ...
... [108](图8). ...
Tandem UGT71B5s catalyze lignan glycosylation in Isatis indigotica with substrates promiscuity
1
2021
... 板蓝根是菘蓝(Isatis indigotica Fortune)的干燥根,具有清热解毒、凉血利咽的功效,临床上常用于治疗流行性感冒和病毒性感染等[102].研究表明,板蓝根抗病毒的药效成分为木脂素类化合物,主要包括:落叶松脂醇(lariciresinol)、开环异落叶松脂醇(secoisolariciresinol)、落叶松脂醇苷以及直铁线莲宁B(clemastanin B)等.目前,已经基本解析了这些成分的生物合成途径(图8).与典型黄酮生物合成途径的前两步相同,苯丙氨酸在苯丙氨酸解氨酶(IiPAL1和IiPAL2)和肉桂酸-4-羟化酶(IiC4H)催化下生成4-香豆酸(图8)[103].在菘蓝中,4-香豆酸可经过两条路径生成松柏醛.第一条路径:在4-香豆酰辅酶A连接酶(Ii4CL2)催化下,得到4-香豆酰辅酶A;4-香豆酰辅酶A在羟基肉桂酰转移酶(IiHCT)和香豆酸-3-羟化酶(IiC3H)催化下,经中间体4-香豆酰莽草酸酯,生成咖啡酰辅酶A(caffeoyl CoA);咖啡酰辅酶A氧甲基转移酶(IiCCoAOMT)和肉桂酰辅酶A还原酶(IiCCR)顺序催化羟基甲基化和还原反应,生成松柏醛(coniferaldehyde)(图8)[103].在第二条途径中,首先IiC3H羟基化4-香豆酸,得到咖啡酸;然后在Ii4CL2/3以及IiCCoAOMT的催化下,与辅酶A连接并甲基化得到阿魏酰辅酶A;IiCCR催化阿魏酰辅酶A的还原,生成松柏醛(图8)[103].除以上两条途径外,在大多数植物中还存在第三条合成松柏醛的途径:首先在咖啡酸氧甲基转移酶(COMT)的催化下,咖啡酸转化为阿魏酸,进一步在4CL的催化下连接辅酶A生成阿魏酰辅酶A;最后CCR催化阿魏酰辅酶A还原,生成松柏醛[103-104].由于目前未从菘蓝中发现COMT,因此是否存在这条路径尚不确定.松柏醛经肉桂醇脱氢酶(IiCAD)氧化,生成木脂素的关键前体化合物松柏醇(coniferyl alcohol)[103].2分子松柏醇通过自由基偶联反应生成第一个具有木脂素骨架的化合物松脂醇(pinoresinol),这步反应被认为由过氧化物酶或漆酶催化完成,dirigent蛋白可保证反应的立体选择性[105].陈瑞兵等[106]从菘蓝转录组中鉴定了19条dirigent蛋白编码基因,在菘蓝毛状根中过表达这些基因,发现IiDIR1和IiDIR2的表达选择性地促进(-)-松脂醇合成,证明了这两个酶在立体选择性控制方面的重要作用.松脂醇/落叶松脂醇还原酶(IiPLR1)连续催化松脂醇的C7-O-C9′和C7′-O-C9醚键的开裂,生成落叶松脂醇(lariciresinol)和开环异落叶松脂醇(secoisolariciresinol)(图8).IiPLR1和AtPrR1(拟南芥的松脂醇还原酶)均为首尾连接的同源二聚体[107].通过两种酶结构的比较分析,揭示了IiPLR1的催化机制[107].IiPLR1催化松脂醇向开环异落叶松脂醇转化的过程包括:松脂醇的结合、落叶松脂醇的生成、落叶松脂醇的释放、落叶松脂醇的结合以及开环异落叶松脂醇的生成.即落叶松脂醇生成后并未立刻继续开环生成开环异落叶松脂醇,而是经历了释放-再结合的过程.相对于IiPLR1,AtPrR1的底物结合口袋空间更小并且底物的进入被更严格地控制,因此阻碍了释放出的落叶松脂醇再次进入活性口袋,不能进一步开环生成开环异落叶松脂醇.两种酶中的β4 loop在底物/产物以及辅因子NADPH/NADP+的结合与释放中发挥了关键作用.具体来讲,β4 loop负责招募NADPH,并且在底物结合后覆盖底物结合槽.β4 loop上的98位氨基酸残基显著影响β4 loop的摆动,从而与底物的选择性密切相关.当把AtPrR1中体积较大的N98突变为体积较小的S98(与IiPLR1相同)后,AtPrR1N98S可产生开环异落叶松脂醇.目前,从菘蓝中表征了四个与木脂素苷生物合成相关的糖基转移酶.其中,IiUGT1是糖基化松脂醇的主要糖基转移酶,可产生松脂醇-4-O-葡萄糖苷(pinoresinol-4-O-glucoside)和松脂醇-4,4′-O-二葡萄糖苷(pinoresinol-4,4′-O-diglucoside)(图8)[108];IiUGT71B5a和IiUGT71B5b同样具有糖基化松脂醇的功能,前者产生松脂醇-4-O-葡萄糖苷和松脂醇-4,4′-O-二葡萄糖苷,后者仅能产生松脂醇-4-O-葡萄糖苷(图8)[109];IiUGT4负责落叶松脂醇的糖基化,可产生落叶松脂醇-4-O-葡萄糖苷(lariciresinol-4-O-glucoside)、落叶松脂醇-4′-O-葡萄糖苷(lariciresinol-4′-O-glucoside)和直铁线莲宁B[108](图8). ...
Pharmacokinetics and pharmacodynamics in clinical use of scopolamine
1
2005
... 颠茄为茄科颠茄属植物颠茄(Atropa belladonna L.)的干燥全草,收录于《中国药典》.颠茄提取物被开发成多种中成药,例如颠茄片、颠茄酊、颠茄流浸膏以及颠茄口腔崩解片等.这些中成药广泛用于镇痛和胃肠道平滑肌解痉等[110-111].颠茄的主要药效成分为托品烷类生物碱,包括莨菪碱(hyoscyamine)和东莨菪碱(scopolamine)等.托品烷生物碱由托品和苯乳酰葡萄糖两个生物合成前体通过酯交换反应生成. ...
Spasmolysis at CT colonography: butyl scopolamine versus glucagon
1
2005
... 颠茄为茄科颠茄属植物颠茄(Atropa belladonna L.)的干燥全草,收录于《中国药典》.颠茄提取物被开发成多种中成药,例如颠茄片、颠茄酊、颠茄流浸膏以及颠茄口腔崩解片等.这些中成药广泛用于镇痛和胃肠道平滑肌解痉等[110-111].颠茄的主要药效成分为托品烷类生物碱,包括莨菪碱(hyoscyamine)和东莨菪碱(scopolamine)等.托品烷生物碱由托品和苯乳酰葡萄糖两个生物合成前体通过酯交换反应生成. ...
A root-expressed L-phenylalanine: 4-hydroxyphenylpyruvate aminotransferase is required for tropane alkaloid biosynthesis in Atropa belladonna
1
2014
... 苯丙氨酸在苯丙氨酸氨基转移酶(AbArAT4)的催化下生成苯丙酮酸(phenylpyruvate)[112],随后在苯丙酮酸还原酶(AbPPAR)的催化下生成苯乳酸(phenyllactic acid)[113],最后在苯乳酸UDP-糖基转移酶(AbUGT1)的催化下发生糖基化反应,生成苯乳酰葡萄糖(phenyllactylglucose)(图9)[114]. ...
A phenylpyruvic acid reductase is required for biosynthesis of tropane alkaloids
1
2018
... 苯丙氨酸在苯丙氨酸氨基转移酶(AbArAT4)的催化下生成苯丙酮酸(phenylpyruvate)[112],随后在苯丙酮酸还原酶(AbPPAR)的催化下生成苯乳酸(phenyllactic acid)[113],最后在苯乳酸UDP-糖基转移酶(AbUGT1)的催化下发生糖基化反应,生成苯乳酰葡萄糖(phenyllactylglucose)(图9)[114]. ...
Functional genomics analysis reveals two novel genes required for littorine biosynthesis
2
2020
... 苯丙氨酸在苯丙氨酸氨基转移酶(AbArAT4)的催化下生成苯丙酮酸(phenylpyruvate)[112],随后在苯丙酮酸还原酶(AbPPAR)的催化下生成苯乳酸(phenyllactic acid)[113],最后在苯乳酸UDP-糖基转移酶(AbUGT1)的催化下发生糖基化反应,生成苯乳酰葡萄糖(phenyllactylglucose)(图9)[114]. ...
... 托品和苯乳酰葡萄糖在海螺碱合成酶(AbLS)催化下生成海螺碱(littorine)[114];海螺碱变位酶(AbCYP80F1)催化重排和氧化反应,生成莨菪醛(hyoscyamine aldehyde)[23,115-116];莨菪碱-6β-羟化酶(AbH6H)立体选择性地羟基化C6,生成山莨菪碱(anisodamine),并进一步形成三元氧环生成东莨菪碱(图9)[117-118].通过解析AbHDH的蛋白晶体结构,揭示了其催化机制.AbHDH首先发生变构使锌离子与莨菪醛的醛基产生静电作用;NADPH C4位的pro-R氢负离子转移到莨菪醛的醛基碳上;Ser54的羟基作为广义酸,为与锌离子相互作用的氧提供质子,从而生成莨菪碱[119](图9).AbHDH催化的还原反应是可逆的,其还原效率是氧化效率的23.36倍[119]. ...
Functional genomic analysis of alkaloid biosynthesis in Hyoscyamus niger reveals a cytochrome P450 involved in littorine rearrangement
1
2006
... 托品和苯乳酰葡萄糖在海螺碱合成酶(AbLS)催化下生成海螺碱(littorine)[114];海螺碱变位酶(AbCYP80F1)催化重排和氧化反应,生成莨菪醛(hyoscyamine aldehyde)[23,115-116];莨菪碱-6β-羟化酶(AbH6H)立体选择性地羟基化C6,生成山莨菪碱(anisodamine),并进一步形成三元氧环生成东莨菪碱(图9)[117-118].通过解析AbHDH的蛋白晶体结构,揭示了其催化机制.AbHDH首先发生变构使锌离子与莨菪醛的醛基产生静电作用;NADPH C4位的pro-R氢负离子转移到莨菪醛的醛基碳上;Ser54的羟基作为广义酸,为与锌离子相互作用的氧提供质子,从而生成莨菪碱[119](图9).AbHDH催化的还原反应是可逆的,其还原效率是氧化效率的23.36倍[119]. ...
Mechanistic insights into the cytochrome P450-mediated oxidation and rearrangement of littorine in tropane alkaloid biosynthesis
1
2009
... 托品和苯乳酰葡萄糖在海螺碱合成酶(AbLS)催化下生成海螺碱(littorine)[114];海螺碱变位酶(AbCYP80F1)催化重排和氧化反应,生成莨菪醛(hyoscyamine aldehyde)[23,115-116];莨菪碱-6β-羟化酶(AbH6H)立体选择性地羟基化C6,生成山莨菪碱(anisodamine),并进一步形成三元氧环生成东莨菪碱(图9)[117-118].通过解析AbHDH的蛋白晶体结构,揭示了其催化机制.AbHDH首先发生变构使锌离子与莨菪醛的醛基产生静电作用;NADPH C4位的pro-R氢负离子转移到莨菪醛的醛基碳上;Ser54的羟基作为广义酸,为与锌离子相互作用的氧提供质子,从而生成莨菪碱[119](图9).AbHDH催化的还原反应是可逆的,其还原效率是氧化效率的23.36倍[119]. ...
Functional characterization of recombinant hyoscyamine 6β-hydroxylase from Atropa belladonna
1
2012
... 托品和苯乳酰葡萄糖在海螺碱合成酶(AbLS)催化下生成海螺碱(littorine)[114];海螺碱变位酶(AbCYP80F1)催化重排和氧化反应,生成莨菪醛(hyoscyamine aldehyde)[23,115-116];莨菪碱-6β-羟化酶(AbH6H)立体选择性地羟基化C6,生成山莨菪碱(anisodamine),并进一步形成三元氧环生成东莨菪碱(图9)[117-118].通过解析AbHDH的蛋白晶体结构,揭示了其催化机制.AbHDH首先发生变构使锌离子与莨菪醛的醛基产生静电作用;NADPH C4位的pro-R氢负离子转移到莨菪醛的醛基碳上;Ser54的羟基作为广义酸,为与锌离子相互作用的氧提供质子,从而生成莨菪碱[119](图9).AbHDH催化的还原反应是可逆的,其还原效率是氧化效率的23.36倍[119]. ...
Biosynthesis of medicinal tropane alkaloids in yeast
1
2020
... 托品和苯乳酰葡萄糖在海螺碱合成酶(AbLS)催化下生成海螺碱(littorine)[114];海螺碱变位酶(AbCYP80F1)催化重排和氧化反应,生成莨菪醛(hyoscyamine aldehyde)[23,115-116];莨菪碱-6β-羟化酶(AbH6H)立体选择性地羟基化C6,生成山莨菪碱(anisodamine),并进一步形成三元氧环生成东莨菪碱(图9)[117-118].通过解析AbHDH的蛋白晶体结构,揭示了其催化机制.AbHDH首先发生变构使锌离子与莨菪醛的醛基产生静电作用;NADPH C4位的pro-R氢负离子转移到莨菪醛的醛基碳上;Ser54的羟基作为广义酸,为与锌离子相互作用的氧提供质子,从而生成莨菪碱[119](图9).AbHDH催化的还原反应是可逆的,其还原效率是氧化效率的23.36倍[119]. ...
Biochemical and metabolic insights into hyoscyamine dehydrogenase
2
2021
... 托品和苯乳酰葡萄糖在海螺碱合成酶(AbLS)催化下生成海螺碱(littorine)[114];海螺碱变位酶(AbCYP80F1)催化重排和氧化反应,生成莨菪醛(hyoscyamine aldehyde)[23,115-116];莨菪碱-6β-羟化酶(AbH6H)立体选择性地羟基化C6,生成山莨菪碱(anisodamine),并进一步形成三元氧环生成东莨菪碱(图9)[117-118].通过解析AbHDH的蛋白晶体结构,揭示了其催化机制.AbHDH首先发生变构使锌离子与莨菪醛的醛基产生静电作用;NADPH C4位的pro-R氢负离子转移到莨菪醛的醛基碳上;Ser54的羟基作为广义酸,为与锌离子相互作用的氧提供质子,从而生成莨菪碱[119](图9).AbHDH催化的还原反应是可逆的,其还原效率是氧化效率的23.36倍[119]. ...
... [119]. ...
Green production of silybin and isosilybin by merging metabolic engineering approaches and enzymatic catalysis
3
2020
... 中药的药效主要源于多成分作用的叠加或协同,极少源于单一成分(例如青蒿素)的活性.目前,中药药效物质的合成生物学研究主要集中在单一药效成分或药效成分群中某一单个成分的生物制备方法的构建.例如:通过联合运用细胞工厂和化学合成实现青蒿素的高效制备[27];分别构建了几种单一人参皂苷成分(包括人参皂苷CK、Rg3、Rh1、Rh2和F1)的细胞工厂[66,68,70-71].成分群的生物合成过程可分为两种情况:①成分群中的组成分子分别由不同的分支路径合成,如前所述的人参皂苷类成分群和淫羊藿苷类成分群;②成分群中的组成分子均由同一路径合成,如檀香挥发油.对于前一种情况,可以分别建立各种成员分子的生物制备方法,然后按照特定的比例进行组合;对于后一种情况,只能通过改造关键生物合成酶(即同时产生多种重要分子的生物合成酶),重塑其产物比例,从而达到精准调控目标成分群配比的目的.近年来,本课题组聚焦上述第二种中药药效成分群的合成生物学方法研究,建立了优质檀香挥发油的细胞工厂[28],实现了水飞蓟药效成分群的“从头”生物制备[120]. ...
... 在水飞蓟宾类成分的生物合成途径中,从酪氨酸到最终产物需要多达15个生物合成酶,并且涉及多种辅因子和毒性中间体.本课题组采用细胞工厂结合体外酶法的策略实现了水飞蓟宾类成分的“从头”合成[120].首先建立了紫杉叶素和松柏醇的细胞工厂.通过表达莽草酸/芳香氨基酸合成途径中两个关键酶的突变体ScARO4K229L和ScARO7G229S,解除酪氨酸对ScARO4和ScARO7的负反馈抑制作用.重点选择与前体供给、辅因子再生以及细胞耐受等多种因素关联的关键蛋白,开展优化,简化调控环节,从而减轻细胞负荷.例如:通过过表达TYR1和ARO8,既加速了前体化合物酪氨酸的合成,又促进了NADPH和α-酮戊二酸两种辅因子的再生循环;通过过表达ZWF1,既加快了NADPH循环,又显著降低了中间体松柏醛对酵母细胞的毒性(图11).最终,组合表达6种酵母内源基因以及14种来自于不同植物和细菌的异源基因,构建了紫杉叶素和松柏醇的细胞工厂.最后,采用大肠杆菌表达APX1t,通过体外酶法合成水飞蓟宾类化合物,经大孔吸附树脂纯化后,产率达301 mg/L,并且水飞蓟宾A、水飞蓟宾B以及异水飞蓟宾A、异水飞蓟宾B含量超过90%[120].从而实现了水飞蓟宾类药效成分的高度富集. ...
... [120].从而实现了水飞蓟宾类药效成分的高度富集. ...
Santalum album
1
2019
... 檀香及檀香挥发油被用于23种《中国药典》收录的成方制剂.如前所述,檀香挥发油包含八种主要药效分子:α-檀香醇、β-檀香醇、epi-β-檀香醇、exo-α-香柠檬醇、α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯.其中,α-檀香醇和β-檀香醇是药效指标成分,也是质控成分[36].只有20~30年树龄的印度产檀香的心材为优质药材,其挥发油中α-檀香醇和β-檀香醇的含量分别为41%~55%和16%~24%,然而由于过度开采,印度檀香资源已功能性灭绝,被列入《世界自然保护联盟濒危物种红色名录》[121]. ...
Reconstruction of the biosynthetic pathway of santalols under control of the GAL regulatory system in yeast
2
2020
... 系统的代谢工程研究,显著提高了檀香挥发油的产量[28,122-123].主要策略包括:通过优化甲羟戊酸途径,促进前体化合物DMAPP和IPP的合成;通过抑制酵母角鲨烯合酶(ERG9)以及敲除酵母二酰基焦磷酸磷酸酶(DPP1)和脂质磷酸磷酸酶(LPP1),降低三萜和法尼醇合成通路对FPP的消耗;优化从乙醇到乙酰辅酶A的转化途径,提高乙酰辅酶A的供给;敲除两种老黄酶(OYE2和OYE3)和两种酰基转移酶(ATF1和ATF2),阻止檀香醇向二氢檀香醇和乙酰二氢檀香醇的转化;通过敲除转录抑制因子ROX1,上调萜类生物合成基因的表达水平等[28,122].在研究中,首次发现RNA m6A修饰对萜类等化合物代谢途径的调控作用,并通过过表达RNA m6A甲基转移酶IME4,进一步提高檀香烯和檀香醇的产量,最终产量达到2.9 g/L[123]. ...
... ,122].在研究中,首次发现RNA m6A修饰对萜类等化合物代谢途径的调控作用,并通过过表达RNA m6A甲基转移酶IME4,进一步提高檀香烯和檀香醇的产量,最终产量达到2.9 g/L[123]. ...
Manipulation of IME4 expression, a global regulation strategy for metabolic engineering in Saccharomyces cerevisiae
3
2023
... 系统的代谢工程研究,显著提高了檀香挥发油的产量[28,122-123].主要策略包括:通过优化甲羟戊酸途径,促进前体化合物DMAPP和IPP的合成;通过抑制酵母角鲨烯合酶(ERG9)以及敲除酵母二酰基焦磷酸磷酸酶(DPP1)和脂质磷酸磷酸酶(LPP1),降低三萜和法尼醇合成通路对FPP的消耗;优化从乙醇到乙酰辅酶A的转化途径,提高乙酰辅酶A的供给;敲除两种老黄酶(OYE2和OYE3)和两种酰基转移酶(ATF1和ATF2),阻止檀香醇向二氢檀香醇和乙酰二氢檀香醇的转化;通过敲除转录抑制因子ROX1,上调萜类生物合成基因的表达水平等[28,122].在研究中,首次发现RNA m6A修饰对萜类等化合物代谢途径的调控作用,并通过过表达RNA m6A甲基转移酶IME4,进一步提高檀香烯和檀香醇的产量,最终产量达到2.9 g/L[123]. ...
... [123]. ...
... 目前,在天然产物(包括中药药效成分群)的合成生物学研究中,所采用的代谢优化方法十分有限,可操控的生物元件无外乎代谢基因[127]、启动子[128]、终止子[129]、转录因子[130]、转运蛋白[131]、辅因子[132]和亚细胞结构[133].事实上,生物体中的代谢调控网络极其复杂,人们对其所知仍然十分有限,这就成为制约合成生物学研究的根本问题[134].尤其对于萜类和芳香类等研究最集中的中药药效物质,由于这些类型化合物的生物合成过程规律性强,所以采用的代谢优化策略同质化现象十分突出,难以突破产量的瓶颈.最近,发现RNA m6A修饰与酿酒酵母中许多重要的代谢通路相关联,例如乙酰辅酶A合成途径、莽草酸途径、多种辅因子的合成和再生途径等;通过过表达RNA m6A甲基转移酶IME4,可以显著提高萜类和芳香类化合物的产量,从而为代谢工程研究提供了一种新策略[123].未来需更深入、系统地研究重要宿主细胞的代谢调控机制,并在发现新机制的基础上发展全新的代谢调控方法,以此突破目前优化手段缺乏的困境. ...
Spatial organization of silybin biosynthesis in milk thistle[Silybum marianum (L.) Gaertn]
1
2017
... 《中国药典》收录的药材水飞蓟为菊科植物水飞蓟Silybum marianum(L.)Gaertn的干燥成熟果实,具有清热解毒、疏肝利胆的功效.水飞蓟宾类成分是水飞蓟的药效物质,对肝炎等多种肝脏疾病具有显著疗效,其中主要药效成分为水飞蓟宾(silybin)A、水飞蓟宾B以及异水飞蓟宾(isosilybin)A、异水飞蓟宾B.除这四种药效成分外,水飞蓟还含有其他19种结构类似的化合物,致使四种药效成分的定向富集十分困难[12].水飞蓟宾类化合物的两个生物合成前体紫杉叶素(taxifolin)和松柏醇(coniferyl alcohol)分别属于黄酮和苯丙素.因此,水飞蓟宾类化合物属于黄酮与苯丙素的杂合化合物,其生物合成途径包含了典型的黄酮和苯丙素途径(图11).水飞蓟中的过氧化物酶(APX1)负责催化紫杉叶素和松柏醇偶联,生成水飞蓟宾A、水飞蓟宾B以及异水飞蓟宾A、异水飞蓟宾B(图11)[124].因此,APX1是实现水飞蓟宾A、水飞蓟宾B以及异水飞蓟宾A、异水飞蓟宾B四种药效成分定向合成的关键酶. ...
Complete biosynthesis of opioids in yeast
1
2015
... 阐明药效物质的生物合成机制是建立其合成生物学制备方法的前提,然而大多数中药材的药效成分群的形成机制尚未完整解析.2020版《中国药典》收录了600多种中药材.这些药材中,药效成分的形成机制被完全阐明的属凤毛麟角.即使对于人参皂苷等研究最广泛的药效成分群,其生物合成途径也尚未完整揭示.而且,目前途径解析研究主要集中在萜类、黄酮、木脂素等类型的化合物,这些类型化合物的生物合成过程具有较强的规律性,相对容易被揭示.而对于生物碱类化合物,结构类型多样,相应的生物合成过程大相径庭,难有规律可循,因此研究难度较大,目前仅在苄基异喹啉类[125-126]、秋水仙碱类[13]、托品烷类[21-26]等少数几种生物碱的途径解析中取得了突破性进展,未来需要加强该方面的研究.此外,成分群生物合成研究不仅要表征生物合成酶,还要准确锁定真正控制成分比例的关键酶并揭示其控制产物多样性的机制.对于存在多种同工酶的情况,需要揭示各个同工酶在产物类型和比例上的精细差别. ...
Analysis of the Coptis chinensis genome reveals the diversification of protoberberine-type alkaloids
1
2021
... 阐明药效物质的生物合成机制是建立其合成生物学制备方法的前提,然而大多数中药材的药效成分群的形成机制尚未完整解析.2020版《中国药典》收录了600多种中药材.这些药材中,药效成分的形成机制被完全阐明的属凤毛麟角.即使对于人参皂苷等研究最广泛的药效成分群,其生物合成途径也尚未完整揭示.而且,目前途径解析研究主要集中在萜类、黄酮、木脂素等类型的化合物,这些类型化合物的生物合成过程具有较强的规律性,相对容易被揭示.而对于生物碱类化合物,结构类型多样,相应的生物合成过程大相径庭,难有规律可循,因此研究难度较大,目前仅在苄基异喹啉类[125-126]、秋水仙碱类[13]、托品烷类[21-26]等少数几种生物碱的途径解析中取得了突破性进展,未来需要加强该方面的研究.此外,成分群生物合成研究不仅要表征生物合成酶,还要准确锁定真正控制成分比例的关键酶并揭示其控制产物多样性的机制.对于存在多种同工酶的情况,需要揭示各个同工酶在产物类型和比例上的精细差别. ...
De novo production of resveratrol from glucose or ethanol by engineered Saccharomyces cerevisiae
1
2015
... 目前,在天然产物(包括中药药效成分群)的合成生物学研究中,所采用的代谢优化方法十分有限,可操控的生物元件无外乎代谢基因[127]、启动子[128]、终止子[129]、转录因子[130]、转运蛋白[131]、辅因子[132]和亚细胞结构[133].事实上,生物体中的代谢调控网络极其复杂,人们对其所知仍然十分有限,这就成为制约合成生物学研究的根本问题[134].尤其对于萜类和芳香类等研究最集中的中药药效物质,由于这些类型化合物的生物合成过程规律性强,所以采用的代谢优化策略同质化现象十分突出,难以突破产量的瓶颈.最近,发现RNA m6A修饰与酿酒酵母中许多重要的代谢通路相关联,例如乙酰辅酶A合成途径、莽草酸途径、多种辅因子的合成和再生途径等;通过过表达RNA m6A甲基转移酶IME4,可以显著提高萜类和芳香类化合物的产量,从而为代谢工程研究提供了一种新策略[123].未来需更深入、系统地研究重要宿主细胞的代谢调控机制,并在发现新机制的基础上发展全新的代谢调控方法,以此突破目前优化手段缺乏的困境. ...
Tuning genetic control through promoter engineering
1
2005
... 目前,在天然产物(包括中药药效成分群)的合成生物学研究中,所采用的代谢优化方法十分有限,可操控的生物元件无外乎代谢基因[127]、启动子[128]、终止子[129]、转录因子[130]、转运蛋白[131]、辅因子[132]和亚细胞结构[133].事实上,生物体中的代谢调控网络极其复杂,人们对其所知仍然十分有限,这就成为制约合成生物学研究的根本问题[134].尤其对于萜类和芳香类等研究最集中的中药药效物质,由于这些类型化合物的生物合成过程规律性强,所以采用的代谢优化策略同质化现象十分突出,难以突破产量的瓶颈.最近,发现RNA m6A修饰与酿酒酵母中许多重要的代谢通路相关联,例如乙酰辅酶A合成途径、莽草酸途径、多种辅因子的合成和再生途径等;通过过表达RNA m6A甲基转移酶IME4,可以显著提高萜类和芳香类化合物的产量,从而为代谢工程研究提供了一种新策略[123].未来需更深入、系统地研究重要宿主细胞的代谢调控机制,并在发现新机制的基础上发展全新的代谢调控方法,以此突破目前优化手段缺乏的困境. ...
Use of expression-enhancing terminators in Saccharomyces cerevisiae to increase mRNA half-life and improve gene expression control for metabolic engineering applications
1
2013
... 目前,在天然产物(包括中药药效成分群)的合成生物学研究中,所采用的代谢优化方法十分有限,可操控的生物元件无外乎代谢基因[127]、启动子[128]、终止子[129]、转录因子[130]、转运蛋白[131]、辅因子[132]和亚细胞结构[133].事实上,生物体中的代谢调控网络极其复杂,人们对其所知仍然十分有限,这就成为制约合成生物学研究的根本问题[134].尤其对于萜类和芳香类等研究最集中的中药药效物质,由于这些类型化合物的生物合成过程规律性强,所以采用的代谢优化策略同质化现象十分突出,难以突破产量的瓶颈.最近,发现RNA m6A修饰与酿酒酵母中许多重要的代谢通路相关联,例如乙酰辅酶A合成途径、莽草酸途径、多种辅因子的合成和再生途径等;通过过表达RNA m6A甲基转移酶IME4,可以显著提高萜类和芳香类化合物的产量,从而为代谢工程研究提供了一种新策略[123].未来需更深入、系统地研究重要宿主细胞的代谢调控机制,并在发现新机制的基础上发展全新的代谢调控方法,以此突破目前优化手段缺乏的困境. ...
Engineering yeast transcription machinery for improved ethanol tolerance and production
1
2006
... 目前,在天然产物(包括中药药效成分群)的合成生物学研究中,所采用的代谢优化方法十分有限,可操控的生物元件无外乎代谢基因[127]、启动子[128]、终止子[129]、转录因子[130]、转运蛋白[131]、辅因子[132]和亚细胞结构[133].事实上,生物体中的代谢调控网络极其复杂,人们对其所知仍然十分有限,这就成为制约合成生物学研究的根本问题[134].尤其对于萜类和芳香类等研究最集中的中药药效物质,由于这些类型化合物的生物合成过程规律性强,所以采用的代谢优化策略同质化现象十分突出,难以突破产量的瓶颈.最近,发现RNA m6A修饰与酿酒酵母中许多重要的代谢通路相关联,例如乙酰辅酶A合成途径、莽草酸途径、多种辅因子的合成和再生途径等;通过过表达RNA m6A甲基转移酶IME4,可以显著提高萜类和芳香类化合物的产量,从而为代谢工程研究提供了一种新策略[123].未来需更深入、系统地研究重要宿主细胞的代谢调控机制,并在发现新机制的基础上发展全新的代谢调控方法,以此突破目前优化手段缺乏的困境. ...
Heterologous transporter expression for improved fatty alcohol secretion in yeast
1
2018
... 目前,在天然产物(包括中药药效成分群)的合成生物学研究中,所采用的代谢优化方法十分有限,可操控的生物元件无外乎代谢基因[127]、启动子[128]、终止子[129]、转录因子[130]、转运蛋白[131]、辅因子[132]和亚细胞结构[133].事实上,生物体中的代谢调控网络极其复杂,人们对其所知仍然十分有限,这就成为制约合成生物学研究的根本问题[134].尤其对于萜类和芳香类等研究最集中的中药药效物质,由于这些类型化合物的生物合成过程规律性强,所以采用的代谢优化策略同质化现象十分突出,难以突破产量的瓶颈.最近,发现RNA m6A修饰与酿酒酵母中许多重要的代谢通路相关联,例如乙酰辅酶A合成途径、莽草酸途径、多种辅因子的合成和再生途径等;通过过表达RNA m6A甲基转移酶IME4,可以显著提高萜类和芳香类化合物的产量,从而为代谢工程研究提供了一种新策略[123].未来需更深入、系统地研究重要宿主细胞的代谢调控机制,并在发现新机制的基础上发展全新的代谢调控方法,以此突破目前优化手段缺乏的困境. ...
Engineering cofactor supply and recycling to drive phenolic acid biosynthesis in yeast
1
2022
... 目前,在天然产物(包括中药药效成分群)的合成生物学研究中,所采用的代谢优化方法十分有限,可操控的生物元件无外乎代谢基因[127]、启动子[128]、终止子[129]、转录因子[130]、转运蛋白[131]、辅因子[132]和亚细胞结构[133].事实上,生物体中的代谢调控网络极其复杂,人们对其所知仍然十分有限,这就成为制约合成生物学研究的根本问题[134].尤其对于萜类和芳香类等研究最集中的中药药效物质,由于这些类型化合物的生物合成过程规律性强,所以采用的代谢优化策略同质化现象十分突出,难以突破产量的瓶颈.最近,发现RNA m6A修饰与酿酒酵母中许多重要的代谢通路相关联,例如乙酰辅酶A合成途径、莽草酸途径、多种辅因子的合成和再生途径等;通过过表达RNA m6A甲基转移酶IME4,可以显著提高萜类和芳香类化合物的产量,从而为代谢工程研究提供了一种新策略[123].未来需更深入、系统地研究重要宿主细胞的代谢调控机制,并在发现新机制的基础上发展全新的代谢调控方法,以此突破目前优化手段缺乏的困境. ...
Harnessing yeast organelles for metabolic engineering
1
2017
... 目前,在天然产物(包括中药药效成分群)的合成生物学研究中,所采用的代谢优化方法十分有限,可操控的生物元件无外乎代谢基因[127]、启动子[128]、终止子[129]、转录因子[130]、转运蛋白[131]、辅因子[132]和亚细胞结构[133].事实上,生物体中的代谢调控网络极其复杂,人们对其所知仍然十分有限,这就成为制约合成生物学研究的根本问题[134].尤其对于萜类和芳香类等研究最集中的中药药效物质,由于这些类型化合物的生物合成过程规律性强,所以采用的代谢优化策略同质化现象十分突出,难以突破产量的瓶颈.最近,发现RNA m6A修饰与酿酒酵母中许多重要的代谢通路相关联,例如乙酰辅酶A合成途径、莽草酸途径、多种辅因子的合成和再生途径等;通过过表达RNA m6A甲基转移酶IME4,可以显著提高萜类和芳香类化合物的产量,从而为代谢工程研究提供了一种新策略[123].未来需更深入、系统地研究重要宿主细胞的代谢调控机制,并在发现新机制的基础上发展全新的代谢调控方法,以此突破目前优化手段缺乏的困境. ...
Engineering cellular metabolism
1
2016
... 目前,在天然产物(包括中药药效成分群)的合成生物学研究中,所采用的代谢优化方法十分有限,可操控的生物元件无外乎代谢基因[127]、启动子[128]、终止子[129]、转录因子[130]、转运蛋白[131]、辅因子[132]和亚细胞结构[133].事实上,生物体中的代谢调控网络极其复杂,人们对其所知仍然十分有限,这就成为制约合成生物学研究的根本问题[134].尤其对于萜类和芳香类等研究最集中的中药药效物质,由于这些类型化合物的生物合成过程规律性强,所以采用的代谢优化策略同质化现象十分突出,难以突破产量的瓶颈.最近,发现RNA m6A修饰与酿酒酵母中许多重要的代谢通路相关联,例如乙酰辅酶A合成途径、莽草酸途径、多种辅因子的合成和再生途径等;通过过表达RNA m6A甲基转移酶IME4,可以显著提高萜类和芳香类化合物的产量,从而为代谢工程研究提供了一种新策略[123].未来需更深入、系统地研究重要宿主细胞的代谢调控机制,并在发现新机制的基础上发展全新的代谢调控方法,以此突破目前优化手段缺乏的困境. ...
Structure-driven protein engineering for production of valuable natural products
1
2023
... 如前所述,成分的比例决定了成分群的药效,所以有效地控制成分比例对于制造高品质的药效成分群至关重要.成分的比例往往由关键生物合成酶控制,如檀香挥发油的成分比例由檀香烯合酶控制[28].因此,通过改造关键酶,可优化成分比例.前面采用理性设计对檀香烯合酶进行改造,起到了优化效果.然而,理性设计要求揭示目标酶的结构和机制,并且往往仅能针对活性口袋内的氨基酸进行改造[135].活性口袋外部的氨基酸可能与酶的构象等特征相关联,因此也可能影响酶的催化功能(如产物的类型和比例等).定向进化可以在未揭示酶的结构和催化机制的情况下,对酶进行系统的改造(既包括活性口袋内部的氨基酸,也包括活性口袋外部的氨基酸),但是需要筛选大量的突变酶[136].因此,未来需要联合理性设计和定向进化两种方法,充分发挥两种方法的优势,通过更有效地改造关键酶,优化成分比例.此外,人工智能辅助的设计技术[137]和新型高通量筛选技术[138]也将推动酶工程领域的高速发展. ...
Directed evolution: methodologies and applications
1
2021
... 如前所述,成分的比例决定了成分群的药效,所以有效地控制成分比例对于制造高品质的药效成分群至关重要.成分的比例往往由关键生物合成酶控制,如檀香挥发油的成分比例由檀香烯合酶控制[28].因此,通过改造关键酶,可优化成分比例.前面采用理性设计对檀香烯合酶进行改造,起到了优化效果.然而,理性设计要求揭示目标酶的结构和机制,并且往往仅能针对活性口袋内的氨基酸进行改造[135].活性口袋外部的氨基酸可能与酶的构象等特征相关联,因此也可能影响酶的催化功能(如产物的类型和比例等).定向进化可以在未揭示酶的结构和催化机制的情况下,对酶进行系统的改造(既包括活性口袋内部的氨基酸,也包括活性口袋外部的氨基酸),但是需要筛选大量的突变酶[136].因此,未来需要联合理性设计和定向进化两种方法,充分发挥两种方法的优势,通过更有效地改造关键酶,优化成分比例.此外,人工智能辅助的设计技术[137]和新型高通量筛选技术[138]也将推动酶工程领域的高速发展. ...
The road to fully programmable protein catalysis
1
2022
... 如前所述,成分的比例决定了成分群的药效,所以有效地控制成分比例对于制造高品质的药效成分群至关重要.成分的比例往往由关键生物合成酶控制,如檀香挥发油的成分比例由檀香烯合酶控制[28].因此,通过改造关键酶,可优化成分比例.前面采用理性设计对檀香烯合酶进行改造,起到了优化效果.然而,理性设计要求揭示目标酶的结构和机制,并且往往仅能针对活性口袋内的氨基酸进行改造[135].活性口袋外部的氨基酸可能与酶的构象等特征相关联,因此也可能影响酶的催化功能(如产物的类型和比例等).定向进化可以在未揭示酶的结构和催化机制的情况下,对酶进行系统的改造(既包括活性口袋内部的氨基酸,也包括活性口袋外部的氨基酸),但是需要筛选大量的突变酶[136].因此,未来需要联合理性设计和定向进化两种方法,充分发挥两种方法的优势,通过更有效地改造关键酶,优化成分比例.此外,人工智能辅助的设计技术[137]和新型高通量筛选技术[138]也将推动酶工程领域的高速发展. ...
A high-throughput mass spectrometric enzyme activity assay enabling the discovery of cytochrome P450 biocatalysts
1
2019
... 如前所述,成分的比例决定了成分群的药效,所以有效地控制成分比例对于制造高品质的药效成分群至关重要.成分的比例往往由关键生物合成酶控制,如檀香挥发油的成分比例由檀香烯合酶控制[28].因此,通过改造关键酶,可优化成分比例.前面采用理性设计对檀香烯合酶进行改造,起到了优化效果.然而,理性设计要求揭示目标酶的结构和机制,并且往往仅能针对活性口袋内的氨基酸进行改造[135].活性口袋外部的氨基酸可能与酶的构象等特征相关联,因此也可能影响酶的催化功能(如产物的类型和比例等).定向进化可以在未揭示酶的结构和催化机制的情况下,对酶进行系统的改造(既包括活性口袋内部的氨基酸,也包括活性口袋外部的氨基酸),但是需要筛选大量的突变酶[136].因此,未来需要联合理性设计和定向进化两种方法,充分发挥两种方法的优势,通过更有效地改造关键酶,优化成分比例.此外,人工智能辅助的设计技术[137]和新型高通量筛选技术[138]也将推动酶工程领域的高速发展. ...