High-level semi-synthetic production of the potent antimalarial artemisinin
1
2013
... 酿酒酵母作为简单的模式真核生物已经实现了多种萜类物质的高效合成,部分物质已经实现了工业化,如青蒿素前体物质青蒿酸[22]、化工原料法尼烯[23].随着生物技术的发展,一些非常规酵母如解脂耶氏酵母、热带假丝酵母等在萜类生产中的优势越来越突出.解脂耶氏酵母(Yarrowia lipolytica)与酿酒酵母相比乙酰辅酶A含量更高,且没有Crabtree效应,耐盐、耐低温并能在低pH值的环境生长,而且能利用葡萄糖、废弃的食用油、乙醇、甘油等多种底物[24].许多萜类物质(如β-胡萝卜素、番茄红素等)的生物合成在解脂耶氏酵母中无需复杂改造便能获得比酿酒酵母更高的滴度[25].2023年,Blenner团队[26]在解脂耶氏酵母里仅进行了较为简单的代谢改造就获得了1 g/L的香叶醇,是迄今为止在酵母中的最高滴度,这充分表明了解脂耶氏酵母生产香叶醇等单萜的潜力.Wei等[27]在解脂耶氏酵母中通过构建α-蒎烯正交生物合成途径、启动子工程、优化前体途径和提高蛋白质溶解度,在葡萄糖为唯一碳源时,α-蒎烯的产量为19.6 mg/L,比初始产量显著提高了218倍.随后在废食用油和木质纤维素水解液培养基中成功获得了33.8 mg/L和36.1 mg/L的α-蒎烯产量,是迄今为止在酵母中报道的最高产量. ...
Rewriting yeast central carbon metabolism for industrial isoprenoid production
1
2016
... 酿酒酵母作为简单的模式真核生物已经实现了多种萜类物质的高效合成,部分物质已经实现了工业化,如青蒿素前体物质青蒿酸[22]、化工原料法尼烯[23].随着生物技术的发展,一些非常规酵母如解脂耶氏酵母、热带假丝酵母等在萜类生产中的优势越来越突出.解脂耶氏酵母(Yarrowia lipolytica)与酿酒酵母相比乙酰辅酶A含量更高,且没有Crabtree效应,耐盐、耐低温并能在低pH值的环境生长,而且能利用葡萄糖、废弃的食用油、乙醇、甘油等多种底物[24].许多萜类物质(如β-胡萝卜素、番茄红素等)的生物合成在解脂耶氏酵母中无需复杂改造便能获得比酿酒酵母更高的滴度[25].2023年,Blenner团队[26]在解脂耶氏酵母里仅进行了较为简单的代谢改造就获得了1 g/L的香叶醇,是迄今为止在酵母中的最高滴度,这充分表明了解脂耶氏酵母生产香叶醇等单萜的潜力.Wei等[27]在解脂耶氏酵母中通过构建α-蒎烯正交生物合成途径、启动子工程、优化前体途径和提高蛋白质溶解度,在葡萄糖为唯一碳源时,α-蒎烯的产量为19.6 mg/L,比初始产量显著提高了218倍.随后在废食用油和木质纤维素水解液培养基中成功获得了33.8 mg/L和36.1 mg/L的α-蒎烯产量,是迄今为止在酵母中报道的最高产量. ...
Advanced strategies for the synthesis of terpenoids in Yarrowia lipolytica
1
2021
... 酿酒酵母作为简单的模式真核生物已经实现了多种萜类物质的高效合成,部分物质已经实现了工业化,如青蒿素前体物质青蒿酸[22]、化工原料法尼烯[23].随着生物技术的发展,一些非常规酵母如解脂耶氏酵母、热带假丝酵母等在萜类生产中的优势越来越突出.解脂耶氏酵母(Yarrowia lipolytica)与酿酒酵母相比乙酰辅酶A含量更高,且没有Crabtree效应,耐盐、耐低温并能在低pH值的环境生长,而且能利用葡萄糖、废弃的食用油、乙醇、甘油等多种底物[24].许多萜类物质(如β-胡萝卜素、番茄红素等)的生物合成在解脂耶氏酵母中无需复杂改造便能获得比酿酒酵母更高的滴度[25].2023年,Blenner团队[26]在解脂耶氏酵母里仅进行了较为简单的代谢改造就获得了1 g/L的香叶醇,是迄今为止在酵母中的最高滴度,这充分表明了解脂耶氏酵母生产香叶醇等单萜的潜力.Wei等[27]在解脂耶氏酵母中通过构建α-蒎烯正交生物合成途径、启动子工程、优化前体途径和提高蛋白质溶解度,在葡萄糖为唯一碳源时,α-蒎烯的产量为19.6 mg/L,比初始产量显著提高了218倍.随后在废食用油和木质纤维素水解液培养基中成功获得了33.8 mg/L和36.1 mg/L的α-蒎烯产量,是迄今为止在酵母中报道的最高产量. ...
A synthetic biology approach to transform Yarrowia lipolytica into a competitive biotechnological producer of β-carotene
1
2018
... 酿酒酵母作为简单的模式真核生物已经实现了多种萜类物质的高效合成,部分物质已经实现了工业化,如青蒿素前体物质青蒿酸[22]、化工原料法尼烯[23].随着生物技术的发展,一些非常规酵母如解脂耶氏酵母、热带假丝酵母等在萜类生产中的优势越来越突出.解脂耶氏酵母(Yarrowia lipolytica)与酿酒酵母相比乙酰辅酶A含量更高,且没有Crabtree效应,耐盐、耐低温并能在低pH值的环境生长,而且能利用葡萄糖、废弃的食用油、乙醇、甘油等多种底物[24].许多萜类物质(如β-胡萝卜素、番茄红素等)的生物合成在解脂耶氏酵母中无需复杂改造便能获得比酿酒酵母更高的滴度[25].2023年,Blenner团队[26]在解脂耶氏酵母里仅进行了较为简单的代谢改造就获得了1 g/L的香叶醇,是迄今为止在酵母中的最高滴度,这充分表明了解脂耶氏酵母生产香叶醇等单萜的潜力.Wei等[27]在解脂耶氏酵母中通过构建α-蒎烯正交生物合成途径、启动子工程、优化前体途径和提高蛋白质溶解度,在葡萄糖为唯一碳源时,α-蒎烯的产量为19.6 mg/L,比初始产量显著提高了218倍.随后在废食用油和木质纤维素水解液培养基中成功获得了33.8 mg/L和36.1 mg/L的α-蒎烯产量,是迄今为止在酵母中报道的最高产量. ...
Engineering Yarrowia lipolytica for the biosynthesis of geraniol
2
2023
... 酿酒酵母作为简单的模式真核生物已经实现了多种萜类物质的高效合成,部分物质已经实现了工业化,如青蒿素前体物质青蒿酸[22]、化工原料法尼烯[23].随着生物技术的发展,一些非常规酵母如解脂耶氏酵母、热带假丝酵母等在萜类生产中的优势越来越突出.解脂耶氏酵母(Yarrowia lipolytica)与酿酒酵母相比乙酰辅酶A含量更高,且没有Crabtree效应,耐盐、耐低温并能在低pH值的环境生长,而且能利用葡萄糖、废弃的食用油、乙醇、甘油等多种底物[24].许多萜类物质(如β-胡萝卜素、番茄红素等)的生物合成在解脂耶氏酵母中无需复杂改造便能获得比酿酒酵母更高的滴度[25].2023年,Blenner团队[26]在解脂耶氏酵母里仅进行了较为简单的代谢改造就获得了1 g/L的香叶醇,是迄今为止在酵母中的最高滴度,这充分表明了解脂耶氏酵母生产香叶醇等单萜的潜力.Wei等[27]在解脂耶氏酵母中通过构建α-蒎烯正交生物合成途径、启动子工程、优化前体途径和提高蛋白质溶解度,在葡萄糖为唯一碳源时,α-蒎烯的产量为19.6 mg/L,比初始产量显著提高了218倍.随后在废食用油和木质纤维素水解液培养基中成功获得了33.8 mg/L和36.1 mg/L的α-蒎烯产量,是迄今为止在酵母中报道的最高产量. ...
... ②过表达3拷贝的
tCrGES和单拷贝的
ERG10、
HMGS、
tHMG1、
IDI11000 | [26] | | 甘油假丝酵母 | ①MVA与IUP双途径 ...
Biosynthesis of α-pinene by genetically engineered Yarrowia lipolytica from low-cost renewable feedstocks
4
2021
... 酿酒酵母作为简单的模式真核生物已经实现了多种萜类物质的高效合成,部分物质已经实现了工业化,如青蒿素前体物质青蒿酸[22]、化工原料法尼烯[23].随着生物技术的发展,一些非常规酵母如解脂耶氏酵母、热带假丝酵母等在萜类生产中的优势越来越突出.解脂耶氏酵母(Yarrowia lipolytica)与酿酒酵母相比乙酰辅酶A含量更高,且没有Crabtree效应,耐盐、耐低温并能在低pH值的环境生长,而且能利用葡萄糖、废弃的食用油、乙醇、甘油等多种底物[24].许多萜类物质(如β-胡萝卜素、番茄红素等)的生物合成在解脂耶氏酵母中无需复杂改造便能获得比酿酒酵母更高的滴度[25].2023年,Blenner团队[26]在解脂耶氏酵母里仅进行了较为简单的代谢改造就获得了1 g/L的香叶醇,是迄今为止在酵母中的最高滴度,这充分表明了解脂耶氏酵母生产香叶醇等单萜的潜力.Wei等[27]在解脂耶氏酵母中通过构建α-蒎烯正交生物合成途径、启动子工程、优化前体途径和提高蛋白质溶解度,在葡萄糖为唯一碳源时,α-蒎烯的产量为19.6 mg/L,比初始产量显著提高了218倍.随后在废食用油和木质纤维素水解液培养基中成功获得了33.8 mg/L和36.1 mg/L的α-蒎烯产量,是迄今为止在酵母中报道的最高产量. ...
... ②利用餐厨废油和木质纤维素水解液作为碳源 | 36.1 | [27] |
| 甘油假丝酵母 | ①强化MVA路径并引入NPP合酶 ...
... HMGR是MVA途径的关键限速酶,其包含两个同工酶HMG1和HMG2,其中HMG1较稳定,HMG2易被细胞降解,两个酶都受不同机制的负反馈调控[56].目前过表达截短的HMR1(tHMG1)已经成为萜类化合物生产中增强前体供应的通用手段.Cao等[15]在解脂耶氏酵母中单独过表达tHMG1使柠檬烯产量比对照菌株提高了约18倍,而同时过表达ERG12和HMG1柠檬烯产量提高了112倍.Wei等[27]过表达HMGR、ERG8与ERG12,α-蒎烯产量提高了13.5倍.由于MVA路径只能产生IPP而不能产生DMAPP,IDI1催化IPP和DMAPP之间的异构化,这使得IDI1酶在单萜的生产中是必不可少的.Ignea等在酿酒酵母中过表达IDI1分别使桧烯和桉树脑产量提高了3倍[57]和5倍[58].当在香叶醇生产中采用相同的策略时,其产量提高了1.45倍[59]. ...
... 优化培养基对促进菌株生长和发酵过程中产物生成具有基础性作用.培养基中不同种类和比例的碳氮源对菌株有不同的影响,当初始葡萄糖浓度改变时,细胞的生长状况也会受到影响,适当的碳氮比可以显著提高细胞的活性[101].Wei等[27]利用厨房废油(WCO)作为碳源在解脂耶氏酵母中成功地实现了合成33.8 mg/L滴度的α-蒎烯,为微生物利用廉价碳源生产单萜类化合物奠定了基础.添加辅助碳源在一定程度上可以促进单萜合成,Cheng等[42]发现当解脂耶氏酵母以甘油为初级碳源、柠檬酸为辅助碳源时,柠檬烯的产量高于以葡萄糖为初级碳源时的产量,柠檬烯产量达到最大值165.3 mg/L.适当的金属离子浓度能够提高酶活,Zhang等[102]研究了在工程菌中添加不同浓度的Mg2+对芳樟醇产量的影响,当在培养基中添加10 mmol/L Mg2+时,芳樟醇产量提高了27%. ...
Glycerol production by a novel osmotolerant yeast Candida glycerinogenes
1
2001
... 产甘油假丝酵母(Candida glycerinogenes)是在高渗透压环境下从天然样品中分离得到的一株GRAS耐高渗工业酵母[28],具有生长迅速、无特殊营养要求的优点,且耐高渗透压、氧化、高热和低pH等多种环境胁迫,是潜在的优良工业底盘细胞[29].马腾飞等[30]最初用α-蒎烯刺激产甘油假丝酵母可以上调MVA途径基因的表达,提高麦角甾醇的含量.随后发现产甘油假丝酵母的蒎烯耐受性是酿酒酵母的5倍,通过强化MVA路径并引入NPP合酶、过表达Hog1基因与外源磷酸酶、添加NaCl升高渗透压促使角鲨烯应答,最后通过优化培养基及5 L发酵罐扩大培养得到16.4 mg/L滴度的蒎烯[31].Zhao等[32]利用MVA和IUP双途径,在天然启动子PGAP的基础上,开发了癸烷响应的杂合启动子,不仅启动子的转录强度提高到了原始的3.6倍,而且有效分离了细胞生长和产物形成,最终在摇瓶水平上获得1194.6 mg/L香叶醇. ...
Identification of key residues for efficient glucose transport by the hexose transporter CgHxt4 in high sugar fermentation yeast Candida glycerinogenes
1
2021
... 产甘油假丝酵母(Candida glycerinogenes)是在高渗透压环境下从天然样品中分离得到的一株GRAS耐高渗工业酵母[28],具有生长迅速、无特殊营养要求的优点,且耐高渗透压、氧化、高热和低pH等多种环境胁迫,是潜在的优良工业底盘细胞[29].马腾飞等[30]最初用α-蒎烯刺激产甘油假丝酵母可以上调MVA途径基因的表达,提高麦角甾醇的含量.随后发现产甘油假丝酵母的蒎烯耐受性是酿酒酵母的5倍,通过强化MVA路径并引入NPP合酶、过表达Hog1基因与外源磷酸酶、添加NaCl升高渗透压促使角鲨烯应答,最后通过优化培养基及5 L发酵罐扩大培养得到16.4 mg/L滴度的蒎烯[31].Zhao等[32]利用MVA和IUP双途径,在天然启动子PGAP的基础上,开发了癸烷响应的杂合启动子,不仅启动子的转录强度提高到了原始的3.6倍,而且有效分离了细胞生长和产物形成,最终在摇瓶水平上获得1194.6 mg/L香叶醇. ...
Effects of trehalose and ergosterol on pinene stress of Candida glycerinogenes
1
2023
... 产甘油假丝酵母(Candida glycerinogenes)是在高渗透压环境下从天然样品中分离得到的一株GRAS耐高渗工业酵母[28],具有生长迅速、无特殊营养要求的优点,且耐高渗透压、氧化、高热和低pH等多种环境胁迫,是潜在的优良工业底盘细胞[29].马腾飞等[30]最初用α-蒎烯刺激产甘油假丝酵母可以上调MVA途径基因的表达,提高麦角甾醇的含量.随后发现产甘油假丝酵母的蒎烯耐受性是酿酒酵母的5倍,通过强化MVA路径并引入NPP合酶、过表达Hog1基因与外源磷酸酶、添加NaCl升高渗透压促使角鲨烯应答,最后通过优化培养基及5 L发酵罐扩大培养得到16.4 mg/L滴度的蒎烯[31].Zhao等[32]利用MVA和IUP双途径,在天然启动子PGAP的基础上,开发了癸烷响应的杂合启动子,不仅启动子的转录强度提高到了原始的3.6倍,而且有效分离了细胞生长和产物形成,最终在摇瓶水平上获得1194.6 mg/L香叶醇. ...
Candida glycerinogenes蒎烯耐受性及其生物合成研究
2
2023
... 产甘油假丝酵母(Candida glycerinogenes)是在高渗透压环境下从天然样品中分离得到的一株GRAS耐高渗工业酵母[28],具有生长迅速、无特殊营养要求的优点,且耐高渗透压、氧化、高热和低pH等多种环境胁迫,是潜在的优良工业底盘细胞[29].马腾飞等[30]最初用α-蒎烯刺激产甘油假丝酵母可以上调MVA途径基因的表达,提高麦角甾醇的含量.随后发现产甘油假丝酵母的蒎烯耐受性是酿酒酵母的5倍,通过强化MVA路径并引入NPP合酶、过表达Hog1基因与外源磷酸酶、添加NaCl升高渗透压促使角鲨烯应答,最后通过优化培养基及5 L发酵罐扩大培养得到16.4 mg/L滴度的蒎烯[31].Zhao等[32]利用MVA和IUP双途径,在天然启动子PGAP的基础上,开发了癸烷响应的杂合启动子,不仅启动子的转录强度提高到了原始的3.6倍,而且有效分离了细胞生长和产物形成,最终在摇瓶水平上获得1194.6 mg/L香叶醇. ...
... ⑤优化培养基及5 L发酵罐扩大 | 16.4 | [31] |
| 桧烯 | 酿酒酵母 | ①在细胞质和线粒体中同时表达t34SabS1 ...
Cell tolernce and biosynthesis of pinene in Candida glycerinogenes
2
2023
... 产甘油假丝酵母(Candida glycerinogenes)是在高渗透压环境下从天然样品中分离得到的一株GRAS耐高渗工业酵母[28],具有生长迅速、无特殊营养要求的优点,且耐高渗透压、氧化、高热和低pH等多种环境胁迫,是潜在的优良工业底盘细胞[29].马腾飞等[30]最初用α-蒎烯刺激产甘油假丝酵母可以上调MVA途径基因的表达,提高麦角甾醇的含量.随后发现产甘油假丝酵母的蒎烯耐受性是酿酒酵母的5倍,通过强化MVA路径并引入NPP合酶、过表达Hog1基因与外源磷酸酶、添加NaCl升高渗透压促使角鲨烯应答,最后通过优化培养基及5 L发酵罐扩大培养得到16.4 mg/L滴度的蒎烯[31].Zhao等[32]利用MVA和IUP双途径,在天然启动子PGAP的基础上,开发了癸烷响应的杂合启动子,不仅启动子的转录强度提高到了原始的3.6倍,而且有效分离了细胞生长和产物形成,最终在摇瓶水平上获得1194.6 mg/L香叶醇. ...
... ⑤优化培养基及5 L发酵罐扩大 | 16.4 | [31] |
| 桧烯 | 酿酒酵母 | ①在细胞质和线粒体中同时表达t34SabS1 ...
Tuning geraniol biosynthesis via a novel decane-responsive promoter in Candida glycerinogenes
3
2022
... 产甘油假丝酵母(Candida glycerinogenes)是在高渗透压环境下从天然样品中分离得到的一株GRAS耐高渗工业酵母[28],具有生长迅速、无特殊营养要求的优点,且耐高渗透压、氧化、高热和低pH等多种环境胁迫,是潜在的优良工业底盘细胞[29].马腾飞等[30]最初用α-蒎烯刺激产甘油假丝酵母可以上调MVA途径基因的表达,提高麦角甾醇的含量.随后发现产甘油假丝酵母的蒎烯耐受性是酿酒酵母的5倍,通过强化MVA路径并引入NPP合酶、过表达Hog1基因与外源磷酸酶、添加NaCl升高渗透压促使角鲨烯应答,最后通过优化培养基及5 L发酵罐扩大培养得到16.4 mg/L滴度的蒎烯[31].Zhao等[32]利用MVA和IUP双途径,在天然启动子PGAP的基础上,开发了癸烷响应的杂合启动子,不仅启动子的转录强度提高到了原始的3.6倍,而且有效分离了细胞生长和产物形成,最终在摇瓶水平上获得1194.6 mg/L香叶醇. ...
... ②设计癸烷响应杂交启动子调控基因表达:将PCgALK1的ARR1元件串联至PGAP的核心启动子(PGAP (core-477)) | 1194.6 | [32] |
| 香茅醇 | 酿酒酵母 | ①表达CrIS还原酶并敲除ATF1 ...
... 内源性基因和异源通路的过表达常常受到宿主自身固有调控网络和与代谢竞争的影响,在酵母中过表达内源MVA途径相关基因仅能一定程度提高产量,仍无法摆脱内在调控机制的限制.为了突破这一瓶颈,有研究者通过在酿酒酵母中引入胆碱激酶(CK)和异戊烯磷酸激酶(IPK)基因组成两步磷酸化途径(IUP),大大缩短了萜类合成前体IPP和DMAPP的合成步骤,且IUP路径独立于天然途径[17].通过异源表达IUP途径,IPP/DMAPP池相对于原生MVA途径提高了147倍,这表明IUP为萜烯合成提供充足的关键前体[63].Zhao等[32]通过在甘油假丝酵母中引入与中心碳代谢脱钩的IUP途径使得菌株的IPP/DMAPP池提高了4.2倍,香叶醇产量提高了99.8%. ...
Development of an efficient genetic manipulation strategy for sequential gene disruption and expression of different heterologous GFP genes in Candida tropicalis
1
2016
... 热带假丝酵母(Candida tropicalis)是一种二倍体非常规酵母,具有细胞生长快、环境耐受能力强、底物范围广等特点[33],且具有较强的ω-氧化途径、β-氧化途径以及木糖利用途径,使其可以代谢烷烃、脂肪酸以及木糖进行生长繁殖,已经在长链二元酸[34]和木糖醇[35]生产中实现了工业化应用.此外,热带假丝酵母内的乙酰辅酶A水平相对较高,可在胞内积累较高含量的脂质,是萜类化合物高效生产的潜在优良底盘细胞.郭晋蓉[36]通过亚细胞区室化、过表达ERG20ww 以及优化初糖浓度和发酵时间得到了141.48 mg/L滴度的柠檬烯,随后导入细胞色素P450酶CYP71A76获得了106.69 mg/L滴度的紫苏酸.表1为近些年利用酵母细胞合成单萜类化合物的进展. ...
十二碳二元酸工业生产试验研究
1
1998
... 热带假丝酵母(Candida tropicalis)是一种二倍体非常规酵母,具有细胞生长快、环境耐受能力强、底物范围广等特点[33],且具有较强的ω-氧化途径、β-氧化途径以及木糖利用途径,使其可以代谢烷烃、脂肪酸以及木糖进行生长繁殖,已经在长链二元酸[34]和木糖醇[35]生产中实现了工业化应用.此外,热带假丝酵母内的乙酰辅酶A水平相对较高,可在胞内积累较高含量的脂质,是萜类化合物高效生产的潜在优良底盘细胞.郭晋蓉[36]通过亚细胞区室化、过表达ERG20ww 以及优化初糖浓度和发酵时间得到了141.48 mg/L滴度的柠檬烯,随后导入细胞色素P450酶CYP71A76获得了106.69 mg/L滴度的紫苏酸.表1为近些年利用酵母细胞合成单萜类化合物的进展. ...
Experimental study on industrial production of dodecanedioic acid
1
1998
... 热带假丝酵母(Candida tropicalis)是一种二倍体非常规酵母,具有细胞生长快、环境耐受能力强、底物范围广等特点[33],且具有较强的ω-氧化途径、β-氧化途径以及木糖利用途径,使其可以代谢烷烃、脂肪酸以及木糖进行生长繁殖,已经在长链二元酸[34]和木糖醇[35]生产中实现了工业化应用.此外,热带假丝酵母内的乙酰辅酶A水平相对较高,可在胞内积累较高含量的脂质,是萜类化合物高效生产的潜在优良底盘细胞.郭晋蓉[36]通过亚细胞区室化、过表达ERG20ww 以及优化初糖浓度和发酵时间得到了141.48 mg/L滴度的柠檬烯,随后导入细胞色素P450酶CYP71A76获得了106.69 mg/L滴度的紫苏酸.表1为近些年利用酵母细胞合成单萜类化合物的进展. ...
Biotechnological production of xylitol from lignocellulosic wastes: a review
1
2014
... 热带假丝酵母(Candida tropicalis)是一种二倍体非常规酵母,具有细胞生长快、环境耐受能力强、底物范围广等特点[33],且具有较强的ω-氧化途径、β-氧化途径以及木糖利用途径,使其可以代谢烷烃、脂肪酸以及木糖进行生长繁殖,已经在长链二元酸[34]和木糖醇[35]生产中实现了工业化应用.此外,热带假丝酵母内的乙酰辅酶A水平相对较高,可在胞内积累较高含量的脂质,是萜类化合物高效生产的潜在优良底盘细胞.郭晋蓉[36]通过亚细胞区室化、过表达ERG20ww 以及优化初糖浓度和发酵时间得到了141.48 mg/L滴度的柠檬烯,随后导入细胞色素P450酶CYP71A76获得了106.69 mg/L滴度的紫苏酸.表1为近些年利用酵母细胞合成单萜类化合物的进展. ...
代谢工程改造热带假丝酵母生产柠檬烯及其衍生物紫苏酸
1
2022
... 热带假丝酵母(Candida tropicalis)是一种二倍体非常规酵母,具有细胞生长快、环境耐受能力强、底物范围广等特点[33],且具有较强的ω-氧化途径、β-氧化途径以及木糖利用途径,使其可以代谢烷烃、脂肪酸以及木糖进行生长繁殖,已经在长链二元酸[34]和木糖醇[35]生产中实现了工业化应用.此外,热带假丝酵母内的乙酰辅酶A水平相对较高,可在胞内积累较高含量的脂质,是萜类化合物高效生产的潜在优良底盘细胞.郭晋蓉[36]通过亚细胞区室化、过表达ERG20ww 以及优化初糖浓度和发酵时间得到了141.48 mg/L滴度的柠檬烯,随后导入细胞色素P450酶CYP71A76获得了106.69 mg/L滴度的紫苏酸.表1为近些年利用酵母细胞合成单萜类化合物的进展. ...
Production of limonene and its derivative perillic acid in Candida tropicalis via metabolic engineering
1
2022
... 热带假丝酵母(Candida tropicalis)是一种二倍体非常规酵母,具有细胞生长快、环境耐受能力强、底物范围广等特点[33],且具有较强的ω-氧化途径、β-氧化途径以及木糖利用途径,使其可以代谢烷烃、脂肪酸以及木糖进行生长繁殖,已经在长链二元酸[34]和木糖醇[35]生产中实现了工业化应用.此外,热带假丝酵母内的乙酰辅酶A水平相对较高,可在胞内积累较高含量的脂质,是萜类化合物高效生产的潜在优良底盘细胞.郭晋蓉[36]通过亚细胞区室化、过表达ERG20ww 以及优化初糖浓度和发酵时间得到了141.48 mg/L滴度的柠檬烯,随后导入细胞色素P450酶CYP71A76获得了106.69 mg/L滴度的紫苏酸.表1为近些年利用酵母细胞合成单萜类化合物的进展. ...
Manipulation of GES and ERG20 for geraniol overproduction in Saccharomyces cerevisiae
5
2017
| 1680 | [37] |
| 解脂耶氏酵母 | ①过表达截短的HMG1、IDI和tCrGES ...
... Fischer等[46]对ERG20的K197位点进行定点突变,发现K197G/A/L/C/S/T/R/D/E/N突变体可以提高香叶醇、芳樟醇和香茅醇的产量.Ignea等[57]通过对ERG20同源建模分析,发现其主要通过F96、A99、N127氨基酸位点抑制FPP合酶活性且不会影响GPP的合成,随后对其进行一系列定点突变,发现突变ERG20F96W 和ERG20N127W 后,桧烯产量分别提高了3.21倍和5.57倍.对ERG20进行F96W和N127W双突变后,桧烯产量增加到10.32倍.Zhang等[66]在线粒体和细胞质中同时表达F96W和N127W组成的ERG20高效双突变酶,使芳樟醇产量提高到2.69 mg/L,比对照菌株提高了2倍.Jiang等[37]通过过表达ERG20的F96W和N127W双突变酶,香叶醇的滴度提高了34%. ...
... 筛选合适的异源单萜合酶并提高其功能性表达,是单萜类产物高效合成的关键和主要挑战.目前已经有大量的单萜合酶被成功挖掘并在酵母细胞中成功表达,如香叶醇合酶、柠檬烯合酶、芳樟醇合酶、蒎烯合酶等.Jiang等[37]在酿酒酵母中表达了9种不同植物来源的香叶醇合酶(geraniol synthases,GES),发现长春花来源的CrGES所产生的香叶醇产量最高. ...
... 大多数植物来源的单萜合酶N端含有转运肽,用于将酶定位至质体,未成熟的酶在到达目标部位后其转运肽被切进一步形成成熟的酶[67].但酵母细胞中缺乏清除质体转运肽的机制,N末端转运肽的存在可能会影响酶的活性,进一步影响单萜的合成.故通过信号肽截短可以在一定程度上提高酶的异源表达活性且防止其错误定位.Zhao等[65]通过表达截短的缬草(Valeriana officinalis)来源香叶醇合成酶(tVoGE),发现香叶醇的产量是全长VoGES的产量的3倍.确定合适的截短位置对于酶的高效表达是必要的,Jiang等[37]利用计算机预测长春花来源的香叶醇合酶CrGES的信号肽结构,在CrGES酶N端的4个不同位置进行截短(S14、L28、S43和S52),发现S43处截短的CrGES酶较另外三种截短酶的二级结构稳定性更高且表现出最高的香叶醇产量(191.61 mg/L),是未截短菌株的4.45倍.Denby等[68]发现薄荷柠檬(Mentha citrata)来源的芳樟醇合成酶在67位(t67McLIS)截短后的活性最佳,芳樟醇产量达到16 mg/L. ...
... 利用蛋白质间的相互作用理论,通过一段短肽连接序列将两个酶进行融合,可以增强底物隧道效应、提高酶的底物浓度和减少底物的消耗.连接linker的长度和蛋白的融合方向是影响融合酶催化活性的关键因素.Wang等[69-70]通过调节GSG linker的数量,构建了5个不同linker长度的融合蛋白CS(cineole synthase)-P450cin,这些融合蛋白在生产水平、生产速率和总生产比率上表现出明显的差异.Jiang等[37]利用短柔性连接肽GSG分别从正向和反向连接t43CrGES与Erg20ww,根据对t43CrGES和Erg20ww 表面电荷分布的分析以及基于静电吸引作用的设计,在反向融合蛋白t43CrGES-ERG20ww 的基础上表达ERG20ww 的另一份拷贝,使香叶醇产量提升了30%,达到523.96 mg/L.Deng等[71]用3个不同长度的连接肽将Actinidia arguta来源的芳樟醇合成酶(AaLS1)与FPPS融合,发现表达(GGGGS)3融合后的蛋白复合物相比于表达两个游离酶芳樟醇产量提高了69.7%.Zhao等[65]发现tVoGES-GGGS-ERG20WW的融合方式使得香叶醇产量提高了1.7倍,反向融合以及其他两种更长的linker产量无明显变化甚至有所降低. ...
A “push-pull-restrain” strategy to improve citronellol production in Saccharomyces cerevisiae
2
66
... ③对融合蛋白、CrIS酶、IDI1使用蛋白支架SF1(SH31PDZ1GBD1) | 8300 | [38] |
| 芳樟醇 | 酿酒酵母 | ①对芳樟醇合成酶(t67OMcLISM)底物结合口袋的入口处氨基酸位点F447E突变 ...
... 与融合蛋白相比,蛋白支架可以组装连续催化的多个酶,拉进不同酶之间的空间距离,提高酶的底物浓度,减少底物损失.这一策略主要依赖于蛋白结构域和配体间的相互作用,可以通过调节蛋白支架上的配体数量和顺序进一步优化蛋白复合体的表达和活性.Jiang等[38]选择SH3(来自于小鼠Crk的SH3结构域)、GBD(大鼠神经-维斯科特-奥尔德里奇综合征蛋白的GTPase结合结构域)和PDZ(来自小鼠α-合酶蛋白的PDZ结构域)构建合成蛋白支架,使用GSG短肽将SH3、GBD、PDZ的配体分别与融合蛋白tCrGES-ERG20F96W/N127W、CrIS、IDI1的C末端融合,调整不同种酶的配体数量后发现SF1(SH31PDZ1GBD1)是最佳的配体比例支架,香茅醇的产量提高了21%达到655.20 mg/L.Zhou等[72]利用短肽标签RIAD和RIDD以1∶2的化学计量比模块化组装芳樟醇合成酶突变体t67OMcLISE343D/E352H和ERG20F96W/N127W,使得芳樟醇产量提高了约42%. ...
Combining protein and organelle engineering for linalool overproduction in Saccharomyces cerevisiae
1
2023
| 2600 | [39] |
| 月桂烯 | 酿酒酵母 | ①使用弱启动子PHXT1替换ERG20的启动子 ...
Engineering Saccharomyces cerevisiae for synthesis of β-myrcene and (E)-β-ocimene
1
2023
| 8.12 | [40] |
| 罗勒烯 | 酿酒酵母 | 34.56 |
| 柠檬烯 | 酿酒酵母 | ①动态抑制竞争性旁路 ...
Efficient synthesis of limonene in Saccharomyces cerevisiae using combinatorial metabolic engineering strategies
3
2023
| 2630 | [41] |
| 解脂耶氏酵母 | ①引入额外拷贝的柠檬烯合成基因 ...
... Kong等[41]将MVA途径和柠檬烯合成途径中的酶整合至线粒体中,以调节柠檬烯的细胞质和线粒体的合成途径,柠檬烯滴度由1097.43 mg/L提高到1586 mg/L.Jia等[45]将N末端截短的桧烯合酶(t34SabS1)分别定位到不同组合的双亚细胞器中(CP/CM/PM/CC/MM),发现在细胞质和线粒体中同时表达时,桧烯的产量最高提升了1.53倍,而后在此基础上继续在过氧化物酶体中引入t34SabS1桧烯产量有所下降,因此合适的细胞器定位对单萜合成是重要的.Kampranis团队发现酵母的过氧化物酶体膜对GPP具有一定的阻隔作用,通过在酿酒酵母的过氧化物酶体中引入MVA路径相关酶、ERG20N127W和单萜合酶来构建单萜合成途径,可以避免细胞质内代谢对单萜合成的干扰.对于其测试的所有单萜类化合物,过氧化物酶体定位后的单萜产量比细胞质中的总产量增加了15~125倍,在半连续补料-分批培养条件下,得到5.5 g/L的香叶醇和2.6 g/L的D-柠檬烯[78]. ...
... 除以上常用策略外,还有很多可以提高单萜产量的方法,如减少单萜内源性转化及弱化单萜的下游途径.Zhao等[96]通过敲除老黄酶OYE2和乙酰转移酶ATF1,减少香叶醇向香茅醇和乙酸香叶酯的转化,香叶醇的产量分别提高了1.7倍和1.6倍.Amiri等[97]用受蛋氨酸抑制的MET3启动子替换鲨烯合成酶ERG9的天然启动子,可有效下调鲨烯合成酶的表达,使酿酒酵母中芳樟醇的积累量达到78 μg/L,是对照菌株的2倍多.酵母细胞的单萜合成途径中涉及到多步氧化还原反应,在提高MVA途径代谢通量后往往会造成胞内辅因子供应不足进而损害细胞内的氧化还原平衡,因此协调细胞内的氧化还原平衡可以在一定程度上增强单萜的合成.目前已利用多种酶促进酵母胞质NADPH的再生,如山梨醇脱氢酶(MnDH1和MnDH2)、葡萄糖-6-磷酸脱氢酶(ZWF)、胞质异柠檬酸脱氢酶(IDP)、琥珀酸半醛脱氢酶(UGA2)和谷氨酸脱氢酶(GDH)等[98].Kong等[41]通过在酿酒酵母中过表达磷酸戊糖途径相关基因ZWF1、GND1、TAL1和TKL1增加NADPH的生成并敲除GDH1和GDH2减少NADPH的消耗,使得柠檬烯产量由889.54 mg/L增加到1097.43 mg/L. ...
Elevating limonene production in oleaginous yeast Yarrowia lipolytica via genetic engineering of limonene biosynthesis pathway and optimization of medium composition
2
2019
| 165.3 | [42] |
| 薄荷醇 | 酿酒酵母 | ①薄荷醇从头合成路径的构建 ...
... 优化培养基对促进菌株生长和发酵过程中产物生成具有基础性作用.培养基中不同种类和比例的碳氮源对菌株有不同的影响,当初始葡萄糖浓度改变时,细胞的生长状况也会受到影响,适当的碳氮比可以显著提高细胞的活性[101].Wei等[27]利用厨房废油(WCO)作为碳源在解脂耶氏酵母中成功地实现了合成33.8 mg/L滴度的α-蒎烯,为微生物利用廉价碳源生产单萜类化合物奠定了基础.添加辅助碳源在一定程度上可以促进单萜合成,Cheng等[42]发现当解脂耶氏酵母以甘油为初级碳源、柠檬酸为辅助碳源时,柠檬烯的产量高于以葡萄糖为初级碳源时的产量,柠檬烯产量达到最大值165.3 mg/L.适当的金属离子浓度能够提高酶活,Zhang等[102]研究了在工程菌中添加不同浓度的Mg2+对芳樟醇产量的影响,当在培养基中添加10 mmol/L Mg2+时,芳樟醇产量提高了27%. ...
Engineered Saccharomyces cerevisiae for the de novo biosynthesis of (-)-menthol
1
2022
| 6.28 | [43] |
| 蒎烯 | 酿酒酵母 | ①表达ERG20WW +tPtPS ...
| 11.7 | [44] |
| 解脂耶氏酵母 | ①构建非正交生物合成途径 ...
Metabolic engineering of Saccharomyces cerevisiae for pinene production
1
2019
| 11.7 | [44] |
| 解脂耶氏酵母 | ①构建非正交生物合成途径 ...
Collaborative subcellular compartmentalization to improve GPP utilization and boost sabinene accumulation in Saccharomyces cerevisiae
2
2020
| 154.9 | [45] |
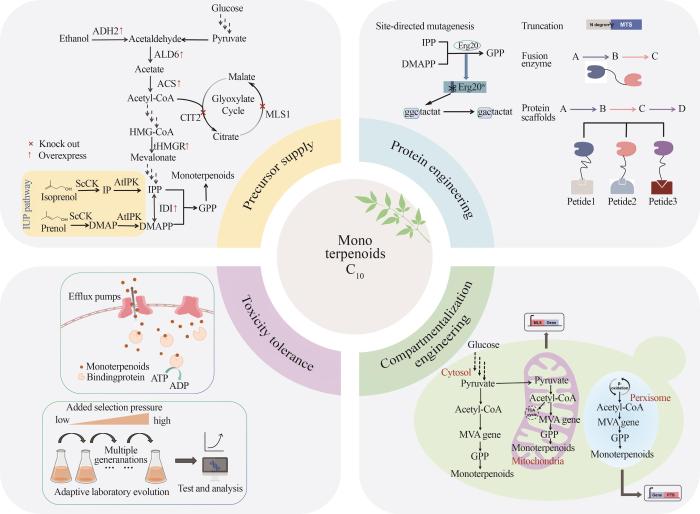
3 代谢工程改造酵母细胞合成单萜类化合物的策略及应用实例直接在酵母细胞中引入外源的单萜合酶往往产量不高,主要存在前体供应不足、关键酶活性及表达水平低和单萜产生的细胞毒性等问题.针对这些问题,近年来众多研究者发展了一系列策略(图2),有效提高了酵母细胞合成单萜的能力. ...
... Kong等[41]将MVA途径和柠檬烯合成途径中的酶整合至线粒体中,以调节柠檬烯的细胞质和线粒体的合成途径,柠檬烯滴度由1097.43 mg/L提高到1586 mg/L.Jia等[45]将N末端截短的桧烯合酶(t34SabS1)分别定位到不同组合的双亚细胞器中(CP/CM/PM/CC/MM),发现在细胞质和线粒体中同时表达时,桧烯的产量最高提升了1.53倍,而后在此基础上继续在过氧化物酶体中引入t34SabS1桧烯产量有所下降,因此合适的细胞器定位对单萜合成是重要的.Kampranis团队发现酵母的过氧化物酶体膜对GPP具有一定的阻隔作用,通过在酿酒酵母的过氧化物酶体中引入MVA路径相关酶、ERG20N127W和单萜合酶来构建单萜合成途径,可以避免细胞质内代谢对单萜合成的干扰.对于其测试的所有单萜类化合物,过氧化物酶体定位后的单萜产量比细胞质中的总产量增加了15~125倍,在半连续补料-分批培养条件下,得到5.5 g/L的香叶醇和2.6 g/L的D-柠檬烯[78]. ...
Metabolic engineering of monoterpene synthesis in yeast
2
2011
... 在植物中,单萜的重要前体物质GPP由专一性GPP合成酶催化IPP和DMAPP合成,但在酵母细胞中由于缺乏特异性的GPP合成酶,内源MVA途径只能释放很少的GPP,使得酵母细胞中GPP的含量远低于FPP,大大限制了单萜的产量[46].为了增加GPP的供应,研究人员采取了包括提高乙酰辅酶A的供应、增强MVA途径的通量、动态截流GPP下游代谢途径以及GPP合成酶的蛋白质工程等在内的多种策略. ...
... Fischer等[46]对ERG20的K197位点进行定点突变,发现K197G/A/L/C/S/T/R/D/E/N突变体可以提高香叶醇、芳樟醇和香茅醇的产量.Ignea等[57]通过对ERG20同源建模分析,发现其主要通过F96、A99、N127氨基酸位点抑制FPP合酶活性且不会影响GPP的合成,随后对其进行一系列定点突变,发现突变ERG20F96W 和ERG20N127W 后,桧烯产量分别提高了3.21倍和5.57倍.对ERG20进行F96W和N127W双突变后,桧烯产量增加到10.32倍.Zhang等[66]在线粒体和细胞质中同时表达F96W和N127W组成的ERG20高效双突变酶,使芳樟醇产量提高到2.69 mg/L,比对照菌株提高了2倍.Jiang等[37]通过过表达ERG20的F96W和N127W双突变酶,香叶醇的滴度提高了34%. ...
Intracellular acetyl unit transport in fungal carbon metabolism
1
2010
... 酵母细胞中乙酰辅酶A的主要合成场所为线粒体且不会被转运到细胞质中,使得乙酰辅酶A的供给成为其生物合成的限速步骤[47].在酿酒酵母中,若以葡萄糖为碳源,乙酰辅酶A来源于细胞质的丙酮酸脱氢酶支路(PDH bypass)以及线粒体中丙酮酸脱氢酶复合物(PDH complex)催化丙酮酸而形成[48].若以乙醇为碳源,乙酰辅酶A的合成路径缩短为在细胞质中合成,两个脱氢酶ADH2和ALD6催化乙酰辅酶A生成乙酸,然后乙酸在乙酰基转移酶(ACS)的催化下生成乙酰辅酶A.为了有效地将碳流重定向到胞质乙酰辅酶A,可以将异源细菌PDH引入到酿酒酵母中以充分利用胞质丙酮酸,从而提高乙酰辅酶A供应[49].然而,由于酿酒酵母具有Crabtree效应,乙醛也可以被乙醇脱氢酶选择性地转化为乙醇.为了最大限度地将乙醇流向乙酰辅酶A,过表达ADH2、ALD6和沙门氏菌(Salmonella enterica)来源的ACS突变体SeACSL641P(乙酰辅酶A合成酶)被证明是一种有效方案[50].然而,在某些情况下单独过表达酵母内源基因ADH2、ALD6和ACS2可能不足以将乙酸转化为乙酰辅酶A,反而导致乙酸溢出以及柠檬烯产量降低[51].除了提高乙酰辅酶A的供应外,也可以通过敲除竞争路径基因柠檬酸合酶CIT2和苹果酸合酶MLS1来阻断乙酰辅酶A的消耗,使得乙酰辅酶A更多地流向单萜合成[52].但当在以乙醇为碳源的菌株里敲除两个基因时,将会严重影响菌株的生长[53]. ...
Metabolism and strategies for enhanced supply of acetyl-CoA in Saccharomyces cerevisiae
1
2021
... 酵母细胞中乙酰辅酶A的主要合成场所为线粒体且不会被转运到细胞质中,使得乙酰辅酶A的供给成为其生物合成的限速步骤[47].在酿酒酵母中,若以葡萄糖为碳源,乙酰辅酶A来源于细胞质的丙酮酸脱氢酶支路(PDH bypass)以及线粒体中丙酮酸脱氢酶复合物(PDH complex)催化丙酮酸而形成[48].若以乙醇为碳源,乙酰辅酶A的合成路径缩短为在细胞质中合成,两个脱氢酶ADH2和ALD6催化乙酰辅酶A生成乙酸,然后乙酸在乙酰基转移酶(ACS)的催化下生成乙酰辅酶A.为了有效地将碳流重定向到胞质乙酰辅酶A,可以将异源细菌PDH引入到酿酒酵母中以充分利用胞质丙酮酸,从而提高乙酰辅酶A供应[49].然而,由于酿酒酵母具有Crabtree效应,乙醛也可以被乙醇脱氢酶选择性地转化为乙醇.为了最大限度地将乙醇流向乙酰辅酶A,过表达ADH2、ALD6和沙门氏菌(Salmonella enterica)来源的ACS突变体SeACSL641P(乙酰辅酶A合成酶)被证明是一种有效方案[50].然而,在某些情况下单独过表达酵母内源基因ADH2、ALD6和ACS2可能不足以将乙酸转化为乙酰辅酶A,反而导致乙酸溢出以及柠檬烯产量降低[51].除了提高乙酰辅酶A的供应外,也可以通过敲除竞争路径基因柠檬酸合酶CIT2和苹果酸合酶MLS1来阻断乙酰辅酶A的消耗,使得乙酰辅酶A更多地流向单萜合成[52].但当在以乙醇为碳源的菌株里敲除两个基因时,将会严重影响菌株的生长[53]. ...
Engineering cofactor and transport mechanisms in Saccharomyces cerevisiae for enhanced acetyl-CoA and polyketide biosynthesis
1
2016
... 酵母细胞中乙酰辅酶A的主要合成场所为线粒体且不会被转运到细胞质中,使得乙酰辅酶A的供给成为其生物合成的限速步骤[47].在酿酒酵母中,若以葡萄糖为碳源,乙酰辅酶A来源于细胞质的丙酮酸脱氢酶支路(PDH bypass)以及线粒体中丙酮酸脱氢酶复合物(PDH complex)催化丙酮酸而形成[48].若以乙醇为碳源,乙酰辅酶A的合成路径缩短为在细胞质中合成,两个脱氢酶ADH2和ALD6催化乙酰辅酶A生成乙酸,然后乙酸在乙酰基转移酶(ACS)的催化下生成乙酰辅酶A.为了有效地将碳流重定向到胞质乙酰辅酶A,可以将异源细菌PDH引入到酿酒酵母中以充分利用胞质丙酮酸,从而提高乙酰辅酶A供应[49].然而,由于酿酒酵母具有Crabtree效应,乙醛也可以被乙醇脱氢酶选择性地转化为乙醇.为了最大限度地将乙醇流向乙酰辅酶A,过表达ADH2、ALD6和沙门氏菌(Salmonella enterica)来源的ACS突变体SeACSL641P(乙酰辅酶A合成酶)被证明是一种有效方案[50].然而,在某些情况下单独过表达酵母内源基因ADH2、ALD6和ACS2可能不足以将乙酸转化为乙酰辅酶A,反而导致乙酸溢出以及柠檬烯产量降低[51].除了提高乙酰辅酶A的供应外,也可以通过敲除竞争路径基因柠檬酸合酶CIT2和苹果酸合酶MLS1来阻断乙酰辅酶A的消耗,使得乙酰辅酶A更多地流向单萜合成[52].但当在以乙醇为碳源的菌株里敲除两个基因时,将会严重影响菌株的生长[53]. ...
Establishing a platform cell factory through engineering of yeast acetyl-CoA metabolism
1
2013
... 酵母细胞中乙酰辅酶A的主要合成场所为线粒体且不会被转运到细胞质中,使得乙酰辅酶A的供给成为其生物合成的限速步骤[47].在酿酒酵母中,若以葡萄糖为碳源,乙酰辅酶A来源于细胞质的丙酮酸脱氢酶支路(PDH bypass)以及线粒体中丙酮酸脱氢酶复合物(PDH complex)催化丙酮酸而形成[48].若以乙醇为碳源,乙酰辅酶A的合成路径缩短为在细胞质中合成,两个脱氢酶ADH2和ALD6催化乙酰辅酶A生成乙酸,然后乙酸在乙酰基转移酶(ACS)的催化下生成乙酰辅酶A.为了有效地将碳流重定向到胞质乙酰辅酶A,可以将异源细菌PDH引入到酿酒酵母中以充分利用胞质丙酮酸,从而提高乙酰辅酶A供应[49].然而,由于酿酒酵母具有Crabtree效应,乙醛也可以被乙醇脱氢酶选择性地转化为乙醇.为了最大限度地将乙醇流向乙酰辅酶A,过表达ADH2、ALD6和沙门氏菌(Salmonella enterica)来源的ACS突变体SeACSL641P(乙酰辅酶A合成酶)被证明是一种有效方案[50].然而,在某些情况下单独过表达酵母内源基因ADH2、ALD6和ACS2可能不足以将乙酸转化为乙酰辅酶A,反而导致乙酸溢出以及柠檬烯产量降低[51].除了提高乙酰辅酶A的供应外,也可以通过敲除竞争路径基因柠檬酸合酶CIT2和苹果酸合酶MLS1来阻断乙酰辅酶A的消耗,使得乙酰辅酶A更多地流向单萜合成[52].但当在以乙醇为碳源的菌株里敲除两个基因时,将会严重影响菌株的生长[53]. ...
Combinatorial engineering of Saccharomyces cerevisiae for improving limonene production
1
2021
... 酵母细胞中乙酰辅酶A的主要合成场所为线粒体且不会被转运到细胞质中,使得乙酰辅酶A的供给成为其生物合成的限速步骤[47].在酿酒酵母中,若以葡萄糖为碳源,乙酰辅酶A来源于细胞质的丙酮酸脱氢酶支路(PDH bypass)以及线粒体中丙酮酸脱氢酶复合物(PDH complex)催化丙酮酸而形成[48].若以乙醇为碳源,乙酰辅酶A的合成路径缩短为在细胞质中合成,两个脱氢酶ADH2和ALD6催化乙酰辅酶A生成乙酸,然后乙酸在乙酰基转移酶(ACS)的催化下生成乙酰辅酶A.为了有效地将碳流重定向到胞质乙酰辅酶A,可以将异源细菌PDH引入到酿酒酵母中以充分利用胞质丙酮酸,从而提高乙酰辅酶A供应[49].然而,由于酿酒酵母具有Crabtree效应,乙醛也可以被乙醇脱氢酶选择性地转化为乙醇.为了最大限度地将乙醇流向乙酰辅酶A,过表达ADH2、ALD6和沙门氏菌(Salmonella enterica)来源的ACS突变体SeACSL641P(乙酰辅酶A合成酶)被证明是一种有效方案[50].然而,在某些情况下单独过表达酵母内源基因ADH2、ALD6和ACS2可能不足以将乙酸转化为乙酰辅酶A,反而导致乙酸溢出以及柠檬烯产量降低[51].除了提高乙酰辅酶A的供应外,也可以通过敲除竞争路径基因柠檬酸合酶CIT2和苹果酸合酶MLS1来阻断乙酰辅酶A的消耗,使得乙酰辅酶A更多地流向单萜合成[52].但当在以乙醇为碳源的菌株里敲除两个基因时,将会严重影响菌株的生长[53]. ...
Design and construction of acetyl-CoA overproducing Saccharomyces cerevisiae strains
1
2014
... 酵母细胞中乙酰辅酶A的主要合成场所为线粒体且不会被转运到细胞质中,使得乙酰辅酶A的供给成为其生物合成的限速步骤[47].在酿酒酵母中,若以葡萄糖为碳源,乙酰辅酶A来源于细胞质的丙酮酸脱氢酶支路(PDH bypass)以及线粒体中丙酮酸脱氢酶复合物(PDH complex)催化丙酮酸而形成[48].若以乙醇为碳源,乙酰辅酶A的合成路径缩短为在细胞质中合成,两个脱氢酶ADH2和ALD6催化乙酰辅酶A生成乙酸,然后乙酸在乙酰基转移酶(ACS)的催化下生成乙酰辅酶A.为了有效地将碳流重定向到胞质乙酰辅酶A,可以将异源细菌PDH引入到酿酒酵母中以充分利用胞质丙酮酸,从而提高乙酰辅酶A供应[49].然而,由于酿酒酵母具有Crabtree效应,乙醛也可以被乙醇脱氢酶选择性地转化为乙醇.为了最大限度地将乙醇流向乙酰辅酶A,过表达ADH2、ALD6和沙门氏菌(Salmonella enterica)来源的ACS突变体SeACSL641P(乙酰辅酶A合成酶)被证明是一种有效方案[50].然而,在某些情况下单独过表达酵母内源基因ADH2、ALD6和ACS2可能不足以将乙酸转化为乙酰辅酶A,反而导致乙酸溢出以及柠檬烯产量降低[51].除了提高乙酰辅酶A的供应外,也可以通过敲除竞争路径基因柠檬酸合酶CIT2和苹果酸合酶MLS1来阻断乙酰辅酶A的消耗,使得乙酰辅酶A更多地流向单萜合成[52].但当在以乙醇为碳源的菌株里敲除两个基因时,将会严重影响菌株的生长[53]. ...
Profiling of cytosolic and peroxisomal acetyl-CoA metabolism in Saccharomyces cerevisiae
1
2012
... 酵母细胞中乙酰辅酶A的主要合成场所为线粒体且不会被转运到细胞质中,使得乙酰辅酶A的供给成为其生物合成的限速步骤[47].在酿酒酵母中,若以葡萄糖为碳源,乙酰辅酶A来源于细胞质的丙酮酸脱氢酶支路(PDH bypass)以及线粒体中丙酮酸脱氢酶复合物(PDH complex)催化丙酮酸而形成[48].若以乙醇为碳源,乙酰辅酶A的合成路径缩短为在细胞质中合成,两个脱氢酶ADH2和ALD6催化乙酰辅酶A生成乙酸,然后乙酸在乙酰基转移酶(ACS)的催化下生成乙酰辅酶A.为了有效地将碳流重定向到胞质乙酰辅酶A,可以将异源细菌PDH引入到酿酒酵母中以充分利用胞质丙酮酸,从而提高乙酰辅酶A供应[49].然而,由于酿酒酵母具有Crabtree效应,乙醛也可以被乙醇脱氢酶选择性地转化为乙醇.为了最大限度地将乙醇流向乙酰辅酶A,过表达ADH2、ALD6和沙门氏菌(Salmonella enterica)来源的ACS突变体SeACSL641P(乙酰辅酶A合成酶)被证明是一种有效方案[50].然而,在某些情况下单独过表达酵母内源基因ADH2、ALD6和ACS2可能不足以将乙酸转化为乙酰辅酶A,反而导致乙酸溢出以及柠檬烯产量降低[51].除了提高乙酰辅酶A的供应外,也可以通过敲除竞争路径基因柠檬酸合酶CIT2和苹果酸合酶MLS1来阻断乙酰辅酶A的消耗,使得乙酰辅酶A更多地流向单萜合成[52].但当在以乙醇为碳源的菌株里敲除两个基因时,将会严重影响菌株的生长[53]. ...
利用不同底盘细胞开展生物合成萜类化合物的研究进展
1
2022
... 萜类化合物是以异戊二烯(C5)作为基本单位,通过多种萜类合酶催化下环化形成基本骨架,并经过羟基化、甲基化、糖基化等后修饰后形成的种类繁多的一大类化合物[1].根据所含异戊二烯单元的数量可以分为单萜、倍半萜、二萜、三萜、四萜、多萜等,其中单萜又可分为无环单萜、单环单萜、双环单萜以及三环单萜[2]. ...
Research progress in biosynthesis of terpenoids using different chassis cells
1
2022
... 萜类化合物是以异戊二烯(C5)作为基本单位,通过多种萜类合酶催化下环化形成基本骨架,并经过羟基化、甲基化、糖基化等后修饰后形成的种类繁多的一大类化合物[1].根据所含异戊二烯单元的数量可以分为单萜、倍半萜、二萜、三萜、四萜、多萜等,其中单萜又可分为无环单萜、单环单萜、双环单萜以及三环单萜[2]. ...
Analysis of monoterpenes and monoterpenoids
1
2020
... 萜类化合物是以异戊二烯(C5)作为基本单位,通过多种萜类合酶催化下环化形成基本骨架,并经过羟基化、甲基化、糖基化等后修饰后形成的种类繁多的一大类化合物[1].根据所含异戊二烯单元的数量可以分为单萜、倍半萜、二萜、三萜、四萜、多萜等,其中单萜又可分为无环单萜、单环单萜、双环单萜以及三环单萜[2]. ...
Assessment of dietary exposure to flavouring substances via consumption of flavoured teas. Part Ⅱ: transfer rates of linalool and linalyl esters into Earl Grey tea infusions
1
2014
... 单萜类化合物大多挥发性强、香气浓郁,是许多植物精油的重要组成部分,由于其丰富的药理学和生物活性,被广泛应用于医药、食品、香料、化妆品和农业等领域中.如芳樟醇因具有强抗菌性和抗氧化活性可以用作防腐剂,延长食品的保质期,并可在茶叶中发挥调味作用[3].柠檬烯可以作用于害虫的多个靶点,通过抑制害虫感觉神经和运动神经的自发性动作[4]、破坏昆虫体壁的蜡质层[5]以及影响昆虫神经系统中的乙酰胆碱酯酶[6]等方式发挥杀虫作用.香叶醇常被用于香料和化妆品的生产.此外,香叶醇能够抑制细胞增殖并诱导细胞凋亡[7],以及靶向血管再生相关的基因[8],因此被视为一种有潜力的抗肿瘤化合物.鉴于部分单萜具有高能量密度和低凝固点,如柠檬烯和α-蒎烯,可作为传统喷气燃料的替代品[9]. ...
A comprehensive review of effective essential oil components in stored-product pest management
1
2023
... 单萜类化合物大多挥发性强、香气浓郁,是许多植物精油的重要组成部分,由于其丰富的药理学和生物活性,被广泛应用于医药、食品、香料、化妆品和农业等领域中.如芳樟醇因具有强抗菌性和抗氧化活性可以用作防腐剂,延长食品的保质期,并可在茶叶中发挥调味作用[3].柠檬烯可以作用于害虫的多个靶点,通过抑制害虫感觉神经和运动神经的自发性动作[4]、破坏昆虫体壁的蜡质层[5]以及影响昆虫神经系统中的乙酰胆碱酯酶[6]等方式发挥杀虫作用.香叶醇常被用于香料和化妆品的生产.此外,香叶醇能够抑制细胞增殖并诱导细胞凋亡[7],以及靶向血管再生相关的基因[8],因此被视为一种有潜力的抗肿瘤化合物.鉴于部分单萜具有高能量密度和低凝固点,如柠檬烯和α-蒎烯,可作为传统喷气燃料的替代品[9]. ...
Synergistic field crop pest management properties of plant-derived essential oils in combination with synthetic pesticides and bioactive molecules: a review
1
2021
... 单萜类化合物大多挥发性强、香气浓郁,是许多植物精油的重要组成部分,由于其丰富的药理学和生物活性,被广泛应用于医药、食品、香料、化妆品和农业等领域中.如芳樟醇因具有强抗菌性和抗氧化活性可以用作防腐剂,延长食品的保质期,并可在茶叶中发挥调味作用[3].柠檬烯可以作用于害虫的多个靶点,通过抑制害虫感觉神经和运动神经的自发性动作[4]、破坏昆虫体壁的蜡质层[5]以及影响昆虫神经系统中的乙酰胆碱酯酶[6]等方式发挥杀虫作用.香叶醇常被用于香料和化妆品的生产.此外,香叶醇能够抑制细胞增殖并诱导细胞凋亡[7],以及靶向血管再生相关的基因[8],因此被视为一种有潜力的抗肿瘤化合物.鉴于部分单萜具有高能量密度和低凝固点,如柠檬烯和α-蒎烯,可作为传统喷气燃料的替代品[9]. ...
Neurotranmission systems as targets for toxicants: a review
1
2013
... 单萜类化合物大多挥发性强、香气浓郁,是许多植物精油的重要组成部分,由于其丰富的药理学和生物活性,被广泛应用于医药、食品、香料、化妆品和农业等领域中.如芳樟醇因具有强抗菌性和抗氧化活性可以用作防腐剂,延长食品的保质期,并可在茶叶中发挥调味作用[3].柠檬烯可以作用于害虫的多个靶点,通过抑制害虫感觉神经和运动神经的自发性动作[4]、破坏昆虫体壁的蜡质层[5]以及影响昆虫神经系统中的乙酰胆碱酯酶[6]等方式发挥杀虫作用.香叶醇常被用于香料和化妆品的生产.此外,香叶醇能够抑制细胞增殖并诱导细胞凋亡[7],以及靶向血管再生相关的基因[8],因此被视为一种有潜力的抗肿瘤化合物.鉴于部分单萜具有高能量密度和低凝固点,如柠檬烯和α-蒎烯,可作为传统喷气燃料的替代品[9]. ...
Geraniol inhibits prostate cancer growth by targeting cell cycle and apoptosis pathways
1
2011
... 单萜类化合物大多挥发性强、香气浓郁,是许多植物精油的重要组成部分,由于其丰富的药理学和生物活性,被广泛应用于医药、食品、香料、化妆品和农业等领域中.如芳樟醇因具有强抗菌性和抗氧化活性可以用作防腐剂,延长食品的保质期,并可在茶叶中发挥调味作用[3].柠檬烯可以作用于害虫的多个靶点,通过抑制害虫感觉神经和运动神经的自发性动作[4]、破坏昆虫体壁的蜡质层[5]以及影响昆虫神经系统中的乙酰胆碱酯酶[6]等方式发挥杀虫作用.香叶醇常被用于香料和化妆品的生产.此外,香叶醇能够抑制细胞增殖并诱导细胞凋亡[7],以及靶向血管再生相关的基因[8],因此被视为一种有潜力的抗肿瘤化合物.鉴于部分单萜具有高能量密度和低凝固点,如柠檬烯和α-蒎烯,可作为传统喷气燃料的替代品[9]. ...
Geraniol suppresses angiogenesis by downregulating vascular endothelial growth factor (VEGF)/VEGFR-2 signaling
1
2015
... 单萜类化合物大多挥发性强、香气浓郁,是许多植物精油的重要组成部分,由于其丰富的药理学和生物活性,被广泛应用于医药、食品、香料、化妆品和农业等领域中.如芳樟醇因具有强抗菌性和抗氧化活性可以用作防腐剂,延长食品的保质期,并可在茶叶中发挥调味作用[3].柠檬烯可以作用于害虫的多个靶点,通过抑制害虫感觉神经和运动神经的自发性动作[4]、破坏昆虫体壁的蜡质层[5]以及影响昆虫神经系统中的乙酰胆碱酯酶[6]等方式发挥杀虫作用.香叶醇常被用于香料和化妆品的生产.此外,香叶醇能够抑制细胞增殖并诱导细胞凋亡[7],以及靶向血管再生相关的基因[8],因此被视为一种有潜力的抗肿瘤化合物.鉴于部分单萜具有高能量密度和低凝固点,如柠檬烯和α-蒎烯,可作为传统喷气燃料的替代品[9]. ...
Metabolic engineering for isoprenoid-based biofuel production
1
2015
... 单萜类化合物大多挥发性强、香气浓郁,是许多植物精油的重要组成部分,由于其丰富的药理学和生物活性,被广泛应用于医药、食品、香料、化妆品和农业等领域中.如芳樟醇因具有强抗菌性和抗氧化活性可以用作防腐剂,延长食品的保质期,并可在茶叶中发挥调味作用[3].柠檬烯可以作用于害虫的多个靶点,通过抑制害虫感觉神经和运动神经的自发性动作[4]、破坏昆虫体壁的蜡质层[5]以及影响昆虫神经系统中的乙酰胆碱酯酶[6]等方式发挥杀虫作用.香叶醇常被用于香料和化妆品的生产.此外,香叶醇能够抑制细胞增殖并诱导细胞凋亡[7],以及靶向血管再生相关的基因[8],因此被视为一种有潜力的抗肿瘤化合物.鉴于部分单萜具有高能量密度和低凝固点,如柠檬烯和α-蒎烯,可作为传统喷气燃料的替代品[9]. ...
Limonene: a versatile chemical of the bioeconomy
1
2014
... 目前,单萜类化合物的来源主要有三种途径,包括植物提取、化学合成和生物合成.传统的直接从植物中提取单萜类化合物产量普遍较低,生产成本较高,无法满足大量的工业需求,而且可能会受到季节和地理变化的影响[10].而由于天然萜类化合物具有特定的结构,化学合成面临的一个关键技术挑战是合成产物往往是混合异构体,很难实现单一结构萜类化合物的合成[11].由于微生物有较短的生命周期与强大的生产力,利用微生物发酵合成萜类化合物提供了一种可替代的高效、可持续和生态友好的萜类化合物生产途径.此外,部分微生物仍可利用废弃食用油等丰富的廉价可回收资源生产萜类化合物,较传统方法更具有可持续性和经济性[12]. ...
Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli
1
2010
... 目前,单萜类化合物的来源主要有三种途径,包括植物提取、化学合成和生物合成.传统的直接从植物中提取单萜类化合物产量普遍较低,生产成本较高,无法满足大量的工业需求,而且可能会受到季节和地理变化的影响[10].而由于天然萜类化合物具有特定的结构,化学合成面临的一个关键技术挑战是合成产物往往是混合异构体,很难实现单一结构萜类化合物的合成[11].由于微生物有较短的生命周期与强大的生产力,利用微生物发酵合成萜类化合物提供了一种可替代的高效、可持续和生态友好的萜类化合物生产途径.此外,部分微生物仍可利用废弃食用油等丰富的廉价可回收资源生产萜类化合物,较传统方法更具有可持续性和经济性[12]. ...
Multicopy integrants of crt genes and co-expression of AMP deaminase improve lycopene production in Yarrowia lipolytica
1
2019
... 在解脂耶氏酵母中,ATP-柠檬酸裂解酶(ACL1、ACL2)是胞质乙酰辅酶A的主要来源,因此过表达ACL1或ACL2可以增加乙酰辅酶A的供应.柠檬酸是线粒体TCA循环的代谢产物,过表达AMP脱氨酶(AMPD)抑制异柠檬酸脱氢酶的活性,将更多的柠檬酸转运到细胞质中从而提高胞质中乙酰辅酶A的通量[54].人工引入异源磷酸酮醇酶(PK)和磷酸转乙酰酶(PTA)能够有效提高胞质乙酰辅酶A的供应,并且已被广泛用于提高萜类化合物的产量[55]. ...
Exploiting synthetic biology platforms for enhanced biosynthesis of natural products in Yarrowia lipolytica
1
2024
... 在解脂耶氏酵母中,ATP-柠檬酸裂解酶(ACL1、ACL2)是胞质乙酰辅酶A的主要来源,因此过表达ACL1或ACL2可以增加乙酰辅酶A的供应.柠檬酸是线粒体TCA循环的代谢产物,过表达AMP脱氨酶(AMPD)抑制异柠檬酸脱氢酶的活性,将更多的柠檬酸转运到细胞质中从而提高胞质中乙酰辅酶A的通量[54].人工引入异源磷酸酮醇酶(PK)和磷酸转乙酰酶(PTA)能够有效提高胞质乙酰辅酶A的供应,并且已被广泛用于提高萜类化合物的产量[55]. ...
Regulation of HMG-CoA reductase in mammals and yeast
1
2011
... HMGR是MVA途径的关键限速酶,其包含两个同工酶HMG1和HMG2,其中HMG1较稳定,HMG2易被细胞降解,两个酶都受不同机制的负反馈调控[56].目前过表达截短的HMR1(tHMG1)已经成为萜类化合物生产中增强前体供应的通用手段.Cao等[15]在解脂耶氏酵母中单独过表达tHMG1使柠檬烯产量比对照菌株提高了约18倍,而同时过表达ERG12和HMG1柠檬烯产量提高了112倍.Wei等[27]过表达HMGR、ERG8与ERG12,α-蒎烯产量提高了13.5倍.由于MVA路径只能产生IPP而不能产生DMAPP,IDI1催化IPP和DMAPP之间的异构化,这使得IDI1酶在单萜的生产中是必不可少的.Ignea等在酿酒酵母中过表达IDI1分别使桧烯和桉树脑产量提高了3倍[57]和5倍[58].当在香叶醇生产中采用相同的策略时,其产量提高了1.45倍[59]. ...
Engineering monoterpene production in yeast using a synthetic dominant negative geranyl diphosphate synthase
2
2014
... HMGR是MVA途径的关键限速酶,其包含两个同工酶HMG1和HMG2,其中HMG1较稳定,HMG2易被细胞降解,两个酶都受不同机制的负反馈调控[56].目前过表达截短的HMR1(tHMG1)已经成为萜类化合物生产中增强前体供应的通用手段.Cao等[15]在解脂耶氏酵母中单独过表达tHMG1使柠檬烯产量比对照菌株提高了约18倍,而同时过表达ERG12和HMG1柠檬烯产量提高了112倍.Wei等[27]过表达HMGR、ERG8与ERG12,α-蒎烯产量提高了13.5倍.由于MVA路径只能产生IPP而不能产生DMAPP,IDI1催化IPP和DMAPP之间的异构化,这使得IDI1酶在单萜的生产中是必不可少的.Ignea等在酿酒酵母中过表达IDI1分别使桧烯和桉树脑产量提高了3倍[57]和5倍[58].当在香叶醇生产中采用相同的策略时,其产量提高了1.45倍[59]. ...
... Fischer等[46]对ERG20的K197位点进行定点突变,发现K197G/A/L/C/S/T/R/D/E/N突变体可以提高香叶醇、芳樟醇和香茅醇的产量.Ignea等[57]通过对ERG20同源建模分析,发现其主要通过F96、A99、N127氨基酸位点抑制FPP合酶活性且不会影响GPP的合成,随后对其进行一系列定点突变,发现突变ERG20F96W 和ERG20N127W 后,桧烯产量分别提高了3.21倍和5.57倍.对ERG20进行F96W和N127W双突变后,桧烯产量增加到10.32倍.Zhang等[66]在线粒体和细胞质中同时表达F96W和N127W组成的ERG20高效双突变酶,使芳樟醇产量提高到2.69 mg/L,比对照菌株提高了2倍.Jiang等[37]通过过表达ERG20的F96W和N127W双突变酶,香叶醇的滴度提高了34%. ...
Improving yeast strains using recyclable integration cassettes, for the production of plant terpenoids
1
2011
... HMGR是MVA途径的关键限速酶,其包含两个同工酶HMG1和HMG2,其中HMG1较稳定,HMG2易被细胞降解,两个酶都受不同机制的负反馈调控[56].目前过表达截短的HMR1(tHMG1)已经成为萜类化合物生产中增强前体供应的通用手段.Cao等[15]在解脂耶氏酵母中单独过表达tHMG1使柠檬烯产量比对照菌株提高了约18倍,而同时过表达ERG12和HMG1柠檬烯产量提高了112倍.Wei等[27]过表达HMGR、ERG8与ERG12,α-蒎烯产量提高了13.5倍.由于MVA路径只能产生IPP而不能产生DMAPP,IDI1催化IPP和DMAPP之间的异构化,这使得IDI1酶在单萜的生产中是必不可少的.Ignea等在酿酒酵母中过表达IDI1分别使桧烯和桉树脑产量提高了3倍[57]和5倍[58].当在香叶醇生产中采用相同的策略时,其产量提高了1.45倍[59]. ...
Overproduction of geraniol by enhanced precursor supply in Saccharomyces cerevisiae
1
2013
... HMGR是MVA途径的关键限速酶,其包含两个同工酶HMG1和HMG2,其中HMG1较稳定,HMG2易被细胞降解,两个酶都受不同机制的负反馈调控[56].目前过表达截短的HMR1(tHMG1)已经成为萜类化合物生产中增强前体供应的通用手段.Cao等[15]在解脂耶氏酵母中单独过表达tHMG1使柠檬烯产量比对照菌株提高了约18倍,而同时过表达ERG12和HMG1柠檬烯产量提高了112倍.Wei等[27]过表达HMGR、ERG8与ERG12,α-蒎烯产量提高了13.5倍.由于MVA路径只能产生IPP而不能产生DMAPP,IDI1催化IPP和DMAPP之间的异构化,这使得IDI1酶在单萜的生产中是必不可少的.Ignea等在酿酒酵母中过表达IDI1分别使桧烯和桉树脑产量提高了3倍[57]和5倍[58].当在香叶醇生产中采用相同的策略时,其产量提高了1.45倍[59]. ...
Machine-learning guided elucidation of contribution of individual steps in the mevalonate pathway and construction of a yeast platform strain for terpenoid production
1
2022
... 除了过表达已知的MVA路径限速酶外,有研究通过机器学习指导的建模定量揭示了每个酶对产物产量的贡献,发现ERG12也是MVA路径关键酶[60].Zhou等[61]在酿酒酵母中过表达整个MVA途径基因提高了前体GPP的通量,使得芳樟醇产量提高到36.48 mg/L.除了过表达关键酶外,一些基因的敲除也可以提高单萜产量,如敲除YPL062W会刺激一些MVA途径基因的上调,将碳流导向单萜前体乙酰辅酶A和MVA,从而提高MVA和香叶醇的产量[62]. ...
Improved linalool production in Saccharomyces cerevisiae by combining directed evolution of linalool synthase and overexpression of the complete mevalonate pathway
1
2020
... 除了过表达已知的MVA路径限速酶外,有研究通过机器学习指导的建模定量揭示了每个酶对产物产量的贡献,发现ERG12也是MVA路径关键酶[60].Zhou等[61]在酿酒酵母中过表达整个MVA途径基因提高了前体GPP的通量,使得芳樟醇产量提高到36.48 mg/L.除了过表达关键酶外,一些基因的敲除也可以提高单萜产量,如敲除YPL062W会刺激一些MVA途径基因的上调,将碳流导向单萜前体乙酰辅酶A和MVA,从而提高MVA和香叶醇的产量[62]. ...
Primary and secondary metabolic effects of a key gene deletion (ΔYPL062W) in metabolically engineered terpenoid-producing Saccharomyces cerevisiae
1
2019
... 除了过表达已知的MVA路径限速酶外,有研究通过机器学习指导的建模定量揭示了每个酶对产物产量的贡献,发现ERG12也是MVA路径关键酶[60].Zhou等[61]在酿酒酵母中过表达整个MVA途径基因提高了前体GPP的通量,使得芳樟醇产量提高到36.48 mg/L.除了过表达关键酶外,一些基因的敲除也可以提高单萜产量,如敲除YPL062W会刺激一些MVA途径基因的上调,将碳流导向单萜前体乙酰辅酶A和MVA,从而提高MVA和香叶醇的产量[62]. ...
Engineering a universal and efficient platform for terpenoid synthesis in yeast
1
2023
... 内源性基因和异源通路的过表达常常受到宿主自身固有调控网络和与代谢竞争的影响,在酵母中过表达内源MVA途径相关基因仅能一定程度提高产量,仍无法摆脱内在调控机制的限制.为了突破这一瓶颈,有研究者通过在酿酒酵母中引入胆碱激酶(CK)和异戊烯磷酸激酶(IPK)基因组成两步磷酸化途径(IUP),大大缩短了萜类合成前体IPP和DMAPP的合成步骤,且IUP路径独立于天然途径[17].通过异源表达IUP途径,IPP/DMAPP池相对于原生MVA途径提高了147倍,这表明IUP为萜烯合成提供充足的关键前体[63].Zhao等[32]通过在甘油假丝酵母中引入与中心碳代谢脱钩的IUP途径使得菌株的IPP/DMAPP池提高了4.2倍,香叶醇产量提高了99.8%. ...
单萜类化合物的微生物合成
1
2022
... 充足的GPP供应对于单萜类化合物的合成至关重要,但大多数微生物中缺乏特异性的GPPS,而是由ERG20催化IPP和DMAPP而得到,随后GPP继续与1分子IPP生成FPP,由于GPP与ERG20的活性位点结合紧密,GPP大部分进一步合成FPP,少部分处于游离状态,这大大限制了单萜的产量[64].Zhao等[65]在酿酒酵母中表达Abies grandis、Picea abies和Catharanthus roseus三种来源的GPP合酶AgPPS2、PaPPS2和CrGPPS并将其截短,香叶醇的产量不仅没有提高,反而有所下降.推测在酵母体内异源GPP合酶的活性较难表达,因此对ERG20进行蛋白质工程改造是增强GPP供应的主要策略. ...
Microbial synthesis of monoterpenoids: a review
1
2022
... 充足的GPP供应对于单萜类化合物的合成至关重要,但大多数微生物中缺乏特异性的GPPS,而是由ERG20催化IPP和DMAPP而得到,随后GPP继续与1分子IPP生成FPP,由于GPP与ERG20的活性位点结合紧密,GPP大部分进一步合成FPP,少部分处于游离状态,这大大限制了单萜的产量[64].Zhao等[65]在酿酒酵母中表达Abies grandis、Picea abies和Catharanthus roseus三种来源的GPP合酶AgPPS2、PaPPS2和CrGPPS并将其截短,香叶醇的产量不仅没有提高,反而有所下降.推测在酵母体内异源GPP合酶的活性较难表达,因此对ERG20进行蛋白质工程改造是增强GPP供应的主要策略. ...
Microbial production of isoprenoids
2
2011
... 目前,单萜类化合物的来源主要有三种途径,包括植物提取、化学合成和生物合成.传统的直接从植物中提取单萜类化合物产量普遍较低,生产成本较高,无法满足大量的工业需求,而且可能会受到季节和地理变化的影响[10].而由于天然萜类化合物具有特定的结构,化学合成面临的一个关键技术挑战是合成产物往往是混合异构体,很难实现单一结构萜类化合物的合成[11].由于微生物有较短的生命周期与强大的生产力,利用微生物发酵合成萜类化合物提供了一种可替代的高效、可持续和生态友好的萜类化合物生产途径.此外,部分微生物仍可利用废弃食用油等丰富的廉价可回收资源生产萜类化合物,较传统方法更具有可持续性和经济性[12]. ...
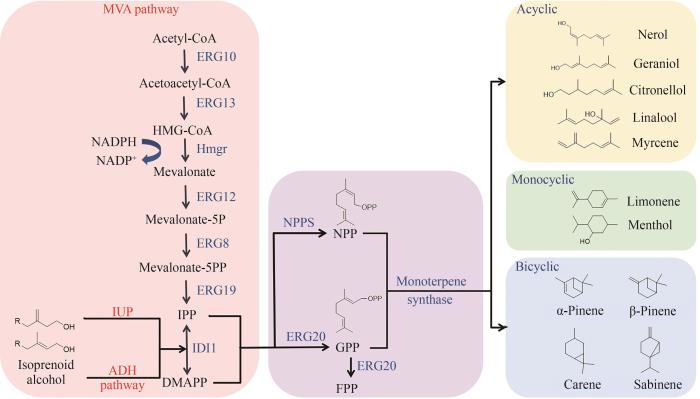
... 微生物中的单萜合成途径可以分为三个模块进行分析:①从碳源到共同前体异戊烯基二磷酸(isopentenyl diphosphate,IPP)和二甲基烯丙基二磷酸(dimethylallyl diphosphate,DMAPP).其来源主要有两条途径:甲羟戊酸(mevalonate,MVA)途径和甲基赤藓糖醇- 4 -磷酸(methylerythritol-4-phosphate,MEP)途径.MEP途径存在于大多数细菌和植物细胞的叶绿体中,而MVA途径存在于真菌、动物、少数细菌以及一些植物的细胞质中[12].②在关键酶香叶基二磷酸合成酶(geranyl diphosphate synthase,GPPS)的催化下,1分子异戊烯基二磷酸(IPP)和1分子二甲基烯丙基二磷酸(DMAPP)立即缩合生成香叶基二磷酸(geranyl diphosphate,GPP).③GPP作为直接前体被各种单萜合成酶(monoterpene synthase,MTS)转化为不同的单萜.GPP的顺式异构体NPP(neryl diphosphate)也可作为前体来生成环状单萜,如在酿酒酵母[14]和解脂耶氏酵母[15]中,NPP合成酶(NPPS)可以显著提高柠檬烯生物合成途径的效率和产量. ...
Properties of alternative microbial hosts used in synthetic biology: towards the design of a modular chassis
1
2016
... 近年来多种微生物(如大肠杆菌、酿酒酵母等)已被设计改造为高效生产单萜类化合物的细胞工厂[13].其中酿酒酵母(Saccharomyces cerevisiae)因具有鲁棒性、清晰的遗传背景以及蛋白后修饰功能等优势,成为应用广泛的工程菌.随着合成生物学的发展,越来越多的研究者们也开始利用解脂耶氏酵母与甘油假丝酵母等非常规酵母生产单萜类化合物.本文综述了酵母异源合成单萜类化合物的研究进展,对近年来代谢改造酵母合成单萜类化合物的主要策略进行总结,讨论目前仍面临的一些瓶颈问题并提出可能的解决措施,以期为酵母细胞工厂高效合成单萜类化合物提供理论依据. ...
Orthogonal monoterpenoid biosynthesis in yeast constructed on an isomeric substrate
1
2019
... 微生物中的单萜合成途径可以分为三个模块进行分析:①从碳源到共同前体异戊烯基二磷酸(isopentenyl diphosphate,IPP)和二甲基烯丙基二磷酸(dimethylallyl diphosphate,DMAPP).其来源主要有两条途径:甲羟戊酸(mevalonate,MVA)途径和甲基赤藓糖醇- 4 -磷酸(methylerythritol-4-phosphate,MEP)途径.MEP途径存在于大多数细菌和植物细胞的叶绿体中,而MVA途径存在于真菌、动物、少数细菌以及一些植物的细胞质中[12].②在关键酶香叶基二磷酸合成酶(geranyl diphosphate synthase,GPPS)的催化下,1分子异戊烯基二磷酸(IPP)和1分子二甲基烯丙基二磷酸(DMAPP)立即缩合生成香叶基二磷酸(geranyl diphosphate,GPP).③GPP作为直接前体被各种单萜合成酶(monoterpene synthase,MTS)转化为不同的单萜.GPP的顺式异构体NPP(neryl diphosphate)也可作为前体来生成环状单萜,如在酿酒酵母[14]和解脂耶氏酵母[15]中,NPP合成酶(NPPS)可以显著提高柠檬烯生物合成途径的效率和产量. ...
Metabolic engineering of oleaginous yeast Yarrowia lipolytica for limonene overproduction
2
2016
... 微生物中的单萜合成途径可以分为三个模块进行分析:①从碳源到共同前体异戊烯基二磷酸(isopentenyl diphosphate,IPP)和二甲基烯丙基二磷酸(dimethylallyl diphosphate,DMAPP).其来源主要有两条途径:甲羟戊酸(mevalonate,MVA)途径和甲基赤藓糖醇- 4 -磷酸(methylerythritol-4-phosphate,MEP)途径.MEP途径存在于大多数细菌和植物细胞的叶绿体中,而MVA途径存在于真菌、动物、少数细菌以及一些植物的细胞质中[12].②在关键酶香叶基二磷酸合成酶(geranyl diphosphate synthase,GPPS)的催化下,1分子异戊烯基二磷酸(IPP)和1分子二甲基烯丙基二磷酸(DMAPP)立即缩合生成香叶基二磷酸(geranyl diphosphate,GPP).③GPP作为直接前体被各种单萜合成酶(monoterpene synthase,MTS)转化为不同的单萜.GPP的顺式异构体NPP(neryl diphosphate)也可作为前体来生成环状单萜,如在酿酒酵母[14]和解脂耶氏酵母[15]中,NPP合成酶(NPPS)可以显著提高柠檬烯生物合成途径的效率和产量. ...
... HMGR是MVA途径的关键限速酶,其包含两个同工酶HMG1和HMG2,其中HMG1较稳定,HMG2易被细胞降解,两个酶都受不同机制的负反馈调控[56].目前过表达截短的HMR1(tHMG1)已经成为萜类化合物生产中增强前体供应的通用手段.Cao等[15]在解脂耶氏酵母中单独过表达tHMG1使柠檬烯产量比对照菌株提高了约18倍,而同时过表达ERG12和HMG1柠檬烯产量提高了112倍.Wei等[27]过表达HMGR、ERG8与ERG12,α-蒎烯产量提高了13.5倍.由于MVA路径只能产生IPP而不能产生DMAPP,IDI1催化IPP和DMAPP之间的异构化,这使得IDI1酶在单萜的生产中是必不可少的.Ignea等在酿酒酵母中过表达IDI1分别使桧烯和桉树脑产量提高了3倍[57]和5倍[58].当在香叶醇生产中采用相同的策略时,其产量提高了1.45倍[59]. ...
Microbial synthesis of pinene
1
2014
... 如图1所示,在酵母细胞中存在内源的MVA途径,乙酰乙酰辅酶A硫解酶(acetoacetyl-CoA thiolase,ERG10)催化乙酰辅酶A(acetyl-CoA)反应生成乙酰乙酰辅酶A,乙酰乙酰辅酶A在羟甲基戊二烯辅酶A合酶(hydroxymethylglutaryl-CoA synthase,ERG13)与羟甲基戊二酰辅酶A还原酶(hydroxymethylglutaryl-CoA reductase,HMGR)的催化作用下生成甲羟戊酸(mevalonate),随后甲羟戊酸激酶(mevalonate kinase,ERG12)、磷酸甲羟戊酸激酶(phosphomevalonate kinase,ERG8)、甲羟戊酸二磷酸脱羧酶(mevalonate diphosphate decarboxylase,ERG19)将甲羟戊酸催化生成IPP,IPP经异戊二烯基焦磷酸异构酶(isopentenyl diphosphate isomerase,IDI)作用异构化形成DMAPP[16].最后IPP与DMAPP以1∶1的比例在法尼基焦磷酸合成酶(farnesyl pyrophosphate synthetase,ERG20)催化下生成单萜的共同前体GPP. ...
Two-step pathway for isoprenoid synthesis
2
2019
... 目前单萜前体合成除了天然的MEP与MVA途径,构建人工生物合成途径可以有效缓解内源途径所带来的代谢负担,且由于其不与细胞内中心代谢耦联,可以有效减少碳通量以及辅因子的竞争.如通过构建异戊烯醇利用途径(isopentenol utilization pathway,IUP),表达酿酒酵母内源的胆碱激酶和拟南芥来源的异戊烯磷酸激酶(IPK)可以将异戊烯醇及其异构体异戊二烯醇生物转化为IPP或DMAPP[17].而利用志贺氏菌来源的非特异性酸性磷酸酶和嗜酸热原体菌来源的IPK开发的一条醇依赖型半萜(alcoholdependent hemiterpene,ADH)途径可将外源异戊烯醇及其异构体二甲基烯丙醇转化为类异戊二烯[18]. ...
... 内源性基因和异源通路的过表达常常受到宿主自身固有调控网络和与代谢竞争的影响,在酵母中过表达内源MVA途径相关基因仅能一定程度提高产量,仍无法摆脱内在调控机制的限制.为了突破这一瓶颈,有研究者通过在酿酒酵母中引入胆碱激酶(CK)和异戊烯磷酸激酶(IPK)基因组成两步磷酸化途径(IUP),大大缩短了萜类合成前体IPP和DMAPP的合成步骤,且IUP路径独立于天然途径[17].通过异源表达IUP途径,IPP/DMAPP池相对于原生MVA途径提高了147倍,这表明IUP为萜烯合成提供充足的关键前体[63].Zhao等[32]通过在甘油假丝酵母中引入与中心碳代谢脱钩的IUP途径使得菌株的IPP/DMAPP池提高了4.2倍,香叶醇产量提高了99.8%. ...
An artificial pathway for isoprenoid biosynthesis decoupled from native hemiterpene metabolism
1
2019
... 目前单萜前体合成除了天然的MEP与MVA途径,构建人工生物合成途径可以有效缓解内源途径所带来的代谢负担,且由于其不与细胞内中心代谢耦联,可以有效减少碳通量以及辅因子的竞争.如通过构建异戊烯醇利用途径(isopentenol utilization pathway,IUP),表达酿酒酵母内源的胆碱激酶和拟南芥来源的异戊烯磷酸激酶(IPK)可以将异戊烯醇及其异构体异戊二烯醇生物转化为IPP或DMAPP[17].而利用志贺氏菌来源的非特异性酸性磷酸酶和嗜酸热原体菌来源的IPK开发的一条醇依赖型半萜(alcoholdependent hemiterpene,ADH)途径可将外源异戊烯醇及其异构体二甲基烯丙醇转化为类异戊二烯[18]. ...
Production of plant natural products through engineered Yarrowia lipolytica
1
2020
... 目前国内外众多学者利用不同微生物如细菌和真菌等,通过导入不同单萜合成酶实现多种单萜类化合物的合成.而在众多宿主中,酵母细胞有其独特的优势:鲁棒性强,适合高密度发酵;有内源MVA途径,相较于MEP途径可以提供更丰富的萜类前体;有完整的蛋白翻译后修饰体系,可以更好地表达氧化还原、羟基化以及糖基化等反应所需的细胞色素P450酶[19];有亚细胞器可以给萜类物质的生产提供更适宜的环境,且通过区室化调控可以更高效地生产单萜[20-21]. ...
The yeast peroxisome: a dynamic storage depot and subcellular factory for squalene overproduction
1
2020
... 目前国内外众多学者利用不同微生物如细菌和真菌等,通过导入不同单萜合成酶实现多种单萜类化合物的合成.而在众多宿主中,酵母细胞有其独特的优势:鲁棒性强,适合高密度发酵;有内源MVA途径,相较于MEP途径可以提供更丰富的萜类前体;有完整的蛋白翻译后修饰体系,可以更好地表达氧化还原、羟基化以及糖基化等反应所需的细胞色素P450酶[19];有亚细胞器可以给萜类物质的生产提供更适宜的环境,且通过区室化调控可以更高效地生产单萜[20-21]. ...
Metabolic compartmentalization in yeast mitochondria: burden and solution for squalene overproduction
1
2021
... 目前国内外众多学者利用不同微生物如细菌和真菌等,通过导入不同单萜合成酶实现多种单萜类化合物的合成.而在众多宿主中,酵母细胞有其独特的优势:鲁棒性强,适合高密度发酵;有内源MVA途径,相较于MEP途径可以提供更丰富的萜类前体;有完整的蛋白翻译后修饰体系,可以更好地表达氧化还原、羟基化以及糖基化等反应所需的细胞色素P450酶[19];有亚细胞器可以给萜类物质的生产提供更适宜的环境,且通过区室化调控可以更高效地生产单萜[20-21]. ...
Improving monoterpene geraniol production through geranyl diphosphate synthesis regulation in Saccharomyces cerevisiae
3
2016
... 充足的GPP供应对于单萜类化合物的合成至关重要,但大多数微生物中缺乏特异性的GPPS,而是由ERG20催化IPP和DMAPP而得到,随后GPP继续与1分子IPP生成FPP,由于GPP与ERG20的活性位点结合紧密,GPP大部分进一步合成FPP,少部分处于游离状态,这大大限制了单萜的产量[64].Zhao等[65]在酿酒酵母中表达Abies grandis、Picea abies和Catharanthus roseus三种来源的GPP合酶AgPPS2、PaPPS2和CrGPPS并将其截短,香叶醇的产量不仅没有提高,反而有所下降.推测在酵母体内异源GPP合酶的活性较难表达,因此对ERG20进行蛋白质工程改造是增强GPP供应的主要策略. ...
... 大多数植物来源的单萜合酶N端含有转运肽,用于将酶定位至质体,未成熟的酶在到达目标部位后其转运肽被切进一步形成成熟的酶[67].但酵母细胞中缺乏清除质体转运肽的机制,N末端转运肽的存在可能会影响酶的活性,进一步影响单萜的合成.故通过信号肽截短可以在一定程度上提高酶的异源表达活性且防止其错误定位.Zhao等[65]通过表达截短的缬草(Valeriana officinalis)来源香叶醇合成酶(tVoGE),发现香叶醇的产量是全长VoGES的产量的3倍.确定合适的截短位置对于酶的高效表达是必要的,Jiang等[37]利用计算机预测长春花来源的香叶醇合酶CrGES的信号肽结构,在CrGES酶N端的4个不同位置进行截短(S14、L28、S43和S52),发现S43处截短的CrGES酶较另外三种截短酶的二级结构稳定性更高且表现出最高的香叶醇产量(191.61 mg/L),是未截短菌株的4.45倍.Denby等[68]发现薄荷柠檬(Mentha citrata)来源的芳樟醇合成酶在67位(t67McLIS)截短后的活性最佳,芳樟醇产量达到16 mg/L. ...
... 利用蛋白质间的相互作用理论,通过一段短肽连接序列将两个酶进行融合,可以增强底物隧道效应、提高酶的底物浓度和减少底物的消耗.连接linker的长度和蛋白的融合方向是影响融合酶催化活性的关键因素.Wang等[69-70]通过调节GSG linker的数量,构建了5个不同linker长度的融合蛋白CS(cineole synthase)-P450cin,这些融合蛋白在生产水平、生产速率和总生产比率上表现出明显的差异.Jiang等[37]利用短柔性连接肽GSG分别从正向和反向连接t43CrGES与Erg20ww,根据对t43CrGES和Erg20ww 表面电荷分布的分析以及基于静电吸引作用的设计,在反向融合蛋白t43CrGES-ERG20ww 的基础上表达ERG20ww 的另一份拷贝,使香叶醇产量提升了30%,达到523.96 mg/L.Deng等[71]用3个不同长度的连接肽将Actinidia arguta来源的芳樟醇合成酶(AaLS1)与FPPS融合,发现表达(GGGGS)3融合后的蛋白复合物相比于表达两个游离酶芳樟醇产量提高了69.7%.Zhao等[65]发现tVoGES-GGGS-ERG20WW的融合方式使得香叶醇产量提高了1.7倍,反向融合以及其他两种更长的linker产量无明显变化甚至有所降低. ...
High-level production of linalool by engineered Saccharomyces cerevisiae harboring dual mevalonate pathways in mitochondria and cytoplasm
1
2020
... Fischer等[46]对ERG20的K197位点进行定点突变,发现K197G/A/L/C/S/T/R/D/E/N突变体可以提高香叶醇、芳樟醇和香茅醇的产量.Ignea等[57]通过对ERG20同源建模分析,发现其主要通过F96、A99、N127氨基酸位点抑制FPP合酶活性且不会影响GPP的合成,随后对其进行一系列定点突变,发现突变ERG20F96W 和ERG20N127W 后,桧烯产量分别提高了3.21倍和5.57倍.对ERG20进行F96W和N127W双突变后,桧烯产量增加到10.32倍.Zhang等[66]在线粒体和细胞质中同时表达F96W和N127W组成的ERG20高效双突变酶,使芳樟醇产量提高到2.69 mg/L,比对照菌株提高了2倍.Jiang等[37]通过过表达ERG20的F96W和N127W双突变酶,香叶醇的滴度提高了34%. ...
Plant terpenoid synthases: molecular biology and phylogenetic analysis
1
1998
... 大多数植物来源的单萜合酶N端含有转运肽,用于将酶定位至质体,未成熟的酶在到达目标部位后其转运肽被切进一步形成成熟的酶[67].但酵母细胞中缺乏清除质体转运肽的机制,N末端转运肽的存在可能会影响酶的活性,进一步影响单萜的合成.故通过信号肽截短可以在一定程度上提高酶的异源表达活性且防止其错误定位.Zhao等[65]通过表达截短的缬草(Valeriana officinalis)来源香叶醇合成酶(tVoGE),发现香叶醇的产量是全长VoGES的产量的3倍.确定合适的截短位置对于酶的高效表达是必要的,Jiang等[37]利用计算机预测长春花来源的香叶醇合酶CrGES的信号肽结构,在CrGES酶N端的4个不同位置进行截短(S14、L28、S43和S52),发现S43处截短的CrGES酶较另外三种截短酶的二级结构稳定性更高且表现出最高的香叶醇产量(191.61 mg/L),是未截短菌株的4.45倍.Denby等[68]发现薄荷柠檬(Mentha citrata)来源的芳樟醇合成酶在67位(t67McLIS)截短后的活性最佳,芳樟醇产量达到16 mg/L. ...
Industrial brewing yeast engineered for the production of primary flavor determinants in hopped beer
1
2018
... 大多数植物来源的单萜合酶N端含有转运肽,用于将酶定位至质体,未成熟的酶在到达目标部位后其转运肽被切进一步形成成熟的酶[67].但酵母细胞中缺乏清除质体转运肽的机制,N末端转运肽的存在可能会影响酶的活性,进一步影响单萜的合成.故通过信号肽截短可以在一定程度上提高酶的异源表达活性且防止其错误定位.Zhao等[65]通过表达截短的缬草(Valeriana officinalis)来源香叶醇合成酶(tVoGE),发现香叶醇的产量是全长VoGES的产量的3倍.确定合适的截短位置对于酶的高效表达是必要的,Jiang等[37]利用计算机预测长春花来源的香叶醇合酶CrGES的信号肽结构,在CrGES酶N端的4个不同位置进行截短(S14、L28、S43和S52),发现S43处截短的CrGES酶较另外三种截短酶的二级结构稳定性更高且表现出最高的香叶醇产量(191.61 mg/L),是未截短菌株的4.45倍.Denby等[68]发现薄荷柠檬(Mentha citrata)来源的芳樟醇合成酶在67位(t67McLIS)截短后的活性最佳,芳樟醇产量达到16 mg/L. ...
Efficient production of oxidized terpenoids via engineering fusion proteins of terpene synthase and cytochrome P450
1
2021
... 利用蛋白质间的相互作用理论,通过一段短肽连接序列将两个酶进行融合,可以增强底物隧道效应、提高酶的底物浓度和减少底物的消耗.连接linker的长度和蛋白的融合方向是影响融合酶催化活性的关键因素.Wang等[69-70]通过调节GSG linker的数量,构建了5个不同linker长度的融合蛋白CS(cineole synthase)-P450cin,这些融合蛋白在生产水平、生产速率和总生产比率上表现出明显的差异.Jiang等[37]利用短柔性连接肽GSG分别从正向和反向连接t43CrGES与Erg20ww,根据对t43CrGES和Erg20ww 表面电荷分布的分析以及基于静电吸引作用的设计,在反向融合蛋白t43CrGES-ERG20ww 的基础上表达ERG20ww 的另一份拷贝,使香叶醇产量提升了30%,达到523.96 mg/L.Deng等[71]用3个不同长度的连接肽将Actinidia arguta来源的芳樟醇合成酶(AaLS1)与FPPS融合,发现表达(GGGGS)3融合后的蛋白复合物相比于表达两个游离酶芳樟醇产量提高了69.7%.Zhao等[65]发现tVoGES-GGGS-ERG20WW的融合方式使得香叶醇产量提高了1.7倍,反向融合以及其他两种更长的linker产量无明显变化甚至有所降低. ...
Chemical synthesis of multifunctional air pollutants: terpene-derived nitrooxy organosulfates
1
2021
... 利用蛋白质间的相互作用理论,通过一段短肽连接序列将两个酶进行融合,可以增强底物隧道效应、提高酶的底物浓度和减少底物的消耗.连接linker的长度和蛋白的融合方向是影响融合酶催化活性的关键因素.Wang等[69-70]通过调节GSG linker的数量,构建了5个不同linker长度的融合蛋白CS(cineole synthase)-P450cin,这些融合蛋白在生产水平、生产速率和总生产比率上表现出明显的差异.Jiang等[37]利用短柔性连接肽GSG分别从正向和反向连接t43CrGES与Erg20ww,根据对t43CrGES和Erg20ww 表面电荷分布的分析以及基于静电吸引作用的设计,在反向融合蛋白t43CrGES-ERG20ww 的基础上表达ERG20ww 的另一份拷贝,使香叶醇产量提升了30%,达到523.96 mg/L.Deng等[71]用3个不同长度的连接肽将Actinidia arguta来源的芳樟醇合成酶(AaLS1)与FPPS融合,发现表达(GGGGS)3融合后的蛋白复合物相比于表达两个游离酶芳樟醇产量提高了69.7%.Zhao等[65]发现tVoGES-GGGS-ERG20WW的融合方式使得香叶醇产量提高了1.7倍,反向融合以及其他两种更长的linker产量无明显变化甚至有所降低. ...
Enhanced (S)-linalool production by fusion expression of farnesyl diphosphate synthase and linalool synthase in Saccharomyces cerevisiae
1
2016
... 利用蛋白质间的相互作用理论,通过一段短肽连接序列将两个酶进行融合,可以增强底物隧道效应、提高酶的底物浓度和减少底物的消耗.连接linker的长度和蛋白的融合方向是影响融合酶催化活性的关键因素.Wang等[69-70]通过调节GSG linker的数量,构建了5个不同linker长度的融合蛋白CS(cineole synthase)-P450cin,这些融合蛋白在生产水平、生产速率和总生产比率上表现出明显的差异.Jiang等[37]利用短柔性连接肽GSG分别从正向和反向连接t43CrGES与Erg20ww,根据对t43CrGES和Erg20ww 表面电荷分布的分析以及基于静电吸引作用的设计,在反向融合蛋白t43CrGES-ERG20ww 的基础上表达ERG20ww 的另一份拷贝,使香叶醇产量提升了30%,达到523.96 mg/L.Deng等[71]用3个不同长度的连接肽将Actinidia arguta来源的芳樟醇合成酶(AaLS1)与FPPS融合,发现表达(GGGGS)3融合后的蛋白复合物相比于表达两个游离酶芳樟醇产量提高了69.7%.Zhao等[65]发现tVoGES-GGGS-ERG20WW的融合方式使得香叶醇产量提高了1.7倍,反向融合以及其他两种更长的linker产量无明显变化甚至有所降低. ...
Combinatorial modulation of linalool synthase and farnesyl diphosphate synthase for linalool overproduction in Saccharomyces cerevisiae
1
2021
... 与融合蛋白相比,蛋白支架可以组装连续催化的多个酶,拉进不同酶之间的空间距离,提高酶的底物浓度,减少底物损失.这一策略主要依赖于蛋白结构域和配体间的相互作用,可以通过调节蛋白支架上的配体数量和顺序进一步优化蛋白复合体的表达和活性.Jiang等[38]选择SH3(来自于小鼠Crk的SH3结构域)、GBD(大鼠神经-维斯科特-奥尔德里奇综合征蛋白的GTPase结合结构域)和PDZ(来自小鼠α-合酶蛋白的PDZ结构域)构建合成蛋白支架,使用GSG短肽将SH3、GBD、PDZ的配体分别与融合蛋白tCrGES-ERG20F96W/N127W、CrIS、IDI1的C末端融合,调整不同种酶的配体数量后发现SF1(SH31PDZ1GBD1)是最佳的配体比例支架,香茅醇的产量提高了21%达到655.20 mg/L.Zhou等[72]利用短肽标签RIAD和RIDD以1∶2的化学计量比模块化组装芳樟醇合成酶突变体t67OMcLISE343D/E352H和ERG20F96W/N127W,使得芳樟醇产量提高了约42%. ...
Distinct redox regulation in sub-cellular compartments in response to various stress conditions in Saccharomyces cerevisiae
1
2013
... 目前酵母内大量的代谢反应发生在细胞质中,单萜合成的代谢工程主要集中在细胞质代谢途径的重组上,利用线粒体、过氧化物酶体、内质网等亚细胞器优化单萜生产的研究受到越来越多的关注.亚细胞器不仅具有异于胞质的理化环境,还具有独特的代谢产物、酶、辅因子等物质,是构建高效合成途径的潜在场所[73].如过氧化物酶体作为脂肪酸β氧化的场所,可以提供充足的乙酰辅酶A.线粒体中的乙酰辅酶A含量比细胞质中的高近20~30倍[74].故合理的细胞器区室化可以极大地提高乙酰辅酶A的利用率.细胞器的膜结构还可以将酶、底物和辅因子在细胞内局部浓缩,改善底物通道,提高产物的合成效率,并且可以减少竞争途径或代谢串扰对底物的消耗,在一定程度上可以减轻有毒中间产物或蛋白对宿主的毒性.目前单萜类化合物亚细胞器定位多为线粒体和过氧化物酶体,内质网和脂滴的细胞器工程尚未应用到单萜的合成中,但角鲨烯[75]、原人参二醇[75]、β-胡萝卜素[76]和番茄红素[77]的合成结果表明这种策略对于单萜类化合物的合成也是可行的. ...
Acetylation dynamics and stoichiometry in Saccharomyces cerevisiae
1
2014
... 目前酵母内大量的代谢反应发生在细胞质中,单萜合成的代谢工程主要集中在细胞质代谢途径的重组上,利用线粒体、过氧化物酶体、内质网等亚细胞器优化单萜生产的研究受到越来越多的关注.亚细胞器不仅具有异于胞质的理化环境,还具有独特的代谢产物、酶、辅因子等物质,是构建高效合成途径的潜在场所[73].如过氧化物酶体作为脂肪酸β氧化的场所,可以提供充足的乙酰辅酶A.线粒体中的乙酰辅酶A含量比细胞质中的高近20~30倍[74].故合理的细胞器区室化可以极大地提高乙酰辅酶A的利用率.细胞器的膜结构还可以将酶、底物和辅因子在细胞内局部浓缩,改善底物通道,提高产物的合成效率,并且可以减少竞争途径或代谢串扰对底物的消耗,在一定程度上可以减轻有毒中间产物或蛋白对宿主的毒性.目前单萜类化合物亚细胞器定位多为线粒体和过氧化物酶体,内质网和脂滴的细胞器工程尚未应用到单萜的合成中,但角鲨烯[75]、原人参二醇[75]、β-胡萝卜素[76]和番茄红素[77]的合成结果表明这种策略对于单萜类化合物的合成也是可行的. ...
Tailoring the Saccharomyces cerevisiae endoplasmic reticulum for functional assembly of terpene synthesis pathway
2
2019
... 目前酵母内大量的代谢反应发生在细胞质中,单萜合成的代谢工程主要集中在细胞质代谢途径的重组上,利用线粒体、过氧化物酶体、内质网等亚细胞器优化单萜生产的研究受到越来越多的关注.亚细胞器不仅具有异于胞质的理化环境,还具有独特的代谢产物、酶、辅因子等物质,是构建高效合成途径的潜在场所[73].如过氧化物酶体作为脂肪酸β氧化的场所,可以提供充足的乙酰辅酶A.线粒体中的乙酰辅酶A含量比细胞质中的高近20~30倍[74].故合理的细胞器区室化可以极大地提高乙酰辅酶A的利用率.细胞器的膜结构还可以将酶、底物和辅因子在细胞内局部浓缩,改善底物通道,提高产物的合成效率,并且可以减少竞争途径或代谢串扰对底物的消耗,在一定程度上可以减轻有毒中间产物或蛋白对宿主的毒性.目前单萜类化合物亚细胞器定位多为线粒体和过氧化物酶体,内质网和脂滴的细胞器工程尚未应用到单萜的合成中,但角鲨烯[75]、原人参二醇[75]、β-胡萝卜素[76]和番茄红素[77]的合成结果表明这种策略对于单萜类化合物的合成也是可行的. ...
... [75]、β-胡萝卜素[76]和番茄红素[77]的合成结果表明这种策略对于单萜类化合物的合成也是可行的. ...
Iterative integration of multiple-copy pathway genes in Yarrowia lipolytica for heterologous β-carotene production
1
2017
... 目前酵母内大量的代谢反应发生在细胞质中,单萜合成的代谢工程主要集中在细胞质代谢途径的重组上,利用线粒体、过氧化物酶体、内质网等亚细胞器优化单萜生产的研究受到越来越多的关注.亚细胞器不仅具有异于胞质的理化环境,还具有独特的代谢产物、酶、辅因子等物质,是构建高效合成途径的潜在场所[73].如过氧化物酶体作为脂肪酸β氧化的场所,可以提供充足的乙酰辅酶A.线粒体中的乙酰辅酶A含量比细胞质中的高近20~30倍[74].故合理的细胞器区室化可以极大地提高乙酰辅酶A的利用率.细胞器的膜结构还可以将酶、底物和辅因子在细胞内局部浓缩,改善底物通道,提高产物的合成效率,并且可以减少竞争途径或代谢串扰对底物的消耗,在一定程度上可以减轻有毒中间产物或蛋白对宿主的毒性.目前单萜类化合物亚细胞器定位多为线粒体和过氧化物酶体,内质网和脂滴的细胞器工程尚未应用到单萜的合成中,但角鲨烯[75]、原人参二醇[75]、β-胡萝卜素[76]和番茄红素[77]的合成结果表明这种策略对于单萜类化合物的合成也是可行的. ...
Lipid engineering combined with systematic metabolic engineering of Saccharomyces cerevisiae for high-yield production of lycopene
1
2019
... 目前酵母内大量的代谢反应发生在细胞质中,单萜合成的代谢工程主要集中在细胞质代谢途径的重组上,利用线粒体、过氧化物酶体、内质网等亚细胞器优化单萜生产的研究受到越来越多的关注.亚细胞器不仅具有异于胞质的理化环境,还具有独特的代谢产物、酶、辅因子等物质,是构建高效合成途径的潜在场所[73].如过氧化物酶体作为脂肪酸β氧化的场所,可以提供充足的乙酰辅酶A.线粒体中的乙酰辅酶A含量比细胞质中的高近20~30倍[74].故合理的细胞器区室化可以极大地提高乙酰辅酶A的利用率.细胞器的膜结构还可以将酶、底物和辅因子在细胞内局部浓缩,改善底物通道,提高产物的合成效率,并且可以减少竞争途径或代谢串扰对底物的消耗,在一定程度上可以减轻有毒中间产物或蛋白对宿主的毒性.目前单萜类化合物亚细胞器定位多为线粒体和过氧化物酶体,内质网和脂滴的细胞器工程尚未应用到单萜的合成中,但角鲨烯[75]、原人参二醇[75]、β-胡萝卜素[76]和番茄红素[77]的合成结果表明这种策略对于单萜类化合物的合成也是可行的. ...
Transforming yeast peroxisomes into microfactories for the efficient production of high-value isoprenoids
1
2020
... Kong等[41]将MVA途径和柠檬烯合成途径中的酶整合至线粒体中,以调节柠檬烯的细胞质和线粒体的合成途径,柠檬烯滴度由1097.43 mg/L提高到1586 mg/L.Jia等[45]将N末端截短的桧烯合酶(t34SabS1)分别定位到不同组合的双亚细胞器中(CP/CM/PM/CC/MM),发现在细胞质和线粒体中同时表达时,桧烯的产量最高提升了1.53倍,而后在此基础上继续在过氧化物酶体中引入t34SabS1桧烯产量有所下降,因此合适的细胞器定位对单萜合成是重要的.Kampranis团队发现酵母的过氧化物酶体膜对GPP具有一定的阻隔作用,通过在酿酒酵母的过氧化物酶体中引入MVA路径相关酶、ERG20N127W和单萜合酶来构建单萜合成途径,可以避免细胞质内代谢对单萜合成的干扰.对于其测试的所有单萜类化合物,过氧化物酶体定位后的单萜产量比细胞质中的总产量增加了15~125倍,在半连续补料-分批培养条件下,得到5.5 g/L的香叶醇和2.6 g/L的D-柠檬烯[78]. ...
Production of the fragrance geraniol in peroxisomes of a product-tolerant baker’s yeast
2
2020
... 有研究发现基因PEX30-32(编码过氧化物酶体生物发生因子)和基因ATG36(编码过氧化物酶体自噬受体)的单敲除和多敲除可以获得持续高数量的过氧化物酶体用于单萜的生产[79].此外,区室化工程仍面临一些挑战需要克服,如细胞器内代谢通量不平衡造成细胞代谢负担,细胞器定位标签对酶的负面影响以及细胞器中蛋白丰度的积累限制. ...
... 除了引入异源转运蛋白外,部分酵母内源ABC转运蛋白相关基因也会促进产物分泌.Hu等[92]选择了多种酵母内源ABC转运蛋白(Pdr5p、Pdr10p、Pdr15p、Ste6p、Yor1p、Pdr18p、Pdr11p、Aus1p、Pdr3p和Tpo1p)来评估其对酵母细胞内D-柠檬烯转运的影响,发现只有转运体Pdr5p和Pdr15p可以提高细胞对D-柠檬烯的耐受能力.Gerke等[79]发现在酿酒酵母中截短后的Bul1基因(编码α-Arrestin-Like Adaptor蛋白)香叶醇的产量提高了63%.但某些单萜可能通过扩散比与外排的转运蛋白结合更快地穿过细胞膜,因此,过表达某些转运体不仅不能提高菌株性能,甚至会对细胞活性产生副作用. ...
Response of Saccharomyces cerevisiae to a monoterpene: evaluation of antifungal potential by DNA microarray analysis
1
2004
... 大多数单萜对微生物细胞有较强的毒性,有研究表明其产生毒性的机制可能有以下几个方面:①改变细胞膜流动性、结构等,导致细胞死亡.Parveen等[80]用α-蒎烯胁迫酿酒酵母,利用转录组学方法发现酿酒酵母在蒎烯胁迫下磷脂合成相关基因显著上调,因此可以推测细胞膜在酿酒酵母抵御单萜胁迫过程中可能发挥关键作用.②细胞壁结构受到损伤从而影响细胞生长.Brennan等[81]发现在柠檬烯刺激下细胞膜未发生变化,细胞对细胞壁降解相关酶的敏感性增加4倍,说明细胞壁结构受到严重破坏,并通过转录组测序发现与细胞壁完整性相关的基因上调.③单萜会破坏细胞内活性氧ROS产生与清除间的平衡,从而使得ROS不断积累,破坏细胞内生物膜、脂质、蛋白质等.Bakkali等[82]研究发现,不同单萜类化合物处理下的酿酒酵母体内积累了不同类型的ROS.④抑制细胞呼吸而影响能量代谢.Uribe等[83]发现,β-蒎烯的积累会抑制以葡萄糖或乙醇为底物的酵母细胞的正常呼吸,也会抑制细胞中质子泵和钾离子的转运,干扰线粒体膜的完整性进而影响ATP的产生.当单萜达到一定浓度时可能会对细胞产生永久损伤甚至死亡,因此缓解单萜类化合物的细胞毒性是构建单萜高效生产菌株的重要方向. ...
Physiological and transcriptional responses of Saccharomyces cerevisiae to d-limonene show changes to the cell wall but not to the plasma membrane
1
2013
... 大多数单萜对微生物细胞有较强的毒性,有研究表明其产生毒性的机制可能有以下几个方面:①改变细胞膜流动性、结构等,导致细胞死亡.Parveen等[80]用α-蒎烯胁迫酿酒酵母,利用转录组学方法发现酿酒酵母在蒎烯胁迫下磷脂合成相关基因显著上调,因此可以推测细胞膜在酿酒酵母抵御单萜胁迫过程中可能发挥关键作用.②细胞壁结构受到损伤从而影响细胞生长.Brennan等[81]发现在柠檬烯刺激下细胞膜未发生变化,细胞对细胞壁降解相关酶的敏感性增加4倍,说明细胞壁结构受到严重破坏,并通过转录组测序发现与细胞壁完整性相关的基因上调.③单萜会破坏细胞内活性氧ROS产生与清除间的平衡,从而使得ROS不断积累,破坏细胞内生物膜、脂质、蛋白质等.Bakkali等[82]研究发现,不同单萜类化合物处理下的酿酒酵母体内积累了不同类型的ROS.④抑制细胞呼吸而影响能量代谢.Uribe等[83]发现,β-蒎烯的积累会抑制以葡萄糖或乙醇为底物的酵母细胞的正常呼吸,也会抑制细胞中质子泵和钾离子的转运,干扰线粒体膜的完整性进而影响ATP的产生.当单萜达到一定浓度时可能会对细胞产生永久损伤甚至死亡,因此缓解单萜类化合物的细胞毒性是构建单萜高效生产菌株的重要方向. ...
Cytotoxicity and gene induction by some essential oils in the yeast Saccharomyces cerevisiae
1
2005
... 大多数单萜对微生物细胞有较强的毒性,有研究表明其产生毒性的机制可能有以下几个方面:①改变细胞膜流动性、结构等,导致细胞死亡.Parveen等[80]用α-蒎烯胁迫酿酒酵母,利用转录组学方法发现酿酒酵母在蒎烯胁迫下磷脂合成相关基因显著上调,因此可以推测细胞膜在酿酒酵母抵御单萜胁迫过程中可能发挥关键作用.②细胞壁结构受到损伤从而影响细胞生长.Brennan等[81]发现在柠檬烯刺激下细胞膜未发生变化,细胞对细胞壁降解相关酶的敏感性增加4倍,说明细胞壁结构受到严重破坏,并通过转录组测序发现与细胞壁完整性相关的基因上调.③单萜会破坏细胞内活性氧ROS产生与清除间的平衡,从而使得ROS不断积累,破坏细胞内生物膜、脂质、蛋白质等.Bakkali等[82]研究发现,不同单萜类化合物处理下的酿酒酵母体内积累了不同类型的ROS.④抑制细胞呼吸而影响能量代谢.Uribe等[83]发现,β-蒎烯的积累会抑制以葡萄糖或乙醇为底物的酵母细胞的正常呼吸,也会抑制细胞中质子泵和钾离子的转运,干扰线粒体膜的完整性进而影响ATP的产生.当单萜达到一定浓度时可能会对细胞产生永久损伤甚至死亡,因此缓解单萜类化合物的细胞毒性是构建单萜高效生产菌株的重要方向. ...
Effects of beta-pinene on yeast membrane functions
1
1985
... 大多数单萜对微生物细胞有较强的毒性,有研究表明其产生毒性的机制可能有以下几个方面:①改变细胞膜流动性、结构等,导致细胞死亡.Parveen等[80]用α-蒎烯胁迫酿酒酵母,利用转录组学方法发现酿酒酵母在蒎烯胁迫下磷脂合成相关基因显著上调,因此可以推测细胞膜在酿酒酵母抵御单萜胁迫过程中可能发挥关键作用.②细胞壁结构受到损伤从而影响细胞生长.Brennan等[81]发现在柠檬烯刺激下细胞膜未发生变化,细胞对细胞壁降解相关酶的敏感性增加4倍,说明细胞壁结构受到严重破坏,并通过转录组测序发现与细胞壁完整性相关的基因上调.③单萜会破坏细胞内活性氧ROS产生与清除间的平衡,从而使得ROS不断积累,破坏细胞内生物膜、脂质、蛋白质等.Bakkali等[82]研究发现,不同单萜类化合物处理下的酿酒酵母体内积累了不同类型的ROS.④抑制细胞呼吸而影响能量代谢.Uribe等[83]发现,β-蒎烯的积累会抑制以葡萄糖或乙醇为底物的酵母细胞的正常呼吸,也会抑制细胞中质子泵和钾离子的转运,干扰线粒体膜的完整性进而影响ATP的产生.当单萜达到一定浓度时可能会对细胞产生永久损伤甚至死亡,因此缓解单萜类化合物的细胞毒性是构建单萜高效生产菌株的重要方向. ...
产香叶醇重组大肠杆菌发酵培养基的优化
1
2015
... 为缓解单萜化合物对细胞产生的毒性,最常用且简单有效的方法为采用两相发酵体系对产物进行原位抽提,不仅可以降低细胞内单萜含量,减缓细胞代谢压力,也可以有效防止目标产物的挥发,从而提高产量[84].常用有机溶剂有十二烷、十四酸异丙酯、正十烷等.Liu等[85]将十四酸异丙酯添加到培养基中形成两相培养系统,有效防止了香叶醇的挥发.但这种策略的效果十分有限,目前研究者提高细胞单萜耐受性的方法主要有两种:减少单萜与细胞接触的外排工程和提高底盘细胞对单萜的耐受性工程. ...
Optimization of medium for production of geraniol by the recombinant Escherichia coli
1
2015
... 为缓解单萜化合物对细胞产生的毒性,最常用且简单有效的方法为采用两相发酵体系对产物进行原位抽提,不仅可以降低细胞内单萜含量,减缓细胞代谢压力,也可以有效防止目标产物的挥发,从而提高产量[84].常用有机溶剂有十二烷、十四酸异丙酯、正十烷等.Liu等[85]将十四酸异丙酯添加到培养基中形成两相培养系统,有效防止了香叶醇的挥发.但这种策略的效果十分有限,目前研究者提高细胞单萜耐受性的方法主要有两种:减少单萜与细胞接触的外排工程和提高底盘细胞对单萜的耐受性工程. ...
Engineering Escherichia coli for high-yield geraniol production with biotransformation of geranyl acetate to geraniol under fed-batch culture
1
2016
... 为缓解单萜化合物对细胞产生的毒性,最常用且简单有效的方法为采用两相发酵体系对产物进行原位抽提,不仅可以降低细胞内单萜含量,减缓细胞代谢压力,也可以有效防止目标产物的挥发,从而提高产量[84].常用有机溶剂有十二烷、十四酸异丙酯、正十烷等.Liu等[85]将十四酸异丙酯添加到培养基中形成两相培养系统,有效防止了香叶醇的挥发.但这种策略的效果十分有限,目前研究者提高细胞单萜耐受性的方法主要有两种:减少单萜与细胞接触的外排工程和提高底盘细胞对单萜的耐受性工程. ...
Engineering microbial biofuel tolerance and export using efflux pumps
1
2011
... 外排工程是指外排泵(主要是外排蛋白)识别并利用质子动力将有毒物质排出细胞外,减少胞内有毒物质的积累,从而减轻有毒物质积累所造成的毒性.大肠杆菌中含天然的外排系统AcrAB-TolC,该系统主要有三个部分:膜融合蛋白(AcrA)、外排转运蛋白(AcrB)和外膜通道蛋白(TolC),可以将细胞内的溶剂、抗生素和其他药物分子等外排到培养基中[86].在酵母细胞中,还没有发现单萜的天然外排蛋白,因此引入异源转运蛋白来转运单萜是有益的.Wang等[87]在酿酒酵母中异源表达子囊菌(Grosmannia clavigera)来源的多效耐药(PDR)转运蛋白GcABC-G1,其以ATP水解为能量来促进(+)-3-蒈烯、D-柠檬烯和β-蒎烯的外排.Demissie等[88]表达薰衣草来源的多药耐药(MDR)型ABC转运蛋白LaABCB1,增强了酵母对香叶醇的耐受性.Chang等[89]在蝴蝶兰中通过双链RNA干扰和基因沉默来下调ABC亚家族G基因PbABCG1和PbABCG2,发现香叶醇的释放有所减少,由此在酵母细胞中异源表达该两个转运蛋白是促进香叶醇外排的一种有效策略.Rafiei等[90]过表达来自长孢轮枝菌的多效性药物转运蛋白旁系同源基因(VlAbcG1a)增强了酿酒酵母对β-蒎烯的抗性.陈天华 [91]在表达桧烯合酶t34SabS1的基础上异源表达外排蛋白GcABCG1,桧烯产量提高了1.04倍. ...
A specialized ABC efflux transporter GcABC-G1 confers monoterpene resistance to Grosmannia clavigera, a bark beetle-associated fungal pathogen of pine trees
1
2013
... 外排工程是指外排泵(主要是外排蛋白)识别并利用质子动力将有毒物质排出细胞外,减少胞内有毒物质的积累,从而减轻有毒物质积累所造成的毒性.大肠杆菌中含天然的外排系统AcrAB-TolC,该系统主要有三个部分:膜融合蛋白(AcrA)、外排转运蛋白(AcrB)和外膜通道蛋白(TolC),可以将细胞内的溶剂、抗生素和其他药物分子等外排到培养基中[86].在酵母细胞中,还没有发现单萜的天然外排蛋白,因此引入异源转运蛋白来转运单萜是有益的.Wang等[87]在酿酒酵母中异源表达子囊菌(Grosmannia clavigera)来源的多效耐药(PDR)转运蛋白GcABC-G1,其以ATP水解为能量来促进(+)-3-蒈烯、D-柠檬烯和β-蒎烯的外排.Demissie等[88]表达薰衣草来源的多药耐药(MDR)型ABC转运蛋白LaABCB1,增强了酵母对香叶醇的耐受性.Chang等[89]在蝴蝶兰中通过双链RNA干扰和基因沉默来下调ABC亚家族G基因PbABCG1和PbABCG2,发现香叶醇的释放有所减少,由此在酵母细胞中异源表达该两个转运蛋白是促进香叶醇外排的一种有效策略.Rafiei等[90]过表达来自长孢轮枝菌的多效性药物转运蛋白旁系同源基因(VlAbcG1a)增强了酿酒酵母对β-蒎烯的抗性.陈天华 [91]在表达桧烯合酶t34SabS1的基础上异源表达外排蛋白GcABCG1,桧烯产量提高了1.04倍. ...
A lavender ABC transporter confers resistance to monoterpene toxicity in yeast
1
2019
... 外排工程是指外排泵(主要是外排蛋白)识别并利用质子动力将有毒物质排出细胞外,减少胞内有毒物质的积累,从而减轻有毒物质积累所造成的毒性.大肠杆菌中含天然的外排系统AcrAB-TolC,该系统主要有三个部分:膜融合蛋白(AcrA)、外排转运蛋白(AcrB)和外膜通道蛋白(TolC),可以将细胞内的溶剂、抗生素和其他药物分子等外排到培养基中[86].在酵母细胞中,还没有发现单萜的天然外排蛋白,因此引入异源转运蛋白来转运单萜是有益的.Wang等[87]在酿酒酵母中异源表达子囊菌(Grosmannia clavigera)来源的多效耐药(PDR)转运蛋白GcABC-G1,其以ATP水解为能量来促进(+)-3-蒈烯、D-柠檬烯和β-蒎烯的外排.Demissie等[88]表达薰衣草来源的多药耐药(MDR)型ABC转运蛋白LaABCB1,增强了酵母对香叶醇的耐受性.Chang等[89]在蝴蝶兰中通过双链RNA干扰和基因沉默来下调ABC亚家族G基因PbABCG1和PbABCG2,发现香叶醇的释放有所减少,由此在酵母细胞中异源表达该两个转运蛋白是促进香叶醇外排的一种有效策略.Rafiei等[90]过表达来自长孢轮枝菌的多效性药物转运蛋白旁系同源基因(VlAbcG1a)增强了酿酒酵母对β-蒎烯的抗性.陈天华 [91]在表达桧烯合酶t34SabS1的基础上异源表达外排蛋白GcABCG1,桧烯产量提高了1.04倍. ...
PbABCG1 and PbABCG2 transporters are required for the emission of floral monoterpenes in Phalaenopsis bellina
1
2023
... 外排工程是指外排泵(主要是外排蛋白)识别并利用质子动力将有毒物质排出细胞外,减少胞内有毒物质的积累,从而减轻有毒物质积累所造成的毒性.大肠杆菌中含天然的外排系统AcrAB-TolC,该系统主要有三个部分:膜融合蛋白(AcrA)、外排转运蛋白(AcrB)和外膜通道蛋白(TolC),可以将细胞内的溶剂、抗生素和其他药物分子等外排到培养基中[86].在酵母细胞中,还没有发现单萜的天然外排蛋白,因此引入异源转运蛋白来转运单萜是有益的.Wang等[87]在酿酒酵母中异源表达子囊菌(Grosmannia clavigera)来源的多效耐药(PDR)转运蛋白GcABC-G1,其以ATP水解为能量来促进(+)-3-蒈烯、D-柠檬烯和β-蒎烯的外排.Demissie等[88]表达薰衣草来源的多药耐药(MDR)型ABC转运蛋白LaABCB1,增强了酵母对香叶醇的耐受性.Chang等[89]在蝴蝶兰中通过双链RNA干扰和基因沉默来下调ABC亚家族G基因PbABCG1和PbABCG2,发现香叶醇的释放有所减少,由此在酵母细胞中异源表达该两个转运蛋白是促进香叶醇外排的一种有效策略.Rafiei等[90]过表达来自长孢轮枝菌的多效性药物转运蛋白旁系同源基因(VlAbcG1a)增强了酿酒酵母对β-蒎烯的抗性.陈天华 [91]在表达桧烯合酶t34SabS1的基础上异源表达外排蛋白GcABCG1,桧烯产量提高了1.04倍. ...
A Verticillium longisporum pleiotropic drug transporter determines tolerance to the plant host β-pinene monoterpene
1
2022
... 外排工程是指外排泵(主要是外排蛋白)识别并利用质子动力将有毒物质排出细胞外,减少胞内有毒物质的积累,从而减轻有毒物质积累所造成的毒性.大肠杆菌中含天然的外排系统AcrAB-TolC,该系统主要有三个部分:膜融合蛋白(AcrA)、外排转运蛋白(AcrB)和外膜通道蛋白(TolC),可以将细胞内的溶剂、抗生素和其他药物分子等外排到培养基中[86].在酵母细胞中,还没有发现单萜的天然外排蛋白,因此引入异源转运蛋白来转运单萜是有益的.Wang等[87]在酿酒酵母中异源表达子囊菌(Grosmannia clavigera)来源的多效耐药(PDR)转运蛋白GcABC-G1,其以ATP水解为能量来促进(+)-3-蒈烯、D-柠檬烯和β-蒎烯的外排.Demissie等[88]表达薰衣草来源的多药耐药(MDR)型ABC转运蛋白LaABCB1,增强了酵母对香叶醇的耐受性.Chang等[89]在蝴蝶兰中通过双链RNA干扰和基因沉默来下调ABC亚家族G基因PbABCG1和PbABCG2,发现香叶醇的释放有所减少,由此在酵母细胞中异源表达该两个转运蛋白是促进香叶醇外排的一种有效策略.Rafiei等[90]过表达来自长孢轮枝菌的多效性药物转运蛋白旁系同源基因(VlAbcG1a)增强了酿酒酵母对β-蒎烯的抗性.陈天华 [91]在表达桧烯合酶t34SabS1的基础上异源表达外排蛋白GcABCG1,桧烯产量提高了1.04倍. ...
高产桧烯酿酒酵母的构建与优化
1
2019
... 外排工程是指外排泵(主要是外排蛋白)识别并利用质子动力将有毒物质排出细胞外,减少胞内有毒物质的积累,从而减轻有毒物质积累所造成的毒性.大肠杆菌中含天然的外排系统AcrAB-TolC,该系统主要有三个部分:膜融合蛋白(AcrA)、外排转运蛋白(AcrB)和外膜通道蛋白(TolC),可以将细胞内的溶剂、抗生素和其他药物分子等外排到培养基中[86].在酵母细胞中,还没有发现单萜的天然外排蛋白,因此引入异源转运蛋白来转运单萜是有益的.Wang等[87]在酿酒酵母中异源表达子囊菌(Grosmannia clavigera)来源的多效耐药(PDR)转运蛋白GcABC-G1,其以ATP水解为能量来促进(+)-3-蒈烯、D-柠檬烯和β-蒎烯的外排.Demissie等[88]表达薰衣草来源的多药耐药(MDR)型ABC转运蛋白LaABCB1,增强了酵母对香叶醇的耐受性.Chang等[89]在蝴蝶兰中通过双链RNA干扰和基因沉默来下调ABC亚家族G基因PbABCG1和PbABCG2,发现香叶醇的释放有所减少,由此在酵母细胞中异源表达该两个转运蛋白是促进香叶醇外排的一种有效策略.Rafiei等[90]过表达来自长孢轮枝菌的多效性药物转运蛋白旁系同源基因(VlAbcG1a)增强了酿酒酵母对β-蒎烯的抗性.陈天华 [91]在表达桧烯合酶t34SabS1的基础上异源表达外排蛋白GcABCG1,桧烯产量提高了1.04倍. ...
Construction and optimization of Saccharomyces cerevisiae for sabinene overproduction
1
2019
... 外排工程是指外排泵(主要是外排蛋白)识别并利用质子动力将有毒物质排出细胞外,减少胞内有毒物质的积累,从而减轻有毒物质积累所造成的毒性.大肠杆菌中含天然的外排系统AcrAB-TolC,该系统主要有三个部分:膜融合蛋白(AcrA)、外排转运蛋白(AcrB)和外膜通道蛋白(TolC),可以将细胞内的溶剂、抗生素和其他药物分子等外排到培养基中[86].在酵母细胞中,还没有发现单萜的天然外排蛋白,因此引入异源转运蛋白来转运单萜是有益的.Wang等[87]在酿酒酵母中异源表达子囊菌(Grosmannia clavigera)来源的多效耐药(PDR)转运蛋白GcABC-G1,其以ATP水解为能量来促进(+)-3-蒈烯、D-柠檬烯和β-蒎烯的外排.Demissie等[88]表达薰衣草来源的多药耐药(MDR)型ABC转运蛋白LaABCB1,增强了酵母对香叶醇的耐受性.Chang等[89]在蝴蝶兰中通过双链RNA干扰和基因沉默来下调ABC亚家族G基因PbABCG1和PbABCG2,发现香叶醇的释放有所减少,由此在酵母细胞中异源表达该两个转运蛋白是促进香叶醇外排的一种有效策略.Rafiei等[90]过表达来自长孢轮枝菌的多效性药物转运蛋白旁系同源基因(VlAbcG1a)增强了酿酒酵母对β-蒎烯的抗性.陈天华 [91]在表达桧烯合酶t34SabS1的基础上异源表达外排蛋白GcABCG1,桧烯产量提高了1.04倍. ...
Improve the production of D-limonene by regulating the mevalonate pathway of Saccharomyces cerevisiae during alcoholic beverage fermentation
1
2020
... 除了引入异源转运蛋白外,部分酵母内源ABC转运蛋白相关基因也会促进产物分泌.Hu等[92]选择了多种酵母内源ABC转运蛋白(Pdr5p、Pdr10p、Pdr15p、Ste6p、Yor1p、Pdr18p、Pdr11p、Aus1p、Pdr3p和Tpo1p)来评估其对酵母细胞内D-柠檬烯转运的影响,发现只有转运体Pdr5p和Pdr15p可以提高细胞对D-柠檬烯的耐受能力.Gerke等[79]发现在酿酒酵母中截短后的Bul1基因(编码α-Arrestin-Like Adaptor蛋白)香叶醇的产量提高了63%.但某些单萜可能通过扩散比与外排的转运蛋白结合更快地穿过细胞膜,因此,过表达某些转运体不仅不能提高菌株性能,甚至会对细胞活性产生副作用. ...
Evolutionary engineering improves tolerance for replacement jet fuels in Saccharomyces cerevisiae
1
2015
... 与外排工程不同,耐受性工程的最终目标不是将单萜类物质运出细胞,而是直接调节对细胞进行改造,增强菌株自身对有毒产物的耐受性.传统的实验室进化(adaptive laboratory evolution,ALE)能够在一定的胁迫条件(高温、低pH、高盐度或特定化学物质)下筛选出理想的表型,快速进化出细胞对有毒物质的耐受性.Brennan等[93]用不同浓度柠檬烯对酿酒酵母进行驯化,经过200代的进化培养得到了6株柠檬烯耐受性显著提高的菌株,通过基因组全测序发现Tcb3p蛋白发生突变,随后通过过表达tTcb3p1-989蛋白验证其功能,发现菌株对柠檬烯的耐受性提高了9倍,并且也显著提高了细胞对包括β-蒎烯和月桂烯在内的其他单萜的耐受性.Li等[94]通过短期的ALE策略,得到了一株耐受1 g/L柠檬烯的解脂耶氏酵母菌株,其柠檬烯产量提高了52%.同时通过转录组学分析发现了8个候选基因有助于提高解脂耶氏酵母对柠檬烯的耐受性,通过形态学和细胞质膜的完整性分析,阐明了柠檬烯对该酵母细胞毒性的潜在机制.李言等[95]用不同浓度的芳樟醇对酿酒酵母进行适应性驯化,筛选得到两株耐受性提高的突变株.通过全基因重测序分析,发现这两株突变株都含有YBR074WT838N、YBR172CK404Q、YHR007CG466R、YMR275CF3844个基因突变,并进一步确定了其对芳樟醇耐受性的提高有协同作用. ...
Simultaneous improvement of limonene production and tolerance in Yarrowia lipolytica through tolerance engineering and evolutionary engineering
1
2021
... 与外排工程不同,耐受性工程的最终目标不是将单萜类物质运出细胞,而是直接调节对细胞进行改造,增强菌株自身对有毒产物的耐受性.传统的实验室进化(adaptive laboratory evolution,ALE)能够在一定的胁迫条件(高温、低pH、高盐度或特定化学物质)下筛选出理想的表型,快速进化出细胞对有毒物质的耐受性.Brennan等[93]用不同浓度柠檬烯对酿酒酵母进行驯化,经过200代的进化培养得到了6株柠檬烯耐受性显著提高的菌株,通过基因组全测序发现Tcb3p蛋白发生突变,随后通过过表达tTcb3p1-989蛋白验证其功能,发现菌株对柠檬烯的耐受性提高了9倍,并且也显著提高了细胞对包括β-蒎烯和月桂烯在内的其他单萜的耐受性.Li等[94]通过短期的ALE策略,得到了一株耐受1 g/L柠檬烯的解脂耶氏酵母菌株,其柠檬烯产量提高了52%.同时通过转录组学分析发现了8个候选基因有助于提高解脂耶氏酵母对柠檬烯的耐受性,通过形态学和细胞质膜的完整性分析,阐明了柠檬烯对该酵母细胞毒性的潜在机制.李言等[95]用不同浓度的芳樟醇对酿酒酵母进行适应性驯化,筛选得到两株耐受性提高的突变株.通过全基因重测序分析,发现这两株突变株都含有YBR074WT838N、YBR172CK404Q、YHR007CG466R、YMR275CF3844个基因突变,并进一步确定了其对芳樟醇耐受性的提高有协同作用. ...
酿酒酵母芳樟醇耐受性的工程改造
1
2022
... 与外排工程不同,耐受性工程的最终目标不是将单萜类物质运出细胞,而是直接调节对细胞进行改造,增强菌株自身对有毒产物的耐受性.传统的实验室进化(adaptive laboratory evolution,ALE)能够在一定的胁迫条件(高温、低pH、高盐度或特定化学物质)下筛选出理想的表型,快速进化出细胞对有毒物质的耐受性.Brennan等[93]用不同浓度柠檬烯对酿酒酵母进行驯化,经过200代的进化培养得到了6株柠檬烯耐受性显著提高的菌株,通过基因组全测序发现Tcb3p蛋白发生突变,随后通过过表达tTcb3p1-989蛋白验证其功能,发现菌株对柠檬烯的耐受性提高了9倍,并且也显著提高了细胞对包括β-蒎烯和月桂烯在内的其他单萜的耐受性.Li等[94]通过短期的ALE策略,得到了一株耐受1 g/L柠檬烯的解脂耶氏酵母菌株,其柠檬烯产量提高了52%.同时通过转录组学分析发现了8个候选基因有助于提高解脂耶氏酵母对柠檬烯的耐受性,通过形态学和细胞质膜的完整性分析,阐明了柠檬烯对该酵母细胞毒性的潜在机制.李言等[95]用不同浓度的芳樟醇对酿酒酵母进行适应性驯化,筛选得到两株耐受性提高的突变株.通过全基因重测序分析,发现这两株突变株都含有YBR074WT838N、YBR172CK404Q、YHR007CG466R、YMR275CF3844个基因突变,并进一步确定了其对芳樟醇耐受性的提高有协同作用. ...
Engineering of Saccharomyces cerevisiae for improved tolerance to linalool
1
2022
... 与外排工程不同,耐受性工程的最终目标不是将单萜类物质运出细胞,而是直接调节对细胞进行改造,增强菌株自身对有毒产物的耐受性.传统的实验室进化(adaptive laboratory evolution,ALE)能够在一定的胁迫条件(高温、低pH、高盐度或特定化学物质)下筛选出理想的表型,快速进化出细胞对有毒物质的耐受性.Brennan等[93]用不同浓度柠檬烯对酿酒酵母进行驯化,经过200代的进化培养得到了6株柠檬烯耐受性显著提高的菌株,通过基因组全测序发现Tcb3p蛋白发生突变,随后通过过表达tTcb3p1-989蛋白验证其功能,发现菌株对柠檬烯的耐受性提高了9倍,并且也显著提高了细胞对包括β-蒎烯和月桂烯在内的其他单萜的耐受性.Li等[94]通过短期的ALE策略,得到了一株耐受1 g/L柠檬烯的解脂耶氏酵母菌株,其柠檬烯产量提高了52%.同时通过转录组学分析发现了8个候选基因有助于提高解脂耶氏酵母对柠檬烯的耐受性,通过形态学和细胞质膜的完整性分析,阐明了柠檬烯对该酵母细胞毒性的潜在机制.李言等[95]用不同浓度的芳樟醇对酿酒酵母进行适应性驯化,筛选得到两株耐受性提高的突变株.通过全基因重测序分析,发现这两株突变株都含有YBR074WT838N、YBR172CK404Q、YHR007CG466R、YMR275CF3844个基因突变,并进一步确定了其对芳樟醇耐受性的提高有协同作用. ...
Dynamic control of ERG20 expression combined with minimized endogenous downstream metabolism contributes to the improvement of geraniol production in Saccharomyces cerevisiae
1
2017
... 除以上常用策略外,还有很多可以提高单萜产量的方法,如减少单萜内源性转化及弱化单萜的下游途径.Zhao等[96]通过敲除老黄酶OYE2和乙酰转移酶ATF1,减少香叶醇向香茅醇和乙酸香叶酯的转化,香叶醇的产量分别提高了1.7倍和1.6倍.Amiri等[97]用受蛋氨酸抑制的MET3启动子替换鲨烯合成酶ERG9的天然启动子,可有效下调鲨烯合成酶的表达,使酿酒酵母中芳樟醇的积累量达到78 μg/L,是对照菌株的2倍多.酵母细胞的单萜合成途径中涉及到多步氧化还原反应,在提高MVA途径代谢通量后往往会造成胞内辅因子供应不足进而损害细胞内的氧化还原平衡,因此协调细胞内的氧化还原平衡可以在一定程度上增强单萜的合成.目前已利用多种酶促进酵母胞质NADPH的再生,如山梨醇脱氢酶(MnDH1和MnDH2)、葡萄糖-6-磷酸脱氢酶(ZWF)、胞质异柠檬酸脱氢酶(IDP)、琥珀酸半醛脱氢酶(UGA2)和谷氨酸脱氢酶(GDH)等[98].Kong等[41]通过在酿酒酵母中过表达磷酸戊糖途径相关基因ZWF1、GND1、TAL1和TKL1增加NADPH的生成并敲除GDH1和GDH2减少NADPH的消耗,使得柠檬烯产量由889.54 mg/L增加到1097.43 mg/L. ...
Metabolic engineering of Saccharomyces cerevisiae for linalool production
1
2016
... 除以上常用策略外,还有很多可以提高单萜产量的方法,如减少单萜内源性转化及弱化单萜的下游途径.Zhao等[96]通过敲除老黄酶OYE2和乙酰转移酶ATF1,减少香叶醇向香茅醇和乙酸香叶酯的转化,香叶醇的产量分别提高了1.7倍和1.6倍.Amiri等[97]用受蛋氨酸抑制的MET3启动子替换鲨烯合成酶ERG9的天然启动子,可有效下调鲨烯合成酶的表达,使酿酒酵母中芳樟醇的积累量达到78 μg/L,是对照菌株的2倍多.酵母细胞的单萜合成途径中涉及到多步氧化还原反应,在提高MVA途径代谢通量后往往会造成胞内辅因子供应不足进而损害细胞内的氧化还原平衡,因此协调细胞内的氧化还原平衡可以在一定程度上增强单萜的合成.目前已利用多种酶促进酵母胞质NADPH的再生,如山梨醇脱氢酶(MnDH1和MnDH2)、葡萄糖-6-磷酸脱氢酶(ZWF)、胞质异柠檬酸脱氢酶(IDP)、琥珀酸半醛脱氢酶(UGA2)和谷氨酸脱氢酶(GDH)等[98].Kong等[41]通过在酿酒酵母中过表达磷酸戊糖途径相关基因ZWF1、GND1、TAL1和TKL1增加NADPH的生成并敲除GDH1和GDH2减少NADPH的消耗,使得柠檬烯产量由889.54 mg/L增加到1097.43 mg/L. ...
Understanding lipogenesis by dynamically profiling transcriptional activity of lipogenic promoters in Yarrowia lipolytica
1
2019
... 除以上常用策略外,还有很多可以提高单萜产量的方法,如减少单萜内源性转化及弱化单萜的下游途径.Zhao等[96]通过敲除老黄酶OYE2和乙酰转移酶ATF1,减少香叶醇向香茅醇和乙酸香叶酯的转化,香叶醇的产量分别提高了1.7倍和1.6倍.Amiri等[97]用受蛋氨酸抑制的MET3启动子替换鲨烯合成酶ERG9的天然启动子,可有效下调鲨烯合成酶的表达,使酿酒酵母中芳樟醇的积累量达到78 μg/L,是对照菌株的2倍多.酵母细胞的单萜合成途径中涉及到多步氧化还原反应,在提高MVA途径代谢通量后往往会造成胞内辅因子供应不足进而损害细胞内的氧化还原平衡,因此协调细胞内的氧化还原平衡可以在一定程度上增强单萜的合成.目前已利用多种酶促进酵母胞质NADPH的再生,如山梨醇脱氢酶(MnDH1和MnDH2)、葡萄糖-6-磷酸脱氢酶(ZWF)、胞质异柠檬酸脱氢酶(IDP)、琥珀酸半醛脱氢酶(UGA2)和谷氨酸脱氢酶(GDH)等[98].Kong等[41]通过在酿酒酵母中过表达磷酸戊糖途径相关基因ZWF1、GND1、TAL1和TKL1增加NADPH的生成并敲除GDH1和GDH2减少NADPH的消耗,使得柠檬烯产量由889.54 mg/L增加到1097.43 mg/L. ...
Production of plant volatile terpenoids (rose oil) by yeast cell factories
1
2021
... 随着研究者们对启动子核心元件和上游激活序列认识的深入,启动子工程也被应用于代谢流的微调.Li等[99]在酿酒酵母中用启动子ERG7替换ERG20的天然启动子,然后异源表达ObGES与OYE2,使香茅醇的产量提高了4450%.Zhao等[100]基于Upc2介导的麦角固醇反馈机制,在甘油假丝酵母中构建了一个系统来自主调节麦角固醇代谢并激活香叶醇合成,以响应细胞内麦角固醇水平的降低.tCrGES在PERG2调控下,该菌株香叶醇产量提高了39.6%.随后进一步在启动子PERG2的上游融合了不同数量的麦角固醇调节元件(SRE),发现杂合启动子PERG2(SREs*3)的活性最高,是原始启动子PERG2的1.8倍,且优化后的香叶醇产量提高了25.5%,达到667.2 mg/L. ...
Metabolic engineering of Candida glycerinogenes for sustainable production of geraniol
1
2023
... 随着研究者们对启动子核心元件和上游激活序列认识的深入,启动子工程也被应用于代谢流的微调.Li等[99]在酿酒酵母中用启动子ERG7替换ERG20的天然启动子,然后异源表达ObGES与OYE2,使香茅醇的产量提高了4450%.Zhao等[100]基于Upc2介导的麦角固醇反馈机制,在甘油假丝酵母中构建了一个系统来自主调节麦角固醇代谢并激活香叶醇合成,以响应细胞内麦角固醇水平的降低.tCrGES在PERG2调控下,该菌株香叶醇产量提高了39.6%.随后进一步在启动子PERG2的上游融合了不同数量的麦角固醇调节元件(SRE),发现杂合启动子PERG2(SREs*3)的活性最高,是原始启动子PERG2的1.8倍,且优化后的香叶醇产量提高了25.5%,达到667.2 mg/L. ...
Enhanced triacylglycerol production with genetically modified Trichosporon oleaginosus
1
2018
... 优化培养基对促进菌株生长和发酵过程中产物生成具有基础性作用.培养基中不同种类和比例的碳氮源对菌株有不同的影响,当初始葡萄糖浓度改变时,细胞的生长状况也会受到影响,适当的碳氮比可以显著提高细胞的活性[101].Wei等[27]利用厨房废油(WCO)作为碳源在解脂耶氏酵母中成功地实现了合成33.8 mg/L滴度的α-蒎烯,为微生物利用廉价碳源生产单萜类化合物奠定了基础.添加辅助碳源在一定程度上可以促进单萜合成,Cheng等[42]发现当解脂耶氏酵母以甘油为初级碳源、柠檬酸为辅助碳源时,柠檬烯的产量高于以葡萄糖为初级碳源时的产量,柠檬烯产量达到最大值165.3 mg/L.适当的金属离子浓度能够提高酶活,Zhang等[102]研究了在工程菌中添加不同浓度的Mg2+对芳樟醇产量的影响,当在培养基中添加10 mmol/L Mg2+时,芳樟醇产量提高了27%. ...
Enhancement of linalool production in Saccharomyces cerevisiae by utilizing isopentenol utilization pathway
1
2022
... 优化培养基对促进菌株生长和发酵过程中产物生成具有基础性作用.培养基中不同种类和比例的碳氮源对菌株有不同的影响,当初始葡萄糖浓度改变时,细胞的生长状况也会受到影响,适当的碳氮比可以显著提高细胞的活性[101].Wei等[27]利用厨房废油(WCO)作为碳源在解脂耶氏酵母中成功地实现了合成33.8 mg/L滴度的α-蒎烯,为微生物利用廉价碳源生产单萜类化合物奠定了基础.添加辅助碳源在一定程度上可以促进单萜合成,Cheng等[42]发现当解脂耶氏酵母以甘油为初级碳源、柠檬酸为辅助碳源时,柠檬烯的产量高于以葡萄糖为初级碳源时的产量,柠檬烯产量达到最大值165.3 mg/L.适当的金属离子浓度能够提高酶活,Zhang等[102]研究了在工程菌中添加不同浓度的Mg2+对芳樟醇产量的影响,当在培养基中添加10 mmol/L Mg2+时,芳樟醇产量提高了27%. ...
Design of four small-molecule-inducible systems in the yeast chromosome, applied to optimize terpene biosynthesis
1
2023
... ③采用动态调控的策略,使代谢途径根据发酵等环境条件的变化自动调节代谢通量,达到目标产物的高效生产.如Voigt课题组[103]通过在酿酒酵母中构建了一个正交的四小分子诱导传感器阵列,测试了四种关键酶的表达强度及表达时机对于芳樟醇合成的影响,以此来实现生物合成的多重调节和控制,从而实现合成芳樟醇的最优化. ...