|
||
|
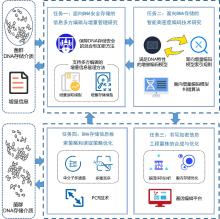
Multi-party collaborative secured DNA data storage and access: toward a hybrid dna-silicon storage facility
Synthetic Biology Journal
DOI: 10.12211/2096-8280.2025-067
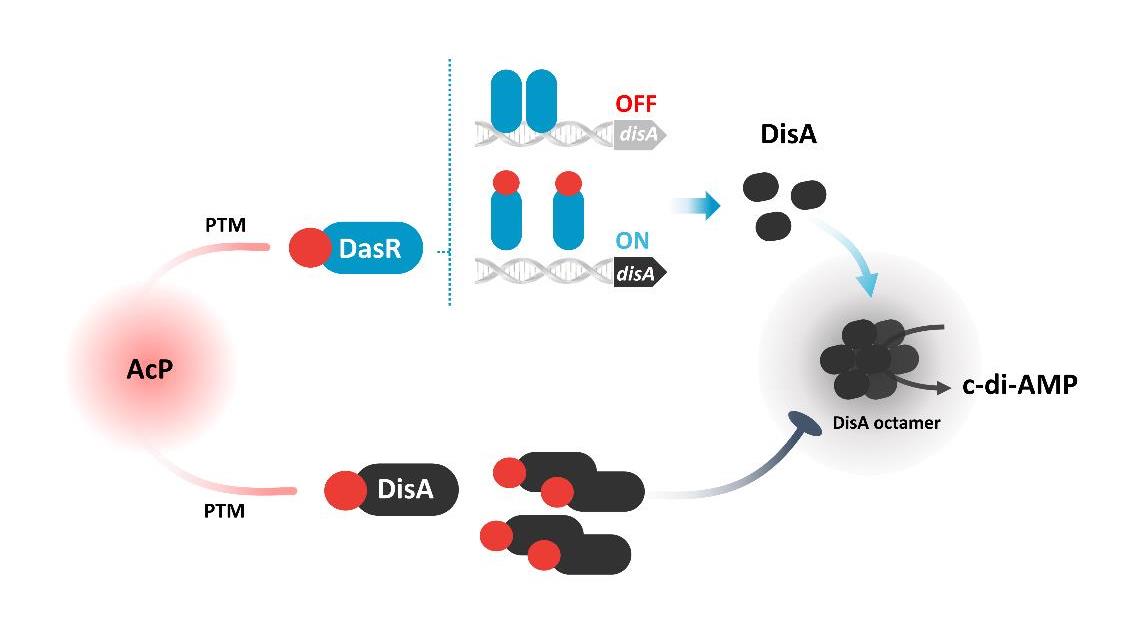
Fig. 5
Molecular mechanism of AcP-dependent acetylation regulating the homeostasis of c-di-AMP in actinomycetes[
Extracts from the Article
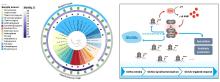
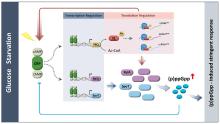
进一步研究发现,乙酰磷酸(AcP)是调控c-di-AMP水平的重要信号分子,通过催化两种不同的底物(DasR和DisA)的乙酰化修饰,调节细胞内c-di-AMP稳态。其中,AcP诱导的乙酰化主要通过干扰蛋白质的多聚体功能结构发挥调节作用:DisA的乙酰化抑制了催化c-di-AMP合成的活性,并且K66是影响其八聚体形成和酶活性的关键乙酰化位点;而DasR的乙酰化能够促进胞内c-di-AMP的合成,其主要原理是通过乙酰化修饰破坏了DasR的转录调控功能,解除了DasR对disA的转录抑制,其中K78是行使该调控功能的关键乙酰化位点。由此表明,AcP可通过对DasR和DisA的乙酰化水平调控,直接/间接调节c-di-AMP的内稳态。进一步的研究还发现,乙酰化的DisA和DasR发生构象变化,在放线菌的形态分化中起着至关重要的作用,利用点突变模拟乙酰化/未乙酰化的底物蛋白,构建相应的过表达菌株,结果表明,屏蔽乙酰化调控信号,有利于放线菌的孢子发育(图5)。以上研究均显示,基于酰基化修饰调控的原理和分子机制对于底盘微生物工程化设计方面的应用潜能。该部分成果受到《科学网》、《上海科技报》等关注和重点宣传报导。
进一步研究发现,乙酰磷酸(AcP)是调控c-di-AMP水平的重要信号分子,通过催化两种不同的底物(DasR和DisA)的乙酰化修饰,调节细胞内c-di-AMP稳态.其中,AcP诱导的乙酰化主要通过干扰蛋白质的多聚体功能结构发挥调节作用:DisA的乙酰化抑制了催化c-di-AMP合成的活性,并且K66是影响其八聚体形成和酶活性的关键乙酰化位点;而DasR的乙酰化能够促进胞内c-di-AMP的合成,其主要原理是通过乙酰化修饰破坏了DasR的转录调控功能,解除了DasR对disA的转录抑制,其中K78是行使该调控功能的关键乙酰化位点.由此表明,AcP可通过对DasR和DisA的乙酰化水平调控,直接/间接调节c-di-AMP的内稳态.进一步的研究还发现,乙酰化的DisA和DasR发生构象变化,在放线菌的形态分化中起着至关重要的作用,利用点突变模拟乙酰化/未乙酰化的底物蛋白,构建相应的过表达菌株,结果表明,屏蔽乙酰化调控信号,有利于放线菌的孢子发育(
进一步研究发现,乙酰磷酸(AcP)是调控c-di-AMP水平的重要信号分子,通过催化两种不同的底物(DasR和DisA)的乙酰化修饰,调节细胞内c-di-AMP稳态.其中,AcP诱导的乙酰化主要通过干扰蛋白质的多聚体功能结构发挥调节作用:DisA的乙酰化抑制了催化c-di-AMP合成的活性,并且K66是影响其八聚体形成和酶活性的关键乙酰化位点;而DasR的乙酰化能够促进胞内c-di-AMP的合成,其主要原理是通过乙酰化修饰破坏了DasR的转录调控功能,解除了DasR对disA的转录抑制,其中K78是行使该调控功能的关键乙酰化位点.由此表明,AcP可通过对DasR和DisA的乙酰化水平调控,直接/间接调节c-di-AMP的内稳态.进一步的研究还发现,乙酰化的DisA和DasR发生构象变化,在放线菌的形态分化中起着至关重要的作用,利用点突变模拟乙酰化/未乙酰化的底物蛋白,构建相应的过表达菌株,结果表明,屏蔽乙酰化调控信号,有利于放线菌的孢子发育(
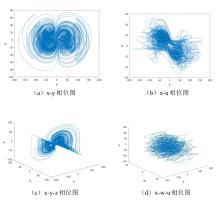
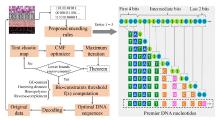
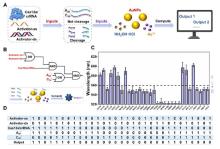
在读取技术革新方面,鲜于运雷教授团队利用DNA的多维度信息(DNA序列种类、长度和浓度)编码,调控纳米金的再生长过程,产生丰富的形态和光学性质变化,从而实现DNA信息编码的可视化读出.通过耦合不同的DNA输入,包括碱基组成、长度和浓度,DNA输入和计算元件介导的金纳米材料生长,项目组构建了多种智能DNA逻辑门,包括YES/NOT、AND/NAND、OR/NOR、XOR和INHIBIT操作.利用这些基本逻辑运算,项目组进一步构造了OR-2到1编码器、奇偶校验器和G码编码器( Allosteric regulation by c-di-AMP modulates a complete N-acetylglucosamine signaling cascade in Saccharopolyspora erythraea 2 2024 ... 进一步研究发现,乙酰磷酸(AcP)是调控c-di-AMP水平的重要信号分子,通过催化两种不同的底物(DasR和DisA)的乙酰化修饰,调节细胞内c-di-AMP稳态.其中,AcP诱导的乙酰化主要通过干扰蛋白质的多聚体功能结构发挥调节作用:DisA的乙酰化抑制了催化c-di-AMP合成的活性,并且K66是影响其八聚体形成和酶活性的关键乙酰化位点;而DasR的乙酰化能够促进胞内c-di-AMP的合成,其主要原理是通过乙酰化修饰破坏了DasR的转录调控功能,解除了DasR对disA的转录抑制,其中K78是行使该调控功能的关键乙酰化位点.由此表明,AcP可通过对DasR和DisA的乙酰化水平调控,直接/间接调节c-di-AMP的内稳态.进一步的研究还发现,乙酰化的DisA和DasR发生构象变化,在放线菌的形态分化中起着至关重要的作用,利用点突变模拟乙酰化/未乙酰化的底物蛋白,构建相应的过表达菌株,结果表明,屏蔽乙酰化调控信号,有利于放线菌的孢子发育(
Other Images/Table from this Article
|