Plant antitumor agents. Ⅵ. The isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia
1
1971
... 紫杉醇(paclitaxel,商品名taxol)是从珍稀植物红豆杉中提取的一种四环二萜类化合物[1].作为目前已发现的最优秀的天然广谱抗癌药物,紫杉醇通过阻止微管蛋白解聚、阻断有丝分裂,从而有效抑制癌细胞再生,在临床上已经广泛用于乳腺癌、卵巢癌、肺癌和其他恶性肿瘤的治疗[2].紫杉醇主要是从红豆杉植物中分离提取或者半合成获得,其含量不足整棵植物的万分之一,并且红豆杉属植物生长缓慢,再生能力差,从植物组织中提取紫杉醇受到极大限制[3].紫杉醇化学结构十分复杂,中心母核和侧链共有11个手性中心,理论上有2048个非对映异构体,这使得化学合成反应条件严苛、产量较低[4].虽然化学家已经通过多种方法对其进行了化学全合成的研究,但合成路线复杂,而且反应条件难以控制,合成得率极低.目前,临床和科研所需的商业化紫杉醇生产多集中于化学半合成法,即首先从红豆杉枝叶里提取出紫杉烷类中间产物,如10-去乙酰巴卡亭Ⅲ(10-deacetylbaccatin Ⅲ,10-DAB)和巴卡亭Ⅲ(baccatin Ⅲ),然后再经过化学合成得到紫杉醇[5-6],然而半合成方法仍然依赖于珍稀的红豆杉植物资源. ...
Molecular mechanism of action of microtubule-stabilizing anticancer agents
1
2013
... 紫杉醇(paclitaxel,商品名taxol)是从珍稀植物红豆杉中提取的一种四环二萜类化合物[1].作为目前已发现的最优秀的天然广谱抗癌药物,紫杉醇通过阻止微管蛋白解聚、阻断有丝分裂,从而有效抑制癌细胞再生,在临床上已经广泛用于乳腺癌、卵巢癌、肺癌和其他恶性肿瘤的治疗[2].紫杉醇主要是从红豆杉植物中分离提取或者半合成获得,其含量不足整棵植物的万分之一,并且红豆杉属植物生长缓慢,再生能力差,从植物组织中提取紫杉醇受到极大限制[3].紫杉醇化学结构十分复杂,中心母核和侧链共有11个手性中心,理论上有2048个非对映异构体,这使得化学合成反应条件严苛、产量较低[4].虽然化学家已经通过多种方法对其进行了化学全合成的研究,但合成路线复杂,而且反应条件难以控制,合成得率极低.目前,临床和科研所需的商业化紫杉醇生产多集中于化学半合成法,即首先从红豆杉枝叶里提取出紫杉烷类中间产物,如10-去乙酰巴卡亭Ⅲ(10-deacetylbaccatin Ⅲ,10-DAB)和巴卡亭Ⅲ(baccatin Ⅲ),然后再经过化学合成得到紫杉醇[5-6],然而半合成方法仍然依赖于珍稀的红豆杉植物资源. ...
Taxol biosynthesis and molecular genetics
1
2006
... 紫杉醇(paclitaxel,商品名taxol)是从珍稀植物红豆杉中提取的一种四环二萜类化合物[1].作为目前已发现的最优秀的天然广谱抗癌药物,紫杉醇通过阻止微管蛋白解聚、阻断有丝分裂,从而有效抑制癌细胞再生,在临床上已经广泛用于乳腺癌、卵巢癌、肺癌和其他恶性肿瘤的治疗[2].紫杉醇主要是从红豆杉植物中分离提取或者半合成获得,其含量不足整棵植物的万分之一,并且红豆杉属植物生长缓慢,再生能力差,从植物组织中提取紫杉醇受到极大限制[3].紫杉醇化学结构十分复杂,中心母核和侧链共有11个手性中心,理论上有2048个非对映异构体,这使得化学合成反应条件严苛、产量较低[4].虽然化学家已经通过多种方法对其进行了化学全合成的研究,但合成路线复杂,而且反应条件难以控制,合成得率极低.目前,临床和科研所需的商业化紫杉醇生产多集中于化学半合成法,即首先从红豆杉枝叶里提取出紫杉烷类中间产物,如10-去乙酰巴卡亭Ⅲ(10-deacetylbaccatin Ⅲ,10-DAB)和巴卡亭Ⅲ(baccatin Ⅲ),然后再经过化学合成得到紫杉醇[5-6],然而半合成方法仍然依赖于珍稀的红豆杉植物资源. ...
Strategies and lessons learned from total synthesis of taxol
1
2023
... 紫杉醇(paclitaxel,商品名taxol)是从珍稀植物红豆杉中提取的一种四环二萜类化合物[1].作为目前已发现的最优秀的天然广谱抗癌药物,紫杉醇通过阻止微管蛋白解聚、阻断有丝分裂,从而有效抑制癌细胞再生,在临床上已经广泛用于乳腺癌、卵巢癌、肺癌和其他恶性肿瘤的治疗[2].紫杉醇主要是从红豆杉植物中分离提取或者半合成获得,其含量不足整棵植物的万分之一,并且红豆杉属植物生长缓慢,再生能力差,从植物组织中提取紫杉醇受到极大限制[3].紫杉醇化学结构十分复杂,中心母核和侧链共有11个手性中心,理论上有2048个非对映异构体,这使得化学合成反应条件严苛、产量较低[4].虽然化学家已经通过多种方法对其进行了化学全合成的研究,但合成路线复杂,而且反应条件难以控制,合成得率极低.目前,临床和科研所需的商业化紫杉醇生产多集中于化学半合成法,即首先从红豆杉枝叶里提取出紫杉烷类中间产物,如10-去乙酰巴卡亭Ⅲ(10-deacetylbaccatin Ⅲ,10-DAB)和巴卡亭Ⅲ(baccatin Ⅲ),然后再经过化学合成得到紫杉醇[5-6],然而半合成方法仍然依赖于珍稀的红豆杉植物资源. ...
紫杉醇及其衍生物的半合成概述
1
2018
... 紫杉醇(paclitaxel,商品名taxol)是从珍稀植物红豆杉中提取的一种四环二萜类化合物[1].作为目前已发现的最优秀的天然广谱抗癌药物,紫杉醇通过阻止微管蛋白解聚、阻断有丝分裂,从而有效抑制癌细胞再生,在临床上已经广泛用于乳腺癌、卵巢癌、肺癌和其他恶性肿瘤的治疗[2].紫杉醇主要是从红豆杉植物中分离提取或者半合成获得,其含量不足整棵植物的万分之一,并且红豆杉属植物生长缓慢,再生能力差,从植物组织中提取紫杉醇受到极大限制[3].紫杉醇化学结构十分复杂,中心母核和侧链共有11个手性中心,理论上有2048个非对映异构体,这使得化学合成反应条件严苛、产量较低[4].虽然化学家已经通过多种方法对其进行了化学全合成的研究,但合成路线复杂,而且反应条件难以控制,合成得率极低.目前,临床和科研所需的商业化紫杉醇生产多集中于化学半合成法,即首先从红豆杉枝叶里提取出紫杉烷类中间产物,如10-去乙酰巴卡亭Ⅲ(10-deacetylbaccatin Ⅲ,10-DAB)和巴卡亭Ⅲ(baccatin Ⅲ),然后再经过化学合成得到紫杉醇[5-6],然而半合成方法仍然依赖于珍稀的红豆杉植物资源. ...
Semi-synthetic overview of taxol and its derivatives
1
2018
... 紫杉醇(paclitaxel,商品名taxol)是从珍稀植物红豆杉中提取的一种四环二萜类化合物[1].作为目前已发现的最优秀的天然广谱抗癌药物,紫杉醇通过阻止微管蛋白解聚、阻断有丝分裂,从而有效抑制癌细胞再生,在临床上已经广泛用于乳腺癌、卵巢癌、肺癌和其他恶性肿瘤的治疗[2].紫杉醇主要是从红豆杉植物中分离提取或者半合成获得,其含量不足整棵植物的万分之一,并且红豆杉属植物生长缓慢,再生能力差,从植物组织中提取紫杉醇受到极大限制[3].紫杉醇化学结构十分复杂,中心母核和侧链共有11个手性中心,理论上有2048个非对映异构体,这使得化学合成反应条件严苛、产量较低[4].虽然化学家已经通过多种方法对其进行了化学全合成的研究,但合成路线复杂,而且反应条件难以控制,合成得率极低.目前,临床和科研所需的商业化紫杉醇生产多集中于化学半合成法,即首先从红豆杉枝叶里提取出紫杉烷类中间产物,如10-去乙酰巴卡亭Ⅲ(10-deacetylbaccatin Ⅲ,10-DAB)和巴卡亭Ⅲ(baccatin Ⅲ),然后再经过化学合成得到紫杉醇[5-6],然而半合成方法仍然依赖于珍稀的红豆杉植物资源. ...
Two-phase total synthesis of taxanes: tactics and strategies
2
2020
... 紫杉醇(paclitaxel,商品名taxol)是从珍稀植物红豆杉中提取的一种四环二萜类化合物[1].作为目前已发现的最优秀的天然广谱抗癌药物,紫杉醇通过阻止微管蛋白解聚、阻断有丝分裂,从而有效抑制癌细胞再生,在临床上已经广泛用于乳腺癌、卵巢癌、肺癌和其他恶性肿瘤的治疗[2].紫杉醇主要是从红豆杉植物中分离提取或者半合成获得,其含量不足整棵植物的万分之一,并且红豆杉属植物生长缓慢,再生能力差,从植物组织中提取紫杉醇受到极大限制[3].紫杉醇化学结构十分复杂,中心母核和侧链共有11个手性中心,理论上有2048个非对映异构体,这使得化学合成反应条件严苛、产量较低[4].虽然化学家已经通过多种方法对其进行了化学全合成的研究,但合成路线复杂,而且反应条件难以控制,合成得率极低.目前,临床和科研所需的商业化紫杉醇生产多集中于化学半合成法,即首先从红豆杉枝叶里提取出紫杉烷类中间产物,如10-去乙酰巴卡亭Ⅲ(10-deacetylbaccatin Ⅲ,10-DAB)和巴卡亭Ⅲ(baccatin Ⅲ),然后再经过化学合成得到紫杉醇[5-6],然而半合成方法仍然依赖于珍稀的红豆杉植物资源. ...
... 紫杉醇作为目前已发现的最优秀的天然抗癌药物,其合成经历了多元化发展的阶段.目前应用最多的依然是半合成法[6],来自Bristol Meyers Squibb(美国百时美施贵宝公司)的市售紫杉醇是通过使用Holton-Ojima方法,以10-去乙酰巴卡亭Ⅲ为前体,紫杉醇的产率可达到90%.但半合成前体的来源(10-去乙酰巴卡亭Ⅲ或者巴卡亭Ⅲ)仍然是通过珍稀植物红豆杉植物提取的方法获得,10-去乙酰巴卡亭Ⅲ或者巴卡亭Ⅲ的生产受到严重的限制,需要通过异源合成来进行大量生产优化.内生真菌培养方法得到了一定的研究,但其产量低、不稳定,没有进一步工业化的相关报道[36,95].植物细胞培养技术提供了另一种在工业水平可持续生产紫杉醇的方法[96],Phyton使用专有的植物细胞发酵(PCF®)技术生产紫杉醇,直接从悬浮细胞生产天然药物成分[97].近年来,不同品种的红豆杉植物资源大规模基因组测序与解析工作相继完成,合成生物学的迅速发展为紫杉醇的异源合成创造了良好的条件. ...
The genomes of Taxus species unveil novel candidates in the biosynthesis of taxoids
1
2021
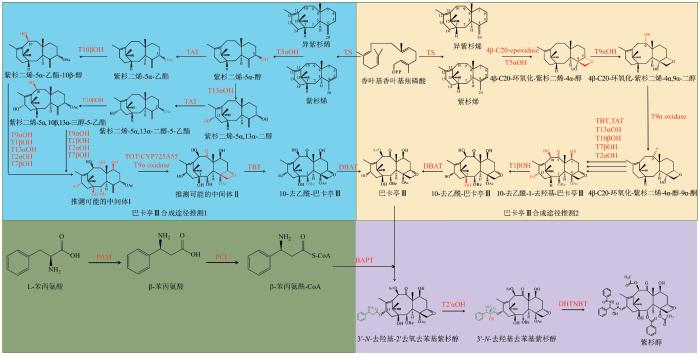
... 近年来,随着红豆杉基因组的完全解析与合成生物学的迅速发展[7],利用合成生物技术,通过重组工程细胞来合成紫杉醇是目前极具应用前景的一种方法,有望解决市场上紫杉醇价格昂贵、供不应求的现状,并且对于濒危药用植物的保护具有十分重要的意义.然而,紫杉醇生物合成过程涉及20多步复杂的酶催化反应,其中大约一半为P450酶介导的羟化反应,其生物合成机制至今尚未被完全解析;与此同时,利用生物转化生产紫杉醇仍然处于起始阶段,虽然利用微生物细胞可以生产高达克级的紫杉二烯,但是紫杉醇合成过程关键氧化酶催化效率低下,且副产物众多、产量极低,其后续的氧化反应面临巨大挑战.因此,本文对紫杉醇生物合成途径解析、红豆杉组学分析、底盘细胞构建、关键前体合成、紫杉醇合成途径关键酶的改造及催化机理解析等相关研究现状进行了系统性的综述,尤其对近期发表的关于C4、C5、C20位之间形成的氧杂环丁烷环相关的突破性进展进行了详细介绍,并基于相关研究进展探讨当前紫杉醇合成生物学研究面临的技术挑战及未来前景(图1和图2).为进一步加强对紫杉醇合成通路和催化机制的理解,需要更加系统深入阐明紫杉醇生物合成机制奠定基础,进而建立高效、绿色生物合成方式,实现紫杉醇合成的可持续发展. ...
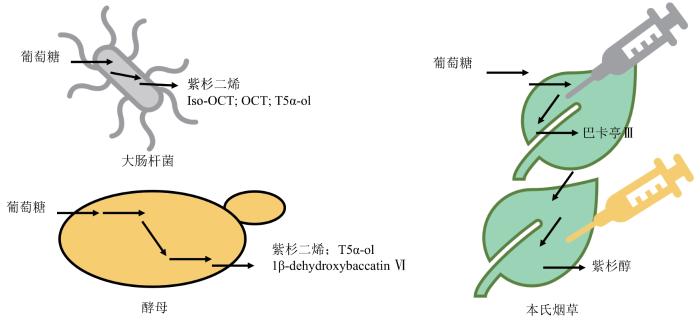
Production of taxadiene by engineering of mevalonate pathway in Escherichia coli and endophytic fungus Alternaria alternata TPF6
5
2017
... 巴卡亭Ⅲ母核的合成:香叶基香叶基焦磷酸(GGPP)是二萜类化合物的共同前体,由香叶基香叶基焦磷酸合酶(geranylgeranyl diphosphate synthase, GGPPS)催化1分子的二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate, DMAPP)和3分子的异戊烯基焦磷酸(isopentenyl diphosphate, IPP)缩合生成.IPP和DMAPP主要来源于位于质体的2-C-甲基-D-赤藻糖醇-4-磷酸(2-C-methyl-D-erythritol-4-phosphate, MEP)途径和位于细胞质的甲羟戊酸(mevalonate, MVA)途径[8].在异戊烯基焦磷酸异构酶(isopentenyl diphosphate isomerase,IDI)的作用下,DMAPP与IPP之间也可进行异构反应.接下来,紫杉二烯合成酶(taxadiene synthase,TS)催化GGPP环化生成紫杉醇二萜骨架结构[8-9],包括约95%的紫杉二烯[Taxa-4(5),11(12)-diene],约5%的异紫杉二烯[Taxa-4(20),11(12)-diene]和其他少量的二萜母核[10].在植物细胞中,虽然位于细胞质的MVA途径同样可以产生异戊烯基焦磷酸前体,但是GGPPS和TS都具有天然质体靶向肽,因此,更偏向于来自质体中的IPP,也就是通过MEP途径产生的IPP[11].紫杉二烯环骨架形成后,发生一系列的后修饰,最终形成紫杉醇的关键前体巴卡亭Ⅲ.这些后修饰包括羟基化、羟基上的酰基化、酮基化和氧杂环丁烷环的形成等. ...
... [8-9],包括约95%的紫杉二烯[Taxa-4(5),11(12)-diene],约5%的异紫杉二烯[Taxa-4(20),11(12)-diene]和其他少量的二萜母核[10].在植物细胞中,虽然位于细胞质的MVA途径同样可以产生异戊烯基焦磷酸前体,但是GGPPS和TS都具有天然质体靶向肽,因此,更偏向于来自质体中的IPP,也就是通过MEP途径产生的IPP[11].紫杉二烯环骨架形成后,发生一系列的后修饰,最终形成紫杉醇的关键前体巴卡亭Ⅲ.这些后修饰包括羟基化、羟基上的酰基化、酮基化和氧杂环丁烷环的形成等. ...
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... [8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
Taxadiene synthase structure and evolution of modular architecture in terpene biosynthesis
4
2011
... 巴卡亭Ⅲ母核的合成:香叶基香叶基焦磷酸(GGPP)是二萜类化合物的共同前体,由香叶基香叶基焦磷酸合酶(geranylgeranyl diphosphate synthase, GGPPS)催化1分子的二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate, DMAPP)和3分子的异戊烯基焦磷酸(isopentenyl diphosphate, IPP)缩合生成.IPP和DMAPP主要来源于位于质体的2-C-甲基-D-赤藻糖醇-4-磷酸(2-C-methyl-D-erythritol-4-phosphate, MEP)途径和位于细胞质的甲羟戊酸(mevalonate, MVA)途径[8].在异戊烯基焦磷酸异构酶(isopentenyl diphosphate isomerase,IDI)的作用下,DMAPP与IPP之间也可进行异构反应.接下来,紫杉二烯合成酶(taxadiene synthase,TS)催化GGPP环化生成紫杉醇二萜骨架结构[8-9],包括约95%的紫杉二烯[Taxa-4(5),11(12)-diene],约5%的异紫杉二烯[Taxa-4(20),11(12)-diene]和其他少量的二萜母核[10].在植物细胞中,虽然位于细胞质的MVA途径同样可以产生异戊烯基焦磷酸前体,但是GGPPS和TS都具有天然质体靶向肽,因此,更偏向于来自质体中的IPP,也就是通过MEP途径产生的IPP[11].紫杉二烯环骨架形成后,发生一系列的后修饰,最终形成紫杉醇的关键前体巴卡亭Ⅲ.这些后修饰包括羟基化、羟基上的酰基化、酮基化和氧杂环丁烷环的形成等. ...
... TS由862个氨基酸残基组成,包括N端一个由80个氨基酸残基组成的质体定位信号和由三个螺旋区域组合而成的催化活性部位[9].其中,C端功能域(S553-V862)由Ⅰ型萜类环化酶组成,N端结构域(M107-I135)和一个“插入”结构域(S349-Q552)是由一个退化的Ⅱ型萜类环化酶组成[87].Ⅰ型萜类环化酶利用三联金属簇连接保守基序DDXXD和(N,D)DXX(S,T)XXXE,激发异戊二烯基底物焦磷酸基团的电离,生成碳正离子,启动催化反应;Ⅱ型萜类环化酶利用DXDD基序中的天冬氨酸形成一般的酸催化作用,来质子化异戊二烯双键或氧环烷基,从而引发碳正离子的形成.尽管这两类萜类环化酶在蛋白折叠和底物激活机制上存在差异,TS的结构表明它们在萜烯生物合成的进化中显著相关[9].TS通过C端功能域行使催化功能.首先,三个Mg2+金属簇结合GGPP并触发焦磷酸的电离;随后,焦磷酸基团的水解过程导致碳正离子中间体的形成;与此同时,酶活性口袋发生了从开放到闭合状态的结构转变;之后,活泼的碳正离子经过多步重排和环化反应生成各种紫杉二烯异构体[84]. ...
... [9].TS通过C端功能域行使催化功能.首先,三个Mg2+金属簇结合GGPP并触发焦磷酸的电离;随后,焦磷酸基团的水解过程导致碳正离子中间体的形成;与此同时,酶活性口袋发生了从开放到闭合状态的结构转变;之后,活泼的碳正离子经过多步重排和环化反应生成各种紫杉二烯异构体[84]. ...
... TS是紫杉醇的生物合成中的关键酶之一,通过TS的环化作用将代谢流引入紫杉醇合成途径.在发酵过程中,GGPP首先在紫杉二烯合酶(TS)的催化下环化生成93.2%的紫杉-4(5),11(12)-二烯,同时还会生成4.7%的紫杉-4(20),11(12)-二烯以及其他少量的二萜母核.随后,仅有10%的紫杉-4(5),11(12)-二烯被紫杉二烯-5α-羟化酶(T5αOH)转化成为目的产物紫杉-4(20),11(12)-二烯-5α-醇[32].但有证据表明对于其底物紫杉二烯而言,T5αOH对底物异紫杉二烯具有更高的亲和力[16].Stephanopoulos和翁经科研究组[32]通过对TS活性区域附近多处氨基酸进行突变研究,发现当第688位的酪氨酸突变为亮氨酸时紫杉-4(20),11(12)-二烯生产比例明显提高,随后将TSY688L突变体转化到T5αOH表达菌株后,使得紫杉二烯- 5α-醇产量提高了2.4倍.该研究表明,通过改造TS提高异紫杉二烯的产量,可以经过T5αOH催化直接进行P450加羟反应,避免经过环氧化物断裂过程,可以明显提高目标产物合成比例.随着TS的晶体结构被解析[9],对关键氨基酸位点进行突变研究也随之进行.Schrepfer等[88]根据其构建的模型,设计出突变体S713T、W753H、W753H/C830A、V584K/L/M、S587A、V714A/I、S713T、C803A/S和Y841F,研究发现这些突变体均未丧失催化活性,其中S713T还具有97.4%的酶活性. ...
The early stages of taxol biosynthesis: an interim report on the synthesis and identification of early pathway metabolites
1
2012
... 巴卡亭Ⅲ母核的合成:香叶基香叶基焦磷酸(GGPP)是二萜类化合物的共同前体,由香叶基香叶基焦磷酸合酶(geranylgeranyl diphosphate synthase, GGPPS)催化1分子的二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate, DMAPP)和3分子的异戊烯基焦磷酸(isopentenyl diphosphate, IPP)缩合生成.IPP和DMAPP主要来源于位于质体的2-C-甲基-D-赤藻糖醇-4-磷酸(2-C-methyl-D-erythritol-4-phosphate, MEP)途径和位于细胞质的甲羟戊酸(mevalonate, MVA)途径[8].在异戊烯基焦磷酸异构酶(isopentenyl diphosphate isomerase,IDI)的作用下,DMAPP与IPP之间也可进行异构反应.接下来,紫杉二烯合成酶(taxadiene synthase,TS)催化GGPP环化生成紫杉醇二萜骨架结构[8-9],包括约95%的紫杉二烯[Taxa-4(5),11(12)-diene],约5%的异紫杉二烯[Taxa-4(20),11(12)-diene]和其他少量的二萜母核[10].在植物细胞中,虽然位于细胞质的MVA途径同样可以产生异戊烯基焦磷酸前体,但是GGPPS和TS都具有天然质体靶向肽,因此,更偏向于来自质体中的IPP,也就是通过MEP途径产生的IPP[11].紫杉二烯环骨架形成后,发生一系列的后修饰,最终形成紫杉醇的关键前体巴卡亭Ⅲ.这些后修饰包括羟基化、羟基上的酰基化、酮基化和氧杂环丁烷环的形成等. ...
Heterologous expression and characterization of a “Pseudomature” form of taxadiene synthase involved in paclitaxel (Taxol) biosynthesis and evaluation of a potential intermediate and inhibitors of the multistep diterpene cyclization reaction
1
2000
... 巴卡亭Ⅲ母核的合成:香叶基香叶基焦磷酸(GGPP)是二萜类化合物的共同前体,由香叶基香叶基焦磷酸合酶(geranylgeranyl diphosphate synthase, GGPPS)催化1分子的二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate, DMAPP)和3分子的异戊烯基焦磷酸(isopentenyl diphosphate, IPP)缩合生成.IPP和DMAPP主要来源于位于质体的2-C-甲基-D-赤藻糖醇-4-磷酸(2-C-methyl-D-erythritol-4-phosphate, MEP)途径和位于细胞质的甲羟戊酸(mevalonate, MVA)途径[8].在异戊烯基焦磷酸异构酶(isopentenyl diphosphate isomerase,IDI)的作用下,DMAPP与IPP之间也可进行异构反应.接下来,紫杉二烯合成酶(taxadiene synthase,TS)催化GGPP环化生成紫杉醇二萜骨架结构[8-9],包括约95%的紫杉二烯[Taxa-4(5),11(12)-diene],约5%的异紫杉二烯[Taxa-4(20),11(12)-diene]和其他少量的二萜母核[10].在植物细胞中,虽然位于细胞质的MVA途径同样可以产生异戊烯基焦磷酸前体,但是GGPPS和TS都具有天然质体靶向肽,因此,更偏向于来自质体中的IPP,也就是通过MEP途径产生的IPP[11].紫杉二烯环骨架形成后,发生一系列的后修饰,最终形成紫杉醇的关键前体巴卡亭Ⅲ.这些后修饰包括羟基化、羟基上的酰基化、酮基化和氧杂环丁烷环的形成等. ...
Synthetic biology identifies the minimal gene set required for paclitaxel biosynthesis in a plant chassis
13
2023
... 紫杉醇的相关后修饰过程中,细胞色素P450酶介导了大部分的羟基化反应,前期已经鉴定出的P450酶有C5、C2、C7、C10和C13位的羟基化酶.近期C4β-C20环氧化酶、C1羟化酶(T1βOH)、C9羟化酶(T9αOH)、C9加氧酶的研究也取得了相应的进展[12-13],目前从紫杉二烯合成到紫杉醇的催化元件均已得到鉴定(表1). ...
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... [
12]
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... [
12]
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... [
12]
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... [
12]
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... 长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... 在近期的研究中,德国马克斯-普朗克研究所的Alisdair R. Fernie等[12]认为ODD酶TB328和P450酶T5αOH协同作用首先形成了4β-C20-环氧化-紫杉二烯-4α-醇,随后进行C9的羟基化和氧化反应,并通过相同的瞬时转化技术和dropout实验鉴定了紫杉烷-1β-羟化酶(T1βOH)、紫杉烷-9α-羟化酶(T9αOH)和紫杉烷9α-氧化酶,接下来的反应顺序尚未确认.随后,中间体2-debenzoyltaxane以区域特异性方式被紫杉烷-2α-O-苯甲酰转移酶(taxane-2α-O-benzoyl transferase,TBT)苯甲酰化,生成10-去乙酰巴卡亭Ⅲ(10-deacetyl baccatin Ⅲ,10-DAB),然后发生紫杉烷环母核上的最后一步修饰反应,10-去乙酰巴卡亭Ⅲ-10-O-乙酰基转移酶(10-deacetylbaccatin Ⅲ-10-O-acetyl transferase,DBAT)催化10-去乙酰巴卡亭Ⅲ在C10位的羟基进一步乙酰化[36],形成巴卡亭Ⅲ.斯坦福大学Sattely课题组[39]通过对紫杉醇合成早期途径在烟草体系进行重构,发现紫杉二烯-5α-醇被紫杉醇合成途径早期催化元件以TAT-T10βOH-DBAT-T13αOH的顺序或者T13αOH-TAT-T10βOH-DBAT的顺序催化形成5α,10β-diacetoxy-13α-ol进行后续反应,最终生成5α,10β-diacetoxy-13-one中间体.闫建斌和周志华课题组基于新发现的氧杂环丁烷合成酶分别在烟草和酿酒酵母中构建了巴卡亭Ⅲ和5α,10β-diacetoxy-13-one的生物合成途径,另外,两个团队都鉴定出了负责紫杉烷C9位羟基化的酶T9αH1[13,30].值得一提的是,周志华团队通过底物饲喂实验推测紫杉二烯-5α-醇是首先通过C13位羟基化进入的紫杉醇合成途径,对先进行C5位乙酰化后进行C10位羟基化的路线解析提出了挑战[30].总之,虽然不同研究团队对于巴卡亭Ⅲ合成途径的催化顺序得到不同结论,近期关于氧杂环丁烷环的研究结果、新功能酶的发现和紫杉烷类化合物异源合成途径的构建进一步丰富了人们对于紫杉醇P450酶催化功能多样性的认知. ...
... β-苯丙氨酰辅酶A(β-phenylalanoyl-CoA)侧链的合成:首先苯丙氨酸氨基变位酶(PAM)催化α-苯丙氨酸异构化产生β-苯丙氨酸[24];然后由β-苯丙氨酰-CoA连接酶(PCL)将侧链活化成β-苯丙氨酰辅酶A[25].2023年,Alisdair R. Fernie团队[12]通过烟草瞬时转化系统成功筛选到了苯丙氨酰-CoA连接酶序列. ...
... 随着高通量测序技术的发展,众多红豆杉转录组数据已经被公布,截至2024年1月10日,在GenBank中可以搜索到多达1254个转录组数据.基于转录组学分析的研究已经确定了若干参与紫杉醇生物合成途径的候选基因和转录因子[43-44],比较转录组分析也用于进行紫杉烷的组织特异性以及在不同红豆杉品系间积累的分析[45].最近对这些公开可用资源的挖掘已经捕获了多个未知催化元件,包括C4β-C20 epoxidase、T9αOH、PCL[25]和T2′αOH等[12].此外,通过RNA-Seq技术,研究人员也对紫杉醇紫杉烷类的调控机制进行了研究,挖掘出了多个调控紫杉醇生物合成的转录因子,如通过对ERF、bHLH、WRKY、MYC、MYB等转录因子家族进行分析和功能研究,发现上述转录因子能够调控紫杉醇的基因的表达,提高了转基因红豆杉细胞系中紫杉醇的含量[46].这些功能基因及转录因子的发现,对推进基因工程方法合成紫杉醇以及其生物合成的相关调控研究具有重要的指导意义. ...
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... 2023年,马克斯-普朗克所研究人员通过转录组学、细胞生物学、代谢组学和单酶缺失实验相结合的方法鉴定了在底盘生物合成紫杉醇所需的最小基因集.通过在本氏烟草中瞬时表达截短质体定位信号的二萜合成酶(nsTXS)、香叶基香叶基磷酸合成酶(nsGGPS)基因以及胞质内甲羟戊酸依赖的类异戊二烯途径的限速酶3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)基因,构建紫杉二烯的生物合成途径,每克鲜重的紫杉二烯含量约为100 µg.该团队利用先前表征过的酶以及新鉴定的环氧酶、紫杉烷1β-羟化酶(T1βOH)、紫杉烷9α-羟化酶(T9αOH)、紫杉烷9α-氧化酶和苯丙氨酰-CoA连接酶(PCL),成功地合成了关键中间体巴卡亭Ⅲ,并且在本氏烟草里成功地实现了巴卡亭Ⅲ到紫杉醇的合成[12].值得注意的是,新鉴定的C4β-C20环氧酶作为一种α-酮戊二酸依赖的双加氧酶可以克服紫杉醇代谢工程的第一个合成瓶颈.烟草植物底盘中的辅因子或者伴侣蛋白可能辅助了C4β-C20环氧酶的功能表达,进而助力在烟草细胞中成功合成巴卡亭Ⅲ,而在大肠杆菌和酿酒酵母中并未实现功能性表达.虽然,相较于紫杉醇天然的合成环境,此研究合成的10-去乙酰巴卡亭Ⅲ和巴卡亭Ⅲ产量较低,但是这些结果表明在异源体系中可以合成10-去乙酰巴卡亭Ⅲ和巴卡亭Ⅲ,已经为它的生物合成定义了一个完整的最小途径.此外,研究人员发现这一途径可能是一个代谢网络,而不是一个线性途径.2024年1月,闫建斌团队与雷晓光团队[13]合作发现了更为精简的巴卡亭Ⅲ合成通路,研究人员通过瞬时表达TOT和T9αH-1与其他7个已知合成基因(TXS、T5αOH、T13αOH、T2αOH、T7βOH、TAT和TBT),在烟草中成功鉴定到了巴卡亭Ⅲ的生成.通过进一步的生化研究分析,发现这些核心基因受植物激素茉莉素共同调控,表现出相似的表达模式和强相关性,表明这些基因在细胞中受到紧密的协同调控.亚细胞定位实验表明起始底物GGPP在叶绿体中经过TXS酶的催化转化为紫杉二烯,随后紫杉二烯通过质体-内质网的接触点被转移到细胞质中,在此过程中,六个内质网锚定的氧化酶(T2αOH、T5αOH、T7βOH、T9αOH、T13αOH和TOT)与两个细胞质定位的酰基转移酶(TAT和TBT)协同作用,最终生成巴卡亭Ⅲ.Elizabeth S. Sattely课题组[39]重构紫杉醇早期生物合成网络,在这里对T5αOH的四种新产物进行了结构表征,其中许多产物似乎是对初级单氧化产物的过度氧化.通过调节T5αOH表达的启动子强度,这些副产物的水平降低,同时紫杉二烯-5α-醇的积累增加了4倍.该工程系统能够重建六步生物合成途径,以生产可分离的5α,10β-二乙酰氧基-紫杉二烯- 13α-醇.通过对紫杉醇生物合成网络的工程化设计,表明红豆杉基因可以协调作用于关键的早期紫杉醇中间体的生物合成生产,并为发现剩余的生物合成基因提供了重要的平台. ...
... 近期对于氧杂环氧丁烷环的形成机制有了突破性的进展,首先是2023年Alisdair R. Fernie课题组[12]发现了催化C4β-C20的氧杂环丁烷形成的关键催化元件TB328.不同于其他参与氧杂环丁烷形成的候选酶序列,TB328不是一种P450酶,而是一种α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶,即ODD酶.研究人员通过烟草瞬时表达,证明了TB328可以催化紫杉素合成紫杉素-4β,20-环氧化物,并且也在烟草底盘中成功实现了巴卡亭Ⅲ的从头合成.然而当研究人员尝试在合成紫杉二烯的大肠杆菌或酿酒酵母菌中表达该酶,尚未得到成功表达,并且其具体的反应机制也因氧化产物产量稀少,无法进行NMR检测而受到限制. ...
Characterization and heterologous reconstitution of Taxus biosynthetic enzymes leading to baccatin Ⅲ
10
2024
... 紫杉醇的相关后修饰过程中,细胞色素P450酶介导了大部分的羟基化反应,前期已经鉴定出的P450酶有C5、C2、C7、C10和C13位的羟基化酶.近期C4β-C20环氧化酶、C1羟化酶(T1βOH)、C9羟化酶(T9αOH)、C9加氧酶的研究也取得了相应的进展[12-13],目前从紫杉二烯合成到紫杉醇的催化元件均已得到鉴定(表1). ...
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... [
13]
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... 长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... 在近期的研究中,德国马克斯-普朗克研究所的Alisdair R. Fernie等[12]认为ODD酶TB328和P450酶T5αOH协同作用首先形成了4β-C20-环氧化-紫杉二烯-4α-醇,随后进行C9的羟基化和氧化反应,并通过相同的瞬时转化技术和dropout实验鉴定了紫杉烷-1β-羟化酶(T1βOH)、紫杉烷-9α-羟化酶(T9αOH)和紫杉烷9α-氧化酶,接下来的反应顺序尚未确认.随后,中间体2-debenzoyltaxane以区域特异性方式被紫杉烷-2α-O-苯甲酰转移酶(taxane-2α-O-benzoyl transferase,TBT)苯甲酰化,生成10-去乙酰巴卡亭Ⅲ(10-deacetyl baccatin Ⅲ,10-DAB),然后发生紫杉烷环母核上的最后一步修饰反应,10-去乙酰巴卡亭Ⅲ-10-O-乙酰基转移酶(10-deacetylbaccatin Ⅲ-10-O-acetyl transferase,DBAT)催化10-去乙酰巴卡亭Ⅲ在C10位的羟基进一步乙酰化[36],形成巴卡亭Ⅲ.斯坦福大学Sattely课题组[39]通过对紫杉醇合成早期途径在烟草体系进行重构,发现紫杉二烯-5α-醇被紫杉醇合成途径早期催化元件以TAT-T10βOH-DBAT-T13αOH的顺序或者T13αOH-TAT-T10βOH-DBAT的顺序催化形成5α,10β-diacetoxy-13α-ol进行后续反应,最终生成5α,10β-diacetoxy-13-one中间体.闫建斌和周志华课题组基于新发现的氧杂环丁烷合成酶分别在烟草和酿酒酵母中构建了巴卡亭Ⅲ和5α,10β-diacetoxy-13-one的生物合成途径,另外,两个团队都鉴定出了负责紫杉烷C9位羟基化的酶T9αH1[13,30].值得一提的是,周志华团队通过底物饲喂实验推测紫杉二烯-5α-醇是首先通过C13位羟基化进入的紫杉醇合成途径,对先进行C5位乙酰化后进行C10位羟基化的路线解析提出了挑战[30].总之,虽然不同研究团队对于巴卡亭Ⅲ合成途径的催化顺序得到不同结论,近期关于氧杂环丁烷环的研究结果、新功能酶的发现和紫杉烷类化合物异源合成途径的构建进一步丰富了人们对于紫杉醇P450酶催化功能多样性的认知. ...
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... 2023年,马克斯-普朗克所研究人员通过转录组学、细胞生物学、代谢组学和单酶缺失实验相结合的方法鉴定了在底盘生物合成紫杉醇所需的最小基因集.通过在本氏烟草中瞬时表达截短质体定位信号的二萜合成酶(nsTXS)、香叶基香叶基磷酸合成酶(nsGGPS)基因以及胞质内甲羟戊酸依赖的类异戊二烯途径的限速酶3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)基因,构建紫杉二烯的生物合成途径,每克鲜重的紫杉二烯含量约为100 µg.该团队利用先前表征过的酶以及新鉴定的环氧酶、紫杉烷1β-羟化酶(T1βOH)、紫杉烷9α-羟化酶(T9αOH)、紫杉烷9α-氧化酶和苯丙氨酰-CoA连接酶(PCL),成功地合成了关键中间体巴卡亭Ⅲ,并且在本氏烟草里成功地实现了巴卡亭Ⅲ到紫杉醇的合成[12].值得注意的是,新鉴定的C4β-C20环氧酶作为一种α-酮戊二酸依赖的双加氧酶可以克服紫杉醇代谢工程的第一个合成瓶颈.烟草植物底盘中的辅因子或者伴侣蛋白可能辅助了C4β-C20环氧酶的功能表达,进而助力在烟草细胞中成功合成巴卡亭Ⅲ,而在大肠杆菌和酿酒酵母中并未实现功能性表达.虽然,相较于紫杉醇天然的合成环境,此研究合成的10-去乙酰巴卡亭Ⅲ和巴卡亭Ⅲ产量较低,但是这些结果表明在异源体系中可以合成10-去乙酰巴卡亭Ⅲ和巴卡亭Ⅲ,已经为它的生物合成定义了一个完整的最小途径.此外,研究人员发现这一途径可能是一个代谢网络,而不是一个线性途径.2024年1月,闫建斌团队与雷晓光团队[13]合作发现了更为精简的巴卡亭Ⅲ合成通路,研究人员通过瞬时表达TOT和T9αH-1与其他7个已知合成基因(TXS、T5αOH、T13αOH、T2αOH、T7βOH、TAT和TBT),在烟草中成功鉴定到了巴卡亭Ⅲ的生成.通过进一步的生化研究分析,发现这些核心基因受植物激素茉莉素共同调控,表现出相似的表达模式和强相关性,表明这些基因在细胞中受到紧密的协同调控.亚细胞定位实验表明起始底物GGPP在叶绿体中经过TXS酶的催化转化为紫杉二烯,随后紫杉二烯通过质体-内质网的接触点被转移到细胞质中,在此过程中,六个内质网锚定的氧化酶(T2αOH、T5αOH、T7βOH、T9αOH、T13αOH和TOT)与两个细胞质定位的酰基转移酶(TAT和TBT)协同作用,最终生成巴卡亭Ⅲ.Elizabeth S. Sattely课题组[39]重构紫杉醇早期生物合成网络,在这里对T5αOH的四种新产物进行了结构表征,其中许多产物似乎是对初级单氧化产物的过度氧化.通过调节T5αOH表达的启动子强度,这些副产物的水平降低,同时紫杉二烯-5α-醇的积累增加了4倍.该工程系统能够重建六步生物合成途径,以生产可分离的5α,10β-二乙酰氧基-紫杉二烯- 13α-醇.通过对紫杉醇生物合成网络的工程化设计,表明红豆杉基因可以协调作用于关键的早期紫杉醇中间体的生物合成生产,并为发现剩余的生物合成基因提供了重要的平台. ...
... 2024年闫建斌团队与雷晓光团队[13]通过对58个紫杉醇生物合成关键候选基因进行筛选,成功发现了能够催化氧杂环丁烷合成的细胞色素P450酶,命名为TOT1.研究人员发现TOT1并不能催化三元环中间体向四元环的转变,而是将双键结构同时转变为三元环和四元环结构,通过密度泛函理论(DFT)计算与酶的底物选择性检测,研究者们进一步揭示了环氧化物和氧杂环丁烷都可以通过TOT1酶中的羰基离子中间体产生,但氧杂环丁烷产物的生成在能量和动力学上都比环氧化物更有利,解释了氧杂环丁烷为优势产物的分子机制,证明了环氧化物不是氧杂环丁烷形成的必要中间体[13].几乎同一时间,周志华研究团队[30]解析了TOT1的同工酶CYP725A55对于该反应的催化机制.周志华团队通过同位素标记实验验证了环氧杂丁烷环很可能通过直接的氧化-酰基重排过程形成,与闫建斌团队推测结果相一致.这一研究结果颠覆了30年来人类对于该结构生成机制的传统认知,填补了仅在植物界中存在的环扩张反应生成含氧四元环结构的分子机制的缺失. ...
... [13].几乎同一时间,周志华研究团队[30]解析了TOT1的同工酶CYP725A55对于该反应的催化机制.周志华团队通过同位素标记实验验证了环氧杂丁烷环很可能通过直接的氧化-酰基重排过程形成,与闫建斌团队推测结果相一致.这一研究结果颠覆了30年来人类对于该结构生成机制的传统认知,填补了仅在植物界中存在的环扩张反应生成含氧四元环结构的分子机制的缺失. ...
... 尤其值得一提的是2023年Alisdair R. Fernie课题组[52]通过转录组学、细胞生物学、代谢组学和单酶缺失实验相结合的方法鉴定了在底盘生物合成紫杉醇所需的最小基因集,筛选到了长时间缺失的C4β-C20环氧化酶、紫杉烷1β-羟化酶(T1βOH)、紫杉烷9α-羟化酶(T9αOH)、紫杉烷9α-氧化酶和苯丙氨酰-CoA连接酶(PCL)进一步完善了紫杉醇的生物合成途径.几乎同时期,Sotirios C. Kampranis团队[35]发现CYP725A4能够催化紫杉二烯前体不同位点氧化,可能通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.此外,研究人员也证实了从紫杉二烯和异紫杉二烯起始均可以生成目标环氧化中间产物.近期,闫建斌团队[13]和周志华团队[30]新鉴定了参与紫杉烷氧杂环丁烷合成的关键酶TOT及同工酶P450酶CYP725A55,三种不同催化机制进一步反映了紫杉醇生物合成途径的复杂性.紫杉醇的生物合成途径可能是一个代谢网络,而不仅仅是一个线性途径,中间催化过程还有待于深入分析.目前紫杉醇的生物合成通路解析与催化机制分析仍然受限于催化反应的复杂性和紫杉醇中间底物的严重不足. ...
Cloning and functional expression of a cDNA encoding geranylgeranyl diphosphate synthase from Taxus canadensis and assessment of the role of this prenyltransferase in cells induced for taxol production
1
1998
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
A cDNA clone for taxadiene synthase, the diterpene cyclase that catalyzes the committed step of taxol biosynthesis
1
1996
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
Cytochrome P450 taxadiene 5α-hydroxylase, a mechanistically unusual monooxygenase catalyzing the first oxygenation step of taxol biosynthesis
2
2004
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... TS是紫杉醇的生物合成中的关键酶之一,通过TS的环化作用将代谢流引入紫杉醇合成途径.在发酵过程中,GGPP首先在紫杉二烯合酶(TS)的催化下环化生成93.2%的紫杉-4(5),11(12)-二烯,同时还会生成4.7%的紫杉-4(20),11(12)-二烯以及其他少量的二萜母核.随后,仅有10%的紫杉-4(5),11(12)-二烯被紫杉二烯-5α-羟化酶(T5αOH)转化成为目的产物紫杉-4(20),11(12)-二烯-5α-醇[32].但有证据表明对于其底物紫杉二烯而言,T5αOH对底物异紫杉二烯具有更高的亲和力[16].Stephanopoulos和翁经科研究组[32]通过对TS活性区域附近多处氨基酸进行突变研究,发现当第688位的酪氨酸突变为亮氨酸时紫杉-4(20),11(12)-二烯生产比例明显提高,随后将TSY688L突变体转化到T5αOH表达菌株后,使得紫杉二烯- 5α-醇产量提高了2.4倍.该研究表明,通过改造TS提高异紫杉二烯的产量,可以经过T5αOH催化直接进行P450加羟反应,避免经过环氧化物断裂过程,可以明显提高目标产物合成比例.随着TS的晶体结构被解析[9],对关键氨基酸位点进行突变研究也随之进行.Schrepfer等[88]根据其构建的模型,设计出突变体S713T、W753H、W753H/C830A、V584K/L/M、S587A、V714A/I、S713T、C803A/S和Y841F,研究发现这些突变体均未丧失催化活性,其中S713T还具有97.4%的酶活性. ...
Taxol biosynthesis: taxane 13 α-hydroxylase is a cytochrome P450-dependent monooxygenase
1
2001
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
Molecular cloning of a taxa-4(20), 11(12)-dien-5α-ol-O-acetyl transferase cDNA from Taxus and functional expression in Escherichia coli
2
2000
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... 先前研究中对于紫杉二烯C5位羟基化的后续反应有两种推测的途径[36]:途径一是Taxa-4(20),11(12)-dien-5α-ol在5α羟基上继续发生乙酰化反应,由紫杉二烯-5α-醇-O-乙酰转移酶(taxadiene-5α-ol-O-acetyl transferase, TAT)催化形成taxa-4(20),11(12)-dien-5α-yl-acetate,再被紫杉烷-10β-羟化酶(T10βOH)催化C10位上发生羟基化,合成taxa-4(20),11(12)-dien-5α-acetoxy-10β-ol.此过程中的TAT同样是一种多功能酶,包括香叶基香叶醇(geranylgeraniol, GGOH)和法尼醇(farnesol)在内的几种类异戊二烯都可以作为该酶的底物,从而生成各类乙酰化产物[18,37].二是CYP725A家族的紫杉烷13α-羟化酶(T13αOH)催化中间体taxa-4(20),11(12)-dien-5α-ol的C13位发生羟基化反应,生成taxa-4(20),11(12)-dien-5α,13α-diol.接下来,在其他位置上继续发生羟基化修饰,对于其他位点C1、C2、C7、C9位发生的羟基化作用以及C2、C5、C10位羟基上的酰基化和C9位的酮基化发生的顺序尚不明确.戴均贵等[38]发现银杏悬浮细胞可催化2α,5α,10β,14β-四乙酰氧基-紫杉-4(20),11(12)-二烯(sinenxan A,SIA)形成9-羟基-SIA,这说明可以从银杏中寻找C9羟化酶,从而在红豆杉中找到相应的同源基因. ...
Random sequencing of an induced Taxus cell cDNA library for identification of clones involved in taxol biosynthesis
1
2004
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
Molecular cloning of a cytochrome P450 taxane 10β- hydroxylase cDNA from Taxus and functional expression in yeast
1
2001
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
Taxol biosynthesis: molecular cloning and characterization of a cytochrome P450 taxoid 7β-hydroxylase
1
2004
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
Molecular cloning and characterization of a cytochrome P450 taxoid 2α-hydroxylase involved in Taxol biosynthesis
1
2004
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
Taxol biosynthesis: molecular cloning of a benzoyl-CoA: taxane 2α-O-benzoyltransferase cDNA from taxus and functional expression in Escherichia coli
2
2000
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... [
23]
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
Cloning, heterologous expression, and characterization of a phenylalanine aminomutase involved in taxol biosynthesis
2
2004
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... β-苯丙氨酰辅酶A(β-phenylalanoyl-CoA)侧链的合成:首先苯丙氨酸氨基变位酶(PAM)催化α-苯丙氨酸异构化产生β-苯丙氨酸[24];然后由β-苯丙氨酰-CoA连接酶(PCL)将侧链活化成β-苯丙氨酰辅酶A[25].2023年,Alisdair R. Fernie团队[12]通过烟草瞬时转化系统成功筛选到了苯丙氨酰-CoA连接酶序列. ...
Transcript profiling of jasmonate-elicited Taxus cells reveals a β-phenylalanine-CoA ligase
4
2016
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... [
25]
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... β-苯丙氨酰辅酶A(β-phenylalanoyl-CoA)侧链的合成:首先苯丙氨酸氨基变位酶(PAM)催化α-苯丙氨酸异构化产生β-苯丙氨酸[24];然后由β-苯丙氨酰-CoA连接酶(PCL)将侧链活化成β-苯丙氨酰辅酶A[25].2023年,Alisdair R. Fernie团队[12]通过烟草瞬时转化系统成功筛选到了苯丙氨酰-CoA连接酶序列. ...
... 随着高通量测序技术的发展,众多红豆杉转录组数据已经被公布,截至2024年1月10日,在GenBank中可以搜索到多达1254个转录组数据.基于转录组学分析的研究已经确定了若干参与紫杉醇生物合成途径的候选基因和转录因子[43-44],比较转录组分析也用于进行紫杉烷的组织特异性以及在不同红豆杉品系间积累的分析[45].最近对这些公开可用资源的挖掘已经捕获了多个未知催化元件,包括C4β-C20 epoxidase、T9αOH、PCL[25]和T2′αOH等[12].此外,通过RNA-Seq技术,研究人员也对紫杉醇紫杉烷类的调控机制进行了研究,挖掘出了多个调控紫杉醇生物合成的转录因子,如通过对ERF、bHLH、WRKY、MYC、MYB等转录因子家族进行分析和功能研究,发现上述转录因子能够调控紫杉醇的基因的表达,提高了转基因红豆杉细胞系中紫杉醇的含量[46].这些功能基因及转录因子的发现,对推进基因工程方法合成紫杉醇以及其生物合成的相关调控研究具有重要的指导意义. ...
The final acylation step in taxol biosynthesis: cloning of the taxoid C13-side-chain N-benzoyltransferase from Taxus
3
2002
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... 紫杉醇的合成:首先,巴卡亭Ⅲ:3-氨基- 13-苯丙酰转移酶(baccatin Ⅲ:3-amino-13-phenylpropanoyltransferase,BAPT)以侧链β-苯丙氨酰辅酶A作为酰基供体,催化巴卡亭Ⅲ的C13 位酰化形成β-苯丙氨酰巴卡亭Ⅲ[26],再经过紫杉烷- 2′α-羟化酶(T2α′OH)催化侧链C2′位的羟基化合成3′-N-去苯甲酰紫杉醇(3′-N-debenzoyltaxol)[27].最后,3′-N-去苯甲酰-2′-脱氧紫杉醇-N-苯酰转移酶(3′-N-debenzoyl-2′-deoxytaxol N-benzoyltransferase,DBTNBT)催化侧链C3′位N原子发生苯甲酰化生成紫杉醇[26]. ...
... [26]. ...
A novel hydroxylation step in the taxane biosynthetic pathway: a new approach to paclitaxel production by synthetic biology
2
2020
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... 紫杉醇的合成:首先,巴卡亭Ⅲ:3-氨基- 13-苯丙酰转移酶(baccatin Ⅲ:3-amino-13-phenylpropanoyltransferase,BAPT)以侧链β-苯丙氨酰辅酶A作为酰基供体,催化巴卡亭Ⅲ的C13 位酰化形成β-苯丙氨酰巴卡亭Ⅲ[26],再经过紫杉烷- 2′α-羟化酶(T2α′OH)催化侧链C2′位的羟基化合成3′-N-去苯甲酰紫杉醇(3′-N-debenzoyltaxol)[27].最后,3′-N-去苯甲酰-2′-脱氧紫杉醇-N-苯酰转移酶(3′-N-debenzoyl-2′-deoxytaxol N-benzoyltransferase,DBTNBT)催化侧链C3′位N原子发生苯甲酰化生成紫杉醇[26]. ...
Taxoid metabolism: taxoid 14β-hydroxylase is a cytochrome P450-dependent monooxygenase
2
2003
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... 此外,在红豆杉植物体内,环化后的紫杉二烯母核在形成之后,将会沿多个分支途径通过其他位置的羟基化或酰化合成其他的紫杉烷类化合物.Jennewein等[28]鉴定出存在于紫杉烷合成另一条分支途径中的P450单加氧酶的紫杉烷-14β-羟化酶(T14βOH).研究表明,T14βOH表达与紫杉醇的含量呈负相关,这进一步说明红豆杉中紫杉烷类物质的合成途径可能有多条线路,形成一个复杂的合成网络,在三环二萜结构母核形成之后,通过各类酶的修饰,从而合成多种紫杉烷类化合物.后续研究显示,除了从GGPP到紫杉醇所必需的19步反应之外,还有几条经过其他羟基化和酰基化反应形成非有效紫杉烷的支路途径,这也是导致其中间副产物众多的一个主要原因[36]. ...
Coexpression in yeast of Taxus cytochrome P450 reductase with cytochrome P450 oxygenases involved in taxol biosynthesis
1
2005
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
Biosynthesis of the highly oxygenated tetracyclic core skeleton of taxol
10
2024
... Identified paclitaxel biosynthetic enzymes
Table 1 | 酶名称 | 简写 | 登录号 | 参考文献 |
|---|
| 1 | Geranylgeranyl diphosphate synthase | GGPPS | AF081514 | [14] |
| 2 | Taxadiene synthase | TS | AY364469 | [15] |
| 3 | Taxadiene-5α-hydroxylase | T5αOH | AY289209 | [16] |
| 4 | Taxadiene-13α-hydroxylase | T13αOH | AY056019 | [17] |
| 5 | Taxadiene-5α-ol-O-acetyl transferase | TAT | AF190130 | [18] |
| 6 | Taxadiene-10β-hydroxylase | T10βOH | AF318211/AY563635 | [19-20] |
| 7 | Taxadiene-7β-hydroxylase | T7βOH | AY307951 | [21] |
| 8 | Taxadiene-2α-hydroxylase | T2αOH | AY518383 | [22] |
| 9 | Taxane-2α-O-benzoyl transferase | TBT | AF297618 | [23] |
| 10 | 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase | DBAT | AF193765 | [23] |
| 11 | Phenylalanine aminomutase | PAM | AY582743 | [24] |
| 12 | β-phenylalanoyl-CoA ligase | PCL | KM593667 | [25] |
| 13 | Baccatin Ⅲ: 3-amino, 13-phenylpropanoyltransferase | BAPT | AY082804 | [25] |
| 14 | Taxane-2′α-hydroxylase | T2′αOH | KP178208 | [26] |
| 15 | N-benzoyl transferase | DBTNBT | AF466397 | [27] |
| 16 | Taxadiene-14β-hydroxylase | T14βOH | AY188177 | [28] |
| 17 | Cytochrome P450 reductase | TcCPR | AY571340 | [29] |
| 18 | C4β-C20 epoxidase | | | [12] |
| 19 | Taxane 1β-hydroxylase | T1βOH | | [12] |
| 20 | Taxane 9α-hydroxylase | T9αOH | | [12] |
| 21 | Taxane 9α-dioxygenase | | | [12] |
| 22 | Phenylalanine-CoA ligase | PCL | | [12] |
| 23 | Taxane oxetanase | TOT | | [13] |
| 24 | Taxane 9α-hydroxylase | T9αH1 | | [13] |
| 25 | Taxane 9α-hydroxylase | CYP725A37 | PP197199/PP197200 | [30] |
| 26 | Taxane oxetanase | CYP725A55 | PP197201 | [30] |
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... [
30]
| 27 | Acyltransferase | AT5 | PP197202 | [30] |
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... [
30]
长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... 长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... 在近期的研究中,德国马克斯-普朗克研究所的Alisdair R. Fernie等[12]认为ODD酶TB328和P450酶T5αOH协同作用首先形成了4β-C20-环氧化-紫杉二烯-4α-醇,随后进行C9的羟基化和氧化反应,并通过相同的瞬时转化技术和dropout实验鉴定了紫杉烷-1β-羟化酶(T1βOH)、紫杉烷-9α-羟化酶(T9αOH)和紫杉烷9α-氧化酶,接下来的反应顺序尚未确认.随后,中间体2-debenzoyltaxane以区域特异性方式被紫杉烷-2α-O-苯甲酰转移酶(taxane-2α-O-benzoyl transferase,TBT)苯甲酰化,生成10-去乙酰巴卡亭Ⅲ(10-deacetyl baccatin Ⅲ,10-DAB),然后发生紫杉烷环母核上的最后一步修饰反应,10-去乙酰巴卡亭Ⅲ-10-O-乙酰基转移酶(10-deacetylbaccatin Ⅲ-10-O-acetyl transferase,DBAT)催化10-去乙酰巴卡亭Ⅲ在C10位的羟基进一步乙酰化[36],形成巴卡亭Ⅲ.斯坦福大学Sattely课题组[39]通过对紫杉醇合成早期途径在烟草体系进行重构,发现紫杉二烯-5α-醇被紫杉醇合成途径早期催化元件以TAT-T10βOH-DBAT-T13αOH的顺序或者T13αOH-TAT-T10βOH-DBAT的顺序催化形成5α,10β-diacetoxy-13α-ol进行后续反应,最终生成5α,10β-diacetoxy-13-one中间体.闫建斌和周志华课题组基于新发现的氧杂环丁烷合成酶分别在烟草和酿酒酵母中构建了巴卡亭Ⅲ和5α,10β-diacetoxy-13-one的生物合成途径,另外,两个团队都鉴定出了负责紫杉烷C9位羟基化的酶T9αH1[13,30].值得一提的是,周志华团队通过底物饲喂实验推测紫杉二烯-5α-醇是首先通过C13位羟基化进入的紫杉醇合成途径,对先进行C5位乙酰化后进行C10位羟基化的路线解析提出了挑战[30].总之,虽然不同研究团队对于巴卡亭Ⅲ合成途径的催化顺序得到不同结论,近期关于氧杂环丁烷环的研究结果、新功能酶的发现和紫杉烷类化合物异源合成途径的构建进一步丰富了人们对于紫杉醇P450酶催化功能多样性的认知. ...
... [30].总之,虽然不同研究团队对于巴卡亭Ⅲ合成途径的催化顺序得到不同结论,近期关于氧杂环丁烷环的研究结果、新功能酶的发现和紫杉烷类化合物异源合成途径的构建进一步丰富了人们对于紫杉醇P450酶催化功能多样性的认知. ...
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... 2024年周志华课题组[30]通过饲喂T5α-ol在酿酒酵母中构建紫杉醇高度氧化中间体的合成通路,系统地阐明了从紫杉烯的C5位单氧化产物到高度氧化的1β-去羟基巴卡亭Ⅵ(1β-dehydroxybaccatin Ⅵ)的完整生物合成途径,助力完全阐明紫杉醇的生物合成途径.研究人员发现了催化第四步羟基化反应的紫杉醇9α-羟化酶,以及通过级联氧化协同酰基重排机制催化氧环酯形成的CYP725A55,并确定了催化C7-OAc形成的乙酰转移酶.此外,该研究团队认为仍然有必要进一步阐明从1β-去羟基巴卡亭Ⅵ到巴卡亭Ⅲ的完整生物合成途径以及紫杉醇的平行生物合成途径,未来还需要进一步确认紫杉烷-1β-羟化酶和紫杉烷9α-氧化酶在合成通路构建中的必要性.相关系统研究为完全阐明紫杉醇的生物合成途径和在酵母细胞中的异源合成奠定了坚实基础. ...
... 2024年闫建斌团队与雷晓光团队[13]通过对58个紫杉醇生物合成关键候选基因进行筛选,成功发现了能够催化氧杂环丁烷合成的细胞色素P450酶,命名为TOT1.研究人员发现TOT1并不能催化三元环中间体向四元环的转变,而是将双键结构同时转变为三元环和四元环结构,通过密度泛函理论(DFT)计算与酶的底物选择性检测,研究者们进一步揭示了环氧化物和氧杂环丁烷都可以通过TOT1酶中的羰基离子中间体产生,但氧杂环丁烷产物的生成在能量和动力学上都比环氧化物更有利,解释了氧杂环丁烷为优势产物的分子机制,证明了环氧化物不是氧杂环丁烷形成的必要中间体[13].几乎同一时间,周志华研究团队[30]解析了TOT1的同工酶CYP725A55对于该反应的催化机制.周志华团队通过同位素标记实验验证了环氧杂丁烷环很可能通过直接的氧化-酰基重排过程形成,与闫建斌团队推测结果相一致.这一研究结果颠覆了30年来人类对于该结构生成机制的传统认知,填补了仅在植物界中存在的环扩张反应生成含氧四元环结构的分子机制的缺失. ...
... 尤其值得一提的是2023年Alisdair R. Fernie课题组[52]通过转录组学、细胞生物学、代谢组学和单酶缺失实验相结合的方法鉴定了在底盘生物合成紫杉醇所需的最小基因集,筛选到了长时间缺失的C4β-C20环氧化酶、紫杉烷1β-羟化酶(T1βOH)、紫杉烷9α-羟化酶(T9αOH)、紫杉烷9α-氧化酶和苯丙氨酰-CoA连接酶(PCL)进一步完善了紫杉醇的生物合成途径.几乎同时期,Sotirios C. Kampranis团队[35]发现CYP725A4能够催化紫杉二烯前体不同位点氧化,可能通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.此外,研究人员也证实了从紫杉二烯和异紫杉二烯起始均可以生成目标环氧化中间产物.近期,闫建斌团队[13]和周志华团队[30]新鉴定了参与紫杉烷氧杂环丁烷合成的关键酶TOT及同工酶P450酶CYP725A55,三种不同催化机制进一步反映了紫杉醇生物合成途径的复杂性.紫杉醇的生物合成途径可能是一个代谢网络,而不仅仅是一个线性途径,中间催化过程还有待于深入分析.目前紫杉醇的生物合成通路解析与催化机制分析仍然受限于催化反应的复杂性和紫杉醇中间底物的严重不足. ...
Mechanistic insights into taxadiene epoxidation by taxadiene-5α-hydroxylase
4
2016
... 长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... [31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... 目前,针对T5αOH的催化机制研究主要集中在自由基-反弹机制和环氧化机制[31,89].Yadav等[34]推测氧铁基团在C3位、C13位、C20位的竞争性质子提取过程是导致T5αOH氧化产物多样性的原因.Edgar等[31-32]推测紫杉二烯首先被T5αOH催化成不稳定的环氧化合物中间体,随后环氧化物进行非特异性断裂,从而生成包括紫杉二烯-5α-醇在内的多种氧化产物,遵循环氧化机制.与此同时,同分异构体异紫杉二烯可以避免经过环氧化合物断裂过程,依然通过正常的P450酶自由基-反弹机制特异性地生成目标产物紫杉二烯-5α-醇.而Barton等[90]发现紫杉二烯-4(5)-环氧化物对酸敏感,在不同的化学条件可以产生不同的重排产物,尤其是暴露在铁卟啉下时极易发生重排.这对紫杉二烯-4(5)-环氧化物作为合格中间体的角色提出了新的挑战.自从T5αOH于1996年在红豆杉中首次发现,研究人员进行了包括N端修饰、电子传递链优化、核糖体开关调控、静息细胞培养、内质网改造、区室化等一系列改造,并对催化温度、O2、pH、辅因子等条件也进行了大量的优化[61,71].但是在T5αOH酶分子改造方面,目前一直没有重大的突破.Yadav等[34]使用6个P450结构作为模板构建了T5αOH的同源模型,并在此基础上设计了53个突变体,其中有6个突变体,其转化率和T5α-ol选择性方面都有所提高.其中的两个突变体K131R和V374L分别表现出牺牲选择性而提高转化率和牺牲转化率而提高选择性的性质.基于对紫杉醇合成关键基因簇的深度解析,本课题组对喜马拉雅红豆杉来源的CYP725A亚家族候选序列进行了大规模的功能筛选,发现T5αOH生成两个拷贝同工酶T5αOH-1和T5αOH-2,经过实验验证都具有催化紫杉二烯C5位羟基化的功能,然而其催化性能相较于已报道的T5αOH并没有任何改善[41]. ...
... [31-32]推测紫杉二烯首先被T5αOH催化成不稳定的环氧化合物中间体,随后环氧化物进行非特异性断裂,从而生成包括紫杉二烯-5α-醇在内的多种氧化产物,遵循环氧化机制.与此同时,同分异构体异紫杉二烯可以避免经过环氧化合物断裂过程,依然通过正常的P450酶自由基-反弹机制特异性地生成目标产物紫杉二烯-5α-醇.而Barton等[90]发现紫杉二烯-4(5)-环氧化物对酸敏感,在不同的化学条件可以产生不同的重排产物,尤其是暴露在铁卟啉下时极易发生重排.这对紫杉二烯-4(5)-环氧化物作为合格中间体的角色提出了新的挑战.自从T5αOH于1996年在红豆杉中首次发现,研究人员进行了包括N端修饰、电子传递链优化、核糖体开关调控、静息细胞培养、内质网改造、区室化等一系列改造,并对催化温度、O2、pH、辅因子等条件也进行了大量的优化[61,71].但是在T5αOH酶分子改造方面,目前一直没有重大的突破.Yadav等[34]使用6个P450结构作为模板构建了T5αOH的同源模型,并在此基础上设计了53个突变体,其中有6个突变体,其转化率和T5α-ol选择性方面都有所提高.其中的两个突变体K131R和V374L分别表现出牺牲选择性而提高转化率和牺牲转化率而提高选择性的性质.基于对紫杉醇合成关键基因簇的深度解析,本课题组对喜马拉雅红豆杉来源的CYP725A亚家族候选序列进行了大规模的功能筛选,发现T5αOH生成两个拷贝同工酶T5αOH-1和T5αOH-2,经过实验验证都具有催化紫杉二烯C5位羟基化的功能,然而其催化性能相较于已报道的T5αOH并没有任何改善[41]. ...
Engineering of taxadiene synthase for improved selectivity and yield of a key taxol biosynthetic intermediate
4
2017
... 长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... TS是紫杉醇的生物合成中的关键酶之一,通过TS的环化作用将代谢流引入紫杉醇合成途径.在发酵过程中,GGPP首先在紫杉二烯合酶(TS)的催化下环化生成93.2%的紫杉-4(5),11(12)-二烯,同时还会生成4.7%的紫杉-4(20),11(12)-二烯以及其他少量的二萜母核.随后,仅有10%的紫杉-4(5),11(12)-二烯被紫杉二烯-5α-羟化酶(T5αOH)转化成为目的产物紫杉-4(20),11(12)-二烯-5α-醇[32].但有证据表明对于其底物紫杉二烯而言,T5αOH对底物异紫杉二烯具有更高的亲和力[16].Stephanopoulos和翁经科研究组[32]通过对TS活性区域附近多处氨基酸进行突变研究,发现当第688位的酪氨酸突变为亮氨酸时紫杉-4(20),11(12)-二烯生产比例明显提高,随后将TSY688L突变体转化到T5αOH表达菌株后,使得紫杉二烯- 5α-醇产量提高了2.4倍.该研究表明,通过改造TS提高异紫杉二烯的产量,可以经过T5αOH催化直接进行P450加羟反应,避免经过环氧化物断裂过程,可以明显提高目标产物合成比例.随着TS的晶体结构被解析[9],对关键氨基酸位点进行突变研究也随之进行.Schrepfer等[88]根据其构建的模型,设计出突变体S713T、W753H、W753H/C830A、V584K/L/M、S587A、V714A/I、S713T、C803A/S和Y841F,研究发现这些突变体均未丧失催化活性,其中S713T还具有97.4%的酶活性. ...
... [32]通过对TS活性区域附近多处氨基酸进行突变研究,发现当第688位的酪氨酸突变为亮氨酸时紫杉-4(20),11(12)-二烯生产比例明显提高,随后将TSY688L突变体转化到T5αOH表达菌株后,使得紫杉二烯- 5α-醇产量提高了2.4倍.该研究表明,通过改造TS提高异紫杉二烯的产量,可以经过T5αOH催化直接进行P450加羟反应,避免经过环氧化物断裂过程,可以明显提高目标产物合成比例.随着TS的晶体结构被解析[9],对关键氨基酸位点进行突变研究也随之进行.Schrepfer等[88]根据其构建的模型,设计出突变体S713T、W753H、W753H/C830A、V584K/L/M、S587A、V714A/I、S713T、C803A/S和Y841F,研究发现这些突变体均未丧失催化活性,其中S713T还具有97.4%的酶活性. ...
... 目前,针对T5αOH的催化机制研究主要集中在自由基-反弹机制和环氧化机制[31,89].Yadav等[34]推测氧铁基团在C3位、C13位、C20位的竞争性质子提取过程是导致T5αOH氧化产物多样性的原因.Edgar等[31-32]推测紫杉二烯首先被T5αOH催化成不稳定的环氧化合物中间体,随后环氧化物进行非特异性断裂,从而生成包括紫杉二烯-5α-醇在内的多种氧化产物,遵循环氧化机制.与此同时,同分异构体异紫杉二烯可以避免经过环氧化合物断裂过程,依然通过正常的P450酶自由基-反弹机制特异性地生成目标产物紫杉二烯-5α-醇.而Barton等[90]发现紫杉二烯-4(5)-环氧化物对酸敏感,在不同的化学条件可以产生不同的重排产物,尤其是暴露在铁卟啉下时极易发生重排.这对紫杉二烯-4(5)-环氧化物作为合格中间体的角色提出了新的挑战.自从T5αOH于1996年在红豆杉中首次发现,研究人员进行了包括N端修饰、电子传递链优化、核糖体开关调控、静息细胞培养、内质网改造、区室化等一系列改造,并对催化温度、O2、pH、辅因子等条件也进行了大量的优化[61,71].但是在T5αOH酶分子改造方面,目前一直没有重大的突破.Yadav等[34]使用6个P450结构作为模板构建了T5αOH的同源模型,并在此基础上设计了53个突变体,其中有6个突变体,其转化率和T5α-ol选择性方面都有所提高.其中的两个突变体K131R和V374L分别表现出牺牲选择性而提高转化率和牺牲转化率而提高选择性的性质.基于对紫杉醇合成关键基因簇的深度解析,本课题组对喜马拉雅红豆杉来源的CYP725A亚家族候选序列进行了大规模的功能筛选,发现T5αOH生成两个拷贝同工酶T5αOH-1和T5αOH-2,经过实验验证都具有催化紫杉二烯C5位羟基化的功能,然而其催化性能相较于已报道的T5αOH并没有任何改善[41]. ...
Taxadiene-5α-ol is a minor product of CYP725A4 when expressed in Escherichia coli
2
2018
... 长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... 在紫杉醇合成的前期途径中,尽管TS的催化能力有限,过程中亦有多种副产物产生[84-85],但它并不是紫杉醇生物合成途径中的关键限速步骤.一直以来,T5αOH催化紫杉二烯C5位羟化的步骤被认为是紫杉醇生物合成途径的关键限速步骤以及瓶颈[33].酶的定向进化是一种常用酶改造技术,其通过模拟基因突变与自然选择的原理,在短时间内对酶进行多轮突变与筛选.尽管定向进化领域取得了重大进展,但利用该方法设计紫杉醇途径的T5αOH和其他P450仍存在诸多挑战,如对于这些酶的催化机制认识不足且缺乏高通量的筛选方法.酶的理性及半理性改造方法将序列、结构、功能等信息作为基础,从而可以增加有利突变的概率,大大降低实验量.酶活性位点内的氨基酸取代有可能提高催化活性,但需要非常精确的构象调控才能在热力学灵活性和结构刚性之间保持一定的平衡[86].利用计算和实验相结合的方法来深入了解途径酶催化的途径,并以此指导蛋白质(半)理性设计工作,尤其是提升P450酶在底物识别和催化效率上的适应性.目前,在设计植物宿主途径方面也取得了显著的突破,这些突破有望解决紫杉醇生物合成中P450酶化学催化的挑战[71]. ...
Unraveling the multispecificity and catalytic promiscuity of taxadiene monooxygenase
3
2014
... 长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... 目前,针对T5αOH的催化机制研究主要集中在自由基-反弹机制和环氧化机制[31,89].Yadav等[34]推测氧铁基团在C3位、C13位、C20位的竞争性质子提取过程是导致T5αOH氧化产物多样性的原因.Edgar等[31-32]推测紫杉二烯首先被T5αOH催化成不稳定的环氧化合物中间体,随后环氧化物进行非特异性断裂,从而生成包括紫杉二烯-5α-醇在内的多种氧化产物,遵循环氧化机制.与此同时,同分异构体异紫杉二烯可以避免经过环氧化合物断裂过程,依然通过正常的P450酶自由基-反弹机制特异性地生成目标产物紫杉二烯-5α-醇.而Barton等[90]发现紫杉二烯-4(5)-环氧化物对酸敏感,在不同的化学条件可以产生不同的重排产物,尤其是暴露在铁卟啉下时极易发生重排.这对紫杉二烯-4(5)-环氧化物作为合格中间体的角色提出了新的挑战.自从T5αOH于1996年在红豆杉中首次发现,研究人员进行了包括N端修饰、电子传递链优化、核糖体开关调控、静息细胞培养、内质网改造、区室化等一系列改造,并对催化温度、O2、pH、辅因子等条件也进行了大量的优化[61,71].但是在T5αOH酶分子改造方面,目前一直没有重大的突破.Yadav等[34]使用6个P450结构作为模板构建了T5αOH的同源模型,并在此基础上设计了53个突变体,其中有6个突变体,其转化率和T5α-ol选择性方面都有所提高.其中的两个突变体K131R和V374L分别表现出牺牲选择性而提高转化率和牺牲转化率而提高选择性的性质.基于对紫杉醇合成关键基因簇的深度解析,本课题组对喜马拉雅红豆杉来源的CYP725A亚家族候选序列进行了大规模的功能筛选,发现T5αOH生成两个拷贝同工酶T5αOH-1和T5αOH-2,经过实验验证都具有催化紫杉二烯C5位羟基化的功能,然而其催化性能相较于已报道的T5αOH并没有任何改善[41]. ...
... [34]使用6个P450结构作为模板构建了T5αOH的同源模型,并在此基础上设计了53个突变体,其中有6个突变体,其转化率和T5α-ol选择性方面都有所提高.其中的两个突变体K131R和V374L分别表现出牺牲选择性而提高转化率和牺牲转化率而提高选择性的性质.基于对紫杉醇合成关键基因簇的深度解析,本课题组对喜马拉雅红豆杉来源的CYP725A亚家族候选序列进行了大规模的功能筛选,发现T5αOH生成两个拷贝同工酶T5αOH-1和T5αOH-2,经过实验验证都具有催化紫杉二烯C5位羟基化的功能,然而其催化性能相较于已报道的T5αOH并没有任何改善[41]. ...
Oxetane ring formation in taxol biosynthesis is catalyzed by a bifunctional cytochrome P450 enzyme
4
2024
... 长期以来,研究人员认为在所有的羟基化反应中,C5位最先发生羟基化反应,由紫杉二烯- 5α-羟化酶CYP725A4(T5αOH)催化[31].异紫杉二烯可被T5αOH直接催化生成紫杉二烯-5α-醇[taxa-4(20),11(12)-dien-5α-ol,T5α-ol][32].而当底物为紫杉二烯时,T5αOH通过在第5位碳上的羟基化和碳双键的迁移将紫杉二烯转化为T5α-ol[33],还可以催化生成OCT[5(12)-oxa-3(11)-cyclotaxane]、iso-OCT[5(11)-oxa-3(11)-cyclotaxane]等多种单氧化以及双氧化副产物[31,34].随后,由于P450酶和酰基转移酶严重的催化杂泛性,尤其对于氧杂环丁烷的形成过程鉴定出了多种不同的催化机制,不同研究团队对巴卡亭Ⅲ合成途径的具体反应顺序进行了不同的推测.2023年10月4日,德国马克斯-普朗克研究所分子生理学研究中心的Zhang Youjun和Alisdair R. Fernie等[12]发现了一种新的C4β-C20环氧化酶(TB328),该酶作为α-酮戊二酸/Fe(Ⅱ)-依赖的双加氧酶(ODD酶)催化C4β- C20的环氧杂丁烷环的形成,研究人员通过dropout实验推测这是紫杉二烯氧化的第一步反应.但由于无法大量分离任何环氧化酶产物进行核磁共振(NMR)结构鉴定,这种环氧酶的催化过程仍然是推测性的.2024年,Zhao等[35]发现CYP725A4可以通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.2024年1月26日,闫建斌团队与雷晓光团队等[13]合作通过在烟草底盘对58个关键候选基因进行酶活测试,鉴定了参与紫杉醇氧杂环丁烷合成的双功能P450酶,命名为TOT1,在红豆杉细胞中敲低TOT1基因表达量,可以显著降低巴卡亭Ⅲ和紫杉醇的生物合成.2024年3月15日,周志华课题组[30]也报道了与TOT1具有相似度97%的P450酶CYP725A55,可以通过同样的级联氧化协同酰基重排机制催化氧杂环丁烷环的形成. ...
... 2024年丹麦哥本哈根大学Sotirios C. Kampranis团队[35]发表了题为《双功能细胞色素P450酶催化紫杉醇生物合成中氧杂环丁烷的形成》的文章,也对现有的研究大多推测“紫杉二烯-5α-醇的C5位先被乙酰化,再通过几步氧化实现环氧化”的过程提出了挑战,研究人员发现红豆杉属植物中存在氧杂环丁烷没有乙酰化的紫杉烷类化合物,因此提出了先成环再乙酰化的推测.在此文中研究人员通过基因组和转录组分析筛选候选基因,并利用酵母和本氏烟草两个不同的表达体系及产物结构解析进行验证,最终确定了催化氧杂环丁烷形成的酶为CYP725A4(即T5αOH),研究人员发现CYP725A4能够催化紫杉二烯前体不同位点氧化,可能通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.此外,该文章也证实了从紫杉二烯和异紫杉二烯起始均可以生成目标环氧化中间产物,这表明紫杉醇可能存在多条不同分支的生物合成路线[35]. ...
... [35]. ...
... 尤其值得一提的是2023年Alisdair R. Fernie课题组[52]通过转录组学、细胞生物学、代谢组学和单酶缺失实验相结合的方法鉴定了在底盘生物合成紫杉醇所需的最小基因集,筛选到了长时间缺失的C4β-C20环氧化酶、紫杉烷1β-羟化酶(T1βOH)、紫杉烷9α-羟化酶(T9αOH)、紫杉烷9α-氧化酶和苯丙氨酰-CoA连接酶(PCL)进一步完善了紫杉醇的生物合成途径.几乎同时期,Sotirios C. Kampranis团队[35]发现CYP725A4能够催化紫杉二烯前体不同位点氧化,可能通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.此外,研究人员也证实了从紫杉二烯和异紫杉二烯起始均可以生成目标环氧化中间产物.近期,闫建斌团队[13]和周志华团队[30]新鉴定了参与紫杉烷氧杂环丁烷合成的关键酶TOT及同工酶P450酶CYP725A55,三种不同催化机制进一步反映了紫杉醇生物合成途径的复杂性.紫杉醇的生物合成途径可能是一个代谢网络,而不仅仅是一个线性途径,中间催化过程还有待于深入分析.目前紫杉醇的生物合成通路解析与催化机制分析仍然受限于催化反应的复杂性和紫杉醇中间底物的严重不足. ...
Biosynthesis of paclitaxel using synthetic biology
4
2022
... 先前研究中对于紫杉二烯C5位羟基化的后续反应有两种推测的途径[36]:途径一是Taxa-4(20),11(12)-dien-5α-ol在5α羟基上继续发生乙酰化反应,由紫杉二烯-5α-醇-O-乙酰转移酶(taxadiene-5α-ol-O-acetyl transferase, TAT)催化形成taxa-4(20),11(12)-dien-5α-yl-acetate,再被紫杉烷-10β-羟化酶(T10βOH)催化C10位上发生羟基化,合成taxa-4(20),11(12)-dien-5α-acetoxy-10β-ol.此过程中的TAT同样是一种多功能酶,包括香叶基香叶醇(geranylgeraniol, GGOH)和法尼醇(farnesol)在内的几种类异戊二烯都可以作为该酶的底物,从而生成各类乙酰化产物[18,37].二是CYP725A家族的紫杉烷13α-羟化酶(T13αOH)催化中间体taxa-4(20),11(12)-dien-5α-ol的C13位发生羟基化反应,生成taxa-4(20),11(12)-dien-5α,13α-diol.接下来,在其他位置上继续发生羟基化修饰,对于其他位点C1、C2、C7、C9位发生的羟基化作用以及C2、C5、C10位羟基上的酰基化和C9位的酮基化发生的顺序尚不明确.戴均贵等[38]发现银杏悬浮细胞可催化2α,5α,10β,14β-四乙酰氧基-紫杉-4(20),11(12)-二烯(sinenxan A,SIA)形成9-羟基-SIA,这说明可以从银杏中寻找C9羟化酶,从而在红豆杉中找到相应的同源基因. ...
... 在近期的研究中,德国马克斯-普朗克研究所的Alisdair R. Fernie等[12]认为ODD酶TB328和P450酶T5αOH协同作用首先形成了4β-C20-环氧化-紫杉二烯-4α-醇,随后进行C9的羟基化和氧化反应,并通过相同的瞬时转化技术和dropout实验鉴定了紫杉烷-1β-羟化酶(T1βOH)、紫杉烷-9α-羟化酶(T9αOH)和紫杉烷9α-氧化酶,接下来的反应顺序尚未确认.随后,中间体2-debenzoyltaxane以区域特异性方式被紫杉烷-2α-O-苯甲酰转移酶(taxane-2α-O-benzoyl transferase,TBT)苯甲酰化,生成10-去乙酰巴卡亭Ⅲ(10-deacetyl baccatin Ⅲ,10-DAB),然后发生紫杉烷环母核上的最后一步修饰反应,10-去乙酰巴卡亭Ⅲ-10-O-乙酰基转移酶(10-deacetylbaccatin Ⅲ-10-O-acetyl transferase,DBAT)催化10-去乙酰巴卡亭Ⅲ在C10位的羟基进一步乙酰化[36],形成巴卡亭Ⅲ.斯坦福大学Sattely课题组[39]通过对紫杉醇合成早期途径在烟草体系进行重构,发现紫杉二烯-5α-醇被紫杉醇合成途径早期催化元件以TAT-T10βOH-DBAT-T13αOH的顺序或者T13αOH-TAT-T10βOH-DBAT的顺序催化形成5α,10β-diacetoxy-13α-ol进行后续反应,最终生成5α,10β-diacetoxy-13-one中间体.闫建斌和周志华课题组基于新发现的氧杂环丁烷合成酶分别在烟草和酿酒酵母中构建了巴卡亭Ⅲ和5α,10β-diacetoxy-13-one的生物合成途径,另外,两个团队都鉴定出了负责紫杉烷C9位羟基化的酶T9αH1[13,30].值得一提的是,周志华团队通过底物饲喂实验推测紫杉二烯-5α-醇是首先通过C13位羟基化进入的紫杉醇合成途径,对先进行C5位乙酰化后进行C10位羟基化的路线解析提出了挑战[30].总之,虽然不同研究团队对于巴卡亭Ⅲ合成途径的催化顺序得到不同结论,近期关于氧杂环丁烷环的研究结果、新功能酶的发现和紫杉烷类化合物异源合成途径的构建进一步丰富了人们对于紫杉醇P450酶催化功能多样性的认知. ...
... 此外,在红豆杉植物体内,环化后的紫杉二烯母核在形成之后,将会沿多个分支途径通过其他位置的羟基化或酰化合成其他的紫杉烷类化合物.Jennewein等[28]鉴定出存在于紫杉烷合成另一条分支途径中的P450单加氧酶的紫杉烷-14β-羟化酶(T14βOH).研究表明,T14βOH表达与紫杉醇的含量呈负相关,这进一步说明红豆杉中紫杉烷类物质的合成途径可能有多条线路,形成一个复杂的合成网络,在三环二萜结构母核形成之后,通过各类酶的修饰,从而合成多种紫杉烷类化合物.后续研究显示,除了从GGPP到紫杉醇所必需的19步反应之外,还有几条经过其他羟基化和酰基化反应形成非有效紫杉烷的支路途径,这也是导致其中间副产物众多的一个主要原因[36]. ...
... 紫杉醇作为目前已发现的最优秀的天然抗癌药物,其合成经历了多元化发展的阶段.目前应用最多的依然是半合成法[6],来自Bristol Meyers Squibb(美国百时美施贵宝公司)的市售紫杉醇是通过使用Holton-Ojima方法,以10-去乙酰巴卡亭Ⅲ为前体,紫杉醇的产率可达到90%.但半合成前体的来源(10-去乙酰巴卡亭Ⅲ或者巴卡亭Ⅲ)仍然是通过珍稀植物红豆杉植物提取的方法获得,10-去乙酰巴卡亭Ⅲ或者巴卡亭Ⅲ的生产受到严重的限制,需要通过异源合成来进行大量生产优化.内生真菌培养方法得到了一定的研究,但其产量低、不稳定,没有进一步工业化的相关报道[36,95].植物细胞培养技术提供了另一种在工业水平可持续生产紫杉醇的方法[96],Phyton使用专有的植物细胞发酵(PCF®)技术生产紫杉醇,直接从悬浮细胞生产天然药物成分[97].近年来,不同品种的红豆杉植物资源大规模基因组测序与解析工作相继完成,合成生物学的迅速发展为紫杉醇的异源合成创造了良好的条件. ...
Optimizing the biosynthesis of oxygenated and acetylated taxol precursors in Saccharomyces cerevisiae using advanced bioprocessing strategies
4
2021
... 先前研究中对于紫杉二烯C5位羟基化的后续反应有两种推测的途径[36]:途径一是Taxa-4(20),11(12)-dien-5α-ol在5α羟基上继续发生乙酰化反应,由紫杉二烯-5α-醇-O-乙酰转移酶(taxadiene-5α-ol-O-acetyl transferase, TAT)催化形成taxa-4(20),11(12)-dien-5α-yl-acetate,再被紫杉烷-10β-羟化酶(T10βOH)催化C10位上发生羟基化,合成taxa-4(20),11(12)-dien-5α-acetoxy-10β-ol.此过程中的TAT同样是一种多功能酶,包括香叶基香叶醇(geranylgeraniol, GGOH)和法尼醇(farnesol)在内的几种类异戊二烯都可以作为该酶的底物,从而生成各类乙酰化产物[18,37].二是CYP725A家族的紫杉烷13α-羟化酶(T13αOH)催化中间体taxa-4(20),11(12)-dien-5α-ol的C13位发生羟基化反应,生成taxa-4(20),11(12)-dien-5α,13α-diol.接下来,在其他位置上继续发生羟基化修饰,对于其他位点C1、C2、C7、C9位发生的羟基化作用以及C2、C5、C10位羟基上的酰基化和C9位的酮基化发生的顺序尚不明确.戴均贵等[38]发现银杏悬浮细胞可催化2α,5α,10β,14β-四乙酰氧基-紫杉-4(20),11(12)-二烯(sinenxan A,SIA)形成9-羟基-SIA,这说明可以从银杏中寻找C9羟化酶,从而在红豆杉中找到相应的同源基因. ...
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... Nowrouzi等[59]通过使用GAL1启动子和带有标签的多拷贝TS基因,得到了菌株LRS5.紫杉二烯的产量提高了22倍,在30 ℃条件下达到了(57±3)mg/L,20 ℃的低温下,紫杉二烯产量可达到129 mg/L.同一研究小组的Walls等[37]在LRS5的基础上,添加了编码T5αOH、同源CPR的基因序列以及从T. cuspidata获得的TAT基因,得到了LRS6菌株.研究者通过对发酵工艺的改进和对pH的控制,将氧化紫杉烷类产物的产量提高了2.7倍,达到78 mg/L.后续,Nowrouzi等[61]又在酿酒酵母细胞中优化了T5αOH在酶和全细胞水平上的高活性条件,发现T5αOH和CPR相互作用的解偶联可能介导酿酒酵母中氧化紫杉烷的形成,并且通过构建融合蛋白来提高T5α-ol产量,利用静息细胞培养测定在10 mL小规模下产生了最高的氧化紫杉烷产量[约(361.4±52.4)mg/L],其中T5α-ol的产量达到(38.1±8.4)mg/L.最近,Xu等[62]利用细胞内源MVA途径,通过将TS与SUMO融合来增加其可溶性表达,并采取推拉式策略来增加前体供给,降低旁路代谢.然后过表达tHMG1、GGS1和TS三个基因,分批补料发酵得到紫杉二烯的产量为101.4 mg/L.Walls等[37]通过增加培养物营养供应解决营养胁迫的影响,最后,在1 L生物反应器的最佳培养条件下,培养95 h时获得紫杉二烯的最高产量为(71±8)mg/L,T5αOH的主要产物iso-OCT、OCT和T5α-ol的产量分别为(16±3)mg/L、(44±3)mg/L和(42±4)mg/L,TAT的产物T5α-Ac的最高产量为(21±0.3)mg/L,几乎比之前的最高水平高出6倍.然而,由于T5αOH在异源宿主中表达能力较差,并且催化活性较低,其主要催化产物是OCT及其异构体iso-OCT,最终仅能够将不到10%的紫杉二烯前体转化为目标产物T5α-ol.与在大肠杆菌细胞中一样,酵母细胞中P450酶的高活性表达在动力学上依赖于细胞内源NADPH的有效供应.此外,酵母细胞中副产物和其他内源代谢物的产生也对紫杉醇的异源生产造成干扰. ...
... [37]通过增加培养物营养供应解决营养胁迫的影响,最后,在1 L生物反应器的最佳培养条件下,培养95 h时获得紫杉二烯的最高产量为(71±8)mg/L,T5αOH的主要产物iso-OCT、OCT和T5α-ol的产量分别为(16±3)mg/L、(44±3)mg/L和(42±4)mg/L,TAT的产物T5α-Ac的最高产量为(21±0.3)mg/L,几乎比之前的最高水平高出6倍.然而,由于T5αOH在异源宿主中表达能力较差,并且催化活性较低,其主要催化产物是OCT及其异构体iso-OCT,最终仅能够将不到10%的紫杉二烯前体转化为目标产物T5α-ol.与在大肠杆菌细胞中一样,酵母细胞中P450酶的高活性表达在动力学上依赖于细胞内源NADPH的有效供应.此外,酵母细胞中副产物和其他内源代谢物的产生也对紫杉醇的异源生产造成干扰. ...
Molecular cloning and characterization of a cytochrome P450 taxoid 9α-hydroxylase in Ginkgo biloba cells
1
2014
... 先前研究中对于紫杉二烯C5位羟基化的后续反应有两种推测的途径[36]:途径一是Taxa-4(20),11(12)-dien-5α-ol在5α羟基上继续发生乙酰化反应,由紫杉二烯-5α-醇-O-乙酰转移酶(taxadiene-5α-ol-O-acetyl transferase, TAT)催化形成taxa-4(20),11(12)-dien-5α-yl-acetate,再被紫杉烷-10β-羟化酶(T10βOH)催化C10位上发生羟基化,合成taxa-4(20),11(12)-dien-5α-acetoxy-10β-ol.此过程中的TAT同样是一种多功能酶,包括香叶基香叶醇(geranylgeraniol, GGOH)和法尼醇(farnesol)在内的几种类异戊二烯都可以作为该酶的底物,从而生成各类乙酰化产物[18,37].二是CYP725A家族的紫杉烷13α-羟化酶(T13αOH)催化中间体taxa-4(20),11(12)-dien-5α-ol的C13位发生羟基化反应,生成taxa-4(20),11(12)-dien-5α,13α-diol.接下来,在其他位置上继续发生羟基化修饰,对于其他位点C1、C2、C7、C9位发生的羟基化作用以及C2、C5、C10位羟基上的酰基化和C9位的酮基化发生的顺序尚不明确.戴均贵等[38]发现银杏悬浮细胞可催化2α,5α,10β,14β-四乙酰氧基-紫杉-4(20),11(12)-二烯(sinenxan A,SIA)形成9-羟基-SIA,这说明可以从银杏中寻找C9羟化酶,从而在红豆杉中找到相应的同源基因. ...
Reconstitution of early paclitaxel biosynthetic network
3
2024
... 在近期的研究中,德国马克斯-普朗克研究所的Alisdair R. Fernie等[12]认为ODD酶TB328和P450酶T5αOH协同作用首先形成了4β-C20-环氧化-紫杉二烯-4α-醇,随后进行C9的羟基化和氧化反应,并通过相同的瞬时转化技术和dropout实验鉴定了紫杉烷-1β-羟化酶(T1βOH)、紫杉烷-9α-羟化酶(T9αOH)和紫杉烷9α-氧化酶,接下来的反应顺序尚未确认.随后,中间体2-debenzoyltaxane以区域特异性方式被紫杉烷-2α-O-苯甲酰转移酶(taxane-2α-O-benzoyl transferase,TBT)苯甲酰化,生成10-去乙酰巴卡亭Ⅲ(10-deacetyl baccatin Ⅲ,10-DAB),然后发生紫杉烷环母核上的最后一步修饰反应,10-去乙酰巴卡亭Ⅲ-10-O-乙酰基转移酶(10-deacetylbaccatin Ⅲ-10-O-acetyl transferase,DBAT)催化10-去乙酰巴卡亭Ⅲ在C10位的羟基进一步乙酰化[36],形成巴卡亭Ⅲ.斯坦福大学Sattely课题组[39]通过对紫杉醇合成早期途径在烟草体系进行重构,发现紫杉二烯-5α-醇被紫杉醇合成途径早期催化元件以TAT-T10βOH-DBAT-T13αOH的顺序或者T13αOH-TAT-T10βOH-DBAT的顺序催化形成5α,10β-diacetoxy-13α-ol进行后续反应,最终生成5α,10β-diacetoxy-13-one中间体.闫建斌和周志华课题组基于新发现的氧杂环丁烷合成酶分别在烟草和酿酒酵母中构建了巴卡亭Ⅲ和5α,10β-diacetoxy-13-one的生物合成途径,另外,两个团队都鉴定出了负责紫杉烷C9位羟基化的酶T9αH1[13,30].值得一提的是,周志华团队通过底物饲喂实验推测紫杉二烯-5α-醇是首先通过C13位羟基化进入的紫杉醇合成途径,对先进行C5位乙酰化后进行C10位羟基化的路线解析提出了挑战[30].总之,虽然不同研究团队对于巴卡亭Ⅲ合成途径的催化顺序得到不同结论,近期关于氧杂环丁烷环的研究结果、新功能酶的发现和紫杉烷类化合物异源合成途径的构建进一步丰富了人们对于紫杉醇P450酶催化功能多样性的认知. ...
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... 2023年,马克斯-普朗克所研究人员通过转录组学、细胞生物学、代谢组学和单酶缺失实验相结合的方法鉴定了在底盘生物合成紫杉醇所需的最小基因集.通过在本氏烟草中瞬时表达截短质体定位信号的二萜合成酶(nsTXS)、香叶基香叶基磷酸合成酶(nsGGPS)基因以及胞质内甲羟戊酸依赖的类异戊二烯途径的限速酶3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)基因,构建紫杉二烯的生物合成途径,每克鲜重的紫杉二烯含量约为100 µg.该团队利用先前表征过的酶以及新鉴定的环氧酶、紫杉烷1β-羟化酶(T1βOH)、紫杉烷9α-羟化酶(T9αOH)、紫杉烷9α-氧化酶和苯丙氨酰-CoA连接酶(PCL),成功地合成了关键中间体巴卡亭Ⅲ,并且在本氏烟草里成功地实现了巴卡亭Ⅲ到紫杉醇的合成[12].值得注意的是,新鉴定的C4β-C20环氧酶作为一种α-酮戊二酸依赖的双加氧酶可以克服紫杉醇代谢工程的第一个合成瓶颈.烟草植物底盘中的辅因子或者伴侣蛋白可能辅助了C4β-C20环氧酶的功能表达,进而助力在烟草细胞中成功合成巴卡亭Ⅲ,而在大肠杆菌和酿酒酵母中并未实现功能性表达.虽然,相较于紫杉醇天然的合成环境,此研究合成的10-去乙酰巴卡亭Ⅲ和巴卡亭Ⅲ产量较低,但是这些结果表明在异源体系中可以合成10-去乙酰巴卡亭Ⅲ和巴卡亭Ⅲ,已经为它的生物合成定义了一个完整的最小途径.此外,研究人员发现这一途径可能是一个代谢网络,而不是一个线性途径.2024年1月,闫建斌团队与雷晓光团队[13]合作发现了更为精简的巴卡亭Ⅲ合成通路,研究人员通过瞬时表达TOT和T9αH-1与其他7个已知合成基因(TXS、T5αOH、T13αOH、T2αOH、T7βOH、TAT和TBT),在烟草中成功鉴定到了巴卡亭Ⅲ的生成.通过进一步的生化研究分析,发现这些核心基因受植物激素茉莉素共同调控,表现出相似的表达模式和强相关性,表明这些基因在细胞中受到紧密的协同调控.亚细胞定位实验表明起始底物GGPP在叶绿体中经过TXS酶的催化转化为紫杉二烯,随后紫杉二烯通过质体-内质网的接触点被转移到细胞质中,在此过程中,六个内质网锚定的氧化酶(T2αOH、T5αOH、T7βOH、T9αOH、T13αOH和TOT)与两个细胞质定位的酰基转移酶(TAT和TBT)协同作用,最终生成巴卡亭Ⅲ.Elizabeth S. Sattely课题组[39]重构紫杉醇早期生物合成网络,在这里对T5αOH的四种新产物进行了结构表征,其中许多产物似乎是对初级单氧化产物的过度氧化.通过调节T5αOH表达的启动子强度,这些副产物的水平降低,同时紫杉二烯-5α-醇的积累增加了4倍.该工程系统能够重建六步生物合成途径,以生产可分离的5α,10β-二乙酰氧基-紫杉二烯- 13α-醇.通过对紫杉醇生物合成网络的工程化设计,表明红豆杉基因可以协调作用于关键的早期紫杉醇中间体的生物合成生产,并为发现剩余的生物合成基因提供了重要的平台. ...
The Taxus genome provides insights into paclitaxel biosynthesis
2
2021
... 历经了数十年研究,虽然紫杉醇合成通路的相关催化元件逐渐得到鉴定,但是由于紫杉醇合成涉及复杂的多酶催化,且副产物众多,中间体结构匮乏,其关键催化机制和合成途径的反应顺序至今尚未被完全解析.近期,中国研究团队先后公布了南方红豆杉[40]、喜马拉雅红豆杉[41]和云南红豆杉[42]的基因组信息,对紫杉醇合成途径起源进化机制和关键基因簇进行了系统研究,有助于解答紫杉醇合成途径的形成和调控等关键科学问题.目前已克隆的红豆杉来源的紫杉醇合成羟化酶被归为CYP725A亚家族[41],研究人员通过对南方红豆杉(Taxus mairei)基因组分析揭示了细胞色素P450家族的基因组分布和调控规律,发现了紫杉醇合成基因在红豆杉9号染色体上的聚集分布现象,并通过建立基因间的共调控网络获得了17个CYP725A基因、3个转移酶和10个转录因子[40].此外,通过对喜马拉雅红豆杉(Taxus wallichiana)进行染色体水平的全基因组测序,解析了红豆杉中生物合成紫杉醇的关键基因簇,获得了31个P450酶候选基因,同时在此基因簇上鉴定出了TS与T5αOH的同工酶TS-2和T5αOH-2,并发现基因串联重复是红豆杉中参与紫杉醇合成的基因家族进化的主要驱动力,为完全解析紫杉醇生物合成途径提供了重要遗传资源[41].在对云南红豆杉(Taxus yunnanensis)基因组解析中发现参与紫杉醇合成的基因簇主要位于12号染色体上,并且紫杉醇合成相关的羟化酶基因家族表现出显著的扩张,这为紫杉醇合成途径的形成奠定良好基础[42].相关基因组学研究将深化人类对于紫杉醇生物合成途径及其遗传基础的理解,有助于解答裸子植物基因组进化领域的关键科学问题,所筛选和鉴定的候选基因以及转录因子为紫杉醇合成生物学研究提供了丰富的遗传资源和靶标,有助于加快紫杉醇异源合成的设计和应用. ...
... [40].此外,通过对喜马拉雅红豆杉(Taxus wallichiana)进行染色体水平的全基因组测序,解析了红豆杉中生物合成紫杉醇的关键基因簇,获得了31个P450酶候选基因,同时在此基因簇上鉴定出了TS与T5αOH的同工酶TS-2和T5αOH-2,并发现基因串联重复是红豆杉中参与紫杉醇合成的基因家族进化的主要驱动力,为完全解析紫杉醇生物合成途径提供了重要遗传资源[41].在对云南红豆杉(Taxus yunnanensis)基因组解析中发现参与紫杉醇合成的基因簇主要位于12号染色体上,并且紫杉醇合成相关的羟化酶基因家族表现出显著的扩张,这为紫杉醇合成途径的形成奠定良好基础[42].相关基因组学研究将深化人类对于紫杉醇生物合成途径及其遗传基础的理解,有助于解答裸子植物基因组进化领域的关键科学问题,所筛选和鉴定的候选基因以及转录因子为紫杉醇合成生物学研究提供了丰富的遗传资源和靶标,有助于加快紫杉醇异源合成的设计和应用. ...
Chromosome-level genome of Himalayan yew provides insights into the origin and evolution of the paclitaxel biosynthetic pathway
4
2021
... 历经了数十年研究,虽然紫杉醇合成通路的相关催化元件逐渐得到鉴定,但是由于紫杉醇合成涉及复杂的多酶催化,且副产物众多,中间体结构匮乏,其关键催化机制和合成途径的反应顺序至今尚未被完全解析.近期,中国研究团队先后公布了南方红豆杉[40]、喜马拉雅红豆杉[41]和云南红豆杉[42]的基因组信息,对紫杉醇合成途径起源进化机制和关键基因簇进行了系统研究,有助于解答紫杉醇合成途径的形成和调控等关键科学问题.目前已克隆的红豆杉来源的紫杉醇合成羟化酶被归为CYP725A亚家族[41],研究人员通过对南方红豆杉(Taxus mairei)基因组分析揭示了细胞色素P450家族的基因组分布和调控规律,发现了紫杉醇合成基因在红豆杉9号染色体上的聚集分布现象,并通过建立基因间的共调控网络获得了17个CYP725A基因、3个转移酶和10个转录因子[40].此外,通过对喜马拉雅红豆杉(Taxus wallichiana)进行染色体水平的全基因组测序,解析了红豆杉中生物合成紫杉醇的关键基因簇,获得了31个P450酶候选基因,同时在此基因簇上鉴定出了TS与T5αOH的同工酶TS-2和T5αOH-2,并发现基因串联重复是红豆杉中参与紫杉醇合成的基因家族进化的主要驱动力,为完全解析紫杉醇生物合成途径提供了重要遗传资源[41].在对云南红豆杉(Taxus yunnanensis)基因组解析中发现参与紫杉醇合成的基因簇主要位于12号染色体上,并且紫杉醇合成相关的羟化酶基因家族表现出显著的扩张,这为紫杉醇合成途径的形成奠定良好基础[42].相关基因组学研究将深化人类对于紫杉醇生物合成途径及其遗传基础的理解,有助于解答裸子植物基因组进化领域的关键科学问题,所筛选和鉴定的候选基因以及转录因子为紫杉醇合成生物学研究提供了丰富的遗传资源和靶标,有助于加快紫杉醇异源合成的设计和应用. ...
... [41],研究人员通过对南方红豆杉(Taxus mairei)基因组分析揭示了细胞色素P450家族的基因组分布和调控规律,发现了紫杉醇合成基因在红豆杉9号染色体上的聚集分布现象,并通过建立基因间的共调控网络获得了17个CYP725A基因、3个转移酶和10个转录因子[40].此外,通过对喜马拉雅红豆杉(Taxus wallichiana)进行染色体水平的全基因组测序,解析了红豆杉中生物合成紫杉醇的关键基因簇,获得了31个P450酶候选基因,同时在此基因簇上鉴定出了TS与T5αOH的同工酶TS-2和T5αOH-2,并发现基因串联重复是红豆杉中参与紫杉醇合成的基因家族进化的主要驱动力,为完全解析紫杉醇生物合成途径提供了重要遗传资源[41].在对云南红豆杉(Taxus yunnanensis)基因组解析中发现参与紫杉醇合成的基因簇主要位于12号染色体上,并且紫杉醇合成相关的羟化酶基因家族表现出显著的扩张,这为紫杉醇合成途径的形成奠定良好基础[42].相关基因组学研究将深化人类对于紫杉醇生物合成途径及其遗传基础的理解,有助于解答裸子植物基因组进化领域的关键科学问题,所筛选和鉴定的候选基因以及转录因子为紫杉醇合成生物学研究提供了丰富的遗传资源和靶标,有助于加快紫杉醇异源合成的设计和应用. ...
... [41].在对云南红豆杉(Taxus yunnanensis)基因组解析中发现参与紫杉醇合成的基因簇主要位于12号染色体上,并且紫杉醇合成相关的羟化酶基因家族表现出显著的扩张,这为紫杉醇合成途径的形成奠定良好基础[42].相关基因组学研究将深化人类对于紫杉醇生物合成途径及其遗传基础的理解,有助于解答裸子植物基因组进化领域的关键科学问题,所筛选和鉴定的候选基因以及转录因子为紫杉醇合成生物学研究提供了丰富的遗传资源和靶标,有助于加快紫杉醇异源合成的设计和应用. ...
... 目前,针对T5αOH的催化机制研究主要集中在自由基-反弹机制和环氧化机制[31,89].Yadav等[34]推测氧铁基团在C3位、C13位、C20位的竞争性质子提取过程是导致T5αOH氧化产物多样性的原因.Edgar等[31-32]推测紫杉二烯首先被T5αOH催化成不稳定的环氧化合物中间体,随后环氧化物进行非特异性断裂,从而生成包括紫杉二烯-5α-醇在内的多种氧化产物,遵循环氧化机制.与此同时,同分异构体异紫杉二烯可以避免经过环氧化合物断裂过程,依然通过正常的P450酶自由基-反弹机制特异性地生成目标产物紫杉二烯-5α-醇.而Barton等[90]发现紫杉二烯-4(5)-环氧化物对酸敏感,在不同的化学条件可以产生不同的重排产物,尤其是暴露在铁卟啉下时极易发生重排.这对紫杉二烯-4(5)-环氧化物作为合格中间体的角色提出了新的挑战.自从T5αOH于1996年在红豆杉中首次发现,研究人员进行了包括N端修饰、电子传递链优化、核糖体开关调控、静息细胞培养、内质网改造、区室化等一系列改造,并对催化温度、O2、pH、辅因子等条件也进行了大量的优化[61,71].但是在T5αOH酶分子改造方面,目前一直没有重大的突破.Yadav等[34]使用6个P450结构作为模板构建了T5αOH的同源模型,并在此基础上设计了53个突变体,其中有6个突变体,其转化率和T5α-ol选择性方面都有所提高.其中的两个突变体K131R和V374L分别表现出牺牲选择性而提高转化率和牺牲转化率而提高选择性的性质.基于对紫杉醇合成关键基因簇的深度解析,本课题组对喜马拉雅红豆杉来源的CYP725A亚家族候选序列进行了大规模的功能筛选,发现T5αOH生成两个拷贝同工酶T5αOH-1和T5αOH-2,经过实验验证都具有催化紫杉二烯C5位羟基化的功能,然而其催化性能相较于已报道的T5αOH并没有任何改善[41]. ...
Taxus yunnanensis genome offers insights into gymnosperm phylogeny and taxol production
2
2021
... 历经了数十年研究,虽然紫杉醇合成通路的相关催化元件逐渐得到鉴定,但是由于紫杉醇合成涉及复杂的多酶催化,且副产物众多,中间体结构匮乏,其关键催化机制和合成途径的反应顺序至今尚未被完全解析.近期,中国研究团队先后公布了南方红豆杉[40]、喜马拉雅红豆杉[41]和云南红豆杉[42]的基因组信息,对紫杉醇合成途径起源进化机制和关键基因簇进行了系统研究,有助于解答紫杉醇合成途径的形成和调控等关键科学问题.目前已克隆的红豆杉来源的紫杉醇合成羟化酶被归为CYP725A亚家族[41],研究人员通过对南方红豆杉(Taxus mairei)基因组分析揭示了细胞色素P450家族的基因组分布和调控规律,发现了紫杉醇合成基因在红豆杉9号染色体上的聚集分布现象,并通过建立基因间的共调控网络获得了17个CYP725A基因、3个转移酶和10个转录因子[40].此外,通过对喜马拉雅红豆杉(Taxus wallichiana)进行染色体水平的全基因组测序,解析了红豆杉中生物合成紫杉醇的关键基因簇,获得了31个P450酶候选基因,同时在此基因簇上鉴定出了TS与T5αOH的同工酶TS-2和T5αOH-2,并发现基因串联重复是红豆杉中参与紫杉醇合成的基因家族进化的主要驱动力,为完全解析紫杉醇生物合成途径提供了重要遗传资源[41].在对云南红豆杉(Taxus yunnanensis)基因组解析中发现参与紫杉醇合成的基因簇主要位于12号染色体上,并且紫杉醇合成相关的羟化酶基因家族表现出显著的扩张,这为紫杉醇合成途径的形成奠定良好基础[42].相关基因组学研究将深化人类对于紫杉醇生物合成途径及其遗传基础的理解,有助于解答裸子植物基因组进化领域的关键科学问题,所筛选和鉴定的候选基因以及转录因子为紫杉醇合成生物学研究提供了丰富的遗传资源和靶标,有助于加快紫杉醇异源合成的设计和应用. ...
... [42].相关基因组学研究将深化人类对于紫杉醇生物合成途径及其遗传基础的理解,有助于解答裸子植物基因组进化领域的关键科学问题,所筛选和鉴定的候选基因以及转录因子为紫杉醇合成生物学研究提供了丰富的遗传资源和靶标,有助于加快紫杉醇异源合成的设计和应用. ...
多组学技术在红豆杉研究中的应用
2
2022
... 随着高通量测序技术的发展,众多红豆杉转录组数据已经被公布,截至2024年1月10日,在GenBank中可以搜索到多达1254个转录组数据.基于转录组学分析的研究已经确定了若干参与紫杉醇生物合成途径的候选基因和转录因子[43-44],比较转录组分析也用于进行紫杉烷的组织特异性以及在不同红豆杉品系间积累的分析[45].最近对这些公开可用资源的挖掘已经捕获了多个未知催化元件,包括C4β-C20 epoxidase、T9αOH、PCL[25]和T2′αOH等[12].此外,通过RNA-Seq技术,研究人员也对紫杉醇紫杉烷类的调控机制进行了研究,挖掘出了多个调控紫杉醇生物合成的转录因子,如通过对ERF、bHLH、WRKY、MYC、MYB等转录因子家族进行分析和功能研究,发现上述转录因子能够调控紫杉醇的基因的表达,提高了转基因红豆杉细胞系中紫杉醇的含量[46].这些功能基因及转录因子的发现,对推进基因工程方法合成紫杉醇以及其生物合成的相关调控研究具有重要的指导意义. ...
... 多组学联合分析可从不同角度来获取红豆杉植物和紫杉醇合成途径的动态变化,从而探索紫杉醇生物合成过程的复杂机制.通过转录组学和代谢组学联合分析,有助于解析红豆杉中代谢物合成的表达调控网络及代谢网络,为进一步解析紫杉烷类化合物的生物合成路径奠定基础;通过蛋白质组学和代谢组学进行关联分析,有助于进一步揭示基因表达调控的内在机制[43].Yu等[47]通过运用蛋白组学和代谢组学方法对红豆杉茎干组织进行系统分析,代谢组学揭示了茎组织中代谢产物积累的组织特异性,蛋白质组学鉴定到了紫杉醇生物合成的10个关键酶,并发现韧皮部特异性表达的TmMYB3通过激活紫杉醇生物合成途径中TBT和TS的表达,从而实现对紫杉醇生物合成的调控,对于紫杉醇生物合成的转录调控具有重要作用.该团队通过超高效液相色谱-串联质谱法(UPLC-MS/MS)对四种主要茎组织中紫杉醇、10-脱乙酰基紫杉醇、巴卡亭Ⅲ和10-DAB含量的变化进行了定量分析,定量结果表明紫杉醇和10-DAB在韧皮部中积累最高,BAC主要在髓中积累,DAP主要在皮层和韧皮部积累,木质部中这四种代谢物的含量最低.最近,该团队利用最新的质谱成像技术,绘制了紫杉烷类化合物在红豆杉幼茎中的可视化分布图.此外,该研究指出T14βOH、T5αOH和TS基因主要在内皮层细胞群中表达,T10βOH和DBTNBT基因主要在木质部薄壁细胞群中表达,DBAT基因在外皮层细胞群中表达.基于单细胞表达谱,筛选得到了包括MYB、TEM、RAV、NAC家族成员在内的大量细胞群特异表达转录因子,并预测了它们的下游靶基因.此研究以单细胞水平的分辨率建立了红豆杉幼茎中主要细胞类型的表达图谱,为进一步研究细胞特异的紫杉烷合成调控机制提供了基础[48]. ...
Application of multi-omics technique in Taxus spp. research
2
2022
... 随着高通量测序技术的发展,众多红豆杉转录组数据已经被公布,截至2024年1月10日,在GenBank中可以搜索到多达1254个转录组数据.基于转录组学分析的研究已经确定了若干参与紫杉醇生物合成途径的候选基因和转录因子[43-44],比较转录组分析也用于进行紫杉烷的组织特异性以及在不同红豆杉品系间积累的分析[45].最近对这些公开可用资源的挖掘已经捕获了多个未知催化元件,包括C4β-C20 epoxidase、T9αOH、PCL[25]和T2′αOH等[12].此外,通过RNA-Seq技术,研究人员也对紫杉醇紫杉烷类的调控机制进行了研究,挖掘出了多个调控紫杉醇生物合成的转录因子,如通过对ERF、bHLH、WRKY、MYC、MYB等转录因子家族进行分析和功能研究,发现上述转录因子能够调控紫杉醇的基因的表达,提高了转基因红豆杉细胞系中紫杉醇的含量[46].这些功能基因及转录因子的发现,对推进基因工程方法合成紫杉醇以及其生物合成的相关调控研究具有重要的指导意义. ...
... 多组学联合分析可从不同角度来获取红豆杉植物和紫杉醇合成途径的动态变化,从而探索紫杉醇生物合成过程的复杂机制.通过转录组学和代谢组学联合分析,有助于解析红豆杉中代谢物合成的表达调控网络及代谢网络,为进一步解析紫杉烷类化合物的生物合成路径奠定基础;通过蛋白质组学和代谢组学进行关联分析,有助于进一步揭示基因表达调控的内在机制[43].Yu等[47]通过运用蛋白组学和代谢组学方法对红豆杉茎干组织进行系统分析,代谢组学揭示了茎组织中代谢产物积累的组织特异性,蛋白质组学鉴定到了紫杉醇生物合成的10个关键酶,并发现韧皮部特异性表达的TmMYB3通过激活紫杉醇生物合成途径中TBT和TS的表达,从而实现对紫杉醇生物合成的调控,对于紫杉醇生物合成的转录调控具有重要作用.该团队通过超高效液相色谱-串联质谱法(UPLC-MS/MS)对四种主要茎组织中紫杉醇、10-脱乙酰基紫杉醇、巴卡亭Ⅲ和10-DAB含量的变化进行了定量分析,定量结果表明紫杉醇和10-DAB在韧皮部中积累最高,BAC主要在髓中积累,DAP主要在皮层和韧皮部积累,木质部中这四种代谢物的含量最低.最近,该团队利用最新的质谱成像技术,绘制了紫杉烷类化合物在红豆杉幼茎中的可视化分布图.此外,该研究指出T14βOH、T5αOH和TS基因主要在内皮层细胞群中表达,T10βOH和DBTNBT基因主要在木质部薄壁细胞群中表达,DBAT基因在外皮层细胞群中表达.基于单细胞表达谱,筛选得到了包括MYB、TEM、RAV、NAC家族成员在内的大量细胞群特异表达转录因子,并预测了它们的下游靶基因.此研究以单细胞水平的分辨率建立了红豆杉幼茎中主要细胞类型的表达图谱,为进一步研究细胞特异的紫杉烷合成调控机制提供了基础[48]. ...
Transcriptome analysis provides insights into light condition effect on paclitaxel biosynthesis in yew saplings
1
2022
... 随着高通量测序技术的发展,众多红豆杉转录组数据已经被公布,截至2024年1月10日,在GenBank中可以搜索到多达1254个转录组数据.基于转录组学分析的研究已经确定了若干参与紫杉醇生物合成途径的候选基因和转录因子[43-44],比较转录组分析也用于进行紫杉烷的组织特异性以及在不同红豆杉品系间积累的分析[45].最近对这些公开可用资源的挖掘已经捕获了多个未知催化元件,包括C4β-C20 epoxidase、T9αOH、PCL[25]和T2′αOH等[12].此外,通过RNA-Seq技术,研究人员也对紫杉醇紫杉烷类的调控机制进行了研究,挖掘出了多个调控紫杉醇生物合成的转录因子,如通过对ERF、bHLH、WRKY、MYC、MYB等转录因子家族进行分析和功能研究,发现上述转录因子能够调控紫杉醇的基因的表达,提高了转基因红豆杉细胞系中紫杉醇的含量[46].这些功能基因及转录因子的发现,对推进基因工程方法合成紫杉醇以及其生物合成的相关调控研究具有重要的指导意义. ...
Comparative transcriptome analysis revealed the tissue-specific accumulations of taxanes among three experimental lines of Taxus yunnanensis
1
2018
... 随着高通量测序技术的发展,众多红豆杉转录组数据已经被公布,截至2024年1月10日,在GenBank中可以搜索到多达1254个转录组数据.基于转录组学分析的研究已经确定了若干参与紫杉醇生物合成途径的候选基因和转录因子[43-44],比较转录组分析也用于进行紫杉烷的组织特异性以及在不同红豆杉品系间积累的分析[45].最近对这些公开可用资源的挖掘已经捕获了多个未知催化元件,包括C4β-C20 epoxidase、T9αOH、PCL[25]和T2′αOH等[12].此外,通过RNA-Seq技术,研究人员也对紫杉醇紫杉烷类的调控机制进行了研究,挖掘出了多个调控紫杉醇生物合成的转录因子,如通过对ERF、bHLH、WRKY、MYC、MYB等转录因子家族进行分析和功能研究,发现上述转录因子能够调控紫杉醇的基因的表达,提高了转基因红豆杉细胞系中紫杉醇的含量[46].这些功能基因及转录因子的发现,对推进基因工程方法合成紫杉醇以及其生物合成的相关调控研究具有重要的指导意义. ...
Transcriptome sequencing reveals regulatory mechanisms of taxol synthesis in Taxus wallichiana var. Mairei
1
2019
... 随着高通量测序技术的发展,众多红豆杉转录组数据已经被公布,截至2024年1月10日,在GenBank中可以搜索到多达1254个转录组数据.基于转录组学分析的研究已经确定了若干参与紫杉醇生物合成途径的候选基因和转录因子[43-44],比较转录组分析也用于进行紫杉烷的组织特异性以及在不同红豆杉品系间积累的分析[45].最近对这些公开可用资源的挖掘已经捕获了多个未知催化元件,包括C4β-C20 epoxidase、T9αOH、PCL[25]和T2′αOH等[12].此外,通过RNA-Seq技术,研究人员也对紫杉醇紫杉烷类的调控机制进行了研究,挖掘出了多个调控紫杉醇生物合成的转录因子,如通过对ERF、bHLH、WRKY、MYC、MYB等转录因子家族进行分析和功能研究,发现上述转录因子能够调控紫杉醇的基因的表达,提高了转基因红豆杉细胞系中紫杉醇的含量[46].这些功能基因及转录因子的发现,对推进基因工程方法合成紫杉醇以及其生物合成的相关调控研究具有重要的指导意义. ...
Tissue-specific study across the stem of Taxus media identifies a phloem-specific TmMYB3 involved in the transcriptional regulation of paclitaxel biosynthesis
1
2020
... 多组学联合分析可从不同角度来获取红豆杉植物和紫杉醇合成途径的动态变化,从而探索紫杉醇生物合成过程的复杂机制.通过转录组学和代谢组学联合分析,有助于解析红豆杉中代谢物合成的表达调控网络及代谢网络,为进一步解析紫杉烷类化合物的生物合成路径奠定基础;通过蛋白质组学和代谢组学进行关联分析,有助于进一步揭示基因表达调控的内在机制[43].Yu等[47]通过运用蛋白组学和代谢组学方法对红豆杉茎干组织进行系统分析,代谢组学揭示了茎组织中代谢产物积累的组织特异性,蛋白质组学鉴定到了紫杉醇生物合成的10个关键酶,并发现韧皮部特异性表达的TmMYB3通过激活紫杉醇生物合成途径中TBT和TS的表达,从而实现对紫杉醇生物合成的调控,对于紫杉醇生物合成的转录调控具有重要作用.该团队通过超高效液相色谱-串联质谱法(UPLC-MS/MS)对四种主要茎组织中紫杉醇、10-脱乙酰基紫杉醇、巴卡亭Ⅲ和10-DAB含量的变化进行了定量分析,定量结果表明紫杉醇和10-DAB在韧皮部中积累最高,BAC主要在髓中积累,DAP主要在皮层和韧皮部积累,木质部中这四种代谢物的含量最低.最近,该团队利用最新的质谱成像技术,绘制了紫杉烷类化合物在红豆杉幼茎中的可视化分布图.此外,该研究指出T14βOH、T5αOH和TS基因主要在内皮层细胞群中表达,T10βOH和DBTNBT基因主要在木质部薄壁细胞群中表达,DBAT基因在外皮层细胞群中表达.基于单细胞表达谱,筛选得到了包括MYB、TEM、RAV、NAC家族成员在内的大量细胞群特异表达转录因子,并预测了它们的下游靶基因.此研究以单细胞水平的分辨率建立了红豆杉幼茎中主要细胞类型的表达图谱,为进一步研究细胞特异的紫杉烷合成调控机制提供了基础[48]. ...
Integrated mass spectrometry imaging and single-cell transcriptome atlas strategies provide novel insights into taxoid biosynthesis and transport in Taxus mairei stems
1
2023
... 多组学联合分析可从不同角度来获取红豆杉植物和紫杉醇合成途径的动态变化,从而探索紫杉醇生物合成过程的复杂机制.通过转录组学和代谢组学联合分析,有助于解析红豆杉中代谢物合成的表达调控网络及代谢网络,为进一步解析紫杉烷类化合物的生物合成路径奠定基础;通过蛋白质组学和代谢组学进行关联分析,有助于进一步揭示基因表达调控的内在机制[43].Yu等[47]通过运用蛋白组学和代谢组学方法对红豆杉茎干组织进行系统分析,代谢组学揭示了茎组织中代谢产物积累的组织特异性,蛋白质组学鉴定到了紫杉醇生物合成的10个关键酶,并发现韧皮部特异性表达的TmMYB3通过激活紫杉醇生物合成途径中TBT和TS的表达,从而实现对紫杉醇生物合成的调控,对于紫杉醇生物合成的转录调控具有重要作用.该团队通过超高效液相色谱-串联质谱法(UPLC-MS/MS)对四种主要茎组织中紫杉醇、10-脱乙酰基紫杉醇、巴卡亭Ⅲ和10-DAB含量的变化进行了定量分析,定量结果表明紫杉醇和10-DAB在韧皮部中积累最高,BAC主要在髓中积累,DAP主要在皮层和韧皮部积累,木质部中这四种代谢物的含量最低.最近,该团队利用最新的质谱成像技术,绘制了紫杉烷类化合物在红豆杉幼茎中的可视化分布图.此外,该研究指出T14βOH、T5αOH和TS基因主要在内皮层细胞群中表达,T10βOH和DBTNBT基因主要在木质部薄壁细胞群中表达,DBAT基因在外皮层细胞群中表达.基于单细胞表达谱,筛选得到了包括MYB、TEM、RAV、NAC家族成员在内的大量细胞群特异表达转录因子,并预测了它们的下游靶基因.此研究以单细胞水平的分辨率建立了红豆杉幼茎中主要细胞类型的表达图谱,为进一步研究细胞特异的紫杉烷合成调控机制提供了基础[48]. ...
Engineering Escherichia coli for the synthesis of taxadiene, a key intermediate in the biosynthesis of taxol
2
2001
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
Isoprenoid pathway optimization for taxol precursor overproduction in Escherichia coli
2
2010
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
Analysis of heterologous taxadiene production in K- and B-derived Escherichia coli
1
2012
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
Construction of an Escherichia coli cell factory to synthesize taxadien-5α-ol, the key precursor of anti-cancer drug paclitaxel
3
2022
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... 在最近的研究中,华东理工大学郁惠蕾团队[52]在大肠杆菌中构建异源MVA途径用于从头合成紫杉醇前体,研究团队首先对途径关键酶TS和细胞色素P450氧化还原酶(cytochmme P450 reductase, CPR)进行筛选,并优化T5αOH-CPR融合蛋白之间的linker及菌株发酵的条件,最终氧化紫杉烷产量达到27 mg/L,其中T5α-ol产量达到7 mg/L,较出发菌株分别提高了12倍和23倍.许建和团队[53]在大肠杆菌中融合表达GGPP和TS,紫杉二烯在摇瓶中的产量达到93.5 mg/L.Abdallah等[55]在枯草芽孢杆菌中过表达植物来源的TS基因和一个合成操纵子,该操纵子携带枯草芽孢杆菌自身MEP途径的基因以及IspA基因(编码香叶基和法尼基焦磷酸合成酶),首次实现在枯草芽孢杆菌168中生产紫杉二烯.此外,通过过表达crtE基因(编码GGPPS)以增加GGPP的供应,与仅表达TS并依赖枯草芽孢杆菌先天途径的菌株相比,MEP途径酶以及IspA和GGPPS基因的过表达导致紫杉二烯产量增加83倍.后者工程菌株产生的紫杉二烯总量为17.8 mg/L,表明枯草芽孢杆菌也可作为一个生产紫杉醇的良好平台.接下来,紫杉二烯经过T5αOH催化,进行第一步氧化修饰过程.但因为大肠杆菌中缺乏内膜系统,并且P450的亲脂性N末端会导致其溶解度降低,使得其在大肠杆菌中很难被成功表达[55].Biggs等[54]通过对P450酶的N端修饰,优化与CPR的相互作用,实现了T5αOH在大肠杆菌中的高效表达,含氧紫杉烷的产量达到(570±45)mg/L.Loncaric等[69]在大肠杆菌中转入DBAT,通过添加外源底物10-DAB,成功半合成中间体巴卡亭Ⅲ. ...
... 尤其值得一提的是2023年Alisdair R. Fernie课题组[52]通过转录组学、细胞生物学、代谢组学和单酶缺失实验相结合的方法鉴定了在底盘生物合成紫杉醇所需的最小基因集,筛选到了长时间缺失的C4β-C20环氧化酶、紫杉烷1β-羟化酶(T1βOH)、紫杉烷9α-羟化酶(T9αOH)、紫杉烷9α-氧化酶和苯丙氨酰-CoA连接酶(PCL)进一步完善了紫杉醇的生物合成途径.几乎同时期,Sotirios C. Kampranis团队[35]发现CYP725A4能够催化紫杉二烯前体不同位点氧化,可能通过两步环氧化机制最终形成氧杂环丁烷,这刷新了从前对于CYP725A4氧化产物和催化机理的认知.此外,研究人员也证实了从紫杉二烯和异紫杉二烯起始均可以生成目标环氧化中间产物.近期,闫建斌团队[13]和周志华团队[30]新鉴定了参与紫杉烷氧杂环丁烷合成的关键酶TOT及同工酶P450酶CYP725A55,三种不同催化机制进一步反映了紫杉醇生物合成途径的复杂性.紫杉醇的生物合成途径可能是一个代谢网络,而不仅仅是一个线性途径,中间催化过程还有待于深入分析.目前紫杉醇的生物合成通路解析与催化机制分析仍然受限于催化反应的复杂性和紫杉醇中间底物的严重不足. ...
Facile biosynthesis of taxadiene by a newly constructed Escherichia coli strain fusing enzymes taxadiene synthase and geranylgeranyl pyrophosphate synthase
2
2022
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... 在最近的研究中,华东理工大学郁惠蕾团队[52]在大肠杆菌中构建异源MVA途径用于从头合成紫杉醇前体,研究团队首先对途径关键酶TS和细胞色素P450氧化还原酶(cytochmme P450 reductase, CPR)进行筛选,并优化T5αOH-CPR融合蛋白之间的linker及菌株发酵的条件,最终氧化紫杉烷产量达到27 mg/L,其中T5α-ol产量达到7 mg/L,较出发菌株分别提高了12倍和23倍.许建和团队[53]在大肠杆菌中融合表达GGPP和TS,紫杉二烯在摇瓶中的产量达到93.5 mg/L.Abdallah等[55]在枯草芽孢杆菌中过表达植物来源的TS基因和一个合成操纵子,该操纵子携带枯草芽孢杆菌自身MEP途径的基因以及IspA基因(编码香叶基和法尼基焦磷酸合成酶),首次实现在枯草芽孢杆菌168中生产紫杉二烯.此外,通过过表达crtE基因(编码GGPPS)以增加GGPP的供应,与仅表达TS并依赖枯草芽孢杆菌先天途径的菌株相比,MEP途径酶以及IspA和GGPPS基因的过表达导致紫杉二烯产量增加83倍.后者工程菌株产生的紫杉二烯总量为17.8 mg/L,表明枯草芽孢杆菌也可作为一个生产紫杉醇的良好平台.接下来,紫杉二烯经过T5αOH催化,进行第一步氧化修饰过程.但因为大肠杆菌中缺乏内膜系统,并且P450的亲脂性N末端会导致其溶解度降低,使得其在大肠杆菌中很难被成功表达[55].Biggs等[54]通过对P450酶的N端修饰,优化与CPR的相互作用,实现了T5αOH在大肠杆菌中的高效表达,含氧紫杉烷的产量达到(570±45)mg/L.Loncaric等[69]在大肠杆菌中转入DBAT,通过添加外源底物10-DAB,成功半合成中间体巴卡亭Ⅲ. ...
Overcoming heterologous protein interdependency to optimize P450-mediated taxol precursor synthesis in Escherichia coli
2
2016
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... 在最近的研究中,华东理工大学郁惠蕾团队[52]在大肠杆菌中构建异源MVA途径用于从头合成紫杉醇前体,研究团队首先对途径关键酶TS和细胞色素P450氧化还原酶(cytochmme P450 reductase, CPR)进行筛选,并优化T5αOH-CPR融合蛋白之间的linker及菌株发酵的条件,最终氧化紫杉烷产量达到27 mg/L,其中T5α-ol产量达到7 mg/L,较出发菌株分别提高了12倍和23倍.许建和团队[53]在大肠杆菌中融合表达GGPP和TS,紫杉二烯在摇瓶中的产量达到93.5 mg/L.Abdallah等[55]在枯草芽孢杆菌中过表达植物来源的TS基因和一个合成操纵子,该操纵子携带枯草芽孢杆菌自身MEP途径的基因以及IspA基因(编码香叶基和法尼基焦磷酸合成酶),首次实现在枯草芽孢杆菌168中生产紫杉二烯.此外,通过过表达crtE基因(编码GGPPS)以增加GGPP的供应,与仅表达TS并依赖枯草芽孢杆菌先天途径的菌株相比,MEP途径酶以及IspA和GGPPS基因的过表达导致紫杉二烯产量增加83倍.后者工程菌株产生的紫杉二烯总量为17.8 mg/L,表明枯草芽孢杆菌也可作为一个生产紫杉醇的良好平台.接下来,紫杉二烯经过T5αOH催化,进行第一步氧化修饰过程.但因为大肠杆菌中缺乏内膜系统,并且P450的亲脂性N末端会导致其溶解度降低,使得其在大肠杆菌中很难被成功表达[55].Biggs等[54]通过对P450酶的N端修饰,优化与CPR的相互作用,实现了T5αOH在大肠杆菌中的高效表达,含氧紫杉烷的产量达到(570±45)mg/L.Loncaric等[69]在大肠杆菌中转入DBAT,通过添加外源底物10-DAB,成功半合成中间体巴卡亭Ⅲ. ...
Metabolic engineering of Bacillus subtilis toward taxadiene biosynthesis as the first committed step for taxol production
3
2019
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... 在最近的研究中,华东理工大学郁惠蕾团队[52]在大肠杆菌中构建异源MVA途径用于从头合成紫杉醇前体,研究团队首先对途径关键酶TS和细胞色素P450氧化还原酶(cytochmme P450 reductase, CPR)进行筛选,并优化T5αOH-CPR融合蛋白之间的linker及菌株发酵的条件,最终氧化紫杉烷产量达到27 mg/L,其中T5α-ol产量达到7 mg/L,较出发菌株分别提高了12倍和23倍.许建和团队[53]在大肠杆菌中融合表达GGPP和TS,紫杉二烯在摇瓶中的产量达到93.5 mg/L.Abdallah等[55]在枯草芽孢杆菌中过表达植物来源的TS基因和一个合成操纵子,该操纵子携带枯草芽孢杆菌自身MEP途径的基因以及IspA基因(编码香叶基和法尼基焦磷酸合成酶),首次实现在枯草芽孢杆菌168中生产紫杉二烯.此外,通过过表达crtE基因(编码GGPPS)以增加GGPP的供应,与仅表达TS并依赖枯草芽孢杆菌先天途径的菌株相比,MEP途径酶以及IspA和GGPPS基因的过表达导致紫杉二烯产量增加83倍.后者工程菌株产生的紫杉二烯总量为17.8 mg/L,表明枯草芽孢杆菌也可作为一个生产紫杉醇的良好平台.接下来,紫杉二烯经过T5αOH催化,进行第一步氧化修饰过程.但因为大肠杆菌中缺乏内膜系统,并且P450的亲脂性N末端会导致其溶解度降低,使得其在大肠杆菌中很难被成功表达[55].Biggs等[54]通过对P450酶的N端修饰,优化与CPR的相互作用,实现了T5αOH在大肠杆菌中的高效表达,含氧紫杉烷的产量达到(570±45)mg/L.Loncaric等[69]在大肠杆菌中转入DBAT,通过添加外源底物10-DAB,成功半合成中间体巴卡亭Ⅲ. ...
... [55].Biggs等[54]通过对P450酶的N端修饰,优化与CPR的相互作用,实现了T5αOH在大肠杆菌中的高效表达,含氧紫杉烷的产量达到(570±45)mg/L.Loncaric等[69]在大肠杆菌中转入DBAT,通过添加外源底物10-DAB,成功半合成中间体巴卡亭Ⅲ. ...
Metabolic engineering of taxadiene biosynthesis in yeast as a first step towards taxol (paclitaxel) production
2
2008
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... 麻省理工学院Zhou等[58]采用共培养方法,利用大肠杆菌和酿酒酵母联合生产氧化紫杉烷.在该系统中,首先利用大肠杆菌具有高生长速率的优势来生产紫杉二烯,而使用酿酒酵母是因为其丰富的内膜系统,使细胞色素P450酶可以在该系统中有效地功能表达.然而,酿酒酵母产生的乙醇是大肠杆菌的生长抑制剂.为了解决这个问题,他们使用木糖作为碳源,而木糖只能被大肠杆菌使用,当大肠杆菌消耗木糖产生乙酸盐,乙酸盐便可以被酿酒酵母代谢,而不产生乙醇.最终,该方法产生了33 mg/L的氧化紫杉烷产物[58].DeJong等[72]将紫杉醇合成途径中的8个基因(GGPPS、TS、T5αOH、T10βOH、T13αOH、TAT、TBT和DBAT)成功转化到酿酒酵母的两个质粒中,通过体内、体外实验验证了基因的表达,并且在系统中检测到GGPP和紫杉二烯.此过程证明了酿酒酵母中融合蛋白的功能,并且天然类异戊二烯前体IPP和DMAPP足以启动萜烯生物合成途径.但是,T5αOH酶的产物T5α-ol的产量非常低.Engels等[56]成功地将编码类异戊二烯合成酶的异源基因,以及抑制竞争途径的调节因子导入到酿酒酵母中.当酵母共表达HMGR、UPC2-1(突变调节蛋白基因)、GGPPS和TS基因时,紫杉二烯的产量达到了8.7 mg/L.此后,Ding等[57]通过蛋白质建模和分子对接,筛选出催化效率最高的GGPPS基因,并将其与ERG20基因、tHMGR基因和TS基因共表达,最终提高紫杉二烯的产量到72.8 mg/L. ...
Biosynthesis of Taxadiene in Saccharomyces cerevisiae: selection of geranylgeranyl diphosphate synthase directed by a computer-aided docking strategy
2
2014
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... 麻省理工学院Zhou等[58]采用共培养方法,利用大肠杆菌和酿酒酵母联合生产氧化紫杉烷.在该系统中,首先利用大肠杆菌具有高生长速率的优势来生产紫杉二烯,而使用酿酒酵母是因为其丰富的内膜系统,使细胞色素P450酶可以在该系统中有效地功能表达.然而,酿酒酵母产生的乙醇是大肠杆菌的生长抑制剂.为了解决这个问题,他们使用木糖作为碳源,而木糖只能被大肠杆菌使用,当大肠杆菌消耗木糖产生乙酸盐,乙酸盐便可以被酿酒酵母代谢,而不产生乙醇.最终,该方法产生了33 mg/L的氧化紫杉烷产物[58].DeJong等[72]将紫杉醇合成途径中的8个基因(GGPPS、TS、T5αOH、T10βOH、T13αOH、TAT、TBT和DBAT)成功转化到酿酒酵母的两个质粒中,通过体内、体外实验验证了基因的表达,并且在系统中检测到GGPP和紫杉二烯.此过程证明了酿酒酵母中融合蛋白的功能,并且天然类异戊二烯前体IPP和DMAPP足以启动萜烯生物合成途径.但是,T5αOH酶的产物T5α-ol的产量非常低.Engels等[56]成功地将编码类异戊二烯合成酶的异源基因,以及抑制竞争途径的调节因子导入到酿酒酵母中.当酵母共表达HMGR、UPC2-1(突变调节蛋白基因)、GGPPS和TS基因时,紫杉二烯的产量达到了8.7 mg/L.此后,Ding等[57]通过蛋白质建模和分子对接,筛选出催化效率最高的GGPPS基因,并将其与ERG20基因、tHMGR基因和TS基因共表达,最终提高紫杉二烯的产量到72.8 mg/L. ...
Distributing a metabolic pathway among a microbial consortium enhances production of natural products
3
2015
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... 麻省理工学院Zhou等[58]采用共培养方法,利用大肠杆菌和酿酒酵母联合生产氧化紫杉烷.在该系统中,首先利用大肠杆菌具有高生长速率的优势来生产紫杉二烯,而使用酿酒酵母是因为其丰富的内膜系统,使细胞色素P450酶可以在该系统中有效地功能表达.然而,酿酒酵母产生的乙醇是大肠杆菌的生长抑制剂.为了解决这个问题,他们使用木糖作为碳源,而木糖只能被大肠杆菌使用,当大肠杆菌消耗木糖产生乙酸盐,乙酸盐便可以被酿酒酵母代谢,而不产生乙醇.最终,该方法产生了33 mg/L的氧化紫杉烷产物[58].DeJong等[72]将紫杉醇合成途径中的8个基因(GGPPS、TS、T5αOH、T10βOH、T13αOH、TAT、TBT和DBAT)成功转化到酿酒酵母的两个质粒中,通过体内、体外实验验证了基因的表达,并且在系统中检测到GGPP和紫杉二烯.此过程证明了酿酒酵母中融合蛋白的功能,并且天然类异戊二烯前体IPP和DMAPP足以启动萜烯生物合成途径.但是,T5αOH酶的产物T5α-ol的产量非常低.Engels等[56]成功地将编码类异戊二烯合成酶的异源基因,以及抑制竞争途径的调节因子导入到酿酒酵母中.当酵母共表达HMGR、UPC2-1(突变调节蛋白基因)、GGPPS和TS基因时,紫杉二烯的产量达到了8.7 mg/L.此后,Ding等[57]通过蛋白质建模和分子对接,筛选出催化效率最高的GGPPS基因,并将其与ERG20基因、tHMGR基因和TS基因共表达,最终提高紫杉二烯的产量到72.8 mg/L. ...
... [58].DeJong等[72]将紫杉醇合成途径中的8个基因(GGPPS、TS、T5αOH、T10βOH、T13αOH、TAT、TBT和DBAT)成功转化到酿酒酵母的两个质粒中,通过体内、体外实验验证了基因的表达,并且在系统中检测到GGPP和紫杉二烯.此过程证明了酿酒酵母中融合蛋白的功能,并且天然类异戊二烯前体IPP和DMAPP足以启动萜烯生物合成途径.但是,T5αOH酶的产物T5α-ol的产量非常低.Engels等[56]成功地将编码类异戊二烯合成酶的异源基因,以及抑制竞争途径的调节因子导入到酿酒酵母中.当酵母共表达HMGR、UPC2-1(突变调节蛋白基因)、GGPPS和TS基因时,紫杉二烯的产量达到了8.7 mg/L.此后,Ding等[57]通过蛋白质建模和分子对接,筛选出催化效率最高的GGPPS基因,并将其与ERG20基因、tHMGR基因和TS基因共表达,最终提高紫杉二烯的产量到72.8 mg/L. ...
Enhanced production of taxadiene in Saccharomyces cerevisiae
2
2020
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... Nowrouzi等[59]通过使用GAL1启动子和带有标签的多拷贝TS基因,得到了菌株LRS5.紫杉二烯的产量提高了22倍,在30 ℃条件下达到了(57±3)mg/L,20 ℃的低温下,紫杉二烯产量可达到129 mg/L.同一研究小组的Walls等[37]在LRS5的基础上,添加了编码T5αOH、同源CPR的基因序列以及从T. cuspidata获得的TAT基因,得到了LRS6菌株.研究者通过对发酵工艺的改进和对pH的控制,将氧化紫杉烷类产物的产量提高了2.7倍,达到78 mg/L.后续,Nowrouzi等[61]又在酿酒酵母细胞中优化了T5αOH在酶和全细胞水平上的高活性条件,发现T5αOH和CPR相互作用的解偶联可能介导酿酒酵母中氧化紫杉烷的形成,并且通过构建融合蛋白来提高T5α-ol产量,利用静息细胞培养测定在10 mL小规模下产生了最高的氧化紫杉烷产量[约(361.4±52.4)mg/L],其中T5α-ol的产量达到(38.1±8.4)mg/L.最近,Xu等[62]利用细胞内源MVA途径,通过将TS与SUMO融合来增加其可溶性表达,并采取推拉式策略来增加前体供给,降低旁路代谢.然后过表达tHMG1、GGS1和TS三个基因,分批补料发酵得到紫杉二烯的产量为101.4 mg/L.Walls等[37]通过增加培养物营养供应解决营养胁迫的影响,最后,在1 L生物反应器的最佳培养条件下,培养95 h时获得紫杉二烯的最高产量为(71±8)mg/L,T5αOH的主要产物iso-OCT、OCT和T5α-ol的产量分别为(16±3)mg/L、(44±3)mg/L和(42±4)mg/L,TAT的产物T5α-Ac的最高产量为(21±0.3)mg/L,几乎比之前的最高水平高出6倍.然而,由于T5αOH在异源宿主中表达能力较差,并且催化活性较低,其主要催化产物是OCT及其异构体iso-OCT,最终仅能够将不到10%的紫杉二烯前体转化为目标产物T5α-ol.与在大肠杆菌细胞中一样,酵母细胞中P450酶的高活性表达在动力学上依赖于细胞内源NADPH的有效供应.此外,酵母细胞中副产物和其他内源代谢物的产生也对紫杉醇的异源生产造成干扰. ...
Enhancing Saccharomyces cerevisiae taxane biosynthesis and overcoming nutritional stress-induced pseudohyphal growth
1
2022
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
Exploring optimal taxol? CYP725A4 activity in Saccharomyces cerevisiae
3
2022
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... Nowrouzi等[59]通过使用GAL1启动子和带有标签的多拷贝TS基因,得到了菌株LRS5.紫杉二烯的产量提高了22倍,在30 ℃条件下达到了(57±3)mg/L,20 ℃的低温下,紫杉二烯产量可达到129 mg/L.同一研究小组的Walls等[37]在LRS5的基础上,添加了编码T5αOH、同源CPR的基因序列以及从T. cuspidata获得的TAT基因,得到了LRS6菌株.研究者通过对发酵工艺的改进和对pH的控制,将氧化紫杉烷类产物的产量提高了2.7倍,达到78 mg/L.后续,Nowrouzi等[61]又在酿酒酵母细胞中优化了T5αOH在酶和全细胞水平上的高活性条件,发现T5αOH和CPR相互作用的解偶联可能介导酿酒酵母中氧化紫杉烷的形成,并且通过构建融合蛋白来提高T5α-ol产量,利用静息细胞培养测定在10 mL小规模下产生了最高的氧化紫杉烷产量[约(361.4±52.4)mg/L],其中T5α-ol的产量达到(38.1±8.4)mg/L.最近,Xu等[62]利用细胞内源MVA途径,通过将TS与SUMO融合来增加其可溶性表达,并采取推拉式策略来增加前体供给,降低旁路代谢.然后过表达tHMG1、GGS1和TS三个基因,分批补料发酵得到紫杉二烯的产量为101.4 mg/L.Walls等[37]通过增加培养物营养供应解决营养胁迫的影响,最后,在1 L生物反应器的最佳培养条件下,培养95 h时获得紫杉二烯的最高产量为(71±8)mg/L,T5αOH的主要产物iso-OCT、OCT和T5α-ol的产量分别为(16±3)mg/L、(44±3)mg/L和(42±4)mg/L,TAT的产物T5α-Ac的最高产量为(21±0.3)mg/L,几乎比之前的最高水平高出6倍.然而,由于T5αOH在异源宿主中表达能力较差,并且催化活性较低,其主要催化产物是OCT及其异构体iso-OCT,最终仅能够将不到10%的紫杉二烯前体转化为目标产物T5α-ol.与在大肠杆菌细胞中一样,酵母细胞中P450酶的高活性表达在动力学上依赖于细胞内源NADPH的有效供应.此外,酵母细胞中副产物和其他内源代谢物的产生也对紫杉醇的异源生产造成干扰. ...
... 目前,针对T5αOH的催化机制研究主要集中在自由基-反弹机制和环氧化机制[31,89].Yadav等[34]推测氧铁基团在C3位、C13位、C20位的竞争性质子提取过程是导致T5αOH氧化产物多样性的原因.Edgar等[31-32]推测紫杉二烯首先被T5αOH催化成不稳定的环氧化合物中间体,随后环氧化物进行非特异性断裂,从而生成包括紫杉二烯-5α-醇在内的多种氧化产物,遵循环氧化机制.与此同时,同分异构体异紫杉二烯可以避免经过环氧化合物断裂过程,依然通过正常的P450酶自由基-反弹机制特异性地生成目标产物紫杉二烯-5α-醇.而Barton等[90]发现紫杉二烯-4(5)-环氧化物对酸敏感,在不同的化学条件可以产生不同的重排产物,尤其是暴露在铁卟啉下时极易发生重排.这对紫杉二烯-4(5)-环氧化物作为合格中间体的角色提出了新的挑战.自从T5αOH于1996年在红豆杉中首次发现,研究人员进行了包括N端修饰、电子传递链优化、核糖体开关调控、静息细胞培养、内质网改造、区室化等一系列改造,并对催化温度、O2、pH、辅因子等条件也进行了大量的优化[61,71].但是在T5αOH酶分子改造方面,目前一直没有重大的突破.Yadav等[34]使用6个P450结构作为模板构建了T5αOH的同源模型,并在此基础上设计了53个突变体,其中有6个突变体,其转化率和T5α-ol选择性方面都有所提高.其中的两个突变体K131R和V374L分别表现出牺牲选择性而提高转化率和牺牲转化率而提高选择性的性质.基于对紫杉醇合成关键基因簇的深度解析,本课题组对喜马拉雅红豆杉来源的CYP725A亚家族候选序列进行了大规模的功能筛选,发现T5αOH生成两个拷贝同工酶T5αOH-1和T5αOH-2,经过实验验证都具有催化紫杉二烯C5位羟基化的功能,然而其催化性能相较于已报道的T5αOH并没有任何改善[41]. ...
Improving solubility and copy number of taxadiene synthase to enhance the titer of taxadiene in Yarrowia lipolytica
2
2023
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... Nowrouzi等[59]通过使用GAL1启动子和带有标签的多拷贝TS基因,得到了菌株LRS5.紫杉二烯的产量提高了22倍,在30 ℃条件下达到了(57±3)mg/L,20 ℃的低温下,紫杉二烯产量可达到129 mg/L.同一研究小组的Walls等[37]在LRS5的基础上,添加了编码T5αOH、同源CPR的基因序列以及从T. cuspidata获得的TAT基因,得到了LRS6菌株.研究者通过对发酵工艺的改进和对pH的控制,将氧化紫杉烷类产物的产量提高了2.7倍,达到78 mg/L.后续,Nowrouzi等[61]又在酿酒酵母细胞中优化了T5αOH在酶和全细胞水平上的高活性条件,发现T5αOH和CPR相互作用的解偶联可能介导酿酒酵母中氧化紫杉烷的形成,并且通过构建融合蛋白来提高T5α-ol产量,利用静息细胞培养测定在10 mL小规模下产生了最高的氧化紫杉烷产量[约(361.4±52.4)mg/L],其中T5α-ol的产量达到(38.1±8.4)mg/L.最近,Xu等[62]利用细胞内源MVA途径,通过将TS与SUMO融合来增加其可溶性表达,并采取推拉式策略来增加前体供给,降低旁路代谢.然后过表达tHMG1、GGS1和TS三个基因,分批补料发酵得到紫杉二烯的产量为101.4 mg/L.Walls等[37]通过增加培养物营养供应解决营养胁迫的影响,最后,在1 L生物反应器的最佳培养条件下,培养95 h时获得紫杉二烯的最高产量为(71±8)mg/L,T5αOH的主要产物iso-OCT、OCT和T5α-ol的产量分别为(16±3)mg/L、(44±3)mg/L和(42±4)mg/L,TAT的产物T5α-Ac的最高产量为(21±0.3)mg/L,几乎比之前的最高水平高出6倍.然而,由于T5αOH在异源宿主中表达能力较差,并且催化活性较低,其主要催化产物是OCT及其异构体iso-OCT,最终仅能够将不到10%的紫杉二烯前体转化为目标产物T5α-ol.与在大肠杆菌细胞中一样,酵母细胞中P450酶的高活性表达在动力学上依赖于细胞内源NADPH的有效供应.此外,酵母细胞中副产物和其他内源代谢物的产生也对紫杉醇的异源生产造成干扰. ...
Improved production of taxol? precursors in S. cerevisiae using combinatorial in silico design and metabolic engineering
1
2023
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
Metabolic engineering of isoprenoid biosynthesis in Arabidopsis for the production of taxadiene, the first committed precursor of Taxol
3
2004
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... 植物系统可以利用阳光和天然二氧化碳产生次生代谢产物[73].利用植物中自身具有充足IPP和DMAPP的优势,部分紫杉醇生物合成途径被转移到拟南芥中[64].通过组成型CaMV 35S启动子过表达TS基因后,在纯合植物中成功检测到紫杉二烯,表明重组蛋白在拟南芥中具有功能.然而,相关基因的过表达对拟南芥的自身生长产生了不利影响,例如下胚轴长度减少、叶子变色以及生长减缓和开花减少.推测可能是因为紫杉二烯具有细胞毒性,或TS的表达会干扰植物发育过程中其他重要萜烯产物如赤霉素或类胡萝卜素的合成.随后,该团队将TS基因的启动子更换为糖皮质激素诱导型启动子,从而防止GGPP在植物生长和发育过程中代谢定向至萜烯途径,减轻了TS表达对拟南芥植株表型的危害,但是紫杉二烯的产量依然很低[64]. ...
... [64]. ...
Metabolic engineering of Nicotiana benthamiana for the increased production of taxadiene
1
2014
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
Chloroplastic metabolic engineering coupled with isoprenoid pool enhancement for committed taxanes biosynthesis in Nicotiana benthamiana
2
2019
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... 研究表明,烟草也是紫杉醇异源生产的优良宿主.Rontein等[74]在烟草中导入了TS和T5αOH基因,并在毛状体中特异表达.但是,改造后的烟草产生的并不是期望得到的T5α-ol,而是副产物OCT.王勇课题组[66]在本氏烟草(Nicotiana benthamiana)中使用叶绿体分离代谢策略来分离TS、T5αOH和CPR,并结合改进的类异戊二烯前体,生产紫杉二烯和T5α-ol,产量分别为56.5 µg/g和1.3 µg/g新鲜叶片.湖北大学张江课题组[67]建立了转质体烟草品种,在叶绿体和细胞质中表达TS基因,紫杉二烯的产量均非常低.然而,当表达添加叶绿体转运肽的TS时,叶绿体中的紫杉二烯含量显著增加,达到87.8 μg/g细胞干重.结果表明,这种中间体向叶绿体的运输及其翻译后修饰对于高水平紫杉二烯的形成非常重要. ...
Importation of taxadiene synthase into chloroplast improves taxadiene production in tobacco
2
2021
... Heterologous expression systems for paclitaxel production
Table 2| 合成体系 | 产物 | 产量 | 研究方法 | 发表 时间 | 参考文献 |
|---|
| 大肠杆菌 | 紫杉二烯 | 1.3 mg/L | 过表达IDI、GGPPS、TS、DXP | 2001 | [49] |
| 大肠杆菌 | 紫杉二烯 | 1 g/L | 多变量模块化代谢工程,过表达TS和T5αOH | 2010 | [50] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | (58±3) mg/L |
| 大肠杆菌 | 紫杉二烯 | 4.5 mg/g DW | JM109(DE3)菌株,22 °C | 2012 | [51] |
| 链格孢菌TPF6 | 紫杉二烯 | (61.9±6.3) μg/L | alcA启动子,过表达IDI、tHMGR | 2017 | [8] |
| 大肠杆菌 | 氧化紫杉烷 | 27 mg/L | TbrTS,Taxus CPR,T5αOH-GSTGS-CPR,引入异源MVA途径 | 2022 | [52] |
| 大肠杆菌 | 紫杉二烯-5α-醇 | 7 mg/L |
| 大肠杆菌 | 紫杉二烯 | 93.5 mg/L | 融合表达GGPP和TS | 2022 | [53] |
| 大肠杆菌 | 氧化紫杉烷 | (570±45) mg/L | P450酶N端修饰 | 2016 | [54] |
| 枯草芽孢杆菌 | 紫杉二烯 | 17.8 mg/L | 过表达MEP途径,GGPPS和TS | 2019 | [55] |
| 酿酒酵母 | 紫杉二烯 | 8.7 mg/L | 共表达tHMGR、突变调节蛋白UPC2-1、GGPPS和TS | 2008 | [56] |
| 酿酒酵母 | 紫杉二烯 | 72.8 mg/L | YSG50菌株,GGPPSbc | 2014 | [57] |
| 酿酒酵母 | 氧化紫杉烷 | 33 mg/L | 大肠杆菌和酿酒酵母共培养 | 2015 | [58] |
| 酿酒酵母 | 紫杉二烯 | 129 mg/L | 增加MBP标签的多拷贝TS,20 ℃ | 2020 | [59] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 20 mg/L | 对发酵工艺的改进,pH优化 | 2021 | [37] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 3.7 mg/L |
| 酿酒酵母 | 氧化紫杉烷 | 78 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 42 mg/L | 2×YP, 统计学确定性筛选设计 | 2022 | [60] |
| 酿酒酵母 | 紫杉二烯-5α-yl-乙酸酯 | 22 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-醇 | (38.1±8.4) mg/L | 启动子pHXT7,融合表达T5OH和CPR,中性pH条件下静息细胞测定 | 2022 | [61] |
| 酿酒酵母 | 氧化紫杉烷 | (361.4±52.4) mg/L |
| 解脂耶氏酵母 | 紫杉二烯 | 101.4 mg/L | 融合表达SUMO与TS,过表达tHMG1、GGS1和TS | 2023 | [62] |
| 酿酒酵母 | 紫杉二烯 | 215 mg/L | 计算代谢工程 | 2023 | [63] |
| 酿酒酵母 | 紫杉二烯-5α-醇 | 43.65 mg/L |
| 酿酒酵母 | 紫杉二烯-5α-乙酸酯 | 26.2 mg/L |
| 酿酒酵母 | 1β-dehydroxybaccatin Ⅵ | | 细胞共共表达已鉴定的12个基因并饲喂紫杉二烯-5α-醇 | 2024 | [30] |
| 拟南芥 | 紫杉二烯 | 600 ng/g DW | 糖皮质激素诱导表达TS | 2004 | [64] |
| 本氏烟草 | 紫杉二烯 | 50 μg/g DW | 表达TS,MeJA诱导,沉默PSY和PDS | 2014 | [65] |
| 本氏烟草 | 紫杉二烯 | (56.6±3.2) µg/g fresh weight | 区室化策略, DXS和GGPPS共表达 | 2019 | [66] |
| 本氏烟草 | 紫杉二烯-5α-醇 | (1.3±0.5) µg/g fresh weight |
| 红花烟草 | 紫杉二烯 | 87.8 μg/g DW | TS的N端融合叶绿体转运肽 | 2021 | [67] |
| 本氏烟草 | 巴卡亭Ⅲ | 154.87 ng/g fresh weight | 瞬时表达C4β-C20环氧化酶基因、T9αOH、T1βOH和T9OX与其他9个已知基因 | 2023 | [12] |
| 紫杉醇 | 64.29 ng/g fresh weight | 瞬时表达PCL与BAPT、PAM、DBTNBT、T2′OH | | |
| 本氏烟草 | 紫杉二烯-5α-醇 | | 弱组成型启动子NOS弱化T5αOH的表达 | | |
| 5α,10β-二乙酰氧基- 紫杉二烯-13α-醇 | 42 µg/g DW | (NOS)T10βOH、DBAT和(NOS)T13αOH | 2024 | [39] |
| 本氏烟草 | 巴卡亭Ⅲ | | 瞬时表达TOT和T9αOH-1与其他7个已知合成基因 | 2024 | [13] |
3.1 原核细胞底盘生物合成紫杉醇研究进展Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
... 研究表明,烟草也是紫杉醇异源生产的优良宿主.Rontein等[74]在烟草中导入了TS和T5αOH基因,并在毛状体中特异表达.但是,改造后的烟草产生的并不是期望得到的T5α-ol,而是副产物OCT.王勇课题组[66]在本氏烟草(Nicotiana benthamiana)中使用叶绿体分离代谢策略来分离TS、T5αOH和CPR,并结合改进的类异戊二烯前体,生产紫杉二烯和T5α-ol,产量分别为56.5 µg/g和1.3 µg/g新鲜叶片.湖北大学张江课题组[67]建立了转质体烟草品种,在叶绿体和细胞质中表达TS基因,紫杉二烯的产量均非常低.然而,当表达添加叶绿体转运肽的TS时,叶绿体中的紫杉二烯含量显著增加,达到87.8 μg/g细胞干重.结果表明,这种中间体向叶绿体的运输及其翻译后修饰对于高水平紫杉二烯的形成非常重要. ...
Computational identification of gene over-expression targets for metabolic engineering of taxadiene production
1
2012
... Huang等[49]首次在大肠杆菌中直接过表达IDI、GGPPS和TS三个基因,紫杉二烯产量约为0.5 mg/L,继续将大肠杆菌自身的脱氧木酮糖-5-磷酸途径进行过表达,使紫杉二烯的产量提升至1.3 mg/L.Ajikumar等[50]引入多变量模块化代谢工程,将紫杉醇合成途径分成两个模块:具有四个限速基因(dxs、idi、ispD和ispF)的上游模块以形成IPP;下游模块具有两个异源基因(GGPPS、TS)以产生紫杉二烯.研究者通过优化大肠杆菌自身的MEP途径和紫杉二烯合成路径,成功地在大肠杆菌中过表达TS和 T5αOH 基因,使得大肠杆菌发酵培养物中紫杉二烯的产量提高了约15 000倍,达到1 g/L(这是迄今为止报道的最高产量),同时紫杉二烯-5α-醇(T5α-ol)的产量也提高了2400倍,达到(58±3)mg/L,为通过类似的细胞色素P450酶氧化合成后续代谢产物提供了基础.研究表明,外源吲哚浓度高于约100 mg/L时,紫杉二烯的合成受到严重抑制,吲哚浓度的进一步增加也会抑制细胞生长,且抑制程度具有高度的菌株依赖性.吲哚与类异戊二烯途径相互作用的生化机制目前尚不清楚,但研究结果表明,吲哚与类异戊二烯途径产生的萜类化合物之间可能存在协同作用,抑制细胞生长.之后,该课题组的Boghigian等[68]也将GGPPS和TS基因与大肠杆菌自身的MEP途径结合,分别探究了大肠杆菌中不同启动子和不同的细胞背景对紫杉二烯生产的影响,结果发现,JM109(DE3)产生的紫杉二烯产量比BL21(DE3)菌株的产量提高约2.5倍,且22 ℃为该菌株生产紫杉二烯的最优温度.之后,Bian等[8]将MVA途径和TS基因转入大肠杆菌中,但紫杉二烯的产量仅有(11.3±0.5)mg/L.之后,Bian等[8]将该紫杉二烯生产途径从细菌转移到丝状真菌中,首先在交链格孢(Alternaria alternata)TPF6体内测试了6个外源启动子的强度,并将其应用于TPF6的代谢工程改造工作中,过表达外源的IDI、tHMGR(truncated 3-hydroxyl-3-methylglutaryl-CoA reductase)以及TS基因,首次报道实现了丝状真菌体内紫杉二烯的稳定合成,产量为(61.9±6.3)μg/L. ...
Profiling a Taxol pathway 10β-acetyltransferase: assessment of the specificity and the production of baccatin Ⅲ by in vivo acetylation in E. coli
1
2006
... 在最近的研究中,华东理工大学郁惠蕾团队[52]在大肠杆菌中构建异源MVA途径用于从头合成紫杉醇前体,研究团队首先对途径关键酶TS和细胞色素P450氧化还原酶(cytochmme P450 reductase, CPR)进行筛选,并优化T5αOH-CPR融合蛋白之间的linker及菌株发酵的条件,最终氧化紫杉烷产量达到27 mg/L,其中T5α-ol产量达到7 mg/L,较出发菌株分别提高了12倍和23倍.许建和团队[53]在大肠杆菌中融合表达GGPP和TS,紫杉二烯在摇瓶中的产量达到93.5 mg/L.Abdallah等[55]在枯草芽孢杆菌中过表达植物来源的TS基因和一个合成操纵子,该操纵子携带枯草芽孢杆菌自身MEP途径的基因以及IspA基因(编码香叶基和法尼基焦磷酸合成酶),首次实现在枯草芽孢杆菌168中生产紫杉二烯.此外,通过过表达crtE基因(编码GGPPS)以增加GGPP的供应,与仅表达TS并依赖枯草芽孢杆菌先天途径的菌株相比,MEP途径酶以及IspA和GGPPS基因的过表达导致紫杉二烯产量增加83倍.后者工程菌株产生的紫杉二烯总量为17.8 mg/L,表明枯草芽孢杆菌也可作为一个生产紫杉醇的良好平台.接下来,紫杉二烯经过T5αOH催化,进行第一步氧化修饰过程.但因为大肠杆菌中缺乏内膜系统,并且P450的亲脂性N末端会导致其溶解度降低,使得其在大肠杆菌中很难被成功表达[55].Biggs等[54]通过对P450酶的N端修饰,优化与CPR的相互作用,实现了T5αOH在大肠杆菌中的高效表达,含氧紫杉烷的产量达到(570±45)mg/L.Loncaric等[69]在大肠杆菌中转入DBAT,通过添加外源底物10-DAB,成功半合成中间体巴卡亭Ⅲ. ...
Combinatorial biosynthesis of medicinal plant secondary metabolites
1
2006
... 由于缺乏有效的类异戊二烯生物合成途径,使用大肠杆菌和其他原核细胞作为植物代谢物的异源生产系统具有一些局限性.另外原核生物宿主倾向于以不溶性和非功能性的形式产生靶蛋白,并且NADPH作为植物细胞色素P450酶的关键辅因子,在原核系统中的供应也十分有限[70].此外,原核生物缺乏真核细胞的区室化,真核细胞的区室化能够创造不同的细胞内环境,允许在最终产物形成过程中对中间代谢产物进行空间或时间分配.而酵母等真核单细胞生物由于具有典型的膜封闭细胞器和细胞区室化而引起了人们的广泛关注[71]. ...
Recent advances in metabolic engineering, protein engineering, and transcriptome-guided insights toward synthetic production of taxol
3
2021
... 由于缺乏有效的类异戊二烯生物合成途径,使用大肠杆菌和其他原核细胞作为植物代谢物的异源生产系统具有一些局限性.另外原核生物宿主倾向于以不溶性和非功能性的形式产生靶蛋白,并且NADPH作为植物细胞色素P450酶的关键辅因子,在原核系统中的供应也十分有限[70].此外,原核生物缺乏真核细胞的区室化,真核细胞的区室化能够创造不同的细胞内环境,允许在最终产物形成过程中对中间代谢产物进行空间或时间分配.而酵母等真核单细胞生物由于具有典型的膜封闭细胞器和细胞区室化而引起了人们的广泛关注[71]. ...
... 在紫杉醇合成的前期途径中,尽管TS的催化能力有限,过程中亦有多种副产物产生[84-85],但它并不是紫杉醇生物合成途径中的关键限速步骤.一直以来,T5αOH催化紫杉二烯C5位羟化的步骤被认为是紫杉醇生物合成途径的关键限速步骤以及瓶颈[33].酶的定向进化是一种常用酶改造技术,其通过模拟基因突变与自然选择的原理,在短时间内对酶进行多轮突变与筛选.尽管定向进化领域取得了重大进展,但利用该方法设计紫杉醇途径的T5αOH和其他P450仍存在诸多挑战,如对于这些酶的催化机制认识不足且缺乏高通量的筛选方法.酶的理性及半理性改造方法将序列、结构、功能等信息作为基础,从而可以增加有利突变的概率,大大降低实验量.酶活性位点内的氨基酸取代有可能提高催化活性,但需要非常精确的构象调控才能在热力学灵活性和结构刚性之间保持一定的平衡[86].利用计算和实验相结合的方法来深入了解途径酶催化的途径,并以此指导蛋白质(半)理性设计工作,尤其是提升P450酶在底物识别和催化效率上的适应性.目前,在设计植物宿主途径方面也取得了显著的突破,这些突破有望解决紫杉醇生物合成中P450酶化学催化的挑战[71]. ...
... 目前,针对T5αOH的催化机制研究主要集中在自由基-反弹机制和环氧化机制[31,89].Yadav等[34]推测氧铁基团在C3位、C13位、C20位的竞争性质子提取过程是导致T5αOH氧化产物多样性的原因.Edgar等[31-32]推测紫杉二烯首先被T5αOH催化成不稳定的环氧化合物中间体,随后环氧化物进行非特异性断裂,从而生成包括紫杉二烯-5α-醇在内的多种氧化产物,遵循环氧化机制.与此同时,同分异构体异紫杉二烯可以避免经过环氧化合物断裂过程,依然通过正常的P450酶自由基-反弹机制特异性地生成目标产物紫杉二烯-5α-醇.而Barton等[90]发现紫杉二烯-4(5)-环氧化物对酸敏感,在不同的化学条件可以产生不同的重排产物,尤其是暴露在铁卟啉下时极易发生重排.这对紫杉二烯-4(5)-环氧化物作为合格中间体的角色提出了新的挑战.自从T5αOH于1996年在红豆杉中首次发现,研究人员进行了包括N端修饰、电子传递链优化、核糖体开关调控、静息细胞培养、内质网改造、区室化等一系列改造,并对催化温度、O2、pH、辅因子等条件也进行了大量的优化[61,71].但是在T5αOH酶分子改造方面,目前一直没有重大的突破.Yadav等[34]使用6个P450结构作为模板构建了T5αOH的同源模型,并在此基础上设计了53个突变体,其中有6个突变体,其转化率和T5α-ol选择性方面都有所提高.其中的两个突变体K131R和V374L分别表现出牺牲选择性而提高转化率和牺牲转化率而提高选择性的性质.基于对紫杉醇合成关键基因簇的深度解析,本课题组对喜马拉雅红豆杉来源的CYP725A亚家族候选序列进行了大规模的功能筛选,发现T5αOH生成两个拷贝同工酶T5αOH-1和T5αOH-2,经过实验验证都具有催化紫杉二烯C5位羟基化的功能,然而其催化性能相较于已报道的T5αOH并没有任何改善[41]. ...
Genetic engineering of taxol biosynthetic genes in Saccharomyces cerevisiae
1
2006
... 麻省理工学院Zhou等[58]采用共培养方法,利用大肠杆菌和酿酒酵母联合生产氧化紫杉烷.在该系统中,首先利用大肠杆菌具有高生长速率的优势来生产紫杉二烯,而使用酿酒酵母是因为其丰富的内膜系统,使细胞色素P450酶可以在该系统中有效地功能表达.然而,酿酒酵母产生的乙醇是大肠杆菌的生长抑制剂.为了解决这个问题,他们使用木糖作为碳源,而木糖只能被大肠杆菌使用,当大肠杆菌消耗木糖产生乙酸盐,乙酸盐便可以被酿酒酵母代谢,而不产生乙醇.最终,该方法产生了33 mg/L的氧化紫杉烷产物[58].DeJong等[72]将紫杉醇合成途径中的8个基因(GGPPS、TS、T5αOH、T10βOH、T13αOH、TAT、TBT和DBAT)成功转化到酿酒酵母的两个质粒中,通过体内、体外实验验证了基因的表达,并且在系统中检测到GGPP和紫杉二烯.此过程证明了酿酒酵母中融合蛋白的功能,并且天然类异戊二烯前体IPP和DMAPP足以启动萜烯生物合成途径.但是,T5αOH酶的产物T5α-ol的产量非常低.Engels等[56]成功地将编码类异戊二烯合成酶的异源基因,以及抑制竞争途径的调节因子导入到酿酒酵母中.当酵母共表达HMGR、UPC2-1(突变调节蛋白基因)、GGPPS和TS基因时,紫杉二烯的产量达到了8.7 mg/L.此后,Ding等[57]通过蛋白质建模和分子对接,筛选出催化效率最高的GGPPS基因,并将其与ERG20基因、tHMGR基因和TS基因共表达,最终提高紫杉二烯的产量到72.8 mg/L. ...
Engineering triterpene and methylated triterpene production in plants provides biochemical and physiological insights into terpene metabolism
1
2016
... 植物系统可以利用阳光和天然二氧化碳产生次生代谢产物[73].利用植物中自身具有充足IPP和DMAPP的优势,部分紫杉醇生物合成途径被转移到拟南芥中[64].通过组成型CaMV 35S启动子过表达TS基因后,在纯合植物中成功检测到紫杉二烯,表明重组蛋白在拟南芥中具有功能.然而,相关基因的过表达对拟南芥的自身生长产生了不利影响,例如下胚轴长度减少、叶子变色以及生长减缓和开花减少.推测可能是因为紫杉二烯具有细胞毒性,或TS的表达会干扰植物发育过程中其他重要萜烯产物如赤霉素或类胡萝卜素的合成.随后,该团队将TS基因的启动子更换为糖皮质激素诱导型启动子,从而防止GGPP在植物生长和发育过程中代谢定向至萜烯途径,减轻了TS表达对拟南芥植株表型的危害,但是紫杉二烯的产量依然很低[64]. ...
CYP725A4 from yew catalyzes complex structural rearrangement of taxa-4(5),11(12)-diene into the cyclic ether 5(12)-oxa-3(11)- cyclotaxane
1
2008
... 研究表明,烟草也是紫杉醇异源生产的优良宿主.Rontein等[74]在烟草中导入了TS和T5αOH基因,并在毛状体中特异表达.但是,改造后的烟草产生的并不是期望得到的T5α-ol,而是副产物OCT.王勇课题组[66]在本氏烟草(Nicotiana benthamiana)中使用叶绿体分离代谢策略来分离TS、T5αOH和CPR,并结合改进的类异戊二烯前体,生产紫杉二烯和T5α-ol,产量分别为56.5 µg/g和1.3 µg/g新鲜叶片.湖北大学张江课题组[67]建立了转质体烟草品种,在叶绿体和细胞质中表达TS基因,紫杉二烯的产量均非常低.然而,当表达添加叶绿体转运肽的TS时,叶绿体中的紫杉二烯含量显著增加,达到87.8 μg/g细胞干重.结果表明,这种中间体向叶绿体的运输及其翻译后修饰对于高水平紫杉二烯的形成非常重要. ...
Overexpression of BAPT and DBTNBT genes in Taxus baccata in vitro cultures to enhance the biotechnological production of paclitaxel
2
2024
... 与此同时,红豆杉的转化体系也取得一定的进展.近期,Mercedes Bonfill团队[75]报道了通过Rhizobium rhizogenes A4介导的转化获得了不同的欧洲紫杉(Taxus baccata)离体转化系.由于转基因红豆杉根生长速度较慢,为获得愈伤组织系并建立细胞悬浮体系,对其进行了去分化处理.研究人员通过过表达两个限制基因BAPT和DBTNBT以及两阶段系统中培养,并通过双重诱导处理刺激紫杉醇的产生.与野生型株系相比,DBTNBT转基因株系生产的紫杉醇含量超过了4倍,而BAPT转基因株系中紫杉醇的含量也增加1倍.这是首次通过直接接种使用携带紫杉醇基因的质粒的两株改良R. rhizogenes A4菌株,成功实现了红豆杉幼苗的转化.此前仅有He等[76]使用R. rhizogenes A4野生型菌株获得了红豆杉的毛状根并且其感染过程是在离体条件下进行的.对紫杉醇生物合成基因的转录分析显示,GGPPS、TS和DBAT基因对DBTNBT的过表达和双重诱导反应最为敏感,它们的表达逐渐而持续地增加[75]. ...
... [75]. ...
Hairy root induction of Taxus baccata L. by natural transformation with Rhizobium rhizogenes
1
2022
... 与此同时,红豆杉的转化体系也取得一定的进展.近期,Mercedes Bonfill团队[75]报道了通过Rhizobium rhizogenes A4介导的转化获得了不同的欧洲紫杉(Taxus baccata)离体转化系.由于转基因红豆杉根生长速度较慢,为获得愈伤组织系并建立细胞悬浮体系,对其进行了去分化处理.研究人员通过过表达两个限制基因BAPT和DBTNBT以及两阶段系统中培养,并通过双重诱导处理刺激紫杉醇的产生.与野生型株系相比,DBTNBT转基因株系生产的紫杉醇含量超过了4倍,而BAPT转基因株系中紫杉醇的含量也增加1倍.这是首次通过直接接种使用携带紫杉醇基因的质粒的两株改良R. rhizogenes A4菌株,成功实现了红豆杉幼苗的转化.此前仅有He等[76]使用R. rhizogenes A4野生型菌株获得了红豆杉的毛状根并且其感染过程是在离体条件下进行的.对紫杉醇生物合成基因的转录分析显示,GGPPS、TS和DBAT基因对DBTNBT的过表达和双重诱导反应最为敏感,它们的表达逐渐而持续地增加[75]. ...
A review: recent advances and future prospects of taxol-producing endophytic fungi
1
2010
... 研究人员发现与红豆杉物种共生的一些内生真菌也能够产生紫杉醇.Zhou等[77]从红豆杉中分离出一种产紫杉醇的内生真菌菌株,产量为125.7 μg/L,并且在诱变后提升产量到314.07 μg/L.赵凯等[78]通过物理、化学等诱变方法获得了产量为448.52 μg/L的高产菌株,并且通过原生质体融合的办法将紫杉醇的产量提高到468.62 μg/L.Wang等[79]首次利用REMI法获得了具有潮霉素B抗性的产紫杉醇真菌菌株BT2.无独有偶,Wei等[80]通过将真菌启动子trpC调控的潮霉素B磷酸转移酶基因转化到内生真菌基因组中,使得原生质体再生的频率高于6%.此两种办法成功开辟了将紫杉醇生物合成基因转移到改良真菌紫杉醇产量的可能性.Zhang等[81]使用农杆菌转化的办法获得了产紫杉醇的枝状枝孢(Cladosporium cladosporioides)菌株MD2,并且建立了高效稳定的真菌转化的最佳共培养条件.Liu等[82]建立了一种农杆菌介导的高效转化办法,用于分类产紫杉醇的内生真菌Ozonium sp. EFY21,并且优化了影响转化和转化体稳定性的几个因素.然而,这些研究都未将紫杉醇生物合成基因整合到转化真菌的基因组中.El-Sayed等[83]利用CRISPR/Cas9系统,通过敲除角鲨烯合酶和藜麦甾醇合酶,阻断丝状真菌中甾醇代谢途径,增加了紫杉醇的产量.总体而言,目前对于红豆杉内生真菌的研究相对偏少,相较于大肠杆菌、酵母菌、烟草底盘来说,红豆杉内生真菌的遗传操作和培养条件等相关研究并不是十分成熟,后续随着组学大数据挖掘、合成生物技术以及检测技术的进步,对于内生真菌的研究会为紫杉醇的生物合成提供更加深入的见解. ...
内生真菌发酵生产紫杉醇的研究现状与展望
1
2008
... 研究人员发现与红豆杉物种共生的一些内生真菌也能够产生紫杉醇.Zhou等[77]从红豆杉中分离出一种产紫杉醇的内生真菌菌株,产量为125.7 μg/L,并且在诱变后提升产量到314.07 μg/L.赵凯等[78]通过物理、化学等诱变方法获得了产量为448.52 μg/L的高产菌株,并且通过原生质体融合的办法将紫杉醇的产量提高到468.62 μg/L.Wang等[79]首次利用REMI法获得了具有潮霉素B抗性的产紫杉醇真菌菌株BT2.无独有偶,Wei等[80]通过将真菌启动子trpC调控的潮霉素B磷酸转移酶基因转化到内生真菌基因组中,使得原生质体再生的频率高于6%.此两种办法成功开辟了将紫杉醇生物合成基因转移到改良真菌紫杉醇产量的可能性.Zhang等[81]使用农杆菌转化的办法获得了产紫杉醇的枝状枝孢(Cladosporium cladosporioides)菌株MD2,并且建立了高效稳定的真菌转化的最佳共培养条件.Liu等[82]建立了一种农杆菌介导的高效转化办法,用于分类产紫杉醇的内生真菌Ozonium sp. EFY21,并且优化了影响转化和转化体稳定性的几个因素.然而,这些研究都未将紫杉醇生物合成基因整合到转化真菌的基因组中.El-Sayed等[83]利用CRISPR/Cas9系统,通过敲除角鲨烯合酶和藜麦甾醇合酶,阻断丝状真菌中甾醇代谢途径,增加了紫杉醇的产量.总体而言,目前对于红豆杉内生真菌的研究相对偏少,相较于大肠杆菌、酵母菌、烟草底盘来说,红豆杉内生真菌的遗传操作和培养条件等相关研究并不是十分成熟,后续随着组学大数据挖掘、合成生物技术以及检测技术的进步,对于内生真菌的研究会为紫杉醇的生物合成提供更加深入的见解. ...
Recent advance and prospect on taxol production by endophytic fungus fermentation—a review
1
2008
... 研究人员发现与红豆杉物种共生的一些内生真菌也能够产生紫杉醇.Zhou等[77]从红豆杉中分离出一种产紫杉醇的内生真菌菌株,产量为125.7 μg/L,并且在诱变后提升产量到314.07 μg/L.赵凯等[78]通过物理、化学等诱变方法获得了产量为448.52 μg/L的高产菌株,并且通过原生质体融合的办法将紫杉醇的产量提高到468.62 μg/L.Wang等[79]首次利用REMI法获得了具有潮霉素B抗性的产紫杉醇真菌菌株BT2.无独有偶,Wei等[80]通过将真菌启动子trpC调控的潮霉素B磷酸转移酶基因转化到内生真菌基因组中,使得原生质体再生的频率高于6%.此两种办法成功开辟了将紫杉醇生物合成基因转移到改良真菌紫杉醇产量的可能性.Zhang等[81]使用农杆菌转化的办法获得了产紫杉醇的枝状枝孢(Cladosporium cladosporioides)菌株MD2,并且建立了高效稳定的真菌转化的最佳共培养条件.Liu等[82]建立了一种农杆菌介导的高效转化办法,用于分类产紫杉醇的内生真菌Ozonium sp. EFY21,并且优化了影响转化和转化体稳定性的几个因素.然而,这些研究都未将紫杉醇生物合成基因整合到转化真菌的基因组中.El-Sayed等[83]利用CRISPR/Cas9系统,通过敲除角鲨烯合酶和藜麦甾醇合酶,阻断丝状真菌中甾醇代谢途径,增加了紫杉醇的产量.总体而言,目前对于红豆杉内生真菌的研究相对偏少,相较于大肠杆菌、酵母菌、烟草底盘来说,红豆杉内生真菌的遗传操作和培养条件等相关研究并不是十分成熟,后续随着组学大数据挖掘、合成生物技术以及检测技术的进步,对于内生真菌的研究会为紫杉醇的生物合成提供更加深入的见解. ...
Transformation of taxol-producing endophytic fungi by restriction enzyme-mediated integration (REMI)
1
2007
... 研究人员发现与红豆杉物种共生的一些内生真菌也能够产生紫杉醇.Zhou等[77]从红豆杉中分离出一种产紫杉醇的内生真菌菌株,产量为125.7 μg/L,并且在诱变后提升产量到314.07 μg/L.赵凯等[78]通过物理、化学等诱变方法获得了产量为448.52 μg/L的高产菌株,并且通过原生质体融合的办法将紫杉醇的产量提高到468.62 μg/L.Wang等[79]首次利用REMI法获得了具有潮霉素B抗性的产紫杉醇真菌菌株BT2.无独有偶,Wei等[80]通过将真菌启动子trpC调控的潮霉素B磷酸转移酶基因转化到内生真菌基因组中,使得原生质体再生的频率高于6%.此两种办法成功开辟了将紫杉醇生物合成基因转移到改良真菌紫杉醇产量的可能性.Zhang等[81]使用农杆菌转化的办法获得了产紫杉醇的枝状枝孢(Cladosporium cladosporioides)菌株MD2,并且建立了高效稳定的真菌转化的最佳共培养条件.Liu等[82]建立了一种农杆菌介导的高效转化办法,用于分类产紫杉醇的内生真菌Ozonium sp. EFY21,并且优化了影响转化和转化体稳定性的几个因素.然而,这些研究都未将紫杉醇生物合成基因整合到转化真菌的基因组中.El-Sayed等[83]利用CRISPR/Cas9系统,通过敲除角鲨烯合酶和藜麦甾醇合酶,阻断丝状真菌中甾醇代谢途径,增加了紫杉醇的产量.总体而言,目前对于红豆杉内生真菌的研究相对偏少,相较于大肠杆菌、酵母菌、烟草底盘来说,红豆杉内生真菌的遗传操作和培养条件等相关研究并不是十分成熟,后续随着组学大数据挖掘、合成生物技术以及检测技术的进步,对于内生真菌的研究会为紫杉醇的生物合成提供更加深入的见解. ...
An efficient transformation system of taxol-producing endophytic fungus EFY-21 (Ozonium sp.)
1
2010
... 研究人员发现与红豆杉物种共生的一些内生真菌也能够产生紫杉醇.Zhou等[77]从红豆杉中分离出一种产紫杉醇的内生真菌菌株,产量为125.7 μg/L,并且在诱变后提升产量到314.07 μg/L.赵凯等[78]通过物理、化学等诱变方法获得了产量为448.52 μg/L的高产菌株,并且通过原生质体融合的办法将紫杉醇的产量提高到468.62 μg/L.Wang等[79]首次利用REMI法获得了具有潮霉素B抗性的产紫杉醇真菌菌株BT2.无独有偶,Wei等[80]通过将真菌启动子trpC调控的潮霉素B磷酸转移酶基因转化到内生真菌基因组中,使得原生质体再生的频率高于6%.此两种办法成功开辟了将紫杉醇生物合成基因转移到改良真菌紫杉醇产量的可能性.Zhang等[81]使用农杆菌转化的办法获得了产紫杉醇的枝状枝孢(Cladosporium cladosporioides)菌株MD2,并且建立了高效稳定的真菌转化的最佳共培养条件.Liu等[82]建立了一种农杆菌介导的高效转化办法,用于分类产紫杉醇的内生真菌Ozonium sp. EFY21,并且优化了影响转化和转化体稳定性的几个因素.然而,这些研究都未将紫杉醇生物合成基因整合到转化真菌的基因组中.El-Sayed等[83]利用CRISPR/Cas9系统,通过敲除角鲨烯合酶和藜麦甾醇合酶,阻断丝状真菌中甾醇代谢途径,增加了紫杉醇的产量.总体而言,目前对于红豆杉内生真菌的研究相对偏少,相较于大肠杆菌、酵母菌、烟草底盘来说,红豆杉内生真菌的遗传操作和培养条件等相关研究并不是十分成熟,后续随着组学大数据挖掘、合成生物技术以及检测技术的进步,对于内生真菌的研究会为紫杉醇的生物合成提供更加深入的见解. ...
Agrobacterium tumefaciens-mediated transformation of a taxol-producing endophytic fungus, Cladosporium cladosporioides MD2
1
2011
... 研究人员发现与红豆杉物种共生的一些内生真菌也能够产生紫杉醇.Zhou等[77]从红豆杉中分离出一种产紫杉醇的内生真菌菌株,产量为125.7 μg/L,并且在诱变后提升产量到314.07 μg/L.赵凯等[78]通过物理、化学等诱变方法获得了产量为448.52 μg/L的高产菌株,并且通过原生质体融合的办法将紫杉醇的产量提高到468.62 μg/L.Wang等[79]首次利用REMI法获得了具有潮霉素B抗性的产紫杉醇真菌菌株BT2.无独有偶,Wei等[80]通过将真菌启动子trpC调控的潮霉素B磷酸转移酶基因转化到内生真菌基因组中,使得原生质体再生的频率高于6%.此两种办法成功开辟了将紫杉醇生物合成基因转移到改良真菌紫杉醇产量的可能性.Zhang等[81]使用农杆菌转化的办法获得了产紫杉醇的枝状枝孢(Cladosporium cladosporioides)菌株MD2,并且建立了高效稳定的真菌转化的最佳共培养条件.Liu等[82]建立了一种农杆菌介导的高效转化办法,用于分类产紫杉醇的内生真菌Ozonium sp. EFY21,并且优化了影响转化和转化体稳定性的几个因素.然而,这些研究都未将紫杉醇生物合成基因整合到转化真菌的基因组中.El-Sayed等[83]利用CRISPR/Cas9系统,通过敲除角鲨烯合酶和藜麦甾醇合酶,阻断丝状真菌中甾醇代谢途径,增加了紫杉醇的产量.总体而言,目前对于红豆杉内生真菌的研究相对偏少,相较于大肠杆菌、酵母菌、烟草底盘来说,红豆杉内生真菌的遗传操作和培养条件等相关研究并不是十分成熟,后续随着组学大数据挖掘、合成生物技术以及检测技术的进步,对于内生真菌的研究会为紫杉醇的生物合成提供更加深入的见解. ...
Agrobacterium tumefaciens-mediated genetic transformation of the taxol-producing endophytic fungus Ozonium sp EFY21
1
2013
... 研究人员发现与红豆杉物种共生的一些内生真菌也能够产生紫杉醇.Zhou等[77]从红豆杉中分离出一种产紫杉醇的内生真菌菌株,产量为125.7 μg/L,并且在诱变后提升产量到314.07 μg/L.赵凯等[78]通过物理、化学等诱变方法获得了产量为448.52 μg/L的高产菌株,并且通过原生质体融合的办法将紫杉醇的产量提高到468.62 μg/L.Wang等[79]首次利用REMI法获得了具有潮霉素B抗性的产紫杉醇真菌菌株BT2.无独有偶,Wei等[80]通过将真菌启动子trpC调控的潮霉素B磷酸转移酶基因转化到内生真菌基因组中,使得原生质体再生的频率高于6%.此两种办法成功开辟了将紫杉醇生物合成基因转移到改良真菌紫杉醇产量的可能性.Zhang等[81]使用农杆菌转化的办法获得了产紫杉醇的枝状枝孢(Cladosporium cladosporioides)菌株MD2,并且建立了高效稳定的真菌转化的最佳共培养条件.Liu等[82]建立了一种农杆菌介导的高效转化办法,用于分类产紫杉醇的内生真菌Ozonium sp. EFY21,并且优化了影响转化和转化体稳定性的几个因素.然而,这些研究都未将紫杉醇生物合成基因整合到转化真菌的基因组中.El-Sayed等[83]利用CRISPR/Cas9系统,通过敲除角鲨烯合酶和藜麦甾醇合酶,阻断丝状真菌中甾醇代谢途径,增加了紫杉醇的产量.总体而言,目前对于红豆杉内生真菌的研究相对偏少,相较于大肠杆菌、酵母菌、烟草底盘来说,红豆杉内生真菌的遗传操作和培养条件等相关研究并不是十分成熟,后续随着组学大数据挖掘、合成生物技术以及检测技术的进步,对于内生真菌的研究会为紫杉醇的生物合成提供更加深入的见解. ...
Genome editing approaches: manipulating of lovastatin and taxol synthesis of filamentous fungi by CRISPR/Cas9 system
1
2017
... 研究人员发现与红豆杉物种共生的一些内生真菌也能够产生紫杉醇.Zhou等[77]从红豆杉中分离出一种产紫杉醇的内生真菌菌株,产量为125.7 μg/L,并且在诱变后提升产量到314.07 μg/L.赵凯等[78]通过物理、化学等诱变方法获得了产量为448.52 μg/L的高产菌株,并且通过原生质体融合的办法将紫杉醇的产量提高到468.62 μg/L.Wang等[79]首次利用REMI法获得了具有潮霉素B抗性的产紫杉醇真菌菌株BT2.无独有偶,Wei等[80]通过将真菌启动子trpC调控的潮霉素B磷酸转移酶基因转化到内生真菌基因组中,使得原生质体再生的频率高于6%.此两种办法成功开辟了将紫杉醇生物合成基因转移到改良真菌紫杉醇产量的可能性.Zhang等[81]使用农杆菌转化的办法获得了产紫杉醇的枝状枝孢(Cladosporium cladosporioides)菌株MD2,并且建立了高效稳定的真菌转化的最佳共培养条件.Liu等[82]建立了一种农杆菌介导的高效转化办法,用于分类产紫杉醇的内生真菌Ozonium sp. EFY21,并且优化了影响转化和转化体稳定性的几个因素.然而,这些研究都未将紫杉醇生物合成基因整合到转化真菌的基因组中.El-Sayed等[83]利用CRISPR/Cas9系统,通过敲除角鲨烯合酶和藜麦甾醇合酶,阻断丝状真菌中甾醇代谢途径,增加了紫杉醇的产量.总体而言,目前对于红豆杉内生真菌的研究相对偏少,相较于大肠杆菌、酵母菌、烟草底盘来说,红豆杉内生真菌的遗传操作和培养条件等相关研究并不是十分成熟,后续随着组学大数据挖掘、合成生物技术以及检测技术的进步,对于内生真菌的研究会为紫杉醇的生物合成提供更加深入的见解. ...
QM/MM study of the taxadiene synthase mechanism
3
2019
... 在紫杉醇合成的前期途径中,尽管TS的催化能力有限,过程中亦有多种副产物产生[84-85],但它并不是紫杉醇生物合成途径中的关键限速步骤.一直以来,T5αOH催化紫杉二烯C5位羟化的步骤被认为是紫杉醇生物合成途径的关键限速步骤以及瓶颈[33].酶的定向进化是一种常用酶改造技术,其通过模拟基因突变与自然选择的原理,在短时间内对酶进行多轮突变与筛选.尽管定向进化领域取得了重大进展,但利用该方法设计紫杉醇途径的T5αOH和其他P450仍存在诸多挑战,如对于这些酶的催化机制认识不足且缺乏高通量的筛选方法.酶的理性及半理性改造方法将序列、结构、功能等信息作为基础,从而可以增加有利突变的概率,大大降低实验量.酶活性位点内的氨基酸取代有可能提高催化活性,但需要非常精确的构象调控才能在热力学灵活性和结构刚性之间保持一定的平衡[86].利用计算和实验相结合的方法来深入了解途径酶催化的途径,并以此指导蛋白质(半)理性设计工作,尤其是提升P450酶在底物识别和催化效率上的适应性.目前,在设计植物宿主途径方面也取得了显著的突破,这些突破有望解决紫杉醇生物合成中P450酶化学催化的挑战[71]. ...
... TS由862个氨基酸残基组成,包括N端一个由80个氨基酸残基组成的质体定位信号和由三个螺旋区域组合而成的催化活性部位[9].其中,C端功能域(S553-V862)由Ⅰ型萜类环化酶组成,N端结构域(M107-I135)和一个“插入”结构域(S349-Q552)是由一个退化的Ⅱ型萜类环化酶组成[87].Ⅰ型萜类环化酶利用三联金属簇连接保守基序DDXXD和(N,D)DXX(S,T)XXXE,激发异戊二烯基底物焦磷酸基团的电离,生成碳正离子,启动催化反应;Ⅱ型萜类环化酶利用DXDD基序中的天冬氨酸形成一般的酸催化作用,来质子化异戊二烯双键或氧环烷基,从而引发碳正离子的形成.尽管这两类萜类环化酶在蛋白折叠和底物激活机制上存在差异,TS的结构表明它们在萜烯生物合成的进化中显著相关[9].TS通过C端功能域行使催化功能.首先,三个Mg2+金属簇结合GGPP并触发焦磷酸的电离;随后,焦磷酸基团的水解过程导致碳正离子中间体的形成;与此同时,酶活性口袋发生了从开放到闭合状态的结构转变;之后,活泼的碳正离子经过多步重排和环化反应生成各种紫杉二烯异构体[84]. ...
... 中间过渡态的反应过程逐渐成为针对TS研究的热点问题,动力学和热力学计算分析表明,TS催化的碳正离子重排受到酶分子所处环境及其自身空间构象的影响.依赖于阳离子的定位、取向和构象改变的强静电相互作用,活性位点空间结构,以及活性位点水分子的存在都会导致反应能垒的变化和不同构型产物的生成[84].对于TS来说,它的活性口袋体积明显大于产物紫杉二烯,这样的空间冗余也是TS产物多样性的原因之一.与此同时,科学家对TS序列进行了多次的突变实验,研究发现除了Y688位点之外,753位的色氨酸残基是TS活性区域的另一关键位点,它通过π键正离子交互作用稳定中间态正离子,当它突变成组氨酸时紫杉二烯全部转化为另一种二萜产物松柏烯A[87-88]. ...
Slow-starter enzymes: role of active-site architecture in the catalytic control of the biosynthesis of taxadiene by taxadiene synthase
1
2018
... 在紫杉醇合成的前期途径中,尽管TS的催化能力有限,过程中亦有多种副产物产生[84-85],但它并不是紫杉醇生物合成途径中的关键限速步骤.一直以来,T5αOH催化紫杉二烯C5位羟化的步骤被认为是紫杉醇生物合成途径的关键限速步骤以及瓶颈[33].酶的定向进化是一种常用酶改造技术,其通过模拟基因突变与自然选择的原理,在短时间内对酶进行多轮突变与筛选.尽管定向进化领域取得了重大进展,但利用该方法设计紫杉醇途径的T5αOH和其他P450仍存在诸多挑战,如对于这些酶的催化机制认识不足且缺乏高通量的筛选方法.酶的理性及半理性改造方法将序列、结构、功能等信息作为基础,从而可以增加有利突变的概率,大大降低实验量.酶活性位点内的氨基酸取代有可能提高催化活性,但需要非常精确的构象调控才能在热力学灵活性和结构刚性之间保持一定的平衡[86].利用计算和实验相结合的方法来深入了解途径酶催化的途径,并以此指导蛋白质(半)理性设计工作,尤其是提升P450酶在底物识别和催化效率上的适应性.目前,在设计植物宿主途径方面也取得了显著的突破,这些突破有望解决紫杉醇生物合成中P450酶化学催化的挑战[71]. ...
Computational protein design for given backbone: recent progresses in general method-related aspects
1
2016
... 在紫杉醇合成的前期途径中,尽管TS的催化能力有限,过程中亦有多种副产物产生[84-85],但它并不是紫杉醇生物合成途径中的关键限速步骤.一直以来,T5αOH催化紫杉二烯C5位羟化的步骤被认为是紫杉醇生物合成途径的关键限速步骤以及瓶颈[33].酶的定向进化是一种常用酶改造技术,其通过模拟基因突变与自然选择的原理,在短时间内对酶进行多轮突变与筛选.尽管定向进化领域取得了重大进展,但利用该方法设计紫杉醇途径的T5αOH和其他P450仍存在诸多挑战,如对于这些酶的催化机制认识不足且缺乏高通量的筛选方法.酶的理性及半理性改造方法将序列、结构、功能等信息作为基础,从而可以增加有利突变的概率,大大降低实验量.酶活性位点内的氨基酸取代有可能提高催化活性,但需要非常精确的构象调控才能在热力学灵活性和结构刚性之间保持一定的平衡[86].利用计算和实验相结合的方法来深入了解途径酶催化的途径,并以此指导蛋白质(半)理性设计工作,尤其是提升P450酶在底物识别和催化效率上的适应性.目前,在设计植物宿主途径方面也取得了显著的突破,这些突破有望解决紫杉醇生物合成中P450酶化学催化的挑战[71]. ...
Natural and engineered production of taxadiene with taxadiene synthase
2
2015
... TS由862个氨基酸残基组成,包括N端一个由80个氨基酸残基组成的质体定位信号和由三个螺旋区域组合而成的催化活性部位[9].其中,C端功能域(S553-V862)由Ⅰ型萜类环化酶组成,N端结构域(M107-I135)和一个“插入”结构域(S349-Q552)是由一个退化的Ⅱ型萜类环化酶组成[87].Ⅰ型萜类环化酶利用三联金属簇连接保守基序DDXXD和(N,D)DXX(S,T)XXXE,激发异戊二烯基底物焦磷酸基团的电离,生成碳正离子,启动催化反应;Ⅱ型萜类环化酶利用DXDD基序中的天冬氨酸形成一般的酸催化作用,来质子化异戊二烯双键或氧环烷基,从而引发碳正离子的形成.尽管这两类萜类环化酶在蛋白折叠和底物激活机制上存在差异,TS的结构表明它们在萜烯生物合成的进化中显著相关[9].TS通过C端功能域行使催化功能.首先,三个Mg2+金属簇结合GGPP并触发焦磷酸的电离;随后,焦磷酸基团的水解过程导致碳正离子中间体的形成;与此同时,酶活性口袋发生了从开放到闭合状态的结构转变;之后,活泼的碳正离子经过多步重排和环化反应生成各种紫杉二烯异构体[84]. ...
... 中间过渡态的反应过程逐渐成为针对TS研究的热点问题,动力学和热力学计算分析表明,TS催化的碳正离子重排受到酶分子所处环境及其自身空间构象的影响.依赖于阳离子的定位、取向和构象改变的强静电相互作用,活性位点空间结构,以及活性位点水分子的存在都会导致反应能垒的变化和不同构型产物的生成[84].对于TS来说,它的活性口袋体积明显大于产物紫杉二烯,这样的空间冗余也是TS产物多样性的原因之一.与此同时,科学家对TS序列进行了多次的突变实验,研究发现除了Y688位点之外,753位的色氨酸残基是TS活性区域的另一关键位点,它通过π键正离子交互作用稳定中间态正离子,当它突变成组氨酸时紫杉二烯全部转化为另一种二萜产物松柏烯A[87-88]. ...
Identification of amino acid networks governing catalysis in the closed complex of class Ⅰ terpene synthases
2
2016
... 中间过渡态的反应过程逐渐成为针对TS研究的热点问题,动力学和热力学计算分析表明,TS催化的碳正离子重排受到酶分子所处环境及其自身空间构象的影响.依赖于阳离子的定位、取向和构象改变的强静电相互作用,活性位点空间结构,以及活性位点水分子的存在都会导致反应能垒的变化和不同构型产物的生成[84].对于TS来说,它的活性口袋体积明显大于产物紫杉二烯,这样的空间冗余也是TS产物多样性的原因之一.与此同时,科学家对TS序列进行了多次的突变实验,研究发现除了Y688位点之外,753位的色氨酸残基是TS活性区域的另一关键位点,它通过π键正离子交互作用稳定中间态正离子,当它突变成组氨酸时紫杉二烯全部转化为另一种二萜产物松柏烯A[87-88]. ...
... TS是紫杉醇的生物合成中的关键酶之一,通过TS的环化作用将代谢流引入紫杉醇合成途径.在发酵过程中,GGPP首先在紫杉二烯合酶(TS)的催化下环化生成93.2%的紫杉-4(5),11(12)-二烯,同时还会生成4.7%的紫杉-4(20),11(12)-二烯以及其他少量的二萜母核.随后,仅有10%的紫杉-4(5),11(12)-二烯被紫杉二烯-5α-羟化酶(T5αOH)转化成为目的产物紫杉-4(20),11(12)-二烯-5α-醇[32].但有证据表明对于其底物紫杉二烯而言,T5αOH对底物异紫杉二烯具有更高的亲和力[16].Stephanopoulos和翁经科研究组[32]通过对TS活性区域附近多处氨基酸进行突变研究,发现当第688位的酪氨酸突变为亮氨酸时紫杉-4(20),11(12)-二烯生产比例明显提高,随后将TSY688L突变体转化到T5αOH表达菌株后,使得紫杉二烯- 5α-醇产量提高了2.4倍.该研究表明,通过改造TS提高异紫杉二烯的产量,可以经过T5αOH催化直接进行P450加羟反应,避免经过环氧化物断裂过程,可以明显提高目标产物合成比例.随着TS的晶体结构被解析[9],对关键氨基酸位点进行突变研究也随之进行.Schrepfer等[88]根据其构建的模型,设计出突变体S713T、W753H、W753H/C830A、V584K/L/M、S587A、V714A/I、S713T、C803A/S和Y841F,研究发现这些突变体均未丧失催化活性,其中S713T还具有97.4%的酶活性. ...
Orthogonal assays clarify the oxidative biochemistry of taxol P450 CYP725A4
1
2016
... 目前,针对T5αOH的催化机制研究主要集中在自由基-反弹机制和环氧化机制[31,89].Yadav等[34]推测氧铁基团在C3位、C13位、C20位的竞争性质子提取过程是导致T5αOH氧化产物多样性的原因.Edgar等[31-32]推测紫杉二烯首先被T5αOH催化成不稳定的环氧化合物中间体,随后环氧化物进行非特异性断裂,从而生成包括紫杉二烯-5α-醇在内的多种氧化产物,遵循环氧化机制.与此同时,同分异构体异紫杉二烯可以避免经过环氧化合物断裂过程,依然通过正常的P450酶自由基-反弹机制特异性地生成目标产物紫杉二烯-5α-醇.而Barton等[90]发现紫杉二烯-4(5)-环氧化物对酸敏感,在不同的化学条件可以产生不同的重排产物,尤其是暴露在铁卟啉下时极易发生重排.这对紫杉二烯-4(5)-环氧化物作为合格中间体的角色提出了新的挑战.自从T5αOH于1996年在红豆杉中首次发现,研究人员进行了包括N端修饰、电子传递链优化、核糖体开关调控、静息细胞培养、内质网改造、区室化等一系列改造,并对催化温度、O2、pH、辅因子等条件也进行了大量的优化[61,71].但是在T5αOH酶分子改造方面,目前一直没有重大的突破.Yadav等[34]使用6个P450结构作为模板构建了T5αOH的同源模型,并在此基础上设计了53个突变体,其中有6个突变体,其转化率和T5α-ol选择性方面都有所提高.其中的两个突变体K131R和V374L分别表现出牺牲选择性而提高转化率和牺牲转化率而提高选择性的性质.基于对紫杉醇合成关键基因簇的深度解析,本课题组对喜马拉雅红豆杉来源的CYP725A亚家族候选序列进行了大规模的功能筛选,发现T5αOH生成两个拷贝同工酶T5αOH-1和T5αOH-2,经过实验验证都具有催化紫杉二烯C5位羟基化的功能,然而其催化性能相较于已报道的T5αOH并没有任何改善[41]. ...
Accessing low-oxidation state taxanes: is taxadiene-4(5)-epoxide on the taxol biosynthetic pathway?
1
2016
... 目前,针对T5αOH的催化机制研究主要集中在自由基-反弹机制和环氧化机制[31,89].Yadav等[34]推测氧铁基团在C3位、C13位、C20位的竞争性质子提取过程是导致T5αOH氧化产物多样性的原因.Edgar等[31-32]推测紫杉二烯首先被T5αOH催化成不稳定的环氧化合物中间体,随后环氧化物进行非特异性断裂,从而生成包括紫杉二烯-5α-醇在内的多种氧化产物,遵循环氧化机制.与此同时,同分异构体异紫杉二烯可以避免经过环氧化合物断裂过程,依然通过正常的P450酶自由基-反弹机制特异性地生成目标产物紫杉二烯-5α-醇.而Barton等[90]发现紫杉二烯-4(5)-环氧化物对酸敏感,在不同的化学条件可以产生不同的重排产物,尤其是暴露在铁卟啉下时极易发生重排.这对紫杉二烯-4(5)-环氧化物作为合格中间体的角色提出了新的挑战.自从T5αOH于1996年在红豆杉中首次发现,研究人员进行了包括N端修饰、电子传递链优化、核糖体开关调控、静息细胞培养、内质网改造、区室化等一系列改造,并对催化温度、O2、pH、辅因子等条件也进行了大量的优化[61,71].但是在T5αOH酶分子改造方面,目前一直没有重大的突破.Yadav等[34]使用6个P450结构作为模板构建了T5αOH的同源模型,并在此基础上设计了53个突变体,其中有6个突变体,其转化率和T5α-ol选择性方面都有所提高.其中的两个突变体K131R和V374L分别表现出牺牲选择性而提高转化率和牺牲转化率而提高选择性的性质.基于对紫杉醇合成关键基因簇的深度解析,本课题组对喜马拉雅红豆杉来源的CYP725A亚家族候选序列进行了大规模的功能筛选,发现T5αOH生成两个拷贝同工酶T5αOH-1和T5αOH-2,经过实验验证都具有催化紫杉二烯C5位羟基化的功能,然而其催化性能相较于已报道的T5αOH并没有任何改善[41]. ...
Unraveling the catalytic mechanism of taxadiene-5α-hydroxylase from crystallography and computational analyses
1
2024
... 2024年本课题组与厦门大学王斌举以及北京大学常振战课题组[91]合作,采用了X射线晶体学、分子动力学(MD)模拟、量子力学/分子力学(QM/MM)计算和QM计算的组合,阐明了CYP725A4与紫杉二烯复合物的晶体结构;通过全面的计算分析,解释了CYP725A4在天然紫杉醇生物合成中的催化机制.研究结果表明,紫杉二烯的氧化提供了两性离子中间体,其可以经历两种竞争的转化路线.一种涉及环氧化物的形成,环氧化物进一步经历水介导的重排形成紫杉二烯-5α-醇产物.在替代途径中,两性离子中间体中氧的质子化促进随后的氢迁移和碳-氧偶联,产生副产物OCT/iso-OCT.与紫杉二烯相反,异紫杉二烯在C5处羟基化直接产生目标产物紫杉二烯-5α-醇.这些晶体学研究和计算分析对CYP725A4的催化机制提出了有价值的见解,并为CYP725A4的进一步工程化奠定了基础. ...
Improving 10-deacetylbaccatin Ⅲ-10-β-O-acetyltransferase catalytic fitness for Taxol production
1
2017
... 近些年来,由于对T5αOH的底物选择性改造和催化活性提升改造较为困难,更多的课题组致力于对其下游途径中DBAT的改造.Li等[92]对DBAT使用丙氨酸扫描识别了其活性位点,设计出的双突变体(G38R/F301V)与野生型DBAT相比,催化效率提高了6倍,单点突变体(G38R)的催化效率提高了2.15倍.其分子对接结果还揭示了 His162在DBAT催化中的关键作用,进行丙氨酸扫描时发现其中4个残基(H162、R363、G361和I164)突变为丙氨酸时会导致活性完全丧失.Lin等[93]借助半理性策略进行设计,产生了双突变体(I43S/D390R),不仅提高了催化效率,而且可以更有效地利用乙酸乙烯酯,这是一种比乙酰CoA 更便宜的酰基供体. ...
Bio-production of baccatin Ⅲ, an important precursor of paclitaxel by a cost-effective approach
1
2018
... 近些年来,由于对T5αOH的底物选择性改造和催化活性提升改造较为困难,更多的课题组致力于对其下游途径中DBAT的改造.Li等[92]对DBAT使用丙氨酸扫描识别了其活性位点,设计出的双突变体(G38R/F301V)与野生型DBAT相比,催化效率提高了6倍,单点突变体(G38R)的催化效率提高了2.15倍.其分子对接结果还揭示了 His162在DBAT催化中的关键作用,进行丙氨酸扫描时发现其中4个残基(H162、R363、G361和I164)突变为丙氨酸时会导致活性完全丧失.Lin等[93]借助半理性策略进行设计,产生了双突变体(I43S/D390R),不仅提高了催化效率,而且可以更有效地利用乙酸乙烯酯,这是一种比乙酰CoA 更便宜的酰基供体. ...
Combinatorial mutation on the β-glycosidase specific to 7-β-xylosyltaxanes and increasing the mutated enzyme production by engineering the recombinant yeast
1
2019
... 目前,来自苗圃培育的红豆杉属植物的紫杉醇是临床供应的主要来源之一,但是其天然含量极低,范围为0~0.069%,且在树皮中含量最高.相比之下,其类似物7-β-木糖基-10-去乙酰紫杉醇(XDT)的含量普遍远高于紫杉醇.通常,如果 XDT的木糖基被去除,则相应的10-去乙酰紫杉醇(DT)可以通过C10位置的乙酰化转化为紫杉醇.Chen等[94]对从真菌来源的糖苷水解酶LXYL-P1-1和LXYL-P1-2的11个位点进行单个和多个定点突变,以定义有利于活性提高的氨基酸位点,并获得具有改进的催化特性的突变体.在所有17个突变体中,E12(A72T/V91S)的β-木糖苷酶和β-葡萄糖苷酶活性最活跃,甚至比LXYL-P1-2高2.8倍和3倍.在紫杉醇提取过程中,这种类似物通常被丢弃,导致资源浪费和潜在的环境污染.若将XDT用于紫杉醇半合成,对降低生物转化成本具有重要的现实意义. ...
产紫杉醇内生真菌研究的回顾、进展及趋势
1
2017
... 紫杉醇作为目前已发现的最优秀的天然抗癌药物,其合成经历了多元化发展的阶段.目前应用最多的依然是半合成法[6],来自Bristol Meyers Squibb(美国百时美施贵宝公司)的市售紫杉醇是通过使用Holton-Ojima方法,以10-去乙酰巴卡亭Ⅲ为前体,紫杉醇的产率可达到90%.但半合成前体的来源(10-去乙酰巴卡亭Ⅲ或者巴卡亭Ⅲ)仍然是通过珍稀植物红豆杉植物提取的方法获得,10-去乙酰巴卡亭Ⅲ或者巴卡亭Ⅲ的生产受到严重的限制,需要通过异源合成来进行大量生产优化.内生真菌培养方法得到了一定的研究,但其产量低、不稳定,没有进一步工业化的相关报道[36,95].植物细胞培养技术提供了另一种在工业水平可持续生产紫杉醇的方法[96],Phyton使用专有的植物细胞发酵(PCF®)技术生产紫杉醇,直接从悬浮细胞生产天然药物成分[97].近年来,不同品种的红豆杉植物资源大规模基因组测序与解析工作相继完成,合成生物学的迅速发展为紫杉醇的异源合成创造了良好的条件. ...
Progress and trends on researches of taxol-producing endophytic fungi
1
2017
... 紫杉醇作为目前已发现的最优秀的天然抗癌药物,其合成经历了多元化发展的阶段.目前应用最多的依然是半合成法[6],来自Bristol Meyers Squibb(美国百时美施贵宝公司)的市售紫杉醇是通过使用Holton-Ojima方法,以10-去乙酰巴卡亭Ⅲ为前体,紫杉醇的产率可达到90%.但半合成前体的来源(10-去乙酰巴卡亭Ⅲ或者巴卡亭Ⅲ)仍然是通过珍稀植物红豆杉植物提取的方法获得,10-去乙酰巴卡亭Ⅲ或者巴卡亭Ⅲ的生产受到严重的限制,需要通过异源合成来进行大量生产优化.内生真菌培养方法得到了一定的研究,但其产量低、不稳定,没有进一步工业化的相关报道[36,95].植物细胞培养技术提供了另一种在工业水平可持续生产紫杉醇的方法[96],Phyton使用专有的植物细胞发酵(PCF®)技术生产紫杉醇,直接从悬浮细胞生产天然药物成分[97].近年来,不同品种的红豆杉植物资源大规模基因组测序与解析工作相继完成,合成生物学的迅速发展为紫杉醇的异源合成创造了良好的条件. ...
南方红豆杉细胞悬浮培养体系优化及动力学研究
1
2019
... 紫杉醇作为目前已发现的最优秀的天然抗癌药物,其合成经历了多元化发展的阶段.目前应用最多的依然是半合成法[6],来自Bristol Meyers Squibb(美国百时美施贵宝公司)的市售紫杉醇是通过使用Holton-Ojima方法,以10-去乙酰巴卡亭Ⅲ为前体,紫杉醇的产率可达到90%.但半合成前体的来源(10-去乙酰巴卡亭Ⅲ或者巴卡亭Ⅲ)仍然是通过珍稀植物红豆杉植物提取的方法获得,10-去乙酰巴卡亭Ⅲ或者巴卡亭Ⅲ的生产受到严重的限制,需要通过异源合成来进行大量生产优化.内生真菌培养方法得到了一定的研究,但其产量低、不稳定,没有进一步工业化的相关报道[36,95].植物细胞培养技术提供了另一种在工业水平可持续生产紫杉醇的方法[96],Phyton使用专有的植物细胞发酵(PCF®)技术生产紫杉醇,直接从悬浮细胞生产天然药物成分[97].近年来,不同品种的红豆杉植物资源大规模基因组测序与解析工作相继完成,合成生物学的迅速发展为紫杉醇的异源合成创造了良好的条件. ...
Study on optimization of cell suspension culture system and kinetics of Taxus chinensis var. mairer
1
2019
... 紫杉醇作为目前已发现的最优秀的天然抗癌药物,其合成经历了多元化发展的阶段.目前应用最多的依然是半合成法[6],来自Bristol Meyers Squibb(美国百时美施贵宝公司)的市售紫杉醇是通过使用Holton-Ojima方法,以10-去乙酰巴卡亭Ⅲ为前体,紫杉醇的产率可达到90%.但半合成前体的来源(10-去乙酰巴卡亭Ⅲ或者巴卡亭Ⅲ)仍然是通过珍稀植物红豆杉植物提取的方法获得,10-去乙酰巴卡亭Ⅲ或者巴卡亭Ⅲ的生产受到严重的限制,需要通过异源合成来进行大量生产优化.内生真菌培养方法得到了一定的研究,但其产量低、不稳定,没有进一步工业化的相关报道[36,95].植物细胞培养技术提供了另一种在工业水平可持续生产紫杉醇的方法[96],Phyton使用专有的植物细胞发酵(PCF®)技术生产紫杉醇,直接从悬浮细胞生产天然药物成分[97].近年来,不同品种的红豆杉植物资源大规模基因组测序与解析工作相继完成,合成生物学的迅速发展为紫杉醇的异源合成创造了良好的条件. ...
Synthetic biology of plant natural products: from pathway elucidation to engineered biosynthesis in plant cells
1
2021
... 紫杉醇作为目前已发现的最优秀的天然抗癌药物,其合成经历了多元化发展的阶段.目前应用最多的依然是半合成法[6],来自Bristol Meyers Squibb(美国百时美施贵宝公司)的市售紫杉醇是通过使用Holton-Ojima方法,以10-去乙酰巴卡亭Ⅲ为前体,紫杉醇的产率可达到90%.但半合成前体的来源(10-去乙酰巴卡亭Ⅲ或者巴卡亭Ⅲ)仍然是通过珍稀植物红豆杉植物提取的方法获得,10-去乙酰巴卡亭Ⅲ或者巴卡亭Ⅲ的生产受到严重的限制,需要通过异源合成来进行大量生产优化.内生真菌培养方法得到了一定的研究,但其产量低、不稳定,没有进一步工业化的相关报道[36,95].植物细胞培养技术提供了另一种在工业水平可持续生产紫杉醇的方法[96],Phyton使用专有的植物细胞发酵(PCF®)技术生产紫杉醇,直接从悬浮细胞生产天然药物成分[97].近年来,不同品种的红豆杉植物资源大规模基因组测序与解析工作相继完成,合成生物学的迅速发展为紫杉醇的异源合成创造了良好的条件. ...
多组学助力紫杉醇合成生物学研究
1
2022
... 红豆杉基因组测序与解析工作的开展以及近期对于氧杂环丁烷环形成机制的研究进展和其他未知催化步骤的鉴定,推动了紫杉醇生物合成途径的解析和异源合成的进步.未来可以对包括CYP725家族在内的红豆杉来源的P450酶分布规律进行更加系统的研究,明确反应步骤,完善紫杉醇的生物合成途径[98].近年来,微生物和烟草细胞体系的构建日趋完善,也极大地助力了紫杉醇中间产物的生物合成.总体来说,紫杉醇前体物质在不同宿主底盘的异源合成均面临一个共同的问题,即早期途径中TS、T5αOH催化功能的混杂性和催化能力差的问题,期待未来通过多物种筛选、理性设计和机器学习的方法进一步得到改进.未来可以通过以下几个方面的工作进一步促进对紫杉醇生物合成相关研究的推进.例如:结合生物信息学分析和高灵敏度检测筛选技术对紫杉醇合成途径中尚未发现的催化元件进行功能鉴定,进一步完善其合成通路;结合结构解析和计算模拟分析关键中间体和关键酶催化机制;通过对关键P450酶进化机制与催化机理解析,结合理性设计方法对低活性P450酶进行改造优化,提高催化活性;将紫杉醇合成模块在烟草细胞或者工程真核微生物中进行有效组装,分析植物细胞中有助于紫杉醇合成途径表达的辅酶、辅因子,增强前体供应,优化蛋白表达,实现紫杉醇的异源合成;另外,可以将化学合成方法和生物合成方法的优势进行有机结合、取长补短,实现紫杉醇绿色、高效合成.相关研究的开展对进一步阐明紫杉醇的生物合成机制,突破关键催化元件的限制性瓶颈,以及进一步推动紫杉醇及相关化合物的合成生物学研究都具有重要科学意义. ...
Recent progress of paclitaxel biosynthesis aided by multi-omics
1
2022
... 红豆杉基因组测序与解析工作的开展以及近期对于氧杂环丁烷环形成机制的研究进展和其他未知催化步骤的鉴定,推动了紫杉醇生物合成途径的解析和异源合成的进步.未来可以对包括CYP725家族在内的红豆杉来源的P450酶分布规律进行更加系统的研究,明确反应步骤,完善紫杉醇的生物合成途径[98].近年来,微生物和烟草细胞体系的构建日趋完善,也极大地助力了紫杉醇中间产物的生物合成.总体来说,紫杉醇前体物质在不同宿主底盘的异源合成均面临一个共同的问题,即早期途径中TS、T5αOH催化功能的混杂性和催化能力差的问题,期待未来通过多物种筛选、理性设计和机器学习的方法进一步得到改进.未来可以通过以下几个方面的工作进一步促进对紫杉醇生物合成相关研究的推进.例如:结合生物信息学分析和高灵敏度检测筛选技术对紫杉醇合成途径中尚未发现的催化元件进行功能鉴定,进一步完善其合成通路;结合结构解析和计算模拟分析关键中间体和关键酶催化机制;通过对关键P450酶进化机制与催化机理解析,结合理性设计方法对低活性P450酶进行改造优化,提高催化活性;将紫杉醇合成模块在烟草细胞或者工程真核微生物中进行有效组装,分析植物细胞中有助于紫杉醇合成途径表达的辅酶、辅因子,增强前体供应,优化蛋白表达,实现紫杉醇的异源合成;另外,可以将化学合成方法和生物合成方法的优势进行有机结合、取长补短,实现紫杉醇绿色、高效合成.相关研究的开展对进一步阐明紫杉醇的生物合成机制,突破关键催化元件的限制性瓶颈,以及进一步推动紫杉醇及相关化合物的合成生物学研究都具有重要科学意义. ...