|
||
|
蛋白质工程在医药产业中的应用
合成生物学
2025, 6 (1):
65-86.
DOI:10.12211/2096-8280.2024-061
蛋白质工程,通过定向进化、半理性或理性设计、计算机辅助设计等手段,实现对蛋白质特定功能的设计和改造,获得的工程化蛋白质在食品、医药、能源、材料等行业具有重要的应用价值。在医药化工领域,工程化酶可作为化学原料药及其中间体合成的高效生物催化剂,实现医药工业绿色制造。在生物制药领域,多肽或蛋白修饰酶的改造可显著提升候选药物的制备效率,诊断酶的改造则可以大幅增强检测的准确性和灵敏度。此外,蛋白质工程在提升治疗性酶和治疗性抗体等生物制剂的生物活性、增强药物稳定性、降低免疫原性等方面也发挥重要作用,从而提高药物的可开发性、安全性和有效性。因此,本文简要回顾了蛋白质工程的发展历程,具体阐述了其在化学原料药合成和生物制药两大产业中的一系列应用实例,旨在剖析蛋白质工程在科技成果转化及医药产业应用中存在的问题与挑战,并展望医药产业中蛋白质工程的未来发展方向,以期为促进产学研一体化发展提供借鉴。  View image in article
图2
LovD9利用非天然酰基供体DMB-S-MMP催化monacolin J的酰化合成辛伐他汀
正文中引用本图/表的段落
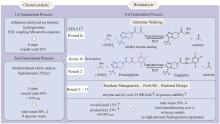
酰基转移酶(acyltransferase,EC 2.3.1.X)催化酰基从供体分子转移到受体分子的羟基、氨基或巯基上,从而产生酰基酯衍生物。2006年,唐奕课题组[67]发现洛伐他汀生物合成基因簇编码的LovD对酰基载体、酰基底物和十氢萘酰基受体有一定的杂泛性。以DMB-S-NAC和DMB-S-MMP等多种硫酯作为酰基供体,用全细胞催化对莫那可林J的C-8位羟基实现了区域选择性的酰基化[66](图2)。这意味着从洛伐他汀到辛伐他汀的合成过程被极大简化。2009年,该课题组通过有限的突变将LovD催化辛伐他汀合成这一非天然反应的kcat提高了5倍[68]。Codexis研究团队获得了工艺许可之后进一步对酶和工艺进行了优化,基于ProSAR对LovD进行了9轮定向进化[69-71],建库216个,筛选突变体61 779个,最终获得了含有29个突变的LovD9。LovD9催化辛伐他汀合成的kcat/Km是野生型LovD的330倍,产生辛伐他汀的效率是LovD的1000倍。一些企业使用该酶和工艺实现了辛伐他汀的大规模生产。Codexis公司和唐奕教授因此获得EPA颁发的“总统绿色化学挑战:2012年更绿色合成途径奖”[72]。LovD9对天然底物α-甲基丁基-酰基载体蛋白(acyl carrier protein,ACP)的活性完全丧失。LovD被改造为了一个能够接受小的游离酰基硫酯,而不再需要ACP的酶。分析突变体晶体结构发现,在进化过程中底物通道逐渐变窄使得LovF的ACP结构域无法进入活性位点。通过较长时间尺度(1~1.5 μs)的分子动力学模拟发现,突变显著改变了催化残基的构象动力学[71]。此外该研究团队还从理性设计的角度对LovD9定向进化的路径进行了阐释[73],为这类酶的改造提供了宝贵经验。
活性↑,稳定性↑ ... Improved Lov-D acyltransferase mediated acylation 1 ... 酰基转移酶(acyltransferase,EC 2.3.1.X)催化酰基从供体分子转移到受体分子的羟基、氨基或巯基上,从而产生酰基酯衍生物.2006年,唐奕课题组[ Variant LovD polypeptides and their uses 0 The role of distant mutations and allosteric regulation on LovD active site dynamics 2 2014 ... 酰基转移酶(acyltransferase,EC 2.3.1.X)催化酰基从供体分子转移到受体分子的羟基、氨基或巯基上,从而产生酰基酯衍生物.2006年,唐奕课题组[
本文的其它图/表
|