|
||
|
Research on live biotherapeutic products in metabolic diseases
Synthetic Biology Journal
DOI: 10.12211/2096-8280.2025-024
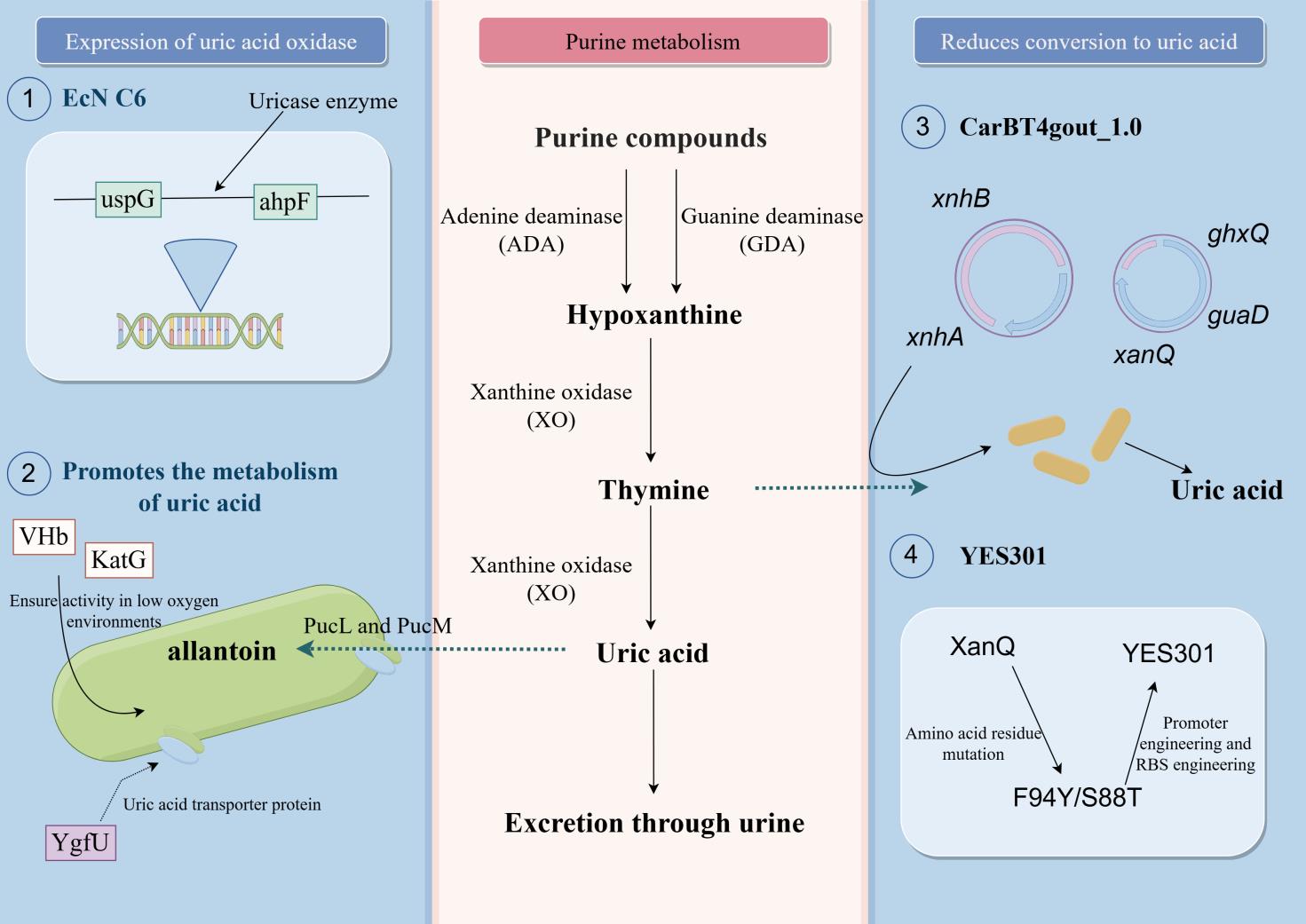
Fig. 2
The pathway of uric acid production in the human body and corresponding LBP treatment program
Extracts from the Article
高尿酸血症(Hyperuricemia, HUA)是一种常见的代谢性疾病,由体内尿酸过度积累导致。尿酸在人体内由黄嘌呤和次黄嘌呤通过黄嘌呤氧化酶的氧化作用产生(图2)。然而,人体内源尿酸氧化酶(UOX)因发生无义突变而失活,无法降解尿酸。人体内的尿酸主要由肾脏排出体外,但约有1/3的尿酸通过肠道排出[21-22]。目前,高尿酸血症的治疗主要是通过黄嘌呤氧化酶抑制剂来减少尿酸的产生,但该类药物存在一定毒副作用[23]。因此,有待一种高效且毒副作用小的治疗方法治疗或缓解高尿酸血症。
促进尿酸的代谢是治疗HUA的关键,且肠道中存在一定的尿酸积累。因此构建活体生物药异源表达尿酸氧化酶是一种可行的降尿酸策略。2022年,夏永振团队在天然益生菌EcN中设计了尿酸降解途径[24](图2)。研究人员异源表达了来自枯草芽孢杆菌(Bacillus subtilis)的尿酸氧化酶PucL和PucM。经过PucL和PucM的酶促反应,尿酸最终转化为对人体无害的尿囊素。为促进尿酸在工程菌内的富集和转化,研究团队引入了尿酸转运蛋白YgfU、大肠杆菌过氧化氢酶KatG(可降解反应中产生的过氧化氢)和细菌血红蛋白VHb(提供氧气作为电子受体)。体外研究表明,重组EcN菌株可在常氧和缺氧条件下有效降解UA。动物实验表明,该菌株能高效降解HUA小鼠模型肠道和血液中的尿酸。此外,胡杨波团队于2022年的研究揭示了细菌中尿酸酶的亚细胞定位对其活性具有显著影响[25]。该团队以产朊假丝酵母NRRL Y-1542(Cyberlindnera jadinii)来源的尿酸氧化酶基因为研究对象,通过融合不同的分泌信号肽,探究了尿酸氧化酶在不同空间位置的活性表现。结果表明,将FtsP信号肽与尿酸氧化酶融合,使其在EcN的周质空间表达,能够显著提高尿酸降解效率。通过分析EcN的转录组数据,研究人员还发现了一个自身转录极低但周围高度转录的非编码区。据此,研究人员将编码尿酸酶的基因片段插入到相应位点,构建了EcN C6(图2)。该菌株具有周质尿酸酶的隔离表达,可在体外降解尿酸。通过高尿酸血症大鼠和小鼠的体内实验,研究人员验证了EcN C6菌株能降低血清尿酸水平、缓解肾脏炎症和损伤、改善肠道菌群失调。
HUA的病理基础是尿酸的过度积累。因此,减少嘌呤向尿酸的转化也是治疗HUA的有效策略之一。张雁团队已鉴定并表征了梭菌属和部分细菌中编码厌氧嘌呤分解途径的基因簇[26]。其中,嘌呤分解酶XnhA和XnhB可直接厌氧降解黄嘌呤,从而规避尿酸的生成。基于此,研究团队将二者引入EcN,并通过CRISPR辅助同源重组引入了黄嘌呤转运酶基因xanQ、鸟嘌呤脱氨酶基因guaD以及嘌呤/次黄嘌呤通透酶基因ghxQ,最终得到菌株CarBT4gout_1.0(图2)。研究表明,口服补充CarBT4gout_1.0可使高尿酸血症黑腹果蝇模型尿酸水平下降59%,有效降低了尿酸盐结核的形成。该研究不仅挖掘了降解嘌呤的全新基因簇,而且证实了活体生物药减少嘌呤向尿酸转化是降解尿酸的有效方案。2024年,叶邦策团队在EcN中过表达了黄嘌呤转运蛋白(XanQ),以提高其对黄嘌呤的吸收能力[27]。研究人员通过计算生物学分析XanQ后,对其进行饱和突变以筛选高活性变体。随后,通过启动子工程和RBS工程优化突变XanQ蛋白的表达水平,最终得到工程益生菌YES301(图2)。与野生型菌株相比,其黄嘌呤和次黄嘌呤转运能力分别增加了8.6倍和4.0倍。高尿酸血症小鼠模型口服YES301后,其血清尿酸水平显著降低至生理范围内,同时小鼠的肾脏损伤得到缓解。重要的是,YES301表现出与临床药物别嘌呤醇相当的疗效,且副作用更少、生物相容性更高。该研究同样证实了通过LBP减少嘌呤向尿酸转化是可行的策略。
目前,活体生物药开发所用到的底盘种类有限,且部分底盘缺少高效的工具或系统.但随着活体生物药展现出巨大潜力,越来越多的研究团队开始拓展可应用于活体生物药的益生菌,同时开发相关的遗传工具与系统[ CBT102-A by CommBio Therapeutics for Phenylketonuria (PKU): Likelihood of Approval 1 ... 目前,PKU的活体生物药已通过初步的临床试验和动物试验验证其有效性.前述工程菌株SYNB1934和SYNB1618已完成Ⅱ期临床试验,结果显示SYNB1618和SYNB1934分别可降低血浆苯丙氨酸约20%和34%.试验过程中未观察到与药物相关的不良反应[ 一种重组肠杆菌及其在降解酪氨酸和苯丙氨酸中的应用 1 ... 除此之外,苏州优信合生技术有限公司同样以EcN为底盘构建了治疗PKU的工程菌株[ 活体生物药:生物技术推动的创新药研发前沿 1 2023 ... 除此之外,苏州优信合生技术有限公司同样以EcN为底盘构建了治疗PKU的工程菌株[ Hyperuricemia and its related diseases: mechanisms and advances in therapy 1 2024 ... 高尿酸血症(Hyperuricemia, HUA)是一种常见的代谢性疾病,由体内尿酸过度积累导致.尿酸在人体内由黄嘌呤和次黄嘌呤通过黄嘌呤氧化酶的氧化作用产生( Role of the intestinal tract in the elimination of uric acid 1 1965 ... 高尿酸血症(Hyperuricemia, HUA)是一种常见的代谢性疾病,由体内尿酸过度积累导致.尿酸在人体内由黄嘌呤和次黄嘌呤通过黄嘌呤氧化酶的氧化作用产生( The treatment of hyperuricemia 1 2016 ... 高尿酸血症(Hyperuricemia, HUA)是一种常见的代谢性疾病,由体内尿酸过度积累导致.尿酸在人体内由黄嘌呤和次黄嘌呤通过黄嘌呤氧化酶的氧化作用产生( Engineered Escherichia coli Nissle 1917 with urate oxidase and an oxygen-recycling system for hyperuricemia treatment 1 2022 ... 促进尿酸的代谢是治疗HUA的关键,且肠道中存在一定的尿酸积累.因此构建活体生物药异源表达尿酸氧化酶是一种可行的降尿酸策略.2022年,夏永振团队在天然益生菌EcN中设计了尿酸降解途径[ Rational design of a genome-based insulated system in facilitates heterologous uricase expression for hyperuricemia treatment 1 2023 ... 促进尿酸的代谢是治疗HUA的关键,且肠道中存在一定的尿酸积累.因此构建活体生物药异源表达尿酸氧化酶是一种可行的降尿酸策略.2022年,夏永振团队在天然益生菌EcN中设计了尿酸降解途径[ Anaerobic purinolytic enzymes enable dietary purine clearance by engineered gut bacteria 1 2023 ... HUA的病理基础是尿酸的过度积累.因此,减少嘌呤向尿酸的转化也是治疗HUA的有效策略之一.张雁团队已鉴定并表征了梭菌属和部分细菌中编码厌氧嘌呤分解途径的基因簇[ Empowering probiotics with high xanthine transport for effective hyperuricemia management 1 2024 ... HUA的病理基础是尿酸的过度积累.因此,减少嘌呤向尿酸的转化也是治疗HUA的有效策略之一.张雁团队已鉴定并表征了梭菌属和部分细菌中编码厌氧嘌呤分解途径的基因簇[ Pathophysiology and Treatment of Enteric Hyperoxaluria 1 2021 ... 肠源性高草酸尿症(enteric hyperoxaluria, EH)是由饮食中草酸盐的过度吸收而导致慢性肾结石和肾衰竭的一种代谢性疾病.草酸盐和钙结合形成草酸钙(calcium oxalate,CaOx)盐,这些盐类极难溶解,并组织成反复发作的尿路结石和肾钙化,导致肾脏逐渐受损,最终导致终末期肾病[ Oxalobacter formigenes: A new hope as a live biotherapeutic agent in the management of calcium oxalate renal stones 1 2022 ... 微生物中,产甲酸草酸杆菌(Oxalobacter formigenes, OF)在人类草酸盐代谢中的作用已被广泛研究.草酸/甲酸盐逆向转运蛋白(OxlT)通过协同甲酸盐的逆向转运将草酸盐转运到细胞质中.甲酰辅酶A转移酶(Frc)将辅酶A从甲酰辅酶A转移至草酸盐,生成草酰辅酶A和甲酸.草酰辅酶A经草酰辅酶A脱羧酶(OxdC)脱羧产生甲酰辅酶A和CO2,以进行下一轮循环[ An engineered bacterial therapeutic lowers urinary oxalate in preclinical models and in silico simulations of enteric hyperoxaluria 2 2022 ... 微生物中,产甲酸草酸杆菌(Oxalobacter formigenes, OF)在人类草酸盐代谢中的作用已被广泛研究.草酸/甲酸盐逆向转运蛋白(OxlT)通过协同甲酸盐的逆向转运将草酸盐转运到细胞质中.甲酰辅酶A转移酶(Frc)将辅酶A从甲酰辅酶A转移至草酸盐,生成草酰辅酶A和甲酸.草酰辅酶A经草酰辅酶A脱羧酶(OxdC)脱羧产生甲酰辅酶A和CO2,以进行下一轮循环[
Other Images/Table from this Article
|