|
||
|
Advances in the Application of CRISPR/Cas Systems in Molecular Diagnostics
Synthetic Biology Journal
DOI: 10.12211/2096-8280.2025-042
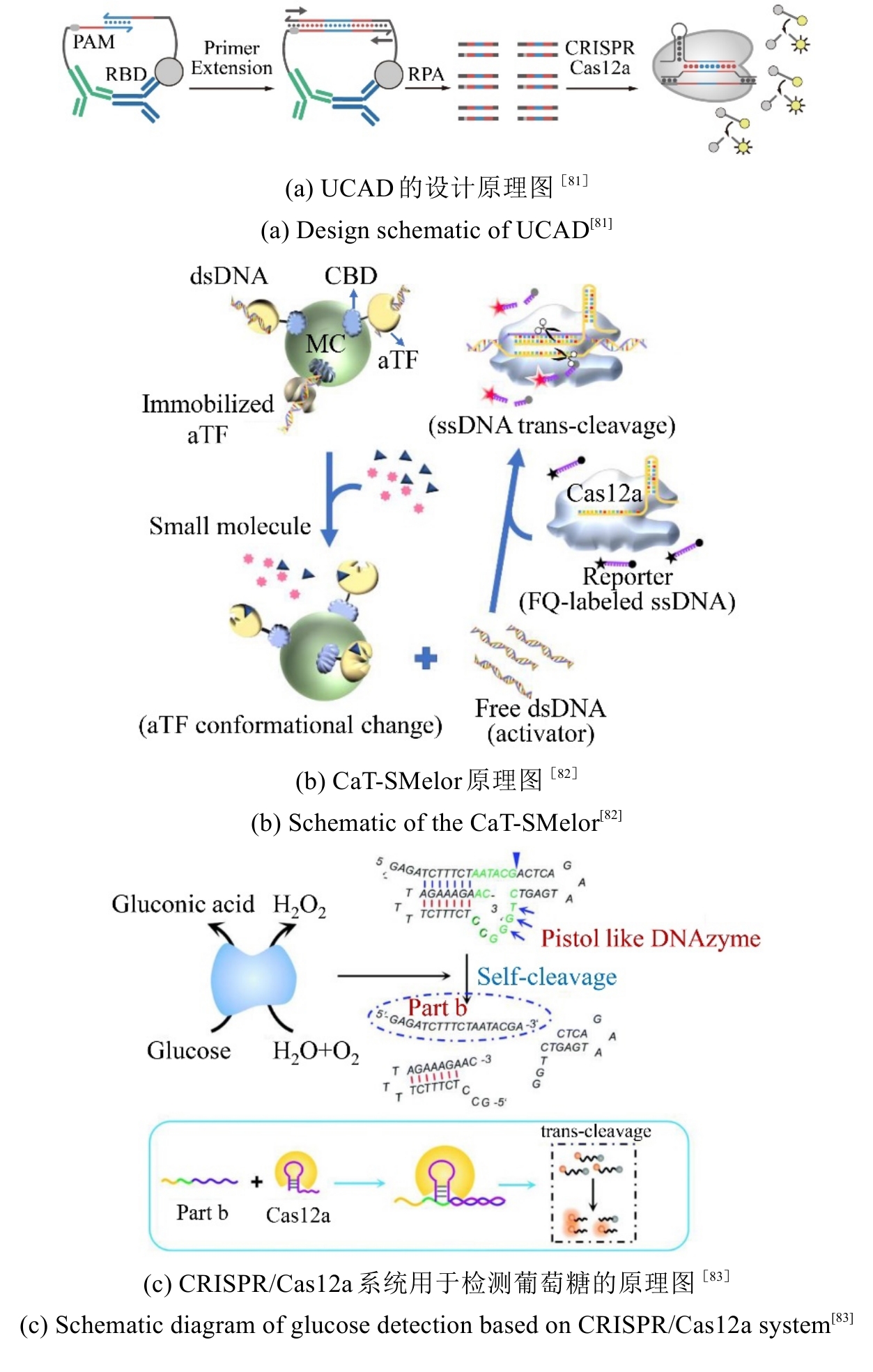
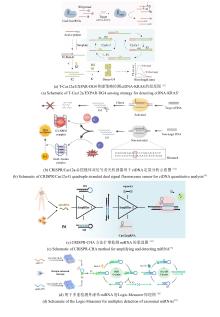
Fig. 7
Antibody/metabolite detection technologies utilizing the CRISPR/Cas system
Extracts from the Article
SARS-CoV-2抗体的定量分析对评估感染后免疫状态、疫苗效力及免疫抑制患者的保护性免疫水平至关重要。传统的免疫检测方法(如ELISA和化学发光免疫测定)因灵敏度不足且检测操作步骤繁琐,不适合用于POCT[70-75]。更为重要的是,这些常规检测方法缺乏足够的灵敏度,难以在感染早期检测到抗体,也无法监测免疫功能受损患者体内抗新冠病毒水平的变化,而这类患者在感染新冠病毒或接种疫苗后,抗体血清转化率会大幅降低[73, 76-80],难以检测感染早期或免疫抑制患者的低浓度抗体。四川大学李峰团队开发的UCAD(Ultrasensitive CRISPR-based Antibody Detection)方法[81],通过将抗体检测转化为CRISPR/Cas12a可识别的DNA条形码信号,灵敏度达到aM级[图7(a)]。其核心策略是利用抗体结合诱导的邻近杂交形成双链DNA模板,经RPA放大后激活Cas12a的非特异性ssDNA切割活性,最终通过荧光或侧流层析实现信号输出。在临床验证中,UCAD对197例血清样本(含65例疫苗接种者)进行检测,展现出100%的敏感性和98.5%的特异性。此外,该方法在85例接种疫苗的肾移植受者中检测到73例(85.9%)传统化学发光免疫测定定义为“不可检测”的抗体,并且在第三剂疫苗接种后,成功监测到84.8%患者的抗体水平有显著提升。这一突破为免疫抑制人群的免疫监测提供了关键工具,也为早期感染诊断和流行病学研究奠定了技术基础。
此外,代谢小分子如尿酸、葡萄糖的精准检测是痛风、糖尿病等慢性疾病诊断的关键因素。传统方法依赖复杂仪器(如高效液相色谱,HPLC)或侵入性采样,限制了POCT的应用。张立新团队[82]提出的CaT-SMelor平台,通过整合变构转录因子(aTF)与CRISPR/Cas12a,将小分子检测转化为DNA信号放大过程[图7(b)]。该平台对尿酸的检测限低至10 nM,在32例临床血清样本中与HPLC和生化分析仪检测结果高度一致。CaT-SMelor展现出高效、低成本的优势,为资源有限环境下的POCT提供了新思路。此外,研究人员设计了一种非侵入性策略,整合葡萄糖氧化酶(GOx)、pistol-like DNAzyme(PLDz)与CRISPR/Cas12a[83]。GOx催化葡萄糖生成H2O2,触发PLDz自剪切并释放Cas12a可识别的DNA片段,通过荧光信号放大实现泪液和唾液中微摩尔级葡萄糖的检测[图7(c)]。该技术突破了血液采样的局限性,在糖尿病早期筛查中展现出独特优势,其检测限(0.1 μM)显著优于传统电化学传感器,为非侵入性血糖监测开辟了新路径。
Other Images/Table from this Article
|