|
||
|
Advances in the biological utilization of one-carbon compounds
Synthetic Biology Journal
DOI: 10.12211/2096-8280.2025-077
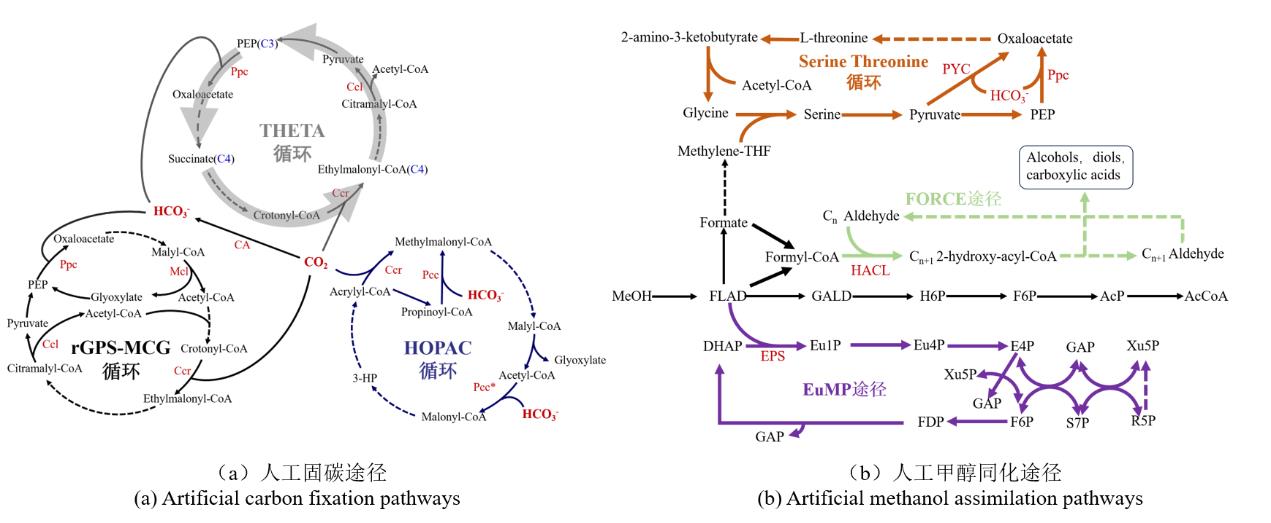
Fig. 2
Artificial metabolic pathways of one-carbon compounds
((A) Artificial carbon fixation pathways. Dotted lines indicate multi-step reactions. PEP, phosphoenolpyruvate; 3-HP, 3-hydroxypropanoate; Ppc, PEP carboxylase; Ccl, citramalyl-CoA lyase; Pcc, propionyl-CoA carboxylase; Ccr, crotonyl-CoA carboxylase; Mcl, malyl-CoA lyase; CA, carbonic anhydras. (B) Artificial methanol assimilation pathways. Dotted lines indicate multi-step reactions. MeOH, methanol; FLAD, Formaldehyde; GALD, glycolaldehyde; H6P, hexose-6-phosphate; F6P, fructose 6-phosphate; AcP, acetyl-phosphate; AcCoA, acetyl-CoA; DHAP, dihydroxyacetone phosphate; Eu1P, erythrulose 1-phosphate; Eu4P, erythrulose 4-phosphate; E4P, erythrose 4-phosphate; GAP, glyceraldehyde 3-phosphate; Ru5P, ribulose 5-phosphate; Xu5P, xylulose 5-phosphate; R5P, ribose 5-phosphate; S7P, sedoheptulose 7-phosphate; FDP, fructose-1,6-bisphosphate; PYC, pyruvate carboxylase; HACL, 2-hydroxyacyl-CoA lyase; EPS, erythrulose 1-phosphate synthase.)
Extracts from the Article
C1的生物利用途径分为天然途径与人工途径两类。天然途径以自养微生物及甲基营养菌经长期进化形成的C1同化途径为主体,包括Calvin-Benson-Bassham(CBB)循环、RuMP途径、XuMP途径及丝氨酸循环(Serine Cycle, SC)等((图1)。相比之下,基于酶元件挖掘与途径重设计原则创制的人工合成途径具有突破自然进化限制的潜力,如STC、SMA途径等(图2)。下文将对这些途径进行详细介绍。
THETA(图2)循环是由9种不同宿主来源的17种酶构建的固碳循环。磷酸烯醇式丙酮酸羧化酶(Ppc)和巴豆酰CoA羧化酶(Ccr)是该途径的关键固碳酶。每轮循环可固定1分子CO2并同化1分子HCO3-,生成1分子乙酰CoA。THETA循环在体外可高效运行,固碳效率远高于CBB循环等天然固碳途径。构成THETA循环的三个模块均能够再大肠杆菌体内运行,这使它成为目前最有潜力在体内实现固碳的人工途径[20]。
HOPAC循环则整合了来自6个不同物种的11种酶(图2)。该循环包含氧化和还原两个部分:氧化部分将丙二酰CoA转化为甲基丙二酰CoA(methylmalonyl-CoA),其关键固碳步骤为丙烯酰CoA(acrylyl-CoA)的羧化反应;还原部分则将甲基丙二酰CoA还原为丙二酰CoA,关键固碳步骤是乙酰CoA羧化合成丙二酰CoA。每轮循环可固定2分子CO2,其中一分子CO2需在碳酸酐酶(CA, carbonic anhydras)催化下形成HCO3-,再被同化利用,生成1分子乙醇酸(glycolate)。该循环与3-HP循环存在相似性,但其能量效率更高,固碳效率与rGPS-MCG循环相当。
rGPS-MCG循环整合了还原性乙醛酸与丙酮酸合成途径和苹果酰CoA-甘油酸途径,并因此得名(图2)。该循环是一种氧耐受的自催化固碳循环。其核心固碳反应由磷酸烯醇式丙酮酸羧化酶(Ppc)和巴豆酰辅酶A羧化酶(Ccr)催化。每轮循环可同化1分子CO2和1分子HCO3-,生成1分子乙酰CoA。该途径的固碳效率显著高于自养生物和光合生物的内源途径[23]。
丝氨酸算算循环(STC)(图2):在丝氨酸循环的基础上,重构苏氨酸裂解模块,将毒性中间体羟基丙酮酸替换为L-2-氨基-3-氧代丁酸,实现低CO2依赖的甘氨酸再生。此途径更适配于大肠杆菌等模式生物[17]。
甲酰辅酶A延伸(FORCE)途径(图2):甲酸在酰辅酶A合成酶的作用下形成甲酰-CoA,甲酰-CoA和甲醛在2-羟基酰-CoA裂解酶(2-hydroxyacyl-CoA lyase,HACL)的催化下缩合形成乙醇酰-CoA,后者通过一系列氧化还原反应形成乙醛,然后甲酰-CoA在HACL的催化下迭代缩合进行碳链延长。利用FORCE途径每轮迭代缩合反应可以使碳链延伸一个碳原子,生成的产物可以通过一系列转化生成细胞生长所需的中心代谢物或者工业需要的化学品[41, 42]。
赤酰糖单磷酸(EuMP)途径(图2):类似于RuMP和XuMP途径,EuMP途径以磷酸二羟丙酮为缩合底物,经赤酰酮糖-1-磷酸合成酶催化生成赤酰糖-4-磷酸(E4P),通过碳重排再生底物并输出GAP[43]。EuMP途径与RuMP途径催化模式相似,且能量效率相当,为C1化合物的生物利用提供了补充。
合成甲醇利用(SMA)途径(图2):利用乙醇醛合酶催化两个乙醛缩合生成羟乙醛,后者与E4P缩合形成己糖-6-磷酸(H6P),然后异构化形成果糖-6-磷酸(F6P),F6P在磷酸解酮酶催化下生成E4P和乙酰磷酸,乙酰磷酸由磷酸乙酰基转移酶催化形成中心代谢物乙酰CoA,E4P可循环用于乙醇醛的缩合转化[3]。SMA途径与2019年发表的SACA途径的功能相似[44],均能够将甲醇转化为acetyl-CoA。尽管SMA途径反应步骤较多,需要的酶种类较SACA途径更复杂,但是其体内兼容性更好,能够使大肠杆菌以甲醇为唯一碳源进行生长。
Other Images/Table from this Article
|