|
||
|
Significant research progress in synthetic biology
Synthetic Biology Journal
2020, 1 (1):
7-28.
DOI: 10.12211/2096-8280.2020-057
As an emerging, interdisciplinary field, synthetic biology has made great advances in many directions due to wide acceptance of its core principles and rapid progress in DNA synthesis. In this paper, recent development in gene circuits, genome design and synthesis, cell factories, and synthetic microbial consortia is reviewed. The complexity of artificial gene circuits that can be designed and constructed is gradually increasing with more refined control. Synthetic genomes are routinely assembled, expanding from prokaryotes (Mycoplasma to Escherichia coli) to eukaryotes (Saccharomyces cerevisiae), and improved capacity in genome design promotes the research of biological evolution. Metabolic pathways of ever-increasing lengths are constructed based on modularization and orthogonality principles to produce molecules of complex structures, and fundamental rewiring of cellular metabolism is performed for enhanced robustness and compatibility. The design and construction of synthetic microbial consortia have been expanded from two-species systems to multi-species systems, so that more sophisticated functions can be achieved. At the end of this paper, new research directions resulted from the interdisciplinary integration of synthetic biology and other disciplines are discussed. 
Fig. 3
The design and construction of cell factories
Extracts from the Article
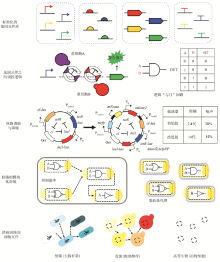
构建细胞工厂从头合成生物基材料单体1,3-丙二醇[66]和重要医药中间体青蒿酸[67,68],开创了传统石化产品和天然产物全新的生产模式,可有效解决石油化工炼制和植物提取对自然资源的依赖和对环境的危害。自此,细胞工厂的设计构建成为合成生物学的一个重要研究方向。伴随着合成生物技术的进步,人们在逐步挑战代谢途径更长、复杂程度更高的化合物合成[图3(a)]。尤其是近期阿片类药物[69]和大麻素[70]的从头合成,展示了构建细胞工厂的巨大潜力。细胞工厂的设计构建,是通过对复杂生命体的工程化重构,实现目标产品的可控和高效合成。其实现过程是在物质代谢和能量代谢水平上,反复进行模块与模块、模块与底盘之间的适配[71]。除适配性外,细胞工厂的发展趋势还承袭了模块化、正交性、鲁棒性等工程化特性。
代谢途径的模块化是细胞工厂构建的基础。模块中的催化元件或来源于对沉默基因簇[72,73]和深度测序数据[74,75]的挖掘,或来源于现有酶分子的定向进化[76,77]甚至蛋白质的从头设计[78,79,80,81],以实现自然界中不能催化或难催化的反应[82,83,84],合成非天然的分子[85,86,87],构建未见报道的合成路径[88,89]。在重构复杂长途径时,采用多元模块工程[90],按代谢节点[90]和元件功能聚类[91]等规则对途径进行模块式划分[图3(b)],以降低途径的复杂程度。通过建立并优化模块功能[92]、调整模块亚细胞器定位[93]以及调节模块之间的表达强度[90],实现模块与模块之间的组合设计和迭代适配。在上述模块化工程原则的指导下,成功实现阿片类药物[69]、维生素B12[94]、托品烷生物碱[95]等长途径的构建。
在物质代谢水平,代谢途径的相对正交化是指底物同化途径或产物合成途径与底盘内源代谢网络最多只以唯一的结点相连,以形成独立的模块,便于后续调控其代谢流通量[105,106]。此种途径的正交化过程可视作对底盘生长和产物合成的解耦[105]。在碳源利用方面,常设计构建非天然途径,或利用葡萄糖、油脂等天然碳源[图3(c),正交化途径1],或转化半纤维素水解产物(木糖、阿拉伯糖、半乳糖)等替代碳源[图3(c),正交化途径2],合成关键前体化合物。例如,合成1,4-丁二醇[107]和琥珀酸[105]的正交化途径。在前体供给方面,常基于非天然前体构建目标产品的正交化人工合成途径[图3(c),正交化途径3]。例如,以NPP(neryl diphosphate)替代其异构体GPP作为单萜合成的前体,通过NPP合酶的引入和单萜合酶的定向进化,可构建正交化的橙花醇、桧烯、柠檬烯等单萜类产品的合成途径[108]。
与原核底盘相比,酿酒酵母等真核底盘具备多种可用于途径模块定位的细胞器,产生区室化效应[97],提高目标产物的合成水平[113,114,115,116,117]。通过调控细胞器的形态、数量、大小等表型,可进一步提高定位途径的通量[118,119]。如果靶向的细胞器具备正交性,可降低此种调控对其他细胞器及底盘内源代谢的干扰。根据参与中心代谢的程度,天然细胞器中过氧化物酶体的正交性最高[120],完全删除过氧化物酶体蛋白不会影响菌体以葡萄糖为底物的生长[121]。而建立人工过氧化物酶体蛋白转运系统,在目标蛋白靶向定位的同时,抑制天然过氧化物酶体蛋白的定位表达[122],开启了定制化细胞器的研究[图3(d)]。此外,借助低密度膜结合蛋白精确控制囊泡膜的自发弯曲,有望实现不依赖于底盘内源基因调控膜的分裂[123],而控制细胞器的表型。
原核生物中天然存在由选择性通透的蛋白质衣壳代替磷脂层分子包裹形成的微室[124]。在真核底盘中重建原核微室或构建类微室结构的人工细胞器,进行异源催化反应,也是细胞器正交化的策略手段[图3(d)]。在重构原核微室时,采用SpyTag/SpyCatcher共价结合[125]或CC-Di-A/CC-Di-B卷曲螺旋(coiled-coil)[126]等蛋白质自主装结构,替代天然微室的包装序列,可解决催化蛋白易发生团聚而丧失活性的问题。但上述方法尚未在真核底盘中进行尝试[127]。而参考天然微室结构,利用自组装蛋白(例如encapsulins[128]、受蓝光调控的Cry2[129]和PixD/PixE[130])的可控表达和组装,已成功在真核生物中构建了包装有催化蛋白的人工细胞器,实现norcoclaurine[131]、脱氧紫色杆菌素[132]等化合物的高效合成。
构建基因线路,随菌体生长代谢或环境条件的变化对途径模块进行动态调控,是在代谢胁迫扰动下提高系统鲁棒性的有效手段[133]。相关基因线路的设计原则一是偶联生长和生产[图3(e)],即产物在胞内的积累正反馈激活必需基因的表达,以避免负向突变在群体中的积累,强迫系统保持目标途径代谢流的稳定和最大化[134,135]。在此基础上进一步采用同时具备正/负两向筛选功能的报告基因,可排除启动子区突变而产生的调控逃逸[136]。另一基因线路设计原则是解耦生长和生产[图3(e)],基于群体响应元件,感知菌体的生长密度,反馈调控产物合成[137];或基于结合化学分子的调控蛋白,响应胞内关键代谢中间体的含量,实时调整产物的积累速率[35],防止有毒中间产物的过量积累[138],以降低异源途径对底盘的代谢胁迫。目前,调控蛋白从特异性识别一种化合物,发展为以不同的响应阈值同时识别两种以上化合物。在发酵前期通过底物的抑制作用限制有毒终产物的积累,在发酵后期通过产物的正反馈作用加快产物的合成[139]。同时,以特异性响应某种代谢物的启动子可代替调控蛋白控制途径模块的表达[138]。在此基础上级联dCas9/sgRNA系统的调控,还可增强响应速度和敏感性[140]。
Other Images/Table from this Article
|