Professor Daniel I C. Wang. a legacy of education, innovation, publication, and leadership
1
2020
... 王先生一生著述丰厚,发表了230余篇科技论文[1],每一篇论文都脚踏实地,注重工程实践与基础理论的结合,为我们后世生物工程学者之楷模.鉴于王先生对生物工程技术的开创性工作,美国化学工程师学会(AIChE)、美国化学学会(ACS)以及MIT都设立了以王义翘先生名字命名的生化工程论坛,用以纪念王先生的卓越贡献.本人有幸蒙先生教诲,被提名并获取了2020年“生物工程与生物技术王义翘奖”(Biotechnology & Bioengineering Daniel IC Wang Award),于8月初在ACS年会发表获奖报告感言并回顾先生贡献,不想先生8月29日仙逝,心中无限悲戚,生化工程领域陨落了一位世界级的学者和先驱,我们也痛失了一位学贯中西、德高望重的师长.王先生高风亮节,治学严谨,心怀家国,提携后进,为我后辈楷模.此文总结的工作,很大程度上受益于王先生在MIT创建的生物工程技术中心;谨以此文,总结并展望我和同事在MIT所从事的主要工作,以寄托对先生的哀思,纪念先生的贡献.愿我们传承先生遗风,肩负先生的治学理念,解决关系国计民生的实际问题,为国为民,脚踏实地地推进生化工程领域的工作,不负先生的教诲.缪改前人诗作一首,以作对先生家世的感怀,与读者共勉: ...
Production of omega-3 eicosapentaenoic acid by metabolic engineering of Yarrowia lipolytica
1
2013
... 功能性油脂广泛应用于食品营养、医药保健、美容护肤、动物饲料以及农业环保等诸多领域.ω-3和ω-6多不饱和脂肪酸,主要应用于婴幼儿奶粉,并有抗衰老、促进心血管健康等保健功效[2];羟基脂肪酸可以用于药物传递载体以及聚合物单体;脂肪醇可用于保护涂层、润滑剂、乳化剂和化妆洗护用品领域.各种植物果实中的油脂(主要以甘油三酯的形式存在,比如棕榈油、大豆油、可可脂、橄榄油、葵花籽油和花生油等),由于其独特的结晶温度和凝固点,赋予了其独特的质地(texture)和口感(mouthful feeling),广泛用于食品、糖果、巧克力点心和美容护肤等领域.动物的结构性油脂(structuring fat)决定了大多数美食细腻丰富的口感,比如西班牙火腿、北京烤鸭、神户牛排和法国鹅肝等(图2),被视为肉类中的珍品,油脂对这些美食的风味及口感起到了不可替代的作用.黄油(butter)主要提炼自奶油,含有较多的短链脂肪酸,成为人们日常饮食中必备的材料.临床测试及运动医学表明,健康的脂肪酸饮食,尤其是多不饱和脂肪酸中ω-3与ω-6脂肪酸的比例,与抗炎、皮肤健康、增肌减肥和免疫等机体功能有直接的关联[3]. ...
The importance of the ratio of omega-6/omega-3 essential fatty acids
1
2002
... 功能性油脂广泛应用于食品营养、医药保健、美容护肤、动物饲料以及农业环保等诸多领域.ω-3和ω-6多不饱和脂肪酸,主要应用于婴幼儿奶粉,并有抗衰老、促进心血管健康等保健功效[2];羟基脂肪酸可以用于药物传递载体以及聚合物单体;脂肪醇可用于保护涂层、润滑剂、乳化剂和化妆洗护用品领域.各种植物果实中的油脂(主要以甘油三酯的形式存在,比如棕榈油、大豆油、可可脂、橄榄油、葵花籽油和花生油等),由于其独特的结晶温度和凝固点,赋予了其独特的质地(texture)和口感(mouthful feeling),广泛用于食品、糖果、巧克力点心和美容护肤等领域.动物的结构性油脂(structuring fat)决定了大多数美食细腻丰富的口感,比如西班牙火腿、北京烤鸭、神户牛排和法国鹅肝等(图2),被视为肉类中的珍品,油脂对这些美食的风味及口感起到了不可替代的作用.黄油(butter)主要提炼自奶油,含有较多的短链脂肪酸,成为人们日常饮食中必备的材料.临床测试及运动医学表明,健康的脂肪酸饮食,尤其是多不饱和脂肪酸中ω-3与ω-6脂肪酸的比例,与抗炎、皮肤健康、增肌减肥和免疫等机体功能有直接的关联[3]. ...
The impacts of oil palm on recent deforestation and biodiversity loss
2
2016
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
... 根据美国农业部的报道,全球每年的植物油需求量达到了2亿吨,并且每年以3%~4.5%的比例增长.棕榈油占据了全球植物油脂总量的40%,2020年全球棕榈油的需求量为8000万吨,主要用于食品饮料、能源、个人护理、化工原料以及医药等领域.棕榈油原材料的年销售额达到了800亿美元 (棕榈油的价格大致为1000美元/吨).其他大宗植物油包括菜籽油、花生油、玉米油和葵花籽油等.全球3/4的棕榈油产自东南亚地区的马来西亚以及印度尼西亚,棕榈油及棕榈园的开发成为当地的主要经济来源.自1985年以来,全球棕榈油的需求每年以6%~7%的比例增长,棕榈园的过分开发造成了热带雨林的破坏(deforestation)[4-5],例如加里曼丹岛(马来西亚称为婆罗洲岛,面积为75万平方公里,亚洲第一大岛,世界第三大岛)65%的热带雨林已经消失,进而导致当地气候变化和降雨减少,生态多样性的丧失、气候的变迁以及棕榈油产业带来的环境污染进而恶化当地的棕榈园经济,目前的农耕和育种技术仅能保证2%~3%的棕榈油产量增长,现实中一个严峻的问题是,全球每年仍有4%的棕榈油缺口(市值大概32亿美元)亟需用可替代的生物技术加以解决. ...
Effect of oil palm sustainability certification on deforestation and fire in Indonesia
2
2018
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
... 根据美国农业部的报道,全球每年的植物油需求量达到了2亿吨,并且每年以3%~4.5%的比例增长.棕榈油占据了全球植物油脂总量的40%,2020年全球棕榈油的需求量为8000万吨,主要用于食品饮料、能源、个人护理、化工原料以及医药等领域.棕榈油原材料的年销售额达到了800亿美元 (棕榈油的价格大致为1000美元/吨).其他大宗植物油包括菜籽油、花生油、玉米油和葵花籽油等.全球3/4的棕榈油产自东南亚地区的马来西亚以及印度尼西亚,棕榈油及棕榈园的开发成为当地的主要经济来源.自1985年以来,全球棕榈油的需求每年以6%~7%的比例增长,棕榈园的过分开发造成了热带雨林的破坏(deforestation)[4-5],例如加里曼丹岛(马来西亚称为婆罗洲岛,面积为75万平方公里,亚洲第一大岛,世界第三大岛)65%的热带雨林已经消失,进而导致当地气候变化和降雨减少,生态多样性的丧失、气候的变迁以及棕榈油产业带来的环境污染进而恶化当地的棕榈园经济,目前的农耕和育种技术仅能保证2%~3%的棕榈油产量增长,现实中一个严峻的问题是,全球每年仍有4%的棕榈油缺口(市值大概32亿美元)亟需用可替代的生物技术加以解决. ...
Yarrowia lipolytica as a biotechnological chassis to produce usual and unusual fatty acids
1
2016
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
Modular optimization of multi-gene pathways for fatty acids production in E. coli
2
2013
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
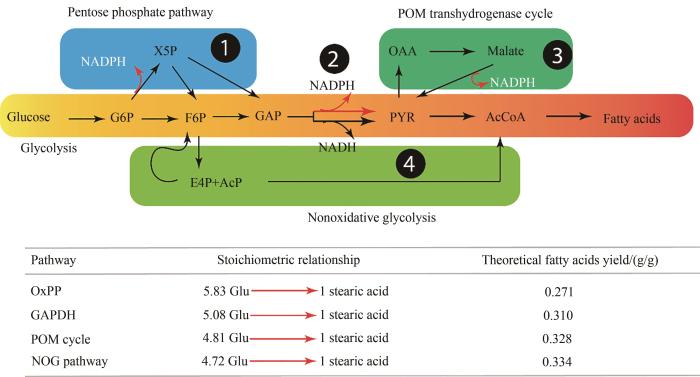
... 不同于酿酒酵母,解脂耶氏酵母细胞质中乙酰辅酶A主要来源于ATP:柠檬酸裂解酶.在碳源充足氮源饥饿状态下,细胞为了充分回收利用氮源,AMP脱氨酶活性增强,将细胞内AMP转化为肌苷单磷酸(IMP).AMP为三羧酸循环中异柠檬酸脱氢酶(IDH)的天然变构激活因子,由于AMP水平的降低,IDH的活性降低,将使得线粒体内积累异柠檬酸.异柠檬酸经顺乌头酸酶逆向反应,转变为柠檬酸,过量的柠檬酸将被排出线粒体,经ATP柠檬酸裂解酶,转化为乙酰辅酶A和草酰乙酸.乙酰辅酶A经羧化后形成malonyl-CoA,转酰化反应后,malonyl-CoA主要以malonyl-ACP的形式存在(图3).β-酮酰-ACP (n)合成酶(β-ketoacyl-ACP synthase)将把malonyl-ACP装载到延伸的碳链上,依次形成β-酮酰-ACP (n+2)、β-羟酰-ACP(n+2)、β-烯酰-ACP(n+2)和β-脂酰-ACP(n+2)[7].每两个碳原子的添加,需要2个分子的还原性辅因子NADPH,依次参与β-酮酰-ACP还原酶与β-烯酰-ACP还原酶所催化的反应(图3).比如硬脂酸的合成需要8轮malonyl-ACP的缩合反应,共计需要16分子的NADPH来完成还原反应.由于解脂耶氏酵母细胞质中不具有NADH激酶或者NADH-NADPH转氢酶,NADH并不能自由转换为NADPH,在葡萄糖作为碳源情况下,解脂耶氏酵母主要的NADPH来源为磷酸戊糖途径(pentose phosphate pathway)[53].在磷酸戊糖途径中,葡萄糖被磷酸化后,分别经由6-磷酸葡萄糖脱氢酶和6-磷酸葡萄糖酸脱氢酶,就会产生2分子的NADPH.这一获取还原力的途径并非最佳选择,原因在于6-磷酸葡萄糖酸脱氢酶具有脱羧功能并产生CO2,解脂耶氏酵母每产生2分子NADPH以消耗1分子CO2为代价.因此每合成1分子硬脂酸(C18:0),细胞需要16分子的NADPH,需要额外消耗4/3分子的葡萄糖(C6H12O6)来提供这些还原力[54-55].硬脂酸骨架中18个碳原子,来源于9个乙酰辅酶A分子,相对应于4.5分子的葡萄糖(1/3的碳原子经过丙酮酸脱氢酶复合体脱羧后丢失).因此,每合成1分子硬脂酸(C18:0),需要4.5分子葡萄糖提供碳原子骨架,另外需要4/3分子葡萄糖提供NADHP还原力,对应的化学计量关系为,对应于每消耗5.83(4.5 + 4/3)分子葡萄糖,产生1分子硬脂酸.理论硬脂酸的得率为0.271 g 硬脂酸/g 葡萄糖[54, 56].理论得率越高,消耗的起始碳源越少;原材料通常占据生产成本的50%,选取高效的NADPH替代途径,将对提高碳源转化率、降低碳源消耗和压缩生产成本,起到至关重要的作用. ...
Integrated bioprocess for conversion of gaseous substrates to liquids
1
2016
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
Application of metabolic controls for the maximization of lipid production in semicontinuous fermentation
1
2017
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
Synthetic biology, systems biology, and metabolic engineering of Yarrowia lipolytica toward a sustainable biorefinery platform
4
2020
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
... [10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
... [10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Synthetic RNA polymerase III promoters facilitate high-efficiency CRISPR-Cas9-mediated genome editing in Yarrowia lipolytica
1
2016
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
Characterization of Met25 as a color associated genetic marker in Yarrowia lipolytica
1
2020
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
CRISPR-Cas12a/Cpf1-assisted precise, efficient and multiplexed genome-editing in Yarrowia lipolytica
0
2020
Genome editing systems across yeast species
0
2020
Implementing CRISPR-Cas12a for efficient genome editing in Yarrowia lipolytica
1
2021
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
Golden Gate Assembly system dedicated to complex pathway manipulation in Yarrowia lipolytica
1
2017
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
Golden Gate-based metabolic engineering strategy for wild-type strains of Yarrowia lipolytica
0
2019
A modular Golden Gate toolkit for Yarrowia lipolytica synthetic biology
0
2019
A golden-gate based cloning toolkit to build violacein pathway libraries in Yarrowia lipolytica
1
2021
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
Genetic tools for streamlined and accelerated pathway engineering in Yarrowia Lipolytica
1
2019
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
YaliBricks, a versatile genetic toolkit for streamlined and rapid pathway engineering in Yarrowia lipolytica
2
2017
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Understanding lipogenesis by dynamically profiling transcriptional activity of lipogenic promoters in Yarrowia lipolytica
1
2019
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
An artificial chromosome ylAC enables efficient assembly of multiple genes in Yarrowia lipolytica for biomanufacturing
1
2020
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
Combining 26S rDNA and the Cre-loxP system for iterative gene integration and efficient marker curation in Yarrowia lipolytica
1
2019
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
Chassis engineering for microbial production of chemicals: from natural microbes to synthetic organisms
1
2020
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
Towards next-generation model microorganism chassis for biomanufacturing
1
2020
... 植物油脂的大量需求造成了热带雨林破坏,气候变迁、生态多样性的流失以及其他诸多环境和社会问题[4-5].微生物发酵不依赖于耕地和环境气候,能够高效转化农业废弃可再生资源(比如生物质纤维素等原材料),因此构建可持续性油脂微生物发酵平台是目前亟待解决的关键技术[6-7].产油解脂耶氏酵母近来备受代谢工程领域的青睐,其原因如下:培养条件简单,能够利用多种底物(包括挥发性有机酸及脂肪烃和石蜡等化合物)快速生长[8-9],无Crabtree效应(不产乙醇)[10],基因组中内含子密度低,便于遗传操作,遗传工具特别是近年来基于Cas9[11]或者Cpf1[12-15]的基因编辑工具以及Golden-gate[16-19]和YaliBrick[20-21]克隆方法的开发,众多分子转录元件的鉴定[22-23],以及基于Cre-LoxP位点的多轮基因整合技术的实现[24],使得解脂耶氏酵母成为了微生物油脂积累研究工作的新宠,解脂耶氏酵母也成为了生产单细胞油脂及衍生物的首选底盘宿主[25-26].本文将从植物油脂的市场近况出发,引导读者认识到目前油脂供应链所面临的可持续发展等严峻问题,以及发展微生物油脂转化平台的严重性和迫切性;围绕产油酵母的高通量筛选及表型鉴定、碳源转化率(yield)、发酵滴度(titer)、生产速率(productivity)、菌体生长适用性(fitness)、代谢调控和生化动力学模型等方面,作者将阐述关键的代谢工程及合成生物学策略,并对利用解脂耶氏酵母生产高附加值植物油脂的经济可行性与技术可行性进行展望. ...
Agricultural and forestry trade drives large share of tropical deforestation emissions
1
2019
... 与棕榈油经济极为相似,全球可可脂的供应链也受到了极大的影响.全球80%的可可脂产自非洲中西部国家,包括科特迪瓦、加纳、喀麦隆和尼日利亚等.可可果(coconuts)中提取的可可脂是制造巧克力的主要成分,全球可可果(cocoa beans)目前年均采集量为500万吨,每吨可可果的价值在3300美元,可可果原材料市场价值为165亿美元,而成品巧克力销售额已经达到1310亿美元,到2025年,成品巧克力的市场预期在1800亿美元左右,目前可可果原材料的供应远不能达到市场的增量需求,造成了大约500亿美元成品巧克力的市场缺口.经营可可园也成为非洲中西部地区农民的主要经济来源,同样由于气候的变迁、降雨的减少,农耕技术的停滞不前,造成当地热带雨林的过量砍伐[27-28],进而导致当地经济与环境的恶化以及诸多社会伦理问题(比如因贫困导致的儿童失学以及雇佣童工、奴工与男权盛行等社会问题).为达成可持续性的发展目标,世界主要巧克力生产商,包括玛氏(Mars)、雀巢(Nestlé)、德芙(Dove)、费列罗(Ferrero Rocher)、好时(Hersey’s)、歌帝梵(Godiva)等公司均提出了未来5~10年用可持续性的可可脂完全替代传统可可脂的发展蓝图. ...
Vulnerability to climate change of cocoa in West Africa: patterns, opportunities and limits to adaptation
1
2016
... 与棕榈油经济极为相似,全球可可脂的供应链也受到了极大的影响.全球80%的可可脂产自非洲中西部国家,包括科特迪瓦、加纳、喀麦隆和尼日利亚等.可可果(coconuts)中提取的可可脂是制造巧克力的主要成分,全球可可果(cocoa beans)目前年均采集量为500万吨,每吨可可果的价值在3300美元,可可果原材料市场价值为165亿美元,而成品巧克力销售额已经达到1310亿美元,到2025年,成品巧克力的市场预期在1800亿美元左右,目前可可果原材料的供应远不能达到市场的增量需求,造成了大约500亿美元成品巧克力的市场缺口.经营可可园也成为非洲中西部地区农民的主要经济来源,同样由于气候的变迁、降雨的减少,农耕技术的停滞不前,造成当地热带雨林的过量砍伐[27-28],进而导致当地经济与环境的恶化以及诸多社会伦理问题(比如因贫困导致的儿童失学以及雇佣童工、奴工与男权盛行等社会问题).为达成可持续性的发展目标,世界主要巧克力生产商,包括玛氏(Mars)、雀巢(Nestlé)、德芙(Dove)、费列罗(Ferrero Rocher)、好时(Hersey’s)、歌帝梵(Godiva)等公司均提出了未来5~10年用可持续性的可可脂完全替代传统可可脂的发展蓝图. ...
Rewiring Yarrowia lipolytica toward triacetic acid lactone for materials generation
1
2018
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Engineering acetyl-CoA metabolic shortcut for eco-friendly production of polyketides triacetic acid lactone in Yarrowia lipolytica
1
2019
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Combining genetically-encoded biosensors with high throughput strain screening to maximize erythritol production in Yarrowia lipolytica
1
2020
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Engineering Yarrowia lipolytica as a platform for synthesis of drop-in transportation fuels and oleochemicals
3
2016
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
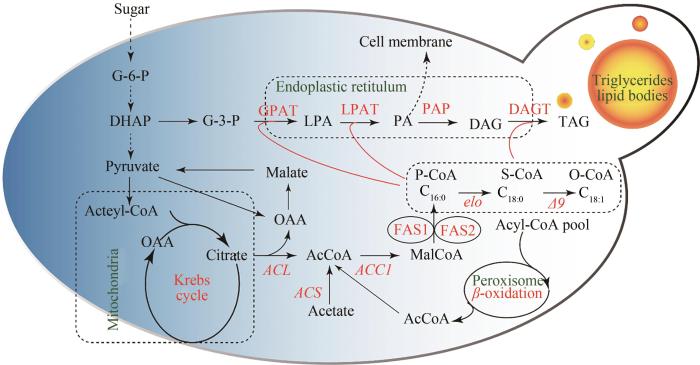
... 解脂耶氏酵母能够高效合成油脂的生物基础在于其胞内高度特异性的功能化分区[59],其中脂肪酸的合成效率高度依赖于脂肪酸合成酶、乙酰辅酶A羧化酶以及苹果酸酶所形成的超酶复合体(lipid metabolon)[60-61],甘油三酯的合成与组装需要内质网与脂质体的协同作用.酶分子的空间定位及细胞内生化反应的分区,能够大大增加中间底物传递和转化的效率,同时能够有效地降低不稳定底物的流失,自然界广泛存在的亚细胞水平超酶复合体,包括糖酵解途径、三羧酸循环以及脂肪酸合成等,均已被细胞成像技术证实.为了充分配置并利用亚细胞水平的不同功能分区,Stephanopoulos课题组首次在解脂耶氏酵母中,将具有脂酰辅酶A(acyl-CoA)和脂酰ACP(acyl-ACP)还原以及水解功能等特异性的酶定位表达于线粒体、脂质过氧化物体(peroxisome)和内质网(ER)等亚细胞器中,改造了产油酵母的生产性状,并配合脂肪醛脱羰酶(aldehyde decarbonylase)或者脂酰辅酶A还原酶(fatty acyl-CoA reductase),使得遗传改造后的酵母产生成了具有生物燃料特征的烷烃类、烯烃类和脂肪醇等化合物[32].酿酒酵母,经代谢工程改造后,能够生成10.4 g/L的游离脂肪酸和1.5 g/L的脂肪醇[62].另外通过表达异源脂肪酸合成酶,于涛等在酿酒酵母中成功表达了分枝杆菌的脂肪酸合成体系,结合acyl-CoA还原酶,生成了24个碳原子的脂肪醇[63].通过表达脂酰辅酶A光脱羧酶(fatty acyl-CoA photodecarboxylase),改造后的解脂耶氏酵母能够利用葡萄糖合成将近1.5 g/L的脂肪烷(烯)烃[34]. ...
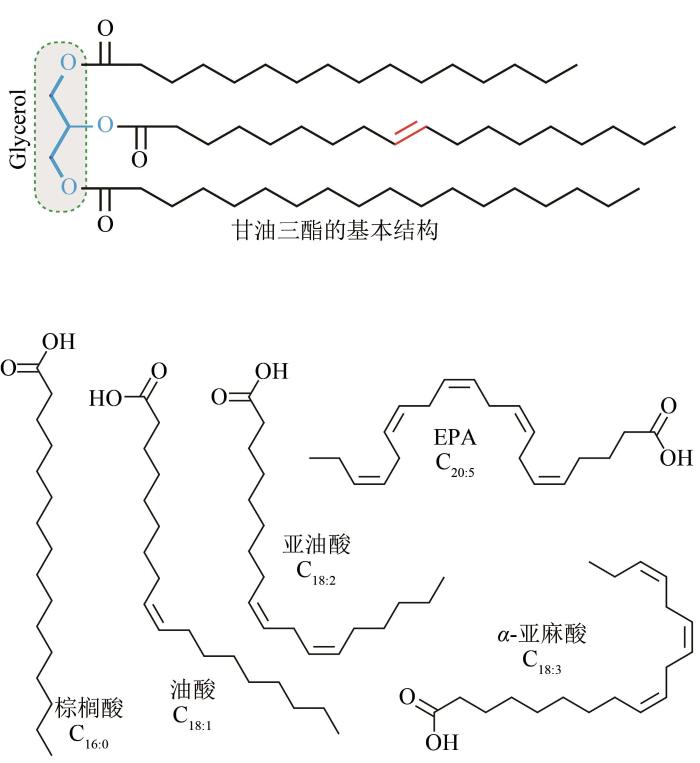
... 脂肪酸碳链长度,决定了生物柴油的理化性质和燃烧性能,比如凝固点和挥发性等;短链功能性油脂分子,易于被动物和人体吸收,通常营养价值也高.因此,控制脂肪酸碳链长度,成为代谢工程研究的热点之一.细菌的脂肪酸合成酶由5个单体亚基构成,每个蛋白亚基负责不同的催化功能,其不同亚基间结合松散,易于工程改造;与细菌不同,真菌中脂肪酸合成酶由两条肽链编码,每条肽链大概有2000个氨基酸,分别编码脂肪酸合成酶的不同功能域.蛋白晶体结构分析表明,真菌脂肪酸合成酶两条肽链组成一个多聚体的分子笼状结构,不同碳链长度的脂酰-ACP(四碳到十四碳)中间体被包裹在脂肪酸合成酶分子笼内部[64],直至棕榈酰-ACP,碳链增加到16才能被脂肪酸合成酶释放,并经过MPT结构域(malonyl/palmitoyl transacylase)将棕榈酰-ACP转变为棕榈酰-CoA(C16∶0),所生成的棕榈酰-CoA通过脂肪酸延长酶(elongase)和去饱和酶(desaturase)依次生成硬脂酰-CoA(C18∶0)和油酰-CoA(C18∶1),并依次加载到3-磷酸甘油骨架上,合成各种脂类化合物(图5).在真菌中,通过直接表达脂酰-ACP硫解酶(fatty acyl-ACP thioesterase)来生产短链脂肪酸的效率低.通过蛋白质的理性设计,Xu等[32]将解脂耶氏酵母中脂肪酸合成酶的MPT(malonyl/palmitoyl transacylase)结构域替换为具有acyl-CoA水解功能的结构域,改造后的酵母能够生产具有不同碳链长度的脂肪酸分子(C12、C14和C16等),提高了解脂耶氏酵母的工业利用价值.另外通过蛋白工程手段,定向改造ACP结构域[65]、酮脂酰ACP 合成酶结构域和MPT转酰基结构域,能够使酿酒酵母生产短链的脂肪酸,C6和C8脂肪酸的产量达到了100~250 mg/L[66].由此看出,蛋白理性改造能够有效控制脂肪酸合成过程碳链的延伸,德国Max Planck Institute的Ashwin Chari课题组以及法兰克福大学Eckhard Boles课题组对此进行了详细的结构生物分析[66-67],进一步阐释了脂肪酸的碳链长度调控机制,为定向改造产油酵母生产短链和中等碳链长度脂肪酸和油脂化合物提供了理论基础. ...
Engineering Yarrowia lipolytica for production of fatty alcohols with YaliBrick vectors
1
2021
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Synthesis of high-titer alka(e)nes in Yarrowia lipolytica is enabled by a discovered mechanism
2
2020
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
... 解脂耶氏酵母能够高效合成油脂的生物基础在于其胞内高度特异性的功能化分区[59],其中脂肪酸的合成效率高度依赖于脂肪酸合成酶、乙酰辅酶A羧化酶以及苹果酸酶所形成的超酶复合体(lipid metabolon)[60-61],甘油三酯的合成与组装需要内质网与脂质体的协同作用.酶分子的空间定位及细胞内生化反应的分区,能够大大增加中间底物传递和转化的效率,同时能够有效地降低不稳定底物的流失,自然界广泛存在的亚细胞水平超酶复合体,包括糖酵解途径、三羧酸循环以及脂肪酸合成等,均已被细胞成像技术证实.为了充分配置并利用亚细胞水平的不同功能分区,Stephanopoulos课题组首次在解脂耶氏酵母中,将具有脂酰辅酶A(acyl-CoA)和脂酰ACP(acyl-ACP)还原以及水解功能等特异性的酶定位表达于线粒体、脂质过氧化物体(peroxisome)和内质网(ER)等亚细胞器中,改造了产油酵母的生产性状,并配合脂肪醛脱羰酶(aldehyde decarbonylase)或者脂酰辅酶A还原酶(fatty acyl-CoA reductase),使得遗传改造后的酵母产生成了具有生物燃料特征的烷烃类、烯烃类和脂肪醇等化合物[32].酿酒酵母,经代谢工程改造后,能够生成10.4 g/L的游离脂肪酸和1.5 g/L的脂肪醇[62].另外通过表达异源脂肪酸合成酶,于涛等在酿酒酵母中成功表达了分枝杆菌的脂肪酸合成体系,结合acyl-CoA还原酶,生成了24个碳原子的脂肪醇[63].通过表达脂酰辅酶A光脱羧酶(fatty acyl-CoA photodecarboxylase),改造后的解脂耶氏酵母能够利用葡萄糖合成将近1.5 g/L的脂肪烷(烯)烃[34]. ...
Production of omega-3 eicosapentaenoic acid by metabolic engineering of Yarrowia lipolytica
1
2013
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Coupling feedback genetic circuits with growth phenotype for dynamic population control and intelligent bioproduction
1
2019
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Optimizing oleaginous yeast cell factories for flavonoids and hydroxylated flavonoids biosynthesis
0
2019
Engineering 4-coumaroyl-CoA derived polyketide production in Yarrowia lipolytica through a β-oxidation mediated strategy
1
2020
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Genetic and bioprocess engineering to improve squalene production in Yarrowia lipolytica
1
2020
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Enhanced squalene biosynthesis in Yarrowia lipolytica based on metabolically engineered acetyl-CoA metabolism
0
2018
Metabolic engineering of Yarrowia lipolytica for improving squalene production
1
2021
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Debottlenecking mevalonate pathway for antimalarial drug precursor amorphadiene biosynthesis in Yarrowia lipolytica
1
2020
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Engineering the oleaginous yeast Yarrowia lipolytica for high-level resveratrol production
1
2020
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Engineering Yarrowia lipolytica as a chassis for de novo synthesis of five aromatic-derived natural products and chemicals
4
2020
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
... [44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
... [44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
... ,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Refactoring ehrlich pathway for high-yield 2-phenylethanol production in Yarrowia lipolytica
1
2020
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
γ-Decalactone production by Yarrowia lipolytica and Lindnera saturnus in crude glycerol
1
2017
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Biotechnological production of γ-decalactone, a peach like aroma, by Yarrowia lipolytica
0
2016
A single-host fermentation process for the production of flavor lactones from non-hydroxylated fatty acids
1
2020
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
A roadmap to engineering antiviral natural products synthesis in microbes
1
2020
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Biotechnological production of flavonoids: an update on plant metabolic engineering, microbial host selection, and genetically encoded biosensors
2
2020
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
... ,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
合成生物技术驱动天然的真核油脂细胞工厂开发
1
2021
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Synthetic biotechnology drives the development of natural eukaryotic lipid cell factories
1
2021
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
Production of plant natural products through engineered Yarrowia lipolytica
1
2020
... 由于解脂耶氏酵母独特的乙酰辅酶A供应模式和不同代谢途径的精细分区,其合成malonyl-CoA和HMG-CoA的效率很高.以解脂耶氏酵母为平台,经代谢工程改造后,该酵母已经被用来生产一系列化合物,包括三乙酸内酯(triacetic acid lactone)[29-30]、赤藓糖醇[31]、脂肪醇[32-33]、脂肪烃[34]、ω-3和ω-6多不饱和脂肪酸[35]、黄酮[36-38]、角鲨烯(squalene)[39-41]、青蒿二烯(amorphadiene)[42]、白藜芦醇(resveratrol)[43-44]、对香豆酸(p-coumaric acid)[44]以及具有玫瑰香味的2-苯乙醇[44-45]、具有桃子香味的丁位癸内酯(δ-decalactone或γ-decalactone)[46-48]、具有抗肿瘤化疗价值的紫杆菌素(violacein)[21,44]、具有抗病毒作用的天然产物[49]等高附加值化合物.由于细胞内独特的油脂疏水环境和代谢途径的分区定位,解脂耶氏酵母尤其适合表达植物次级代谢产物的代谢途径[10, 50],例如萜烯类化合物的合成需要特异性的细胞色素P450氧化还原酶,解脂耶氏酵母内质网和脂质体为P450的区位选择性和立体选择性以及高效电子传递提供了独特的微环境[10,50].南京师范大学的黄和课题组[51]、马里兰大学徐鹏课题组[10]和清华大学的李春课题组[52]已经对此内容进行了详细的总结,在此不做赘述.本文将对碳源与油脂转化率的关键因素,以及涉及解脂耶氏酵母代谢分区特异性的代谢工程策略进行讨论,阐明高产油脂解脂耶氏酵母的科学问题所在,以期广大代谢工程学者一起突破这一技术瓶颈,实现微生物油脂的可持续化生产. ...
The oxidative pentose phosphate pathway is the primary source of NADPH for lipid overproduction from glucose in Yarrowia lipolytica
1
2015
... 不同于酿酒酵母,解脂耶氏酵母细胞质中乙酰辅酶A主要来源于ATP:柠檬酸裂解酶.在碳源充足氮源饥饿状态下,细胞为了充分回收利用氮源,AMP脱氨酶活性增强,将细胞内AMP转化为肌苷单磷酸(IMP).AMP为三羧酸循环中异柠檬酸脱氢酶(IDH)的天然变构激活因子,由于AMP水平的降低,IDH的活性降低,将使得线粒体内积累异柠檬酸.异柠檬酸经顺乌头酸酶逆向反应,转变为柠檬酸,过量的柠檬酸将被排出线粒体,经ATP柠檬酸裂解酶,转化为乙酰辅酶A和草酰乙酸.乙酰辅酶A经羧化后形成malonyl-CoA,转酰化反应后,malonyl-CoA主要以malonyl-ACP的形式存在(图3).β-酮酰-ACP (n)合成酶(β-ketoacyl-ACP synthase)将把malonyl-ACP装载到延伸的碳链上,依次形成β-酮酰-ACP (n+2)、β-羟酰-ACP(n+2)、β-烯酰-ACP(n+2)和β-脂酰-ACP(n+2)[7].每两个碳原子的添加,需要2个分子的还原性辅因子NADPH,依次参与β-酮酰-ACP还原酶与β-烯酰-ACP还原酶所催化的反应(图3).比如硬脂酸的合成需要8轮malonyl-ACP的缩合反应,共计需要16分子的NADPH来完成还原反应.由于解脂耶氏酵母细胞质中不具有NADH激酶或者NADH-NADPH转氢酶,NADH并不能自由转换为NADPH,在葡萄糖作为碳源情况下,解脂耶氏酵母主要的NADPH来源为磷酸戊糖途径(pentose phosphate pathway)[53].在磷酸戊糖途径中,葡萄糖被磷酸化后,分别经由6-磷酸葡萄糖脱氢酶和6-磷酸葡萄糖酸脱氢酶,就会产生2分子的NADPH.这一获取还原力的途径并非最佳选择,原因在于6-磷酸葡萄糖酸脱氢酶具有脱羧功能并产生CO2,解脂耶氏酵母每产生2分子NADPH以消耗1分子CO2为代价.因此每合成1分子硬脂酸(C18:0),细胞需要16分子的NADPH,需要额外消耗4/3分子的葡萄糖(C6H12O6)来提供这些还原力[54-55].硬脂酸骨架中18个碳原子,来源于9个乙酰辅酶A分子,相对应于4.5分子的葡萄糖(1/3的碳原子经过丙酮酸脱氢酶复合体脱羧后丢失).因此,每合成1分子硬脂酸(C18:0),需要4.5分子葡萄糖提供碳原子骨架,另外需要4/3分子葡萄糖提供NADHP还原力,对应的化学计量关系为,对应于每消耗5.83(4.5 + 4/3)分子葡萄糖,产生1分子硬脂酸.理论硬脂酸的得率为0.271 g 硬脂酸/g 葡萄糖[54, 56].理论得率越高,消耗的起始碳源越少;原材料通常占据生产成本的50%,选取高效的NADPH替代途径,将对提高碳源转化率、降低碳源消耗和压缩生产成本,起到至关重要的作用. ...
The role of malic enzyme as the provider of NADPH in oleaginous microorganisms: a reappraisal and unsolved problems
2
2014
... 不同于酿酒酵母,解脂耶氏酵母细胞质中乙酰辅酶A主要来源于ATP:柠檬酸裂解酶.在碳源充足氮源饥饿状态下,细胞为了充分回收利用氮源,AMP脱氨酶活性增强,将细胞内AMP转化为肌苷单磷酸(IMP).AMP为三羧酸循环中异柠檬酸脱氢酶(IDH)的天然变构激活因子,由于AMP水平的降低,IDH的活性降低,将使得线粒体内积累异柠檬酸.异柠檬酸经顺乌头酸酶逆向反应,转变为柠檬酸,过量的柠檬酸将被排出线粒体,经ATP柠檬酸裂解酶,转化为乙酰辅酶A和草酰乙酸.乙酰辅酶A经羧化后形成malonyl-CoA,转酰化反应后,malonyl-CoA主要以malonyl-ACP的形式存在(图3).β-酮酰-ACP (n)合成酶(β-ketoacyl-ACP synthase)将把malonyl-ACP装载到延伸的碳链上,依次形成β-酮酰-ACP (n+2)、β-羟酰-ACP(n+2)、β-烯酰-ACP(n+2)和β-脂酰-ACP(n+2)[7].每两个碳原子的添加,需要2个分子的还原性辅因子NADPH,依次参与β-酮酰-ACP还原酶与β-烯酰-ACP还原酶所催化的反应(图3).比如硬脂酸的合成需要8轮malonyl-ACP的缩合反应,共计需要16分子的NADPH来完成还原反应.由于解脂耶氏酵母细胞质中不具有NADH激酶或者NADH-NADPH转氢酶,NADH并不能自由转换为NADPH,在葡萄糖作为碳源情况下,解脂耶氏酵母主要的NADPH来源为磷酸戊糖途径(pentose phosphate pathway)[53].在磷酸戊糖途径中,葡萄糖被磷酸化后,分别经由6-磷酸葡萄糖脱氢酶和6-磷酸葡萄糖酸脱氢酶,就会产生2分子的NADPH.这一获取还原力的途径并非最佳选择,原因在于6-磷酸葡萄糖酸脱氢酶具有脱羧功能并产生CO2,解脂耶氏酵母每产生2分子NADPH以消耗1分子CO2为代价.因此每合成1分子硬脂酸(C18:0),细胞需要16分子的NADPH,需要额外消耗4/3分子的葡萄糖(C6H12O6)来提供这些还原力[54-55].硬脂酸骨架中18个碳原子,来源于9个乙酰辅酶A分子,相对应于4.5分子的葡萄糖(1/3的碳原子经过丙酮酸脱氢酶复合体脱羧后丢失).因此,每合成1分子硬脂酸(C18:0),需要4.5分子葡萄糖提供碳原子骨架,另外需要4/3分子葡萄糖提供NADHP还原力,对应的化学计量关系为,对应于每消耗5.83(4.5 + 4/3)分子葡萄糖,产生1分子硬脂酸.理论硬脂酸的得率为0.271 g 硬脂酸/g 葡萄糖[54, 56].理论得率越高,消耗的起始碳源越少;原材料通常占据生产成本的50%,选取高效的NADPH替代途径,将对提高碳源转化率、降低碳源消耗和压缩生产成本,起到至关重要的作用. ...
... [54, 56].理论得率越高,消耗的起始碳源越少;原材料通常占据生产成本的50%,选取高效的NADPH替代途径,将对提高碳源转化率、降低碳源消耗和压缩生产成本,起到至关重要的作用. ...
The role of malic enzyme in the regulation of lipid accumulation in filamentous fungi
1
1999
... 不同于酿酒酵母,解脂耶氏酵母细胞质中乙酰辅酶A主要来源于ATP:柠檬酸裂解酶.在碳源充足氮源饥饿状态下,细胞为了充分回收利用氮源,AMP脱氨酶活性增强,将细胞内AMP转化为肌苷单磷酸(IMP).AMP为三羧酸循环中异柠檬酸脱氢酶(IDH)的天然变构激活因子,由于AMP水平的降低,IDH的活性降低,将使得线粒体内积累异柠檬酸.异柠檬酸经顺乌头酸酶逆向反应,转变为柠檬酸,过量的柠檬酸将被排出线粒体,经ATP柠檬酸裂解酶,转化为乙酰辅酶A和草酰乙酸.乙酰辅酶A经羧化后形成malonyl-CoA,转酰化反应后,malonyl-CoA主要以malonyl-ACP的形式存在(图3).β-酮酰-ACP (n)合成酶(β-ketoacyl-ACP synthase)将把malonyl-ACP装载到延伸的碳链上,依次形成β-酮酰-ACP (n+2)、β-羟酰-ACP(n+2)、β-烯酰-ACP(n+2)和β-脂酰-ACP(n+2)[7].每两个碳原子的添加,需要2个分子的还原性辅因子NADPH,依次参与β-酮酰-ACP还原酶与β-烯酰-ACP还原酶所催化的反应(图3).比如硬脂酸的合成需要8轮malonyl-ACP的缩合反应,共计需要16分子的NADPH来完成还原反应.由于解脂耶氏酵母细胞质中不具有NADH激酶或者NADH-NADPH转氢酶,NADH并不能自由转换为NADPH,在葡萄糖作为碳源情况下,解脂耶氏酵母主要的NADPH来源为磷酸戊糖途径(pentose phosphate pathway)[53].在磷酸戊糖途径中,葡萄糖被磷酸化后,分别经由6-磷酸葡萄糖脱氢酶和6-磷酸葡萄糖酸脱氢酶,就会产生2分子的NADPH.这一获取还原力的途径并非最佳选择,原因在于6-磷酸葡萄糖酸脱氢酶具有脱羧功能并产生CO2,解脂耶氏酵母每产生2分子NADPH以消耗1分子CO2为代价.因此每合成1分子硬脂酸(C18:0),细胞需要16分子的NADPH,需要额外消耗4/3分子的葡萄糖(C6H12O6)来提供这些还原力[54-55].硬脂酸骨架中18个碳原子,来源于9个乙酰辅酶A分子,相对应于4.5分子的葡萄糖(1/3的碳原子经过丙酮酸脱氢酶复合体脱羧后丢失).因此,每合成1分子硬脂酸(C18:0),需要4.5分子葡萄糖提供碳原子骨架,另外需要4/3分子葡萄糖提供NADHP还原力,对应的化学计量关系为,对应于每消耗5.83(4.5 + 4/3)分子葡萄糖,产生1分子硬脂酸.理论硬脂酸的得率为0.271 g 硬脂酸/g 葡萄糖[54, 56].理论得率越高,消耗的起始碳源越少;原材料通常占据生产成本的50%,选取高效的NADPH替代途径,将对提高碳源转化率、降低碳源消耗和压缩生产成本,起到至关重要的作用. ...
Lipid production in Yarrowia lipolytica is maximized by engineering cytosolic redox metabolism
5
2017
... 不同于酿酒酵母,解脂耶氏酵母细胞质中乙酰辅酶A主要来源于ATP:柠檬酸裂解酶.在碳源充足氮源饥饿状态下,细胞为了充分回收利用氮源,AMP脱氨酶活性增强,将细胞内AMP转化为肌苷单磷酸(IMP).AMP为三羧酸循环中异柠檬酸脱氢酶(IDH)的天然变构激活因子,由于AMP水平的降低,IDH的活性降低,将使得线粒体内积累异柠檬酸.异柠檬酸经顺乌头酸酶逆向反应,转变为柠檬酸,过量的柠檬酸将被排出线粒体,经ATP柠檬酸裂解酶,转化为乙酰辅酶A和草酰乙酸.乙酰辅酶A经羧化后形成malonyl-CoA,转酰化反应后,malonyl-CoA主要以malonyl-ACP的形式存在(图3).β-酮酰-ACP (n)合成酶(β-ketoacyl-ACP synthase)将把malonyl-ACP装载到延伸的碳链上,依次形成β-酮酰-ACP (n+2)、β-羟酰-ACP(n+2)、β-烯酰-ACP(n+2)和β-脂酰-ACP(n+2)[7].每两个碳原子的添加,需要2个分子的还原性辅因子NADPH,依次参与β-酮酰-ACP还原酶与β-烯酰-ACP还原酶所催化的反应(图3).比如硬脂酸的合成需要8轮malonyl-ACP的缩合反应,共计需要16分子的NADPH来完成还原反应.由于解脂耶氏酵母细胞质中不具有NADH激酶或者NADH-NADPH转氢酶,NADH并不能自由转换为NADPH,在葡萄糖作为碳源情况下,解脂耶氏酵母主要的NADPH来源为磷酸戊糖途径(pentose phosphate pathway)[53].在磷酸戊糖途径中,葡萄糖被磷酸化后,分别经由6-磷酸葡萄糖脱氢酶和6-磷酸葡萄糖酸脱氢酶,就会产生2分子的NADPH.这一获取还原力的途径并非最佳选择,原因在于6-磷酸葡萄糖酸脱氢酶具有脱羧功能并产生CO2,解脂耶氏酵母每产生2分子NADPH以消耗1分子CO2为代价.因此每合成1分子硬脂酸(C18:0),细胞需要16分子的NADPH,需要额外消耗4/3分子的葡萄糖(C6H12O6)来提供这些还原力[54-55].硬脂酸骨架中18个碳原子,来源于9个乙酰辅酶A分子,相对应于4.5分子的葡萄糖(1/3的碳原子经过丙酮酸脱氢酶复合体脱羧后丢失).因此,每合成1分子硬脂酸(C18:0),需要4.5分子葡萄糖提供碳原子骨架,另外需要4/3分子葡萄糖提供NADHP还原力,对应的化学计量关系为,对应于每消耗5.83(4.5 + 4/3)分子葡萄糖,产生1分子硬脂酸.理论硬脂酸的得率为0.271 g 硬脂酸/g 葡萄糖[54, 56].理论得率越高,消耗的起始碳源越少;原材料通常占据生产成本的50%,选取高效的NADPH替代途径,将对提高碳源转化率、降低碳源消耗和压缩生产成本,起到至关重要的作用. ...
... 从以上分析可知,辅酶NADPH的供应效率,决定了脂肪酸的理论得率.产油酵母细胞中存在了诸多NADPH的替代途径,作者在此已将可能的替代途径及其对应的化学计量关系归纳,并计算了各自替代途径的脂肪酸得率.为了提高解脂耶氏酵母产油的得率,Stephanopoulous课题组系统地测试了不同还原型辅酶(NADPH)替代途径对解脂耶氏酵母合成甘油三酯的影响,通过NADPH的化学计量关系的理论计算并探索最佳的NADPH替换途径[56].作者系统性地分析比较了磷酸戊糖途径,NADPH-特异性的3-磷酸甘油醛脱氢酶(NADPH-specific 3-phosphoglyceraldehyde dehydrogenase),丙酮酸-草酰乙酸-苹果酸转氢反应(pyruvate-oxaloacetate-malate transhydrogenase cycle),以及非氧化性糖酵解途径(non-oxidative glycolysis pathway)产生还原性辅因子NADPH效率的差异(图4),构建了一系列重组解脂耶氏酵母,发现NADPH-特异性的3-磷酸甘油醛脱氢酶(NADPH-specific GAPDH)与异源表达的苹果酸酶(malic enzyme),能够高效地弥补磷酸戊糖途径NADPH还原力的不足,改造后的解脂耶氏酵母能够高效地整合乙酰辅酶A(acetyl-CoA)和NADPH,其产油量高达99.7 g/L,油脂的过程得率达到了0.27 g脂肪酸甲酯/g葡萄糖,油脂积累速度达到了1.2 g/(L·h)[56].这一结果使我们朝向构建可持续性的微生物油脂平台迈进了一大步. ...
... [56].这一结果使我们朝向构建可持续性的微生物油脂平台迈进了一大步. ...
... [
56]
(图示中包含了以下四种途径:①磷酸戊糖途径;②NADPH-特异性的3-磷酸甘油醛脱氢酶;③丙酮酸-草酰乙酸-苹果酸转氢反应;④非氧化性糖酵解途径) ...
... (图示中包含了以下四种途径:①磷酸戊糖途径;②NADPH-特异性的3-磷酸甘油醛脱氢酶;③丙酮酸-草酰乙酸-苹果酸转氢反应;④非氧化性糖酵解途径)
Carbon conversion efficiency from NADPH for fatty acids synthesis pathways <sup>[<xref ref-type="bibr" rid="R56">56</xref>]</sup>(OxPP—oxidative pentose phosphate pathway; GAPHD—NADPH-specific glyceraldehyde-3-phosphate dehydrogenase; POM cycle—pyruvate-oxaloacetate-malate transhydrogenase cycle; NOG—non-oxidative glycolytic pathway) ...
In-depth understanding of molecular mechanisms of aldehyde toxicity to engineer robust Saccharomyces cerevisiae
1
2021
... 基于解脂耶氏酵母的氧化应激防御机制(oxidative stress defense pathway),Jayakody等发现该酵母积累过多的亲核的负电自由基,包括脂质过氧化物、超氧化物和自由醛基等,这些负电阴离子损伤蛋白质催化功能,影响DNA复制的保真性[57],并促使细胞凋零,菌体呈现假菌丝状(hyphae).为克服这一缺陷,该课题组加强了氧化还原的保护力,过表达了NADPH途径以及谷胱甘肽还原酶和过氧化酶,改造后的解脂耶氏酵母能够更好地抵抗氧化压力,细胞形态呈现单细胞、圆球形,细胞的甘油三酯含量显著提高至81.4%,甘油三酯的生产速率提高至0.97 g/(L·h)[58]. ...
Engineering oxidative stress defense pathways to build a robust lipid production platform in Yarrowia lipolytica
1
2017
... 基于解脂耶氏酵母的氧化应激防御机制(oxidative stress defense pathway),Jayakody等发现该酵母积累过多的亲核的负电自由基,包括脂质过氧化物、超氧化物和自由醛基等,这些负电阴离子损伤蛋白质催化功能,影响DNA复制的保真性[57],并促使细胞凋零,菌体呈现假菌丝状(hyphae).为克服这一缺陷,该课题组加强了氧化还原的保护力,过表达了NADPH途径以及谷胱甘肽还原酶和过氧化酶,改造后的解脂耶氏酵母能够更好地抵抗氧化压力,细胞形态呈现单细胞、圆球形,细胞的甘油三酯含量显著提高至81.4%,甘油三酯的生产速率提高至0.97 g/(L·h)[58]. ...
Synthetic yeast brews neuroactive compounds
1
2021
... 解脂耶氏酵母能够高效合成油脂的生物基础在于其胞内高度特异性的功能化分区[59],其中脂肪酸的合成效率高度依赖于脂肪酸合成酶、乙酰辅酶A羧化酶以及苹果酸酶所形成的超酶复合体(lipid metabolon)[60-61],甘油三酯的合成与组装需要内质网与脂质体的协同作用.酶分子的空间定位及细胞内生化反应的分区,能够大大增加中间底物传递和转化的效率,同时能够有效地降低不稳定底物的流失,自然界广泛存在的亚细胞水平超酶复合体,包括糖酵解途径、三羧酸循环以及脂肪酸合成等,均已被细胞成像技术证实.为了充分配置并利用亚细胞水平的不同功能分区,Stephanopoulos课题组首次在解脂耶氏酵母中,将具有脂酰辅酶A(acyl-CoA)和脂酰ACP(acyl-ACP)还原以及水解功能等特异性的酶定位表达于线粒体、脂质过氧化物体(peroxisome)和内质网(ER)等亚细胞器中,改造了产油酵母的生产性状,并配合脂肪醛脱羰酶(aldehyde decarbonylase)或者脂酰辅酶A还原酶(fatty acyl-CoA reductase),使得遗传改造后的酵母产生成了具有生物燃料特征的烷烃类、烯烃类和脂肪醇等化合物[32].酿酒酵母,经代谢工程改造后,能够生成10.4 g/L的游离脂肪酸和1.5 g/L的脂肪醇[62].另外通过表达异源脂肪酸合成酶,于涛等在酿酒酵母中成功表达了分枝杆菌的脂肪酸合成体系,结合acyl-CoA还原酶,生成了24个碳原子的脂肪醇[63].通过表达脂酰辅酶A光脱羧酶(fatty acyl-CoA photodecarboxylase),改造后的解脂耶氏酵母能够利用葡萄糖合成将近1.5 g/L的脂肪烷(烯)烃[34]. ...
First evidence for a multienzyme complex of lipid biosynthesis pathway enzymes in Cunninghamella bainieri
1
2018
... 解脂耶氏酵母能够高效合成油脂的生物基础在于其胞内高度特异性的功能化分区[59],其中脂肪酸的合成效率高度依赖于脂肪酸合成酶、乙酰辅酶A羧化酶以及苹果酸酶所形成的超酶复合体(lipid metabolon)[60-61],甘油三酯的合成与组装需要内质网与脂质体的协同作用.酶分子的空间定位及细胞内生化反应的分区,能够大大增加中间底物传递和转化的效率,同时能够有效地降低不稳定底物的流失,自然界广泛存在的亚细胞水平超酶复合体,包括糖酵解途径、三羧酸循环以及脂肪酸合成等,均已被细胞成像技术证实.为了充分配置并利用亚细胞水平的不同功能分区,Stephanopoulos课题组首次在解脂耶氏酵母中,将具有脂酰辅酶A(acyl-CoA)和脂酰ACP(acyl-ACP)还原以及水解功能等特异性的酶定位表达于线粒体、脂质过氧化物体(peroxisome)和内质网(ER)等亚细胞器中,改造了产油酵母的生产性状,并配合脂肪醛脱羰酶(aldehyde decarbonylase)或者脂酰辅酶A还原酶(fatty acyl-CoA reductase),使得遗传改造后的酵母产生成了具有生物燃料特征的烷烃类、烯烃类和脂肪醇等化合物[32].酿酒酵母,经代谢工程改造后,能够生成10.4 g/L的游离脂肪酸和1.5 g/L的脂肪醇[62].另外通过表达异源脂肪酸合成酶,于涛等在酿酒酵母中成功表达了分枝杆菌的脂肪酸合成体系,结合acyl-CoA还原酶,生成了24个碳原子的脂肪醇[63].通过表达脂酰辅酶A光脱羧酶(fatty acyl-CoA photodecarboxylase),改造后的解脂耶氏酵母能够利用葡萄糖合成将近1.5 g/L的脂肪烷(烯)烃[34]. ...
Regulation of lipid accumulation in oleaginous micro-organisms
1
2002
... 解脂耶氏酵母能够高效合成油脂的生物基础在于其胞内高度特异性的功能化分区[59],其中脂肪酸的合成效率高度依赖于脂肪酸合成酶、乙酰辅酶A羧化酶以及苹果酸酶所形成的超酶复合体(lipid metabolon)[60-61],甘油三酯的合成与组装需要内质网与脂质体的协同作用.酶分子的空间定位及细胞内生化反应的分区,能够大大增加中间底物传递和转化的效率,同时能够有效地降低不稳定底物的流失,自然界广泛存在的亚细胞水平超酶复合体,包括糖酵解途径、三羧酸循环以及脂肪酸合成等,均已被细胞成像技术证实.为了充分配置并利用亚细胞水平的不同功能分区,Stephanopoulos课题组首次在解脂耶氏酵母中,将具有脂酰辅酶A(acyl-CoA)和脂酰ACP(acyl-ACP)还原以及水解功能等特异性的酶定位表达于线粒体、脂质过氧化物体(peroxisome)和内质网(ER)等亚细胞器中,改造了产油酵母的生产性状,并配合脂肪醛脱羰酶(aldehyde decarbonylase)或者脂酰辅酶A还原酶(fatty acyl-CoA reductase),使得遗传改造后的酵母产生成了具有生物燃料特征的烷烃类、烯烃类和脂肪醇等化合物[32].酿酒酵母,经代谢工程改造后,能够生成10.4 g/L的游离脂肪酸和1.5 g/L的脂肪醇[62].另外通过表达异源脂肪酸合成酶,于涛等在酿酒酵母中成功表达了分枝杆菌的脂肪酸合成体系,结合acyl-CoA还原酶,生成了24个碳原子的脂肪醇[63].通过表达脂酰辅酶A光脱羧酶(fatty acyl-CoA photodecarboxylase),改造后的解脂耶氏酵母能够利用葡萄糖合成将近1.5 g/L的脂肪烷(烯)烃[34]. ...
Production of fatty acid-derived oleochemicals and biofuels by synthetic yeast cell factories
1
2016
... 解脂耶氏酵母能够高效合成油脂的生物基础在于其胞内高度特异性的功能化分区[59],其中脂肪酸的合成效率高度依赖于脂肪酸合成酶、乙酰辅酶A羧化酶以及苹果酸酶所形成的超酶复合体(lipid metabolon)[60-61],甘油三酯的合成与组装需要内质网与脂质体的协同作用.酶分子的空间定位及细胞内生化反应的分区,能够大大增加中间底物传递和转化的效率,同时能够有效地降低不稳定底物的流失,自然界广泛存在的亚细胞水平超酶复合体,包括糖酵解途径、三羧酸循环以及脂肪酸合成等,均已被细胞成像技术证实.为了充分配置并利用亚细胞水平的不同功能分区,Stephanopoulos课题组首次在解脂耶氏酵母中,将具有脂酰辅酶A(acyl-CoA)和脂酰ACP(acyl-ACP)还原以及水解功能等特异性的酶定位表达于线粒体、脂质过氧化物体(peroxisome)和内质网(ER)等亚细胞器中,改造了产油酵母的生产性状,并配合脂肪醛脱羰酶(aldehyde decarbonylase)或者脂酰辅酶A还原酶(fatty acyl-CoA reductase),使得遗传改造后的酵母产生成了具有生物燃料特征的烷烃类、烯烃类和脂肪醇等化合物[32].酿酒酵母,经代谢工程改造后,能够生成10.4 g/L的游离脂肪酸和1.5 g/L的脂肪醇[62].另外通过表达异源脂肪酸合成酶,于涛等在酿酒酵母中成功表达了分枝杆菌的脂肪酸合成体系,结合acyl-CoA还原酶,生成了24个碳原子的脂肪醇[63].通过表达脂酰辅酶A光脱羧酶(fatty acyl-CoA photodecarboxylase),改造后的解脂耶氏酵母能够利用葡萄糖合成将近1.5 g/L的脂肪烷(烯)烃[34]. ...
Metabolic engineering of Saccharomyces cerevisiae for production of very long chain fatty acid-derived chemicals
1
2017
... 解脂耶氏酵母能够高效合成油脂的生物基础在于其胞内高度特异性的功能化分区[59],其中脂肪酸的合成效率高度依赖于脂肪酸合成酶、乙酰辅酶A羧化酶以及苹果酸酶所形成的超酶复合体(lipid metabolon)[60-61],甘油三酯的合成与组装需要内质网与脂质体的协同作用.酶分子的空间定位及细胞内生化反应的分区,能够大大增加中间底物传递和转化的效率,同时能够有效地降低不稳定底物的流失,自然界广泛存在的亚细胞水平超酶复合体,包括糖酵解途径、三羧酸循环以及脂肪酸合成等,均已被细胞成像技术证实.为了充分配置并利用亚细胞水平的不同功能分区,Stephanopoulos课题组首次在解脂耶氏酵母中,将具有脂酰辅酶A(acyl-CoA)和脂酰ACP(acyl-ACP)还原以及水解功能等特异性的酶定位表达于线粒体、脂质过氧化物体(peroxisome)和内质网(ER)等亚细胞器中,改造了产油酵母的生产性状,并配合脂肪醛脱羰酶(aldehyde decarbonylase)或者脂酰辅酶A还原酶(fatty acyl-CoA reductase),使得遗传改造后的酵母产生成了具有生物燃料特征的烷烃类、烯烃类和脂肪醇等化合物[32].酿酒酵母,经代谢工程改造后,能够生成10.4 g/L的游离脂肪酸和1.5 g/L的脂肪醇[62].另外通过表达异源脂肪酸合成酶,于涛等在酿酒酵母中成功表达了分枝杆菌的脂肪酸合成体系,结合acyl-CoA还原酶,生成了24个碳原子的脂肪醇[63].通过表达脂酰辅酶A光脱羧酶(fatty acyl-CoA photodecarboxylase),改造后的解脂耶氏酵母能够利用葡萄糖合成将近1.5 g/L的脂肪烷(烯)烃[34]. ...
Fatty acid biosynthesis revisited: structure elucidation and metabolic engineering
1
2015
... 脂肪酸碳链长度,决定了生物柴油的理化性质和燃烧性能,比如凝固点和挥发性等;短链功能性油脂分子,易于被动物和人体吸收,通常营养价值也高.因此,控制脂肪酸碳链长度,成为代谢工程研究的热点之一.细菌的脂肪酸合成酶由5个单体亚基构成,每个蛋白亚基负责不同的催化功能,其不同亚基间结合松散,易于工程改造;与细菌不同,真菌中脂肪酸合成酶由两条肽链编码,每条肽链大概有2000个氨基酸,分别编码脂肪酸合成酶的不同功能域.蛋白晶体结构分析表明,真菌脂肪酸合成酶两条肽链组成一个多聚体的分子笼状结构,不同碳链长度的脂酰-ACP(四碳到十四碳)中间体被包裹在脂肪酸合成酶分子笼内部[64],直至棕榈酰-ACP,碳链增加到16才能被脂肪酸合成酶释放,并经过MPT结构域(malonyl/palmitoyl transacylase)将棕榈酰-ACP转变为棕榈酰-CoA(C16∶0),所生成的棕榈酰-CoA通过脂肪酸延长酶(elongase)和去饱和酶(desaturase)依次生成硬脂酰-CoA(C18∶0)和油酰-CoA(C18∶1),并依次加载到3-磷酸甘油骨架上,合成各种脂类化合物(图5).在真菌中,通过直接表达脂酰-ACP硫解酶(fatty acyl-ACP thioesterase)来生产短链脂肪酸的效率低.通过蛋白质的理性设计,Xu等[32]将解脂耶氏酵母中脂肪酸合成酶的MPT(malonyl/palmitoyl transacylase)结构域替换为具有acyl-CoA水解功能的结构域,改造后的酵母能够生产具有不同碳链长度的脂肪酸分子(C12、C14和C16等),提高了解脂耶氏酵母的工业利用价值.另外通过蛋白工程手段,定向改造ACP结构域[65]、酮脂酰ACP 合成酶结构域和MPT转酰基结构域,能够使酿酒酵母生产短链的脂肪酸,C6和C8脂肪酸的产量达到了100~250 mg/L[66].由此看出,蛋白理性改造能够有效控制脂肪酸合成过程碳链的延伸,德国Max Planck Institute的Ashwin Chari课题组以及法兰克福大学Eckhard Boles课题组对此进行了详细的结构生物分析[66-67],进一步阐释了脂肪酸的碳链长度调控机制,为定向改造产油酵母生产短链和中等碳链长度脂肪酸和油脂化合物提供了理论基础. ...
Multidimensional engineering of Saccharomyces cerevisiae for efficient synthesis of medium-chain fatty acids
1
2020
... 脂肪酸碳链长度,决定了生物柴油的理化性质和燃烧性能,比如凝固点和挥发性等;短链功能性油脂分子,易于被动物和人体吸收,通常营养价值也高.因此,控制脂肪酸碳链长度,成为代谢工程研究的热点之一.细菌的脂肪酸合成酶由5个单体亚基构成,每个蛋白亚基负责不同的催化功能,其不同亚基间结合松散,易于工程改造;与细菌不同,真菌中脂肪酸合成酶由两条肽链编码,每条肽链大概有2000个氨基酸,分别编码脂肪酸合成酶的不同功能域.蛋白晶体结构分析表明,真菌脂肪酸合成酶两条肽链组成一个多聚体的分子笼状结构,不同碳链长度的脂酰-ACP(四碳到十四碳)中间体被包裹在脂肪酸合成酶分子笼内部[64],直至棕榈酰-ACP,碳链增加到16才能被脂肪酸合成酶释放,并经过MPT结构域(malonyl/palmitoyl transacylase)将棕榈酰-ACP转变为棕榈酰-CoA(C16∶0),所生成的棕榈酰-CoA通过脂肪酸延长酶(elongase)和去饱和酶(desaturase)依次生成硬脂酰-CoA(C18∶0)和油酰-CoA(C18∶1),并依次加载到3-磷酸甘油骨架上,合成各种脂类化合物(图5).在真菌中,通过直接表达脂酰-ACP硫解酶(fatty acyl-ACP thioesterase)来生产短链脂肪酸的效率低.通过蛋白质的理性设计,Xu等[32]将解脂耶氏酵母中脂肪酸合成酶的MPT(malonyl/palmitoyl transacylase)结构域替换为具有acyl-CoA水解功能的结构域,改造后的酵母能够生产具有不同碳链长度的脂肪酸分子(C12、C14和C16等),提高了解脂耶氏酵母的工业利用价值.另外通过蛋白工程手段,定向改造ACP结构域[65]、酮脂酰ACP 合成酶结构域和MPT转酰基结构域,能够使酿酒酵母生产短链的脂肪酸,C6和C8脂肪酸的产量达到了100~250 mg/L[66].由此看出,蛋白理性改造能够有效控制脂肪酸合成过程碳链的延伸,德国Max Planck Institute的Ashwin Chari课题组以及法兰克福大学Eckhard Boles课题组对此进行了详细的结构生物分析[66-67],进一步阐释了脂肪酸的碳链长度调控机制,为定向改造产油酵母生产短链和中等碳链长度脂肪酸和油脂化合物提供了理论基础. ...
Engineering fungal de novo fatty acid synthesis for short chain fatty acid production
2
2017
... 脂肪酸碳链长度,决定了生物柴油的理化性质和燃烧性能,比如凝固点和挥发性等;短链功能性油脂分子,易于被动物和人体吸收,通常营养价值也高.因此,控制脂肪酸碳链长度,成为代谢工程研究的热点之一.细菌的脂肪酸合成酶由5个单体亚基构成,每个蛋白亚基负责不同的催化功能,其不同亚基间结合松散,易于工程改造;与细菌不同,真菌中脂肪酸合成酶由两条肽链编码,每条肽链大概有2000个氨基酸,分别编码脂肪酸合成酶的不同功能域.蛋白晶体结构分析表明,真菌脂肪酸合成酶两条肽链组成一个多聚体的分子笼状结构,不同碳链长度的脂酰-ACP(四碳到十四碳)中间体被包裹在脂肪酸合成酶分子笼内部[64],直至棕榈酰-ACP,碳链增加到16才能被脂肪酸合成酶释放,并经过MPT结构域(malonyl/palmitoyl transacylase)将棕榈酰-ACP转变为棕榈酰-CoA(C16∶0),所生成的棕榈酰-CoA通过脂肪酸延长酶(elongase)和去饱和酶(desaturase)依次生成硬脂酰-CoA(C18∶0)和油酰-CoA(C18∶1),并依次加载到3-磷酸甘油骨架上,合成各种脂类化合物(图5).在真菌中,通过直接表达脂酰-ACP硫解酶(fatty acyl-ACP thioesterase)来生产短链脂肪酸的效率低.通过蛋白质的理性设计,Xu等[32]将解脂耶氏酵母中脂肪酸合成酶的MPT(malonyl/palmitoyl transacylase)结构域替换为具有acyl-CoA水解功能的结构域,改造后的酵母能够生产具有不同碳链长度的脂肪酸分子(C12、C14和C16等),提高了解脂耶氏酵母的工业利用价值.另外通过蛋白工程手段,定向改造ACP结构域[65]、酮脂酰ACP 合成酶结构域和MPT转酰基结构域,能够使酿酒酵母生产短链的脂肪酸,C6和C8脂肪酸的产量达到了100~250 mg/L[66].由此看出,蛋白理性改造能够有效控制脂肪酸合成过程碳链的延伸,德国Max Planck Institute的Ashwin Chari课题组以及法兰克福大学Eckhard Boles课题组对此进行了详细的结构生物分析[66-67],进一步阐释了脂肪酸的碳链长度调控机制,为定向改造产油酵母生产短链和中等碳链长度脂肪酸和油脂化合物提供了理论基础. ...
... [66-67],进一步阐释了脂肪酸的碳链长度调控机制,为定向改造产油酵母生产短链和中等碳链长度脂肪酸和油脂化合物提供了理论基础. ...
Discovery of a regulatory subunit of the yeast fatty acid synthase
1
2020
... 脂肪酸碳链长度,决定了生物柴油的理化性质和燃烧性能,比如凝固点和挥发性等;短链功能性油脂分子,易于被动物和人体吸收,通常营养价值也高.因此,控制脂肪酸碳链长度,成为代谢工程研究的热点之一.细菌的脂肪酸合成酶由5个单体亚基构成,每个蛋白亚基负责不同的催化功能,其不同亚基间结合松散,易于工程改造;与细菌不同,真菌中脂肪酸合成酶由两条肽链编码,每条肽链大概有2000个氨基酸,分别编码脂肪酸合成酶的不同功能域.蛋白晶体结构分析表明,真菌脂肪酸合成酶两条肽链组成一个多聚体的分子笼状结构,不同碳链长度的脂酰-ACP(四碳到十四碳)中间体被包裹在脂肪酸合成酶分子笼内部[64],直至棕榈酰-ACP,碳链增加到16才能被脂肪酸合成酶释放,并经过MPT结构域(malonyl/palmitoyl transacylase)将棕榈酰-ACP转变为棕榈酰-CoA(C16∶0),所生成的棕榈酰-CoA通过脂肪酸延长酶(elongase)和去饱和酶(desaturase)依次生成硬脂酰-CoA(C18∶0)和油酰-CoA(C18∶1),并依次加载到3-磷酸甘油骨架上,合成各种脂类化合物(图5).在真菌中,通过直接表达脂酰-ACP硫解酶(fatty acyl-ACP thioesterase)来生产短链脂肪酸的效率低.通过蛋白质的理性设计,Xu等[32]将解脂耶氏酵母中脂肪酸合成酶的MPT(malonyl/palmitoyl transacylase)结构域替换为具有acyl-CoA水解功能的结构域,改造后的酵母能够生产具有不同碳链长度的脂肪酸分子(C12、C14和C16等),提高了解脂耶氏酵母的工业利用价值.另外通过蛋白工程手段,定向改造ACP结构域[65]、酮脂酰ACP 合成酶结构域和MPT转酰基结构域,能够使酿酒酵母生产短链的脂肪酸,C6和C8脂肪酸的产量达到了100~250 mg/L[66].由此看出,蛋白理性改造能够有效控制脂肪酸合成过程碳链的延伸,德国Max Planck Institute的Ashwin Chari课题组以及法兰克福大学Eckhard Boles课题组对此进行了详细的结构生物分析[66-67],进一步阐释了脂肪酸的碳链长度调控机制,为定向改造产油酵母生产短链和中等碳链长度脂肪酸和油脂化合物提供了理论基础. ...
Harnessing Yarrowia lipolytica lipogenesis to create a platform for lipid and biofuel production
1
2014
... 氮源饥饿(nitrogen starvation)所造成的异柠檬酸脱氢酶活性减弱和ATP:柠檬酸裂解酶活性增强是产油酵母开启油脂合成的重要生化特征.其中一个重要前提是,AMP脱氨酶活性增强,从而导致细胞内AMP水平下降,进而导致异柠檬酸脱氢酶活性减弱[68].虽然目前学术界缺乏氮源饥饿导致AMP脱氨酶活性增强的直接生化证据,过量表达AMP脱氨酶后能够使细胞内产生更多的乙酰辅酶A,进而使得解脂耶氏酵母积累较多番茄红素(lycopene)[69].然而直接过表达AMP脱氨酶,似乎并不能显著提高产油酵母油脂的积累,表明产油酵母油脂的积累存在其他关键调控位点,或者AMP脱氨酶的调控有可能发生在蛋白翻译后修饰(post-translational modification)水平上[70].最近也有其他报道,比如过表达AMP脱氨酶后能够使产油真菌Mortierella alpina中油脂含量提高15%~34%[71]. ...
Multicopy integrants of crt genes and co-expression of AMP deaminase improve lycopene production in Yarrowia lipolytica
1
2019
... 氮源饥饿(nitrogen starvation)所造成的异柠檬酸脱氢酶活性减弱和ATP:柠檬酸裂解酶活性增强是产油酵母开启油脂合成的重要生化特征.其中一个重要前提是,AMP脱氨酶活性增强,从而导致细胞内AMP水平下降,进而导致异柠檬酸脱氢酶活性减弱[68].虽然目前学术界缺乏氮源饥饿导致AMP脱氨酶活性增强的直接生化证据,过量表达AMP脱氨酶后能够使细胞内产生更多的乙酰辅酶A,进而使得解脂耶氏酵母积累较多番茄红素(lycopene)[69].然而直接过表达AMP脱氨酶,似乎并不能显著提高产油酵母油脂的积累,表明产油酵母油脂的积累存在其他关键调控位点,或者AMP脱氨酶的调控有可能发生在蛋白翻译后修饰(post-translational modification)水平上[70].最近也有其他报道,比如过表达AMP脱氨酶后能够使产油真菌Mortierella alpina中油脂含量提高15%~34%[71]. ...
Functional overexpression and characterization of lipogenesis-related genes in the oleaginous yeast Yarrowia lipolytica
1
2016
... 氮源饥饿(nitrogen starvation)所造成的异柠檬酸脱氢酶活性减弱和ATP:柠檬酸裂解酶活性增强是产油酵母开启油脂合成的重要生化特征.其中一个重要前提是,AMP脱氨酶活性增强,从而导致细胞内AMP水平下降,进而导致异柠檬酸脱氢酶活性减弱[68].虽然目前学术界缺乏氮源饥饿导致AMP脱氨酶活性增强的直接生化证据,过量表达AMP脱氨酶后能够使细胞内产生更多的乙酰辅酶A,进而使得解脂耶氏酵母积累较多番茄红素(lycopene)[69].然而直接过表达AMP脱氨酶,似乎并不能显著提高产油酵母油脂的积累,表明产油酵母油脂的积累存在其他关键调控位点,或者AMP脱氨酶的调控有可能发生在蛋白翻译后修饰(post-translational modification)水平上[70].最近也有其他报道,比如过表达AMP脱氨酶后能够使产油真菌Mortierella alpina中油脂含量提高15%~34%[71]. ...
Role of adenosine monophosphate deaminase during fatty acid accumulation in oleaginous fungus Mortierella alpina
1
2019
... 氮源饥饿(nitrogen starvation)所造成的异柠檬酸脱氢酶活性减弱和ATP:柠檬酸裂解酶活性增强是产油酵母开启油脂合成的重要生化特征.其中一个重要前提是,AMP脱氨酶活性增强,从而导致细胞内AMP水平下降,进而导致异柠檬酸脱氢酶活性减弱[68].虽然目前学术界缺乏氮源饥饿导致AMP脱氨酶活性增强的直接生化证据,过量表达AMP脱氨酶后能够使细胞内产生更多的乙酰辅酶A,进而使得解脂耶氏酵母积累较多番茄红素(lycopene)[69].然而直接过表达AMP脱氨酶,似乎并不能显著提高产油酵母油脂的积累,表明产油酵母油脂的积累存在其他关键调控位点,或者AMP脱氨酶的调控有可能发生在蛋白翻译后修饰(post-translational modification)水平上[70].最近也有其他报道,比如过表达AMP脱氨酶后能够使产油真菌Mortierella alpina中油脂含量提高15%~34%[71]. ...
Snf1 is a regulator of lipid accumulation in Yarrowia lipolytica
3
2013
... Snf1/AMPK是真核生物中高度保守的碳源与能量调控蛋白.有关真菌中碳源代谢,主要涉及Snf1/AMPK相关的应激活化蛋白激酶,近来成为了研究解脂耶氏酵母油脂积累机理的调控热点[72].SNF1/AMPKs通常以异三聚体复合物(heterotrimeric complex)的形式存在,主要由具催化功能的α-亚基(Snf1)和两个调控亚基组成,调控亚基包含了β-亚基(Sip1、Sip2或Gal83)和γ-亚基(Snf4),解脂耶氏酵母中含有高度保守的Snf1/AMPK系统,经过Blast分析,Snf1、Snf4、Gal83和Sip2分别对应于解脂耶氏酵母的YALI0D02101g、YALI0C03421g、YALI0E13926p和YALI0C00429p等编码序列[72].杜邦的科学发现Snf1缺失的解脂耶氏酵母能够高效积累油脂,包括EPA等不饱和脂肪酸,进一步经过基因芯片和实时定量PCR分析,他们发现Snf1活性缺失,能够激活油脂积累代谢途径[72]. ...
... [72].杜邦的科学发现Snf1缺失的解脂耶氏酵母能够高效积累油脂,包括EPA等不饱和脂肪酸,进一步经过基因芯片和实时定量PCR分析,他们发现Snf1活性缺失,能够激活油脂积累代谢途径[72]. ...
... [72]. ...
Multi-omics analysis reveals regulators of the response to nitrogen limitation in Yarrowia lipolytica
2
2016
... 近年来,系统水平的多组学分析手段,包括蛋白组、磷酸蛋白组和代谢组学分析,已经被广泛用于研究解脂耶氏酵母的碳源、能量代谢以及油脂积累的积累.其中,美国西北太平洋国家实验室的Scott Baker课题组发现氮源氨基酸代谢,与解脂耶氏酵母脂肪酸的积累息息相关.比如,在氮源饥饿状态下,核糖体结构相关基因的表达高度下调,预示油脂积累阶段蛋白表达的减弱[73];细胞为了回收利用含氮化合物,包括丙氨酸、腐胺(putrescine)、亚精胺(spermidine)和尿素(urea)等化合物将会被分解,进而导致细胞内产生糖醇和三羧酸循环代谢相关的溢出代谢物,包括甘露醇、赤藓糖醇以及柠檬酸、富马酸和苹果酸等副产物.在氮源限制情况下,该课题组通过磷酸蛋白组学分析,发现了1219个新的磷酸化位点,其中133个磷酸化位点与氮源饥饿显著关联[73],这些磷酸化位点主要集中于蛋白激酶和具DNA结合活性的转录因子.在酶学水平,磷酸化主要修饰脂肪合成途径的ATP:柠檬酸裂解酶和乙酰辅酶A羧化酶,同时磷酸化导致了脂肪酸氧化降解途径的减弱,这一研究表明磷酸化调控是油脂积累的关键成因. ...
... [73],这些磷酸化位点主要集中于蛋白激酶和具DNA结合活性的转录因子.在酶学水平,磷酸化主要修饰脂肪合成途径的ATP:柠檬酸裂解酶和乙酰辅酶A羧化酶,同时磷酸化导致了脂肪酸氧化降解途径的减弱,这一研究表明磷酸化调控是油脂积累的关键成因. ...
Regulation of amino-acid metabolism controls flux to lipid accumulation in Yarrowia lipolytica
1
2016
... 通过不同碳氮比条件下的恒化器培养,Nielsen课题组对解脂耶氏酵母积累油脂的调控机理进行了研究.通过全基因组规模的RNAseq测序,该课组发现油脂的积累,不依赖于转录水平的调控;脂肪酸碳流的代谢调控主要发生在氨基酸代谢途径[74],由此发现脂肪酸合成前体acetyl-CoA,很大一部分来源于氨基酸的代谢氧化,这一结论与Alper课题组发现的亮氨酸/异亮氨酸代谢参与解脂耶氏酵母脂肪酸合成相互佐证[75].有关解脂耶氏酵母中氮源代谢调控,Pomraning等[76]最近揭示了氮源代谢阻遏(nitrogen catabolite repression)与GATA家族锌指蛋白转录因子(GATA zinc finger transcription factors)之间的关联.比如删除锌指转录因子gzf3和gzf2,会造成细胞氮源特异性的生长缺陷和油脂的大量积累.另外碳源代谢阻遏因子mig1也与锌指蛋白转录因子的活性相关[76].揭示碳源与氮源代谢调控因子将会加深我们对解脂耶氏酵母积累油脂的分子机理的认识.未来5~10年,我们期望解脂耶氏酵母领域的科学工作者,将会描绘一幅更加清晰的碳源/氮源调控网络,为我们构建可持续性的细胞油脂工厂奠定基础. ...
Harnessing Yarrowia lipolytica lipogenesis to create a platform for lipid and biofuel production
1
2014
... 通过不同碳氮比条件下的恒化器培养,Nielsen课题组对解脂耶氏酵母积累油脂的调控机理进行了研究.通过全基因组规模的RNAseq测序,该课组发现油脂的积累,不依赖于转录水平的调控;脂肪酸碳流的代谢调控主要发生在氨基酸代谢途径[74],由此发现脂肪酸合成前体acetyl-CoA,很大一部分来源于氨基酸的代谢氧化,这一结论与Alper课题组发现的亮氨酸/异亮氨酸代谢参与解脂耶氏酵母脂肪酸合成相互佐证[75].有关解脂耶氏酵母中氮源代谢调控,Pomraning等[76]最近揭示了氮源代谢阻遏(nitrogen catabolite repression)与GATA家族锌指蛋白转录因子(GATA zinc finger transcription factors)之间的关联.比如删除锌指转录因子gzf3和gzf2,会造成细胞氮源特异性的生长缺陷和油脂的大量积累.另外碳源代谢阻遏因子mig1也与锌指蛋白转录因子的活性相关[76].揭示碳源与氮源代谢调控因子将会加深我们对解脂耶氏酵母积累油脂的分子机理的认识.未来5~10年,我们期望解脂耶氏酵母领域的科学工作者,将会描绘一幅更加清晰的碳源/氮源调控网络,为我们构建可持续性的细胞油脂工厂奠定基础. ...
Regulation of nitrogen metabolism by GATA zinc finger transcription factors in Yarrowia lipolytica
2
2017
... 通过不同碳氮比条件下的恒化器培养,Nielsen课题组对解脂耶氏酵母积累油脂的调控机理进行了研究.通过全基因组规模的RNAseq测序,该课组发现油脂的积累,不依赖于转录水平的调控;脂肪酸碳流的代谢调控主要发生在氨基酸代谢途径[74],由此发现脂肪酸合成前体acetyl-CoA,很大一部分来源于氨基酸的代谢氧化,这一结论与Alper课题组发现的亮氨酸/异亮氨酸代谢参与解脂耶氏酵母脂肪酸合成相互佐证[75].有关解脂耶氏酵母中氮源代谢调控,Pomraning等[76]最近揭示了氮源代谢阻遏(nitrogen catabolite repression)与GATA家族锌指蛋白转录因子(GATA zinc finger transcription factors)之间的关联.比如删除锌指转录因子gzf3和gzf2,会造成细胞氮源特异性的生长缺陷和油脂的大量积累.另外碳源代谢阻遏因子mig1也与锌指蛋白转录因子的活性相关[76].揭示碳源与氮源代谢调控因子将会加深我们对解脂耶氏酵母积累油脂的分子机理的认识.未来5~10年,我们期望解脂耶氏酵母领域的科学工作者,将会描绘一幅更加清晰的碳源/氮源调控网络,为我们构建可持续性的细胞油脂工厂奠定基础. ...
... [76].揭示碳源与氮源代谢调控因子将会加深我们对解脂耶氏酵母积累油脂的分子机理的认识.未来5~10年,我们期望解脂耶氏酵母领域的科学工作者,将会描绘一幅更加清晰的碳源/氮源调控网络,为我们构建可持续性的细胞油脂工厂奠定基础. ...
Analytical solution for a hybrid Logistic-Monod cell growth model in batch and continuous stirred tank reactor culture
1
2020
... 在生物加工制造过程中,生化过程动力学建模能够给我们提供最优化的发酵控制参数.对生物过程的动态分析,有助于我们根据细胞的生理状态,制定最优化的细胞生长和控制参数,从而最大限度地提高碳源的利用率,增加细胞强度,降低生产成本与提高经济可行性[77].油脂分子属于胞内积累的代谢产物,油脂的过量积累会对细胞生长的适应性(growth fitness)产生负面影响,目前常用的动力学模型主要考虑胞外产物、酶蛋白活性、或者次级代谢产物的积累,比如柠檬酸[78]、纳豆激酶[79]和灵芝酸[80]等的动力学,此类生化过程建模相对简单.有关油脂化合物积累的动力学模型已经扩展到微藻[81]和解脂耶氏酵母[82],所构建的模型并没有考虑油脂合成对细胞生长的影响、过程得率等经济指标.为了进一步加深对解脂耶氏酵母积累油脂发酵过程的认识,作者将细胞总生物量(Xtotal)分为油脂(P)和非油脂生物量(oil-free biomass,X),并引入一个负担系数(γ)来描述油脂积累对细胞生长的影响.根据生化反应动力学原则,分批培养条件下,油脂积累的非结构动力学模型可以归纳如表1. ...
Kinetics of biomass formation and citric acid production by Aspergillus niger on pilot plant scale
1
1981
... 在生物加工制造过程中,生化过程动力学建模能够给我们提供最优化的发酵控制参数.对生物过程的动态分析,有助于我们根据细胞的生理状态,制定最优化的细胞生长和控制参数,从而最大限度地提高碳源的利用率,增加细胞强度,降低生产成本与提高经济可行性[77].油脂分子属于胞内积累的代谢产物,油脂的过量积累会对细胞生长的适应性(growth fitness)产生负面影响,目前常用的动力学模型主要考虑胞外产物、酶蛋白活性、或者次级代谢产物的积累,比如柠檬酸[78]、纳豆激酶[79]和灵芝酸[80]等的动力学,此类生化过程建模相对简单.有关油脂化合物积累的动力学模型已经扩展到微藻[81]和解脂耶氏酵母[82],所构建的模型并没有考虑油脂合成对细胞生长的影响、过程得率等经济指标.为了进一步加深对解脂耶氏酵母积累油脂发酵过程的认识,作者将细胞总生物量(Xtotal)分为油脂(P)和非油脂生物量(oil-free biomass,X),并引入一个负担系数(γ)来描述油脂积累对细胞生长的影响.根据生化反应动力学原则,分批培养条件下,油脂积累的非结构动力学模型可以归纳如表1. ...
Microbial production of nattokinase: current progress, challenge and prospect
1
2017
... 在生物加工制造过程中,生化过程动力学建模能够给我们提供最优化的发酵控制参数.对生物过程的动态分析,有助于我们根据细胞的生理状态,制定最优化的细胞生长和控制参数,从而最大限度地提高碳源的利用率,增加细胞强度,降低生产成本与提高经济可行性[77].油脂分子属于胞内积累的代谢产物,油脂的过量积累会对细胞生长的适应性(growth fitness)产生负面影响,目前常用的动力学模型主要考虑胞外产物、酶蛋白活性、或者次级代谢产物的积累,比如柠檬酸[78]、纳豆激酶[79]和灵芝酸[80]等的动力学,此类生化过程建模相对简单.有关油脂化合物积累的动力学模型已经扩展到微藻[81]和解脂耶氏酵母[82],所构建的模型并没有考虑油脂合成对细胞生长的影响、过程得率等经济指标.为了进一步加深对解脂耶氏酵母积累油脂发酵过程的认识,作者将细胞总生物量(Xtotal)分为油脂(P)和非油脂生物量(oil-free biomass,X),并引入一个负担系数(γ)来描述油脂积累对细胞生长的影响.根据生化反应动力学原则,分批培养条件下,油脂积累的非结构动力学模型可以归纳如表1. ...
Improved production of mycelial biomass and ganoderic acid by submerged culture of Ganoderma lucidum SB97 using complex media
1
2008
... 在生物加工制造过程中,生化过程动力学建模能够给我们提供最优化的发酵控制参数.对生物过程的动态分析,有助于我们根据细胞的生理状态,制定最优化的细胞生长和控制参数,从而最大限度地提高碳源的利用率,增加细胞强度,降低生产成本与提高经济可行性[77].油脂分子属于胞内积累的代谢产物,油脂的过量积累会对细胞生长的适应性(growth fitness)产生负面影响,目前常用的动力学模型主要考虑胞外产物、酶蛋白活性、或者次级代谢产物的积累,比如柠檬酸[78]、纳豆激酶[79]和灵芝酸[80]等的动力学,此类生化过程建模相对简单.有关油脂化合物积累的动力学模型已经扩展到微藻[81]和解脂耶氏酵母[82],所构建的模型并没有考虑油脂合成对细胞生长的影响、过程得率等经济指标.为了进一步加深对解脂耶氏酵母积累油脂发酵过程的认识,作者将细胞总生物量(Xtotal)分为油脂(P)和非油脂生物量(oil-free biomass,X),并引入一个负担系数(γ)来描述油脂积累对细胞生长的影响.根据生化反应动力学原则,分批培养条件下,油脂积累的非结构动力学模型可以归纳如表1. ...
Kinetic modeling of microalgal growth and lipid synthesis for biodiesel production
1
2015
... 在生物加工制造过程中,生化过程动力学建模能够给我们提供最优化的发酵控制参数.对生物过程的动态分析,有助于我们根据细胞的生理状态,制定最优化的细胞生长和控制参数,从而最大限度地提高碳源的利用率,增加细胞强度,降低生产成本与提高经济可行性[77].油脂分子属于胞内积累的代谢产物,油脂的过量积累会对细胞生长的适应性(growth fitness)产生负面影响,目前常用的动力学模型主要考虑胞外产物、酶蛋白活性、或者次级代谢产物的积累,比如柠檬酸[78]、纳豆激酶[79]和灵芝酸[80]等的动力学,此类生化过程建模相对简单.有关油脂化合物积累的动力学模型已经扩展到微藻[81]和解脂耶氏酵母[82],所构建的模型并没有考虑油脂合成对细胞生长的影响、过程得率等经济指标.为了进一步加深对解脂耶氏酵母积累油脂发酵过程的认识,作者将细胞总生物量(Xtotal)分为油脂(P)和非油脂生物量(oil-free biomass,X),并引入一个负担系数(γ)来描述油脂积累对细胞生长的影响.根据生化反应动力学原则,分批培养条件下,油脂积累的非结构动力学模型可以归纳如表1. ...
Modeling lipid accumulation and degradation in Yarrowia lipolytica cultivated on industrial fats
1
2003
... 在生物加工制造过程中,生化过程动力学建模能够给我们提供最优化的发酵控制参数.对生物过程的动态分析,有助于我们根据细胞的生理状态,制定最优化的细胞生长和控制参数,从而最大限度地提高碳源的利用率,增加细胞强度,降低生产成本与提高经济可行性[77].油脂分子属于胞内积累的代谢产物,油脂的过量积累会对细胞生长的适应性(growth fitness)产生负面影响,目前常用的动力学模型主要考虑胞外产物、酶蛋白活性、或者次级代谢产物的积累,比如柠檬酸[78]、纳豆激酶[79]和灵芝酸[80]等的动力学,此类生化过程建模相对简单.有关油脂化合物积累的动力学模型已经扩展到微藻[81]和解脂耶氏酵母[82],所构建的模型并没有考虑油脂合成对细胞生长的影响、过程得率等经济指标.为了进一步加深对解脂耶氏酵母积累油脂发酵过程的认识,作者将细胞总生物量(Xtotal)分为油脂(P)和非油脂生物量(oil-free biomass,X),并引入一个负担系数(γ)来描述油脂积累对细胞生长的影响.根据生化反应动力学原则,分批培养条件下,油脂积累的非结构动力学模型可以归纳如表1. ...
The fatty acid transport protein Fat1p is involved in the export of fatty acids from lipid bodies in Yarrowia lipolytica
1
2014
... 高通量筛选及表型鉴定是构建微生物油脂平台的核心技术.基于油脂的特异性荧光染色剂、近红外光谱、拉曼光谱,结合流式细胞仪与微流体技术,将会为构建高效的油脂细胞工厂提供一把利刃.所谓“工欲善其事,必先利其器”.近年来,一些学者开发了油脂分子探针(Bodipy,Invitrogen公司),能够在活体细胞内特异性地与长链油脂分子结合,受到480 nm激发,进而释放510 nm波段特异性的荧光.与传统的尼罗河红染色剂(Nile red)相比,Bodipy具有灵敏度高、样品处理简单等优点.另外,Bodipy可用于解脂耶氏酵母脂质体(lipid droplet 或者lipid body)的染色,用于细胞生物学和油脂积累的研究[83].基于尼罗河红和Bodipy,近来学者开发了快速、简易的微藻中油脂定量方法,作者总结了两种染色剂的应用范围,特别提到了各自染色剂的准确性受到光谱特性、荧光染色剂浓度、有机溶剂、细胞浓度、温度以及反应时间的影响[84].需要特别指出的是,经过优化后的Bodipy方法,可以准确快速地用来筛选高产油脂的解脂耶氏酵母[85],筛选出的解脂耶氏酵母,产油量高达85 g/L,细胞含油量达到了77%,产油速率达到了0.73 g/(L·h). ...
The use of fluorescent Nile red and BODIPY for lipid measurement in microalgae
1
2015
... 高通量筛选及表型鉴定是构建微生物油脂平台的核心技术.基于油脂的特异性荧光染色剂、近红外光谱、拉曼光谱,结合流式细胞仪与微流体技术,将会为构建高效的油脂细胞工厂提供一把利刃.所谓“工欲善其事,必先利其器”.近年来,一些学者开发了油脂分子探针(Bodipy,Invitrogen公司),能够在活体细胞内特异性地与长链油脂分子结合,受到480 nm激发,进而释放510 nm波段特异性的荧光.与传统的尼罗河红染色剂(Nile red)相比,Bodipy具有灵敏度高、样品处理简单等优点.另外,Bodipy可用于解脂耶氏酵母脂质体(lipid droplet 或者lipid body)的染色,用于细胞生物学和油脂积累的研究[83].基于尼罗河红和Bodipy,近来学者开发了快速、简易的微藻中油脂定量方法,作者总结了两种染色剂的应用范围,特别提到了各自染色剂的准确性受到光谱特性、荧光染色剂浓度、有机溶剂、细胞浓度、温度以及反应时间的影响[84].需要特别指出的是,经过优化后的Bodipy方法,可以准确快速地用来筛选高产油脂的解脂耶氏酵母[85],筛选出的解脂耶氏酵母,产油量高达85 g/L,细胞含油量达到了77%,产油速率达到了0.73 g/(L·h). ...
Engineering of a high lipid producing Yarrowia lipolytica strain
1
2016
... 高通量筛选及表型鉴定是构建微生物油脂平台的核心技术.基于油脂的特异性荧光染色剂、近红外光谱、拉曼光谱,结合流式细胞仪与微流体技术,将会为构建高效的油脂细胞工厂提供一把利刃.所谓“工欲善其事,必先利其器”.近年来,一些学者开发了油脂分子探针(Bodipy,Invitrogen公司),能够在活体细胞内特异性地与长链油脂分子结合,受到480 nm激发,进而释放510 nm波段特异性的荧光.与传统的尼罗河红染色剂(Nile red)相比,Bodipy具有灵敏度高、样品处理简单等优点.另外,Bodipy可用于解脂耶氏酵母脂质体(lipid droplet 或者lipid body)的染色,用于细胞生物学和油脂积累的研究[83].基于尼罗河红和Bodipy,近来学者开发了快速、简易的微藻中油脂定量方法,作者总结了两种染色剂的应用范围,特别提到了各自染色剂的准确性受到光谱特性、荧光染色剂浓度、有机溶剂、细胞浓度、温度以及反应时间的影响[84].需要特别指出的是,经过优化后的Bodipy方法,可以准确快速地用来筛选高产油脂的解脂耶氏酵母[85],筛选出的解脂耶氏酵母,产油量高达85 g/L,细胞含油量达到了77%,产油速率达到了0.73 g/(L·h). ...
Application of Fourier transform infrared (FT-IR) spectroscopy in determination of microalgal compositions
1
2014
... 除了荧光剂以外,一些在线油脂检测手段,比如近红外光谱(infrared spectra)和拉曼光谱(Raman spectra),成为了研究胞内油脂积累的新型分析工具.脂类分子中的酯键含有甲氧基和羰基,脂分子中交替的亚甲基以及不饱和双键,以及稀有的羟基都会产生特征性的红外光谱吸收.基于此,可以采用傅里叶变换近红外光谱(Fourier transform infrared spectroscopy)来检测细胞组分的动态变化,特别是胞内油脂含量、胞内碳源与氮源变化的比例,基于脂质/氨氮和碳源/氨氮的比例,作者进而确定了利用红外光谱进行精确油脂定量和微藻细胞筛选的方法[86].为了精确确定产油酵母胞内油脂积累的动力学,近来一些学者建立了基于傅里叶变换近红外光谱的脂类定量模型[87].作者选取了3种产油酵母(Rhodotorula toruloides CBS 14,Lipomyces starkeyi CBS 1807和Yarrowia lipolytica CBS 6114),利用偏最小二乘回归(partial least squares regression),进而确定了对应3种酵母的油脂含量定量模型,经过试验验证,混合样品油脂含量与模型预测达到了高达90.5%的相关性,单一产油酵母模型预测的相关性高达96%~98%,这一方法的建立,将会极大简化产油酵母高通量筛选. ...
FT-NIR: a tool for rapid intracellular lipid quantification in oleaginous yeasts
1
2019
... 除了荧光剂以外,一些在线油脂检测手段,比如近红外光谱(infrared spectra)和拉曼光谱(Raman spectra),成为了研究胞内油脂积累的新型分析工具.脂类分子中的酯键含有甲氧基和羰基,脂分子中交替的亚甲基以及不饱和双键,以及稀有的羟基都会产生特征性的红外光谱吸收.基于此,可以采用傅里叶变换近红外光谱(Fourier transform infrared spectroscopy)来检测细胞组分的动态变化,特别是胞内油脂含量、胞内碳源与氮源变化的比例,基于脂质/氨氮和碳源/氨氮的比例,作者进而确定了利用红外光谱进行精确油脂定量和微藻细胞筛选的方法[86].为了精确确定产油酵母胞内油脂积累的动力学,近来一些学者建立了基于傅里叶变换近红外光谱的脂类定量模型[87].作者选取了3种产油酵母(Rhodotorula toruloides CBS 14,Lipomyces starkeyi CBS 1807和Yarrowia lipolytica CBS 6114),利用偏最小二乘回归(partial least squares regression),进而确定了对应3种酵母的油脂含量定量模型,经过试验验证,混合样品油脂含量与模型预测达到了高达90.5%的相关性,单一产油酵母模型预测的相关性高达96%~98%,这一方法的建立,将会极大简化产油酵母高通量筛选. ...
The use of raman spectroscopy to monitor metabolic changes in stressed Metschnikowia sp. yeasts
1
2021
... 拉曼光谱主要来研究晶格中分子的振动频率或者转动频率,其发射光源可以为可见光、近红外光和近紫外光等.拉曼光谱,已经用来定量检测脂质分子的脂肪酸组成,包括碳链长度以及不饱和度等关键数据[88],其精度也达到了传统的气质联用方法.此外,拉曼光谱具有不破坏细胞体、样品处理简单等优势.根据激发态拉曼散射光谱技术(stimulated Raman scattering microscopy),哈佛大学谢晓亮课题组在单细胞水平对3种产油酵母积累油脂的过程进行了分子表征(美国能源部报告https://doi.org/10.2172/1418344),结合微流体技术,该课题组能够分离出高产油脂的酵母菌株,进一步通过单细胞转录组分析,确定了产油基因调控的关键位点,该研究为产油酵母的油脂积累机理、表型及基因型高通量鉴定提供了基础.另外,最新发展的微流体微滴技术[89]也为产油酵母的表型快速鉴定与细胞分离提供了可能.通过光化学和级联质谱(photochemistry and tandem MS),最近学者也可以精确测定CC双键的位置以及甘油三酯sn1、sn2和sn3位置的脂肪酸类型[90]. ...
Microdroplet-assisted screening of biomolecule production for metabolic engineering applications
1
2020
... 拉曼光谱主要来研究晶格中分子的振动频率或者转动频率,其发射光源可以为可见光、近红外光和近紫外光等.拉曼光谱,已经用来定量检测脂质分子的脂肪酸组成,包括碳链长度以及不饱和度等关键数据[88],其精度也达到了传统的气质联用方法.此外,拉曼光谱具有不破坏细胞体、样品处理简单等优势.根据激发态拉曼散射光谱技术(stimulated Raman scattering microscopy),哈佛大学谢晓亮课题组在单细胞水平对3种产油酵母积累油脂的过程进行了分子表征(美国能源部报告https://doi.org/10.2172/1418344),结合微流体技术,该课题组能够分离出高产油脂的酵母菌株,进一步通过单细胞转录组分析,确定了产油基因调控的关键位点,该研究为产油酵母的油脂积累机理、表型及基因型高通量鉴定提供了基础.另外,最新发展的微流体微滴技术[89]也为产油酵母的表型快速鉴定与细胞分离提供了可能.通过光化学和级联质谱(photochemistry and tandem MS),最近学者也可以精确测定CC双键的位置以及甘油三酯sn1、sn2和sn3位置的脂肪酸类型[90]. ...
Large-scale lipid analysis with C C location and sn-position isomer resolving power
1
2020
... 拉曼光谱主要来研究晶格中分子的振动频率或者转动频率,其发射光源可以为可见光、近红外光和近紫外光等.拉曼光谱,已经用来定量检测脂质分子的脂肪酸组成,包括碳链长度以及不饱和度等关键数据[88],其精度也达到了传统的气质联用方法.此外,拉曼光谱具有不破坏细胞体、样品处理简单等优势.根据激发态拉曼散射光谱技术(stimulated Raman scattering microscopy),哈佛大学谢晓亮课题组在单细胞水平对3种产油酵母积累油脂的过程进行了分子表征(美国能源部报告https://doi.org/10.2172/1418344),结合微流体技术,该课题组能够分离出高产油脂的酵母菌株,进一步通过单细胞转录组分析,确定了产油基因调控的关键位点,该研究为产油酵母的油脂积累机理、表型及基因型高通量鉴定提供了基础.另外,最新发展的微流体微滴技术[89]也为产油酵母的表型快速鉴定与细胞分离提供了可能.通过光化学和级联质谱(photochemistry and tandem MS),最近学者也可以精确测定CC双键的位置以及甘油三酯sn1、sn2和sn3位置的脂肪酸类型[90]. ...
Advances in metabolic engineering of saccharomyces cerevisiae for cocoa butter equivalent production
1
2020
... 假定可以用产油酵母转化淀粉质或者蔗糖类作物生产功能性油脂,解脂耶氏酵母生产油脂的极限得率为0.271 g油脂/g葡萄糖,根据主要糖料作物单位面积的产量和含糖量,我们可以大致推算出,1 hm2糖料作物经酵母转化后的最大产油得率(表3).在常用的糖料作物中,种植1 hm2甘蔗,其中蔗糖经解脂耶氏酵母转化后,最大产油得率可以达到3.07 t/(hm2·a),接近于1 hm2棕榈树的产油率[3.69 t/(hm2·a)](表2);而种植1 hm2玉米,其中淀粉经解脂耶氏酵母转化后,最大产油得率可以达到2.15 t/(hm2·a)(表3);甘蔗和玉米作为原材料的产油得率远远大于红薯[1.36 t/(hm2·a)].巴西的甘蔗年产量已达6.7亿吨(670 000 000 t,湿重),为产油酵母的工业化生产提供了极为廉价的原料底物.考虑到生物转化和发酵中其他成本(比如淀粉水解,原材料预处理,氮源消耗,水电,人工以及油脂的提取分离)占理论转化成本的50%,利用甘蔗作为原材料的油脂得率为1.54 t/(hm2·a),假定碳源转化率占理论转化率(0.271 g/g)的75%,实际的功能性油脂的真实得率为1.16 t/(hm2·a).考虑到终端产物的价值链,棕榈油主要用于工业加工,其他植物油(玉米油、花生油和菜籽油等)主要用于食品烹炸,可可脂的主要用途是制作巧克力,以可可脂的售价为7000美元/t计,种植1 hm2甘蔗,所产蔗糖作为底物经产油解脂耶氏酵母转化后的毛利润可以达到8120美元/(hm2·a);玉米等主要粮食作物的价格在210美元/t,种植1 hm2玉米的毛利润在2247美元/(hm2·a),与1 hm2甘蔗的毛收益[2100美元/(hm2·a)]相近,就价值而言,利用解脂耶氏酵母生产可可脂,可以将原材料(甘蔗)的经济价值提高2.86倍,将玉米的经济价值提高2.6倍.目前Nielsen课题组已经在酿酒酵母中尝试表达可可脂合成的关键化学步骤,所产的油脂成分接近于可可脂,但产量与工业化大规模化生产还有一定差距[91-93].宋元达课题组利用了解脂耶氏酵母中的sn2特异性的脂肪酶,将羊油脂中sn2位置的饱和脂肪酸替换为油酸,得到了更加健康且脂肪酸组成接近可可脂的组分[94];另外该课题组也优化了解脂耶氏酵母生产可可脂的发酵条件,确定了以甘油和酒石酸氨为发酵原料,并发现升高发酵温度有助于促进可可脂的生成[95]. ...
Cocoa butter-like lipid production ability of non-oleaginous and oleaginous yeasts under nitrogen-limited culture conditions
0
2017
Expression of cocoa genes in Saccharomyces cerevisiae improves cocoa butter production
1
2018
... 假定可以用产油酵母转化淀粉质或者蔗糖类作物生产功能性油脂,解脂耶氏酵母生产油脂的极限得率为0.271 g油脂/g葡萄糖,根据主要糖料作物单位面积的产量和含糖量,我们可以大致推算出,1 hm2糖料作物经酵母转化后的最大产油得率(表3).在常用的糖料作物中,种植1 hm2甘蔗,其中蔗糖经解脂耶氏酵母转化后,最大产油得率可以达到3.07 t/(hm2·a),接近于1 hm2棕榈树的产油率[3.69 t/(hm2·a)](表2);而种植1 hm2玉米,其中淀粉经解脂耶氏酵母转化后,最大产油得率可以达到2.15 t/(hm2·a)(表3);甘蔗和玉米作为原材料的产油得率远远大于红薯[1.36 t/(hm2·a)].巴西的甘蔗年产量已达6.7亿吨(670 000 000 t,湿重),为产油酵母的工业化生产提供了极为廉价的原料底物.考虑到生物转化和发酵中其他成本(比如淀粉水解,原材料预处理,氮源消耗,水电,人工以及油脂的提取分离)占理论转化成本的50%,利用甘蔗作为原材料的油脂得率为1.54 t/(hm2·a),假定碳源转化率占理论转化率(0.271 g/g)的75%,实际的功能性油脂的真实得率为1.16 t/(hm2·a).考虑到终端产物的价值链,棕榈油主要用于工业加工,其他植物油(玉米油、花生油和菜籽油等)主要用于食品烹炸,可可脂的主要用途是制作巧克力,以可可脂的售价为7000美元/t计,种植1 hm2甘蔗,所产蔗糖作为底物经产油解脂耶氏酵母转化后的毛利润可以达到8120美元/(hm2·a);玉米等主要粮食作物的价格在210美元/t,种植1 hm2玉米的毛利润在2247美元/(hm2·a),与1 hm2甘蔗的毛收益[2100美元/(hm2·a)]相近,就价值而言,利用解脂耶氏酵母生产可可脂,可以将原材料(甘蔗)的经济价值提高2.86倍,将玉米的经济价值提高2.6倍.目前Nielsen课题组已经在酿酒酵母中尝试表达可可脂合成的关键化学步骤,所产的油脂成分接近于可可脂,但产量与工业化大规模化生产还有一定差距[91-93].宋元达课题组利用了解脂耶氏酵母中的sn2特异性的脂肪酶,将羊油脂中sn2位置的饱和脂肪酸替换为油酸,得到了更加健康且脂肪酸组成接近可可脂的组分[94];另外该课题组也优化了解脂耶氏酵母生产可可脂的发酵条件,确定了以甘油和酒石酸氨为发酵原料,并发现升高发酵温度有助于促进可可脂的生成[95]. ...
Conversion of mutton fat to cocoa butter equivalent by increasing the unsaturated fatty acids at the sn-2 position of triacylglycerol through fermentation by Yarrowia Lipolytica
1
2015
... 假定可以用产油酵母转化淀粉质或者蔗糖类作物生产功能性油脂,解脂耶氏酵母生产油脂的极限得率为0.271 g油脂/g葡萄糖,根据主要糖料作物单位面积的产量和含糖量,我们可以大致推算出,1 hm2糖料作物经酵母转化后的最大产油得率(表3).在常用的糖料作物中,种植1 hm2甘蔗,其中蔗糖经解脂耶氏酵母转化后,最大产油得率可以达到3.07 t/(hm2·a),接近于1 hm2棕榈树的产油率[3.69 t/(hm2·a)](表2);而种植1 hm2玉米,其中淀粉经解脂耶氏酵母转化后,最大产油得率可以达到2.15 t/(hm2·a)(表3);甘蔗和玉米作为原材料的产油得率远远大于红薯[1.36 t/(hm2·a)].巴西的甘蔗年产量已达6.7亿吨(670 000 000 t,湿重),为产油酵母的工业化生产提供了极为廉价的原料底物.考虑到生物转化和发酵中其他成本(比如淀粉水解,原材料预处理,氮源消耗,水电,人工以及油脂的提取分离)占理论转化成本的50%,利用甘蔗作为原材料的油脂得率为1.54 t/(hm2·a),假定碳源转化率占理论转化率(0.271 g/g)的75%,实际的功能性油脂的真实得率为1.16 t/(hm2·a).考虑到终端产物的价值链,棕榈油主要用于工业加工,其他植物油(玉米油、花生油和菜籽油等)主要用于食品烹炸,可可脂的主要用途是制作巧克力,以可可脂的售价为7000美元/t计,种植1 hm2甘蔗,所产蔗糖作为底物经产油解脂耶氏酵母转化后的毛利润可以达到8120美元/(hm2·a);玉米等主要粮食作物的价格在210美元/t,种植1 hm2玉米的毛利润在2247美元/(hm2·a),与1 hm2甘蔗的毛收益[2100美元/(hm2·a)]相近,就价值而言,利用解脂耶氏酵母生产可可脂,可以将原材料(甘蔗)的经济价值提高2.86倍,将玉米的经济价值提高2.6倍.目前Nielsen课题组已经在酿酒酵母中尝试表达可可脂合成的关键化学步骤,所产的油脂成分接近于可可脂,但产量与工业化大规模化生产还有一定差距[91-93].宋元达课题组利用了解脂耶氏酵母中的sn2特异性的脂肪酶,将羊油脂中sn2位置的饱和脂肪酸替换为油酸,得到了更加健康且脂肪酸组成接近可可脂的组分[94];另外该课题组也优化了解脂耶氏酵母生产可可脂的发酵条件,确定了以甘油和酒石酸氨为发酵原料,并发现升高发酵温度有助于促进可可脂的生成[95]. ...
Cocoa-butter-equivalent production from Yarrowia lipolytica by optimization of fermentation technology
1
2016
... 假定可以用产油酵母转化淀粉质或者蔗糖类作物生产功能性油脂,解脂耶氏酵母生产油脂的极限得率为0.271 g油脂/g葡萄糖,根据主要糖料作物单位面积的产量和含糖量,我们可以大致推算出,1 hm2糖料作物经酵母转化后的最大产油得率(表3).在常用的糖料作物中,种植1 hm2甘蔗,其中蔗糖经解脂耶氏酵母转化后,最大产油得率可以达到3.07 t/(hm2·a),接近于1 hm2棕榈树的产油率[3.69 t/(hm2·a)](表2);而种植1 hm2玉米,其中淀粉经解脂耶氏酵母转化后,最大产油得率可以达到2.15 t/(hm2·a)(表3);甘蔗和玉米作为原材料的产油得率远远大于红薯[1.36 t/(hm2·a)].巴西的甘蔗年产量已达6.7亿吨(670 000 000 t,湿重),为产油酵母的工业化生产提供了极为廉价的原料底物.考虑到生物转化和发酵中其他成本(比如淀粉水解,原材料预处理,氮源消耗,水电,人工以及油脂的提取分离)占理论转化成本的50%,利用甘蔗作为原材料的油脂得率为1.54 t/(hm2·a),假定碳源转化率占理论转化率(0.271 g/g)的75%,实际的功能性油脂的真实得率为1.16 t/(hm2·a).考虑到终端产物的价值链,棕榈油主要用于工业加工,其他植物油(玉米油、花生油和菜籽油等)主要用于食品烹炸,可可脂的主要用途是制作巧克力,以可可脂的售价为7000美元/t计,种植1 hm2甘蔗,所产蔗糖作为底物经产油解脂耶氏酵母转化后的毛利润可以达到8120美元/(hm2·a);玉米等主要粮食作物的价格在210美元/t,种植1 hm2玉米的毛利润在2247美元/(hm2·a),与1 hm2甘蔗的毛收益[2100美元/(hm2·a)]相近,就价值而言,利用解脂耶氏酵母生产可可脂,可以将原材料(甘蔗)的经济价值提高2.86倍,将玉米的经济价值提高2.6倍.目前Nielsen课题组已经在酿酒酵母中尝试表达可可脂合成的关键化学步骤,所产的油脂成分接近于可可脂,但产量与工业化大规模化生产还有一定差距[91-93].宋元达课题组利用了解脂耶氏酵母中的sn2特异性的脂肪酶,将羊油脂中sn2位置的饱和脂肪酸替换为油酸,得到了更加健康且脂肪酸组成接近可可脂的组分[94];另外该课题组也优化了解脂耶氏酵母生产可可脂的发酵条件,确定了以甘油和酒石酸氨为发酵原料,并发现升高发酵温度有助于促进可可脂的生成[95]. ...
Production of polyunsaturated fatty acids by polyketide synthases in both prokaryotes and eukaryotes
1
2001
... 健康的功能性油脂主要是含有多不饱和键的亚麻酸(α-linolenic acid,C18∶3)和EPA(eicosapentaenoic acid,C20∶5)等,主要有益智、降血脂、抗血栓和抗炎等功效,是人类必需的营养素之一,其中亚麻酸主要来源于植物提取,EPA主要源于深海藻类或者鱼类.其生物合成涉及多步去不饱和酶,在微生物中合成效率较低.研究发现,一些微藻中多不饱和脂肪酸合成酶为一个复杂的聚酮酶复合物(polyketide synthase, PKS)结构[96],其合成过程不同于一般的脂肪酸合成酶.在解脂耶氏酵母中异源表达微藻类的PKS,提高其功能活性,利用产油酵母的产油特性,将有利于我们构建高效合成EPA或者DHA的酵母.微藻与解脂耶氏酵母共培养或许也能解决脂肪酸前体供应的难题,从而提高多不饱和脂肪酸合成的效率.开发产油酵母微生物资源,提供健康的功能性油脂,将会解决一系列能源、健康食品和环境资源等问题,促进我们向可持续性的低碳经济模式转变. ...