|
||
 View image in article
图1
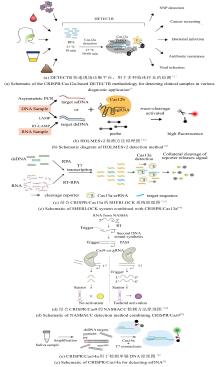
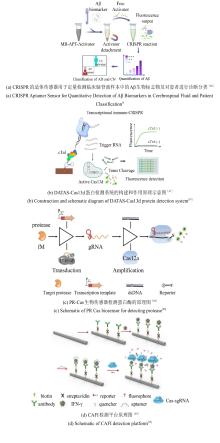
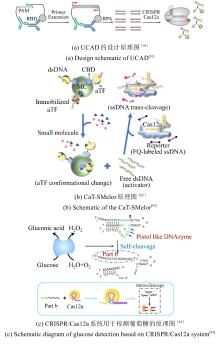
用于生物传感和生物成像的CRISPR/Cas系统的原理图
正文中引用本图/表的段落
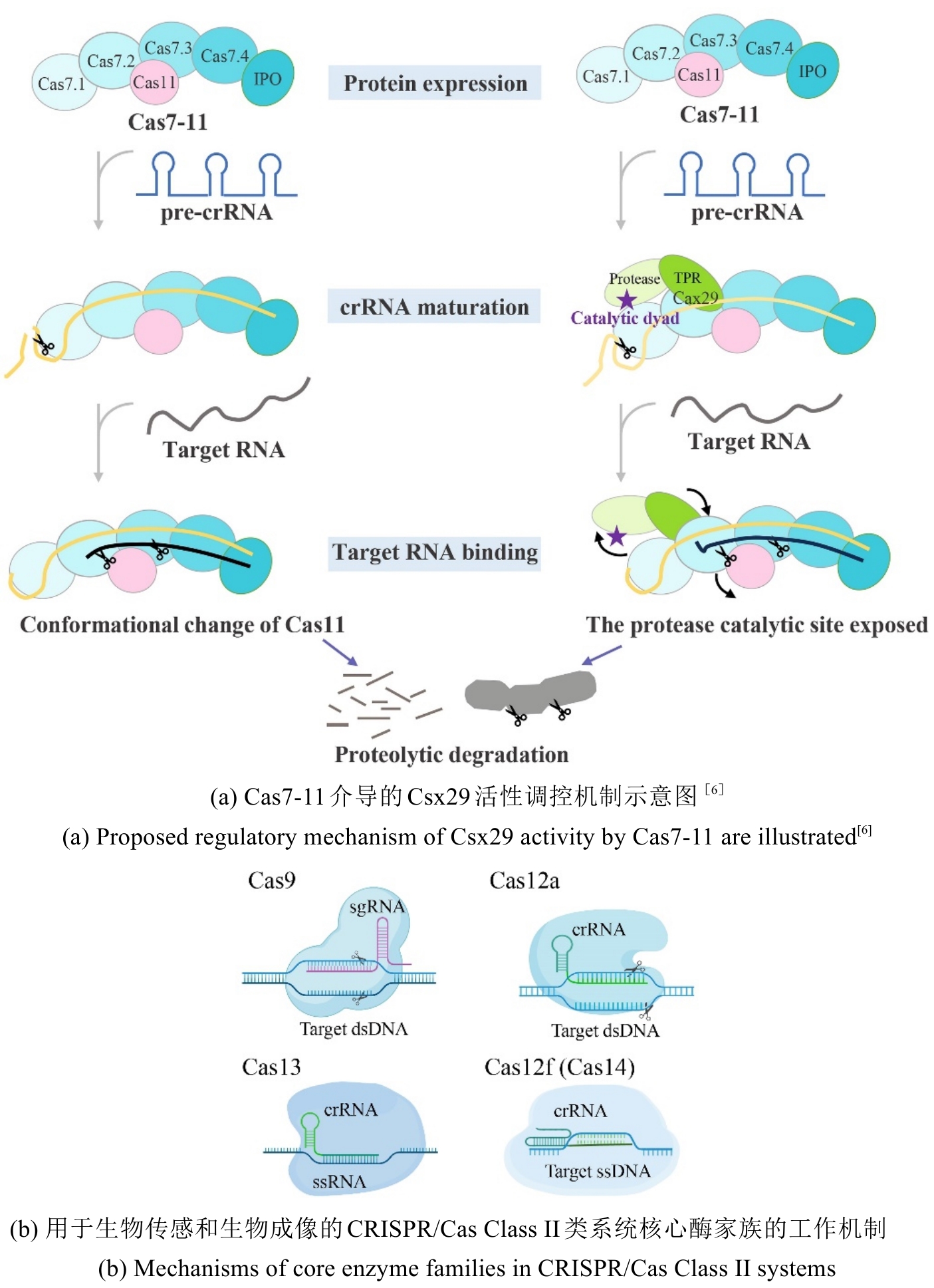
在Class I系统中,效应器由多亚基复合物构成(如Ⅰ型、Ⅲ型和Ⅳ型),其核心Cascade复合物通过Cas5/6/7/8/11蛋白的协同作用实现前体RNA序列处理、靶标识别及核酸切割。值得注意的是,不同亚型(如I-A与I-E)的复合物组分差异显著增强了系统适应能力[1]。然而,由于多亚基结构的复杂性、大分子量及多重调控机制等特征,Class I系统在分子诊断领域的应用研究相对较少。其中,Cas7-11由4个Cas7及1个Cas11结构域组成的多功能融合蛋白,具备独立完成crRNA介导的RNA靶向切割的能力,这一特性有效简化了操作系统,省去了复杂的环节与步骤,使其更为便捷高效[6][图1(a)]。通过工程化修饰Cas7-11的RNA识别域,或整合微流控芯片等技术,Cas7-11系统在多重核酸检测(如病原体筛查、肿瘤标志物检测)领域可与Class II系统形成技术互补,为分子诊断提供多元化解决方案。
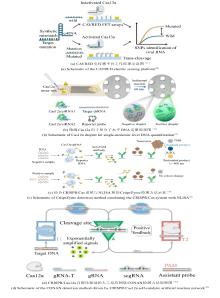
Class II系统通过单个效应蛋白执行功能,该系统作为基因组编辑的核心工具,涵盖II型、V型和VI型三个分支。其核心酶家族(Cas9、Cas12、Cas13及Cas14)凭借差异化的底物特异性(dsDNA/ssDNA/RNA),在基因编辑与分子诊断领域实现多元化应用[图1(b)]。II型系统以Cas9为标志性蛋白,通过crRNA-tracrRNA复合体(sgRNA)定位靶DNA,依赖PAM序列在RuvC与HNH核酸酶结构域协同作用下引起双链断裂[17, 18]。V型系统中,Cas12家族展现独特功能优势:V-A型Cas蛋白(如Cas12a)在crRNA引导下,能够特异性识别与crRNA互补且含有PAM序列的双链DNA靶标,并通过其RuvC结构域依次切割非靶链和靶链,这一过程称为顺式切割活性。顺式切割完成后,Cas12a被激活,进而获得对非目标单链DNA的非特异性切割能力,即反式切割活性。其中,反式切割活性可通过荧光ssDNA探针的降解实现信号输出,已成为一种高效的信号放大方式。此外,当Cas12a遇到与crRNA互补的单链DNA时,即使该单链DNA不依赖PAM序列,也能激活Cas12a的核酸内切酶活性;V-B型(Cas12b)高温稳定特性能够适配现场即时检测(POCT)需求[8]。Cas12f(V-F亚型,又称Cas14)作为CRISPR/Cas系统中已知最小的效应蛋白之一,大小在400~700个氨基酸之间,通过crRNA引导特异性识别单链DNA靶标,并触发非特异性切割任意的ssDNA,展现出反式切割活性[9]。VI型系统专攻RNA调控:Cas13a(VI-A型)结合靶RNA后,HEPN结构域构象变化激活非特异RNase活性,可切割周围任意单链RNA。通过设计多个crRNA(每个靶标对应一个crRNA)及不同荧光报告探针,单管反应中可并行检测多靶标[14, 19-21]。Class II类系统的模块化特性与功能多样性,为开发高灵敏、多场景适配的分子诊断技术奠定了基础。
本文的其它图/表
|