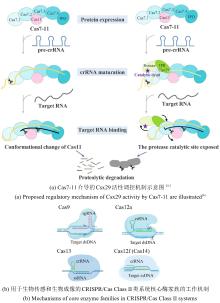
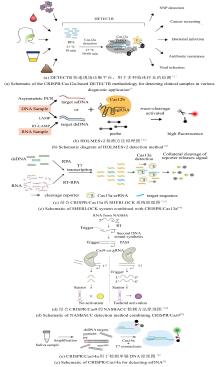
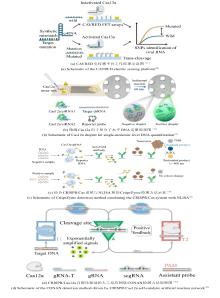
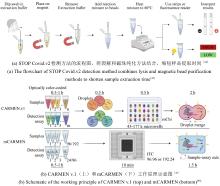
|
||
 View image in article
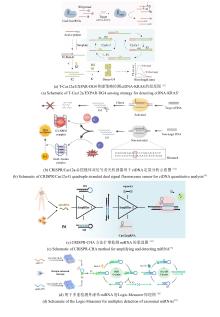
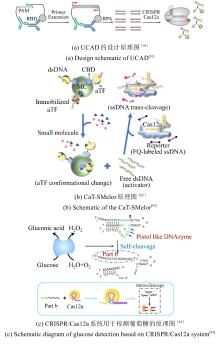
图6
CRISPR/Cas系统用于检测蛋白的方法
正文中引用本图/表的段落
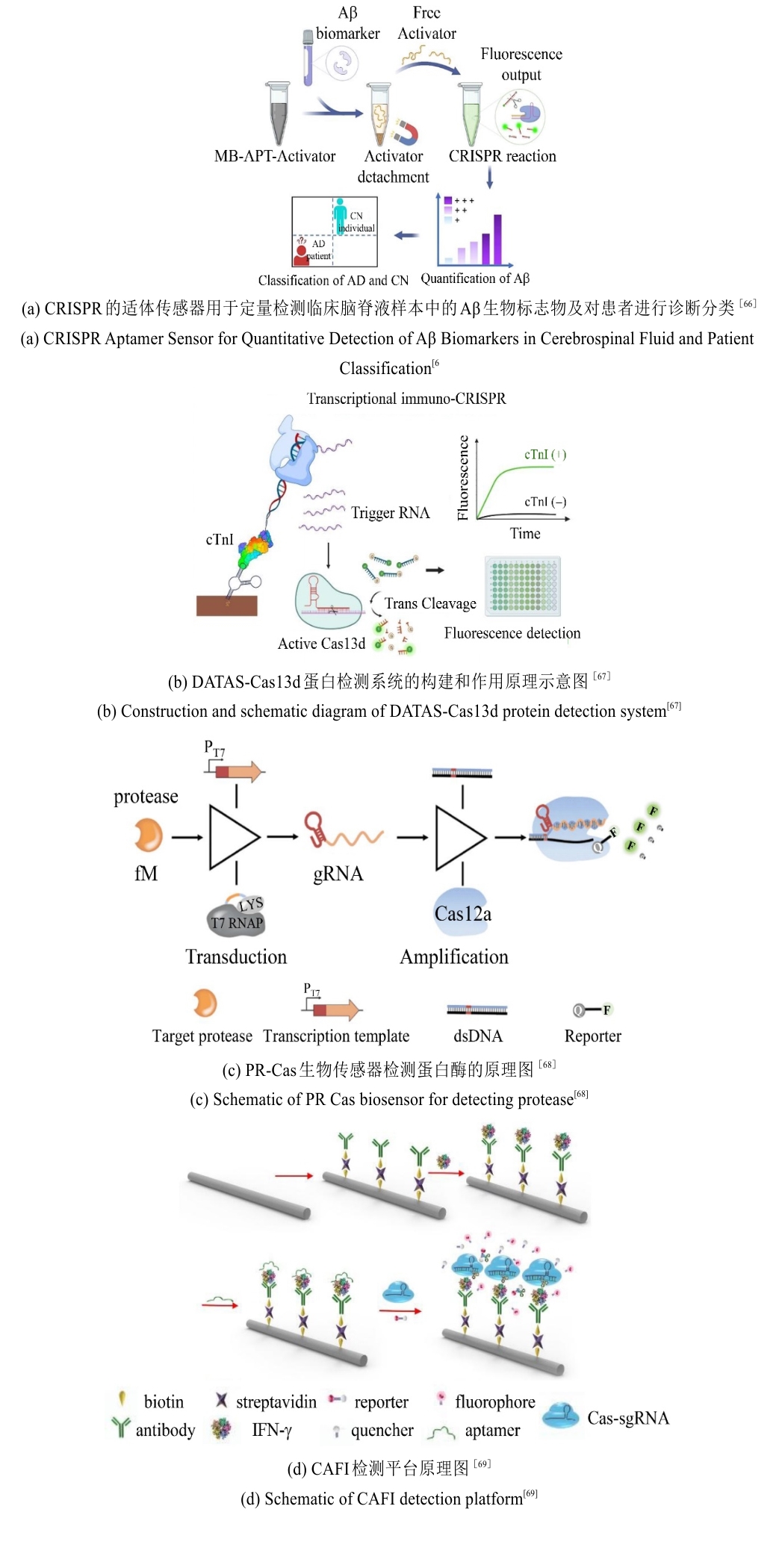
在神经退行性疾病领域,阿尔茨海默病(AD)的早期诊断依赖于脑脊液(CSF)中Aβ40/Aβ42蛋白的定量检测。刘长春团队开发了一种CRISPR/Cas12a驱动的适配体传感器[66],通过利用适配体与Aβ蛋白特异性结合,释放DNA激活剂以触发Cas12a的反式切割活性,从而实现对CSF中Aβ40和Aβ42的超灵敏检测。结合Aβ42/Aβ40比值,其模块化设计为其他标志物检测提供了通用框架[图6(a)]。在心血管急症诊断中,心肌肌钙蛋白I(cTnI)的快速检测对急性心肌梗死(AMI)至关重要。南京大学张晶晶课题组提出了一种双适配体转录扩增策略(DATAS-Cas13d),通过双适配体结合cTnI触发体外RNA转录,激活Cas13的RNA切割活性,在血清中实现9.3 pM的灵敏度,成本仅为ELISA的一半[67]。该传感器在10%人血清中的检测限为0.67 ng/mL,且对干扰蛋白(如肌红蛋白)展现出良好的特异性差异,凸显其在急诊应用场景中的实用性与优势[图6(b)]。除了适配体传感器外,CRISPR技术进一步拓展至蛋白酶活性监测及复杂样本的检测。笔者团队针对癌症进展中的关键蛋白酶,例如基质金属蛋白酶2(MMP-2),开发了一种蛋白酶触发转录激活与CRISPR/Cas12a系统联用的新型检测体系,称为PR-Cas[68]。通过设计蛋白酶激活的RNA聚合酶,将单个蛋白酶切割事件转化为多拷贝gRNA输出[图6(c)],结合Cas12a的反式切割活性,实现飞摩尔级灵敏度。该系统成功应用于临床血清样本中MMP-2活性分析,为癌症转移监测提供了新工具。
面对痕量蛋白在复杂生物基质(如全血、汗液)中的检测挑战,Ewa Goldys团队提出了CRISPR/Cas12a辅助的光纤免疫传感器[69]。通过抗体-适配体夹心结构捕获目标蛋白γ干扰素(IFN-γ),并触发Cas12a切割荧光报告分子[图6(d)],CAFI在100 μL样本中实现1 fg/mL(58.8 aM)的检测限,较ELISA灵敏度提升千倍。该系统在血清、全血、唾液等多种样本中均表现优异,且通过替换抗体/适配体可适配多目标检测。CRISPR技术通过适配体传感器、蛋白酶活性监测及光纤传感等多元化策略,突破了传统蛋白检测的灵敏度与样本适应性限制。未来,进一步整合便携式设备、多种标志物联检及体内实时监测能力,将推动CRISPR蛋白传感器向临床转化迈出关键一步,为精准医疗提供底层技术支撑。
本文的其它图/表
|