|
||
 View image in article
图5
CRISPR/Cas系统在癌症生物标志物检测中的应用
正文中引用本图/表的段落
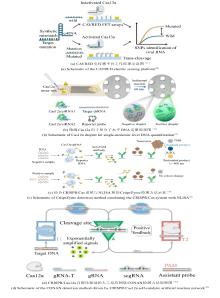
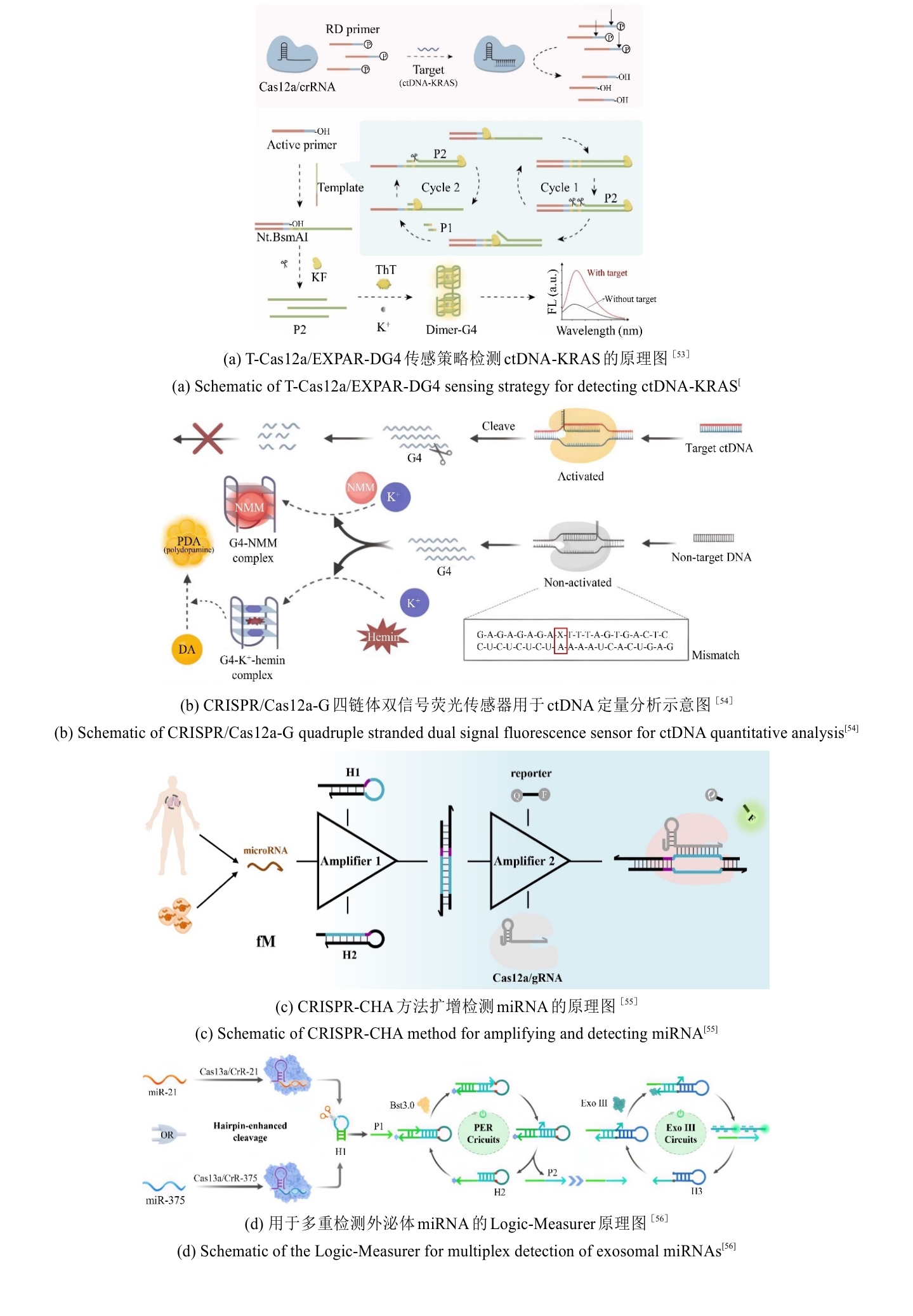
循环肿瘤DNA(circulating tumor DNA,ctDNA)作为癌症生物标志物,由肿瘤细胞释放至外周血循环系统中,对诊断、治疗和预后评估具有重要意义[50-52]。尽管传统组织活检被视为诊断的金标准方法,但其存在侵袭性强、取样区域有限以及可能引发潜在并发症等局限性。液体活检作为一种无创诊断方法,具有广阔的应用前景,然而,由于血清中目标ctDNA含量极低且易受背景DNA干扰,其检测依然面临巨大挑战。重庆大学霍丹群研究团队开发了一种超灵敏、无标记的荧光生物传感器用于ctDNA检测[53]。通过CRISPR/Cas12a切割RNA-DNA嵌合引物(RD primer)启动指数扩增反应(EXPAR),生成富G序列并形成二聚体G-四链体(Dimer-G4),结合硫磺素T(ThT)实现荧光信号显著增强,灵敏度达57 aM,适用于多种肿瘤标志物的广谱检测[图5(a)]。四川大学陈飘飘团队则提出了一种双信号荧光传感器方法[54],Cas12a能够特异性识别目标ctDNA,并对G-四链体进行反式切割,通过竞争性结合NMM荧光染料和催化多巴胺生成聚多巴胺(PDA)的酶活性,以荧光信号降低反映ctDNA浓度,用于免标记免分离ctDNA快速定量分析,检测限低至4 aM,在40分钟内实现对乳腺癌特异性突变的检测[图5(b)]。这两种方法均结合了CRISPR/Cas12a的高特异性和G-四链体的信号放大能力,避免了复杂标记步骤,且在血清环境中表现出优异的抗干扰性。前者的策略通过多重扩增实现超低检测限,而后者的方法操作简便,适用于资源有限环境。两种技术共同推动了ctDNA检测向高灵敏、便捷化及临床实用化发展,为癌症早期诊断和动态监测提供了互补性解决方案。
microRNA(miRNA)作为疾病诊断的关键生物标志物,因其在基因调控和细胞间通讯中的核心作用备受关注,尤其是外泌体miRNA因其高稳定性和疾病特异性,成为无创液体活检的重要靶标[57-59]。然而,传统检测方法(如Quantitative Real-time polymerase chain reaction, RT-qPCR)依赖复杂的RNA提取和扩增步骤,不仅耗时且可能破坏样本完整性,难以满足临床对高灵敏度和便捷性的需求[60-62]。近年来,CRISPR/Cas系统凭借其精准的分子识别和信号放大能力,为miRNA检测开辟了新路径。例如,笔者团队将CRISPR/Cas12a与催化发夹组装(CHA)电路耦合[55],通过CHA将miRNA转化为可激活Cas12a的DNA双链,实现双重信号放大,灵敏度达亚飞摩尔级,为多靶标检测提供了通用平台[图5(c)]。唱凯团队则进一步优化CRISPR/Cas13a的协同作用[56],设计“Logic-Measurer”多酶级联电路[图5(d)],整合引物交换反应(PER)和外切酶III的级联放大,通过OR逻辑门同步检测miR-21和miR-375,将检测灵敏度提升至2.1 fM,并在315例乳腺癌样本中验证了87.3%的诊断准确率,凸显临床转化潜力。张开翔团队采用脂质体介导的膜融合策略将CRISPR/Cas13a转染到外泌体中,称为MFS-CRISPR,直接测量血浆中的外泌体miRNA[63]。通过测量临床样本评估了MFS-CRISPR试验,乳腺癌患者和健康供体的miR-21表达差异显著。由于该方法灵敏度高且简便易行,在癌症诊断和治疗监测方面具有良好的临床应用前景。这些研究将CRISPR/Cas系统的特异性识别与不同信号放大方式相结合的策略,突破了传统灵敏度瓶颈,推动了CRISPR/Cas系统在miRNA检测中的应用[64, 65]。
本文的其它图/表
|