|
||
 View image in article
图3
无核酸预扩增的免扩增CRSIPR技术策略
正文中引用本图/表的段落
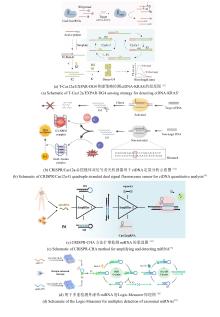
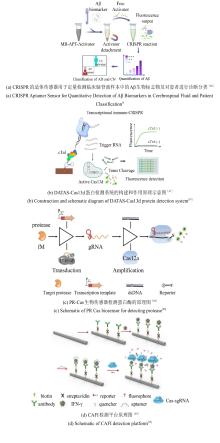
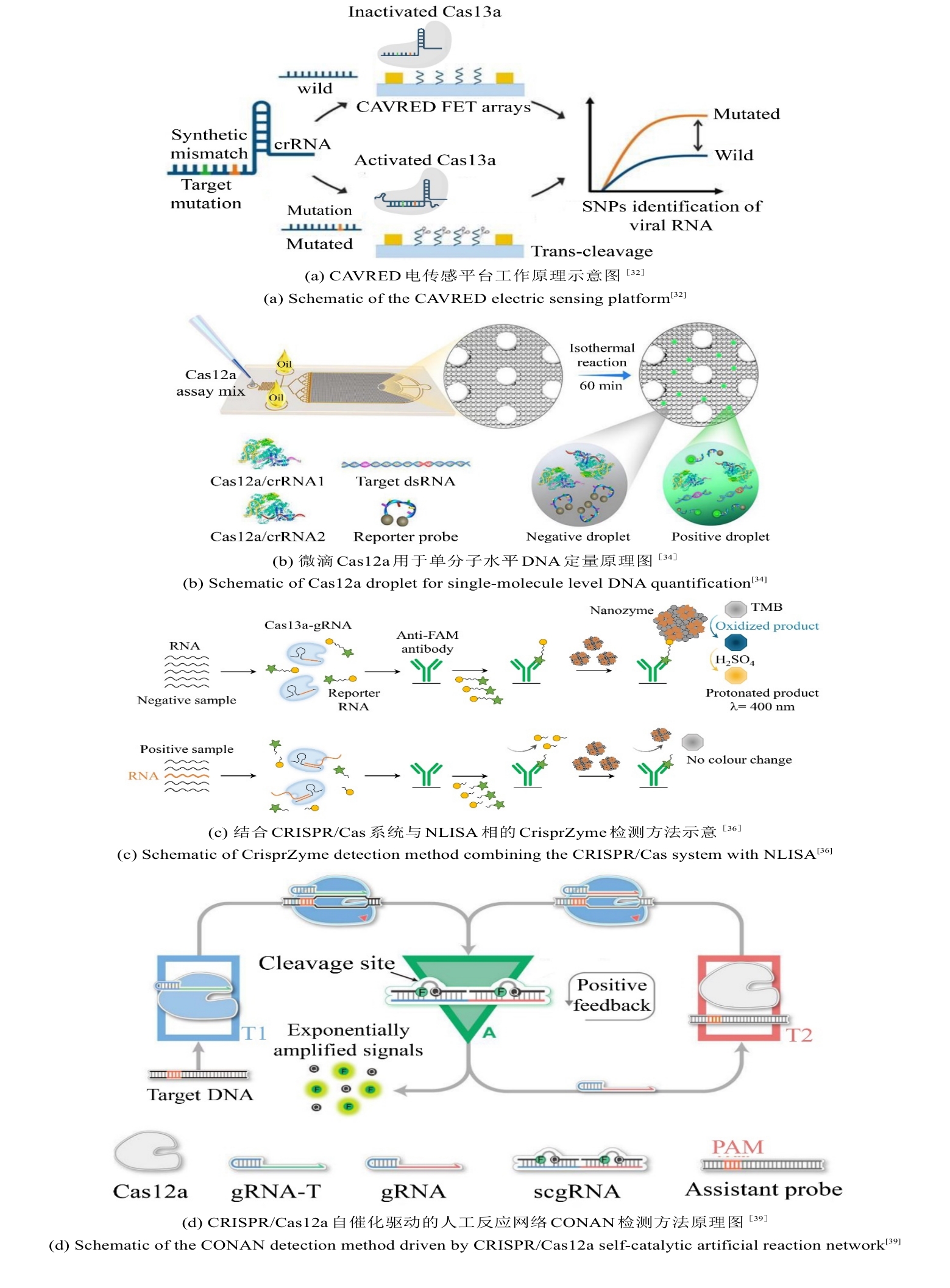
将Cas蛋白的反式切割活性与酶级联反应相结合,可显著增强信号放大,从而提升检测灵敏度,例如将Cas12a与核酸外切酶联用实现靶标触发的循环切割,检测限可达亚飞摩尔水平。优化crRNA设计(如引入化学修饰或锁定核酸LNA)及信号报告探针(如调整淬灭基团间距)能够提升信噪比[27-31]。通过引入场效应晶体管(FET)等新型信号转导模式,CRISPR识别事件可被实时转化为电信号变化。例如,石墨烯FET传感器通过利用Cas13a介导的RNA结合引发表面电荷重排[图3(a)],实现RNA的无标记检测,灵敏度可达0.1 pM[32]。此外,将CRISPR/Cas系统与液滴数字技术相结合,可构建用于直接分子检测的超灵敏生物传感平台。周小明教授团队构建了Cas13a的微体积液滴直接检测体系,结合pL级液滴微流控技术,实现了对病原微生物16S rRNA的高灵敏度检测[33]。在他们的后续研究工作中,通过Cas12a反式切割活性实现单分子计数,灵敏度达1 copy/μL,适用于循环肿瘤DNA绝对定量[图3(b)],实现了对任意核酸的免扩增检测[34]。Rikiya Watanabe研究团队开发了一种无扩增数字RNA检测系统SATORI(CRISPR-based amplification-free digital RNA detection),该方法融合了CRISPR/Cas13介导的RNA识别机制与微腔阵列技术,通过微孔芯片实现对SARS-CoV-2 RNA的单分子检测,灵敏度可达0.1 copies/μL[35]。此外,James J. Collins团队通过将CRISPR/Cas系统与纳米酶联免疫吸附测定(NLISA)相结合[36],在室温下通过催化金属纳米颗粒(CrisprZyme)实现对Cas13介导RNA的无扩增定量检测,并支持比色法及侧向流动平台判读[图3(c)]。该技术兼容多种Cas酶,可检测RNA,已成功应用于急性心肌梗死鉴别和前列腺癌诊断检测。其作为通用型信号催化剂,显著拓展了CRISPR诊断的靶标覆盖范围。当前,CRISPR切割过程易破坏核酸等温扩增模板,致使二者在单管、单步的检测中难以兼容。而分步检测方案不仅操作繁琐,还存在引发气溶胶假阳性风险。光控gRNA能够在核酸检测中实现不同反应系统的时间激活,从而有效解决上述难题[29, 31, 37, 38]。
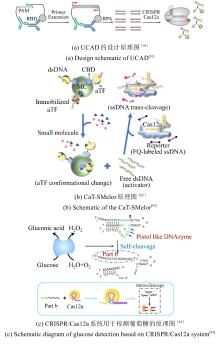
在信号放大机制创新方面,研究者提出自催化驱动的CRISPR检测系统以突破灵敏度极限。例如,CALSA(CRISPR/Cas自催化扩增)通过LNA修饰的分裂激活剂构建正反馈回路,利用Cas12a反式切割触发级联反应,检测限低至10 aM,适用于单链DNA及基因组DNA的超敏检测[40]。笔者团队通过CRISPR/Cas自催化驱动的正反馈信号放大系统CONAN(CRISPR/Cas-only amplification network)[图3(d)],其核心机制是当靶标dsDNA存在时,含有常规的Cas12a反应体系T1模块被激活,同时释放gRNA,游离的gRNA进一步与T2体系中的Cas12a结合,识别体系中存在辅助探针,触发新一轮Cas12a激活,荧光信号呈指数级增长[39]。然而,这种级联放大机制在提升检测灵敏度的同时,也可能因本底信号的非特异性激活引起假阳性扩增。Rashid Bashir团队突破单Cas12a系统局限,开发了一种内置正反馈回路的CRISPR-Cascade核酸检测方法[41]。该方法无需核酸预扩增,通过优化反应温度和封锁核酸修饰等参数,能够在10分钟内实现阿托摩尔级DNA的高灵敏检测。该方法能够精准识别耐甲氧西林金黄色葡萄球菌、对甲氧西林敏感的金黄色葡萄球菌、大肠杆菌及HBV等血流感染病原体,并构建多重OR逻辑门实现综合诊断。此外,研究者们利用表面等离子体共振或纳米孔传感的新型信号输出模式,进一步拓展了检测的应用场景,例如纳米孔传感器通过激活Cas13a的切割活性,引起电流变化,从而实现了目标RNA实时定量检测。研究者们还通过优化CRISPR/Cas反应的关键参数、采用数字化灵敏检测平台、偶联其它更灵敏的信号传感器、设计级联反应以放大输出信号等策略,有效提升了免扩增CRISPR/Cas技术的性能。这些免扩增策略通过整合微流控技术、材料科学与分子工程,为病原体即时诊断、肿瘤突变追踪及耐药基因监测提供精准、高效的技术支撑,推动分子诊断向更灵敏、更便携的方向发展。
本文的其它图/表
|