|
||
|
中药药效成分群的合成生物学研究进展
合成生物学
2024, 5 (3):
631-657.
DOI:10.12211/2096-8280.2023-082
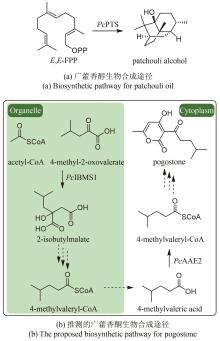
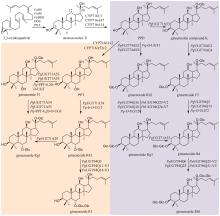
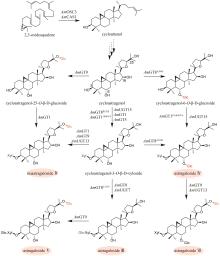
中药是中华民族的文化瑰宝,也是我国在新药创制领域的重要驱动力。许多中药材来源于稀缺物种,其药效物质的规模化获取困难,是制约中药新药创制研究的重要瓶颈。合成生物学的出现和快速发展为解决这一瓶颈问题提供了新的途径。目前,中药药效物质的合成生物学研究在单个药效分子的生物制备方法上取得了重要进展。中药的药效主要源于多成分作用的叠加和协同,所以药效成分群是中药药效物质的主要形式,然而针对药效成分群的合成生物学研究鲜有报道。建立中药药效成分群合成生物技术的关键是精确调控组成分子的比例,从而产出优质药效成分群。本文首先总结了挥发油、总皂苷、总黄酮、总木脂素、总生物碱等重要类型中药药效成分群形成机制的研究进展。然后,重点以檀香挥发油为例,介绍如何通过酶工程和代谢工程的联合运用实现药效成分群成分比例和产量的双重优化。最后,对中药药效成分群合成生物学领域的未来研究重点进行了展望,包括:(1)加强中药药效成分群生物合成途径解析方面的研究,重点深入阐明复杂药效成分群的形成机制;(2)加强代谢优化手段方面的创新研究,重点揭示未知代谢调控机制并基于此发展创新调控策略;(3)加强酶工程方法学的创新研究,重点发展新型理性设计和定向进化的联用技术以及人工智能辅助的酶工程技术。 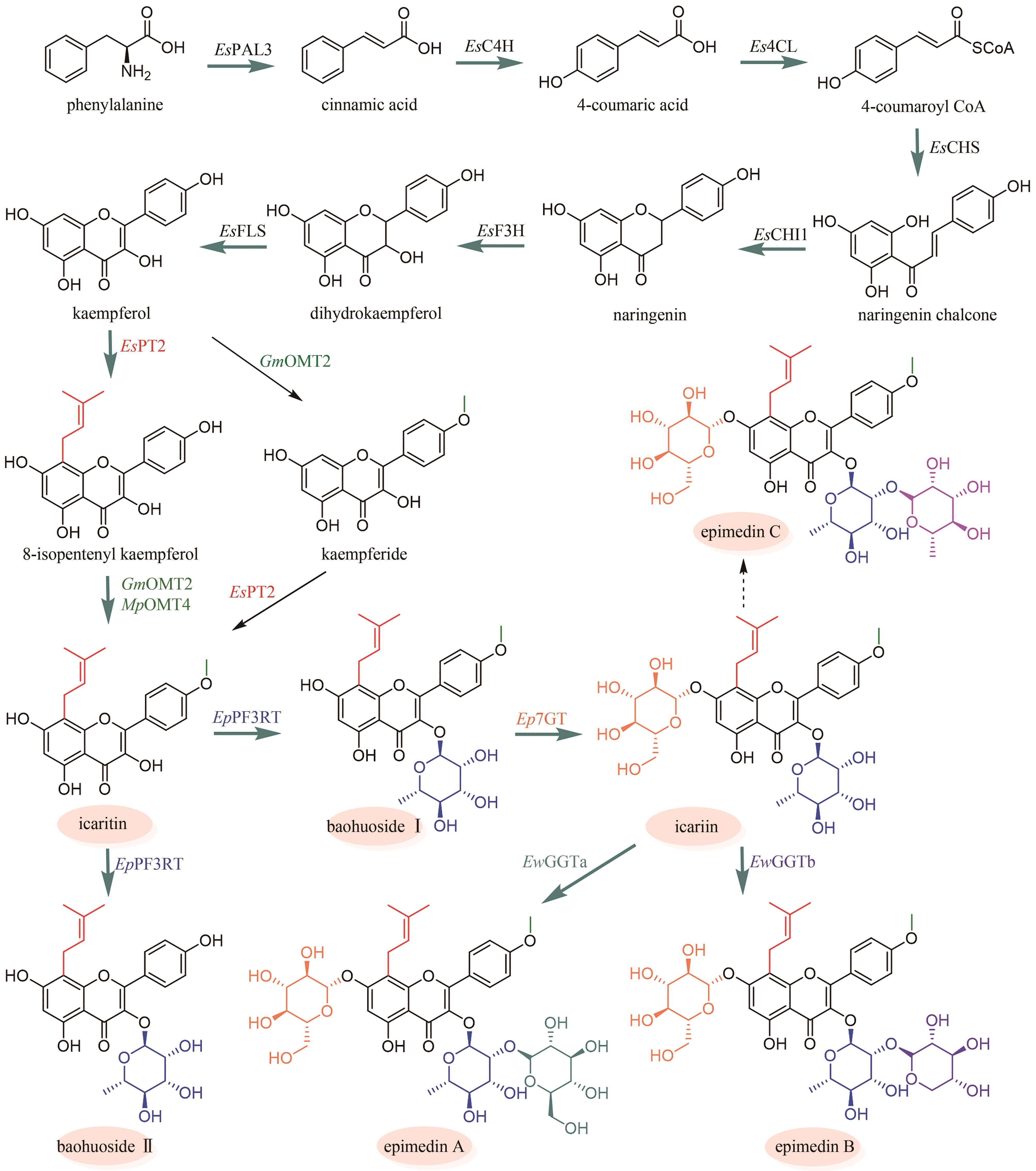 View image in article
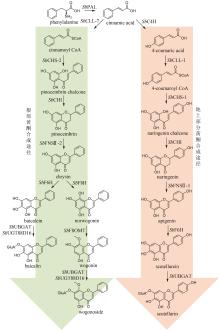
图7
淫羊藿黄酮类成分群的生物合成途径
正文中引用本图/表的段落
淫羊藿黄酮类药效成分群的生物合成途径基本被解析(图7)。其中,从苯丙氨酸到柚皮素的转化过程与典型的黄酮生物合成途径完全一致。例如:在箭叶淫羊藿中鉴定了苯丙氨酸解氨酶(EsPAL3)、肉桂酸-4-羟化酶(EsC4H)、4-香豆酰辅酶A连接酶(Es4CL)、查尔酮合酶(EsCHS)和查尔酮异构酶(EsCHI1)[94]。柚皮素经黄烷酮3-羟化酶(EsF3H)和黄酮醇合酶(EsFLS)顺序催化C3羟基化以及C2和C3脱氢,形成山柰酚(kaempferol)[95-96];异戊烯基转移酶EsPT2可高效催化山柰酚C8位的异戊烯基化,生成8-异戊烯基山柰酚(8-isopentenyl kaempferol),转化率达到65%[97](图7)。EsPT2也可催化山柰素的异戊烯基化,生成淫羊藿素(icaritin),然而转化率仅为8.0%(图7)。这个结果表明:从山柰酚到淫羊藿素的转化过程是先在C8位异戊烯基化,后发生C4′位羟基的甲基化[97]。目前,尚未鉴定出淫羊藿中催化8-异戊烯基山柰酚C4′位羟基甲基化的甲基转移酶。但是,发现大豆[Glycine max (L.) Merr.]中的GmOMT2[97]以及胡椒薄荷(Mentha×piperita Linnaeus)中的MpOMT4[96]具有上述催化活性。前者在pH为8.5时转化率最高(81.1%)[97];而后者在酸性条件下具有优良的催化活性,在酿酒酵母(pH 5.0~5.6)中对8-异戊烯基山柰酚的转化率达到76%[96]。最后,淫羊藿素在多种糖基转移酶作用下,发生糖苷化。拟巫山淫羊藿中的糖基转移酶EpPF3RT具有显著的区域特异性和糖基供体特异性,仅能特异性地在8-异戊烯基山柰酚和淫羊藿素的C3位羟基引入鼠李糖,分别生成宝藿苷(baohuoside)Ⅱ和宝藿苷Ⅰ(图7)[98]。Ep7GT在宝藿苷Ⅰ的C-7位羟基引入葡萄糖,生成淫羊藿苷(icariin)(图7)。Ep7GT具有糖基供体多样性:以宝藿苷Ⅰ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-木糖、UDP-N-乙酰氨基葡萄糖和TDP-葡萄糖;以宝藿苷Ⅱ为糖基受体时,Ep7GT可接受的糖基供体包括UDP-葡萄糖、UDP-木糖和UDP-N-乙酰氨基葡萄糖[99]。巫山淫羊藿中的两个糖基转移酶EwGGTa和EwGGTb可分别催化淫羊藿苷C3位鼠李糖基进一步发生葡萄糖基化和木糖基化,生成朝藿定(epimedin)A和朝藿定B(图7)[100]。目前,尚未表征在淫羊藿苷C3位鼠李糖基上进一步引入鼠李糖的糖基转移酶,该酶的发现是未来这类化合物途径解析研究的重点。
本文的其它图/表
|