|
||
|
高黏性蛋白材料的合成生物学及应用
合成生物学
2025, 6 (4):
806-828.
DOI:10.12211/2096-8280.2025-043
高黏性蛋白材料因其卓越的生物黏附性和潜在的生物相容性,在生物医用材料和黏合剂领域展现出巨大的应用潜力。然而,传统方式获取的高黏蛋白材料面临诸多挑战,如产量低、结构复杂、难以规模化生产等。合成生物学作为新兴的交叉学科,为解决这些瓶颈提供了创新策略。本综述系统总结了近年来高黏性蛋白材料的生物合成、改性及应用进展,重点突出了合成生物学在解决高黏性蛋白材料产量、可控性以及功能多样性等方面的优势。全面梳理了基因工程实现对贻贝黏蛋白、藤壶胶蛋白和扇贝足丝蛋白等黏附蛋白的精确设计和高效表达,从而克服高黏蛋白材料在产量和可控性方面的限制。同时,综述了这些蛋白材料在生物黏合剂和医用功能涂层方面的独特优势,如贻贝蛋白的湿面黏附性、藤壶胶蛋白的强黏附性以及类弹性蛋白的可调控性。通过合成生物学方法,可以突破高黏蛋白材料在产量、性能和功能方面的限制,加速其在组织工程、表界面改性等领域的应用。最后,总结了当前合成生物学在高黏蛋白材料领域的最新进展和创新点,并展望了其未来的发展方向,为开发高性能、多功能的高黏蛋白材料提供了新的思路和策略。 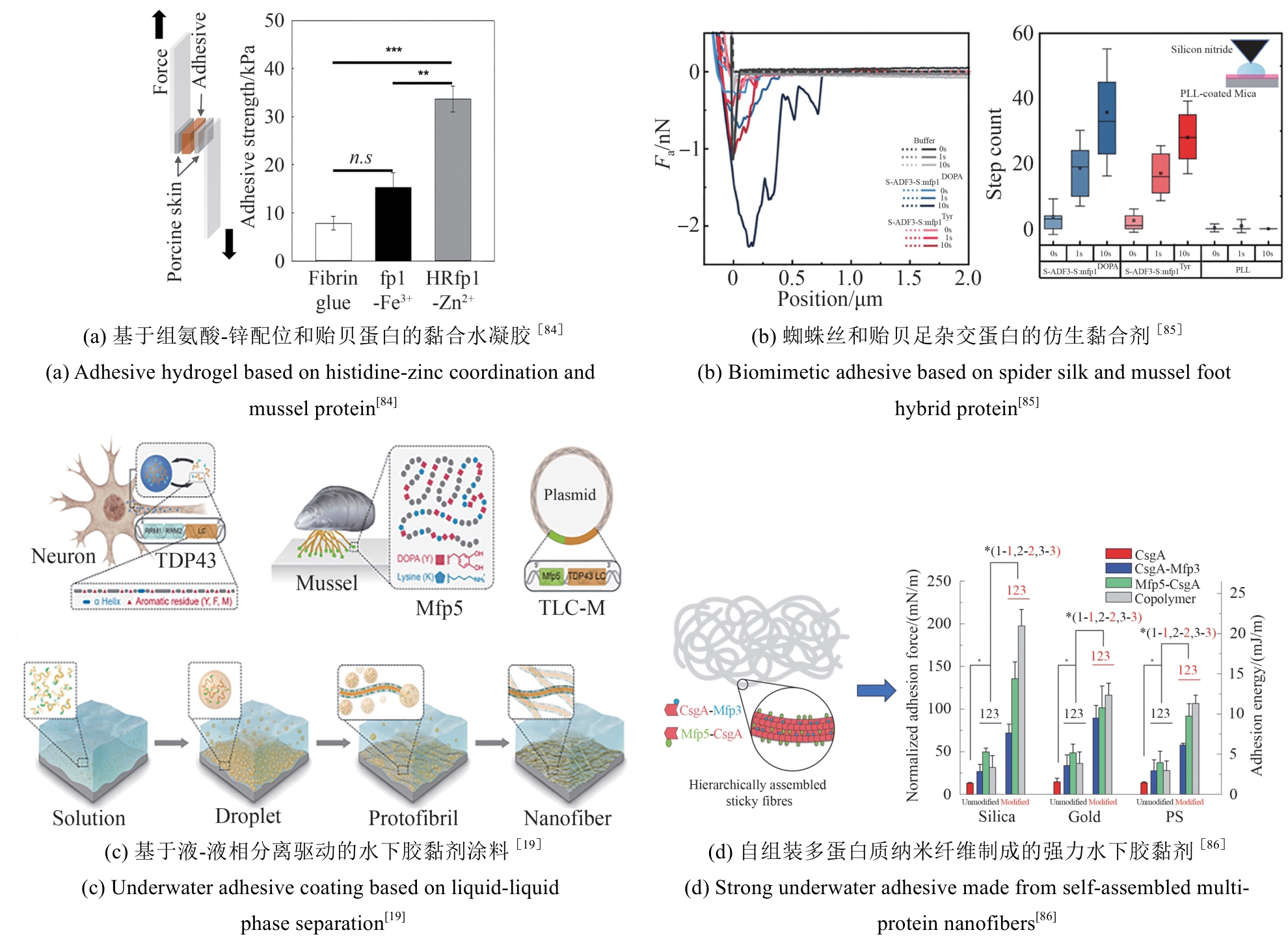 View image in article
图2
Mfp在水下黏合剂中的应用
正文中引用本图/表的段落
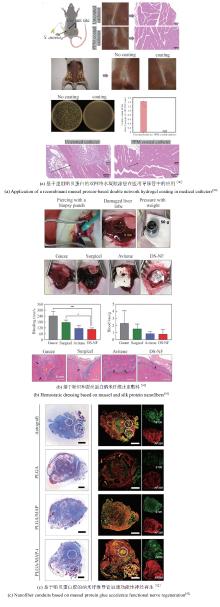
近年来,一些以DOPA为基础设计的多肽、水凝胶、聚合物等材料不断涌现,在界面黏附领域引起了广泛关注[83]。例如,Cha团队[84]通过基因融合富含组氨酸的连接蛋白Mfp-4结构域与富含DOPA的足斑蛋白Mfp-1,开发出一种新型混合黏附蛋白HRfp1。该蛋白利用组氨酸-Zn金属配位形成水凝胶,由于DOPA未参与交联而保留了黏附活性,从而克服了传统Mfp研究中黏附性与交联相互制约的难题,同时维持了优异的水下高黏附性能。这种组氨酸协同DOPA的多维设计策略为开发兼具自愈能力和强黏附性的仿生材料提供了新思路[图2(a)]。类似地,Yin等[85]利用合成生物技术将蛛丝蛋白(ADF3)与Mfp-1相结合,开发了一种高性能仿生黏合剂。他们利用SpyCatcher-SpyTag系统将两种蛋白共价偶联,并通过氧化贻贝足蛋白中的酪氨酸生成DOPA以增强黏附性[图2(b)]。
同时,一种利用理性设计结合模块基因策略的方法被用于水下黏合材料。通过这种方法构建的多结构域蛋白能够自组装形成性能媲美甚至超越天然材料的分子材料。钟超教授团队[19]将哺乳动物细胞DNA结合蛋白TDP43的低复杂结构域LC与Mfp-5融合,制备了重组蛋白TLC-M。TLC-M融合蛋白在低温下通过LC结构域的液-液相分离性质形成蛋白浓度很高的凝结体。该液态凝结体易逐层吸附在基底表面,最终能够进一步脱水组装成致密的淀粉样蛋白纤维涂层,表现出很强的水下黏附性能。这为构建基于液固相转变和自组装驱动的可控功能蛋白材料提供了新方向[图2(c)]。该团队还将Mfp与大肠杆菌淀粉样蛋白CsgA融合,构建了多功能水下黏合剂。该杂化材料能够自组装成Mfp黏附域暴露于CsgA淀粉样蛋白核心之外的高阶结构,水下黏附能可达20.9 mJ/m2,是目前生物衍生蛋白质黏合剂的1.5倍。其性能优于单独的Mfp或CsgA纤维,且在pH≥7.0时具有更强的抗氧化性[86][图2(d)]。
本文的其它图/表
|