|
||
|
高黏性蛋白材料的合成生物学及应用
合成生物学
2025, 6 (4):
806-828.
DOI:10.12211/2096-8280.2025-043
高黏性蛋白材料因其卓越的生物黏附性和潜在的生物相容性,在生物医用材料和黏合剂领域展现出巨大的应用潜力。然而,传统方式获取的高黏蛋白材料面临诸多挑战,如产量低、结构复杂、难以规模化生产等。合成生物学作为新兴的交叉学科,为解决这些瓶颈提供了创新策略。本综述系统总结了近年来高黏性蛋白材料的生物合成、改性及应用进展,重点突出了合成生物学在解决高黏性蛋白材料产量、可控性以及功能多样性等方面的优势。全面梳理了基因工程实现对贻贝黏蛋白、藤壶胶蛋白和扇贝足丝蛋白等黏附蛋白的精确设计和高效表达,从而克服高黏蛋白材料在产量和可控性方面的限制。同时,综述了这些蛋白材料在生物黏合剂和医用功能涂层方面的独特优势,如贻贝蛋白的湿面黏附性、藤壶胶蛋白的强黏附性以及类弹性蛋白的可调控性。通过合成生物学方法,可以突破高黏蛋白材料在产量、性能和功能方面的限制,加速其在组织工程、表界面改性等领域的应用。最后,总结了当前合成生物学在高黏蛋白材料领域的最新进展和创新点,并展望了其未来的发展方向,为开发高性能、多功能的高黏蛋白材料提供了新的思路和策略。 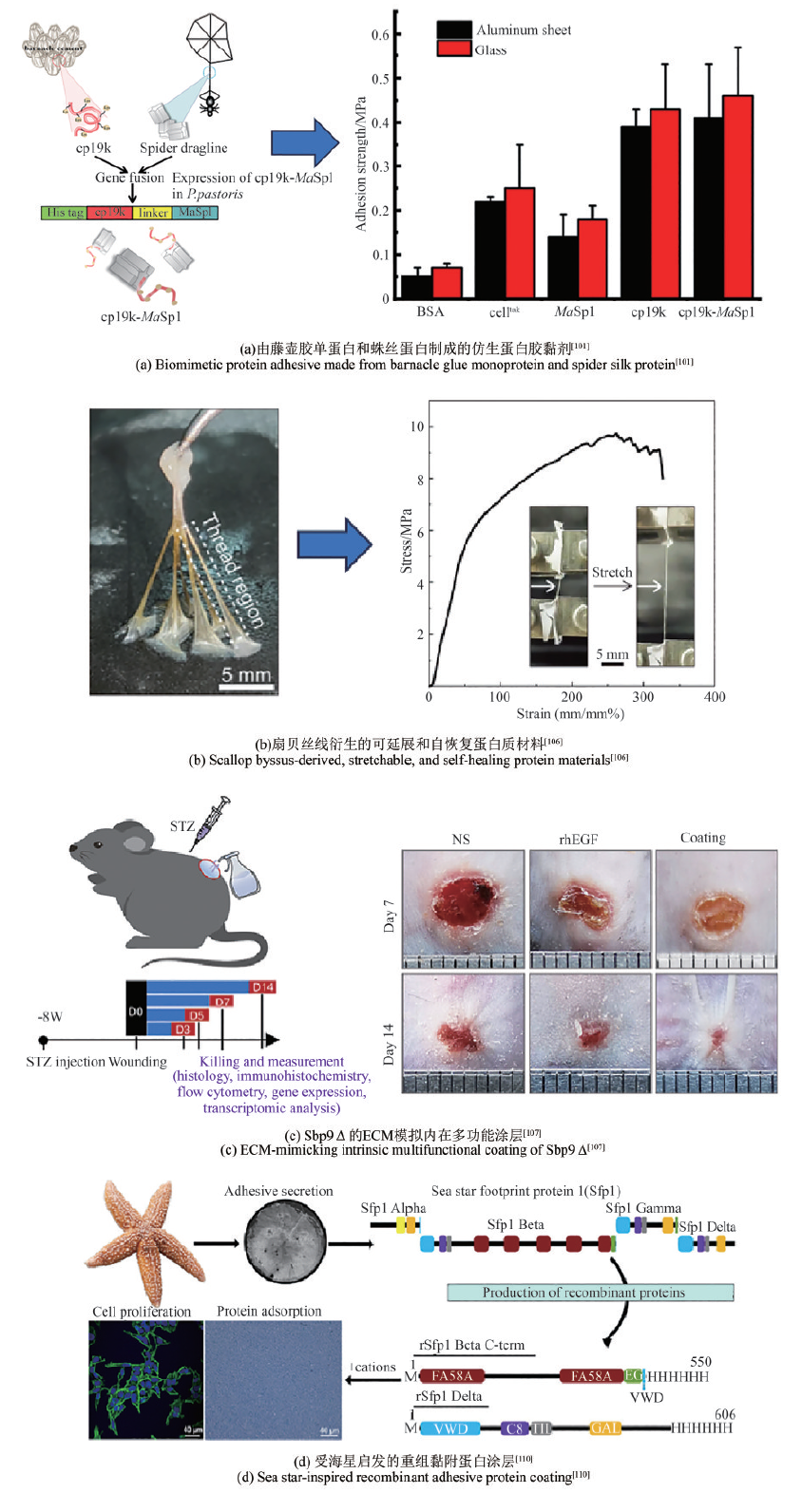 View image in article
图4
藤壶和扇贝等其他海洋黏附蛋白的应用
正文中引用本图/表的段落
对藤壶胶黏附机制和黏胶蛋白的研究成果,为水下黏附剂的研发提供了坚实的理论基础。Ye等[101]通过基因设计并过表达了一种由cp19k和蛛丝蛋白(MaSp1)组成的融合蛋白(cp19k-MaSp1),并且通过静电纺丝制备的cp19k-MaSp1蛋白纤维支架表现出非常高的极端拉伸强度[(112.7±11.6)MPa]和优异的延展性(438.4%± 43.9%)[图4(a)]。Yan团队[102]为了提高Mrcp19k的水下黏弹性能与非水性环境下的黏附性能,利用基因工程学的方法,将不同的蛋白功能模块与Mrcp19k融合,构建了多种融合型黏合蛋白。结果显示,功能模块SpyCatcher/SpyTag以及ELP与黏合蛋白Mrcp19k融合,均能进一步提高黏合蛋白Mrcp19k的水下黏弹性能与非水性环境下的黏附性能。
Sbp的水下黏附能力,使其成为理想的生物医用黏合剂候选材料。例如,钟超团队[106]的研究揭示了扇贝足丝蛋白Sbp5-2中TRM结构赋予材料高延展性和自恢复特性。他们利用基因工程构建了含7个TRM串联的重组蛋白rTRM7,并在大肠杆菌中高效表达后,通过拉丝工艺制备的仿生纤维再现了天然材料的力学性能。研究发现,氢键、金属配位和二硫键构成的分子交联网络是性能调控的关键。通过嵌入石墨烯,他们开发出e-rTRM7导电纤维,并成功应用于人体运动监测传感器。该工作为生物基高性能材料设计提供了新思路,其可扩展生产和环境适应性在智能穿戴、医疗监测领域展现出潜在的应用前景[图4(b)]。Wang等[107]则聚焦于扇贝足丝蛋白Sbp9Δ(含10~13个表皮生长因子样EGFL模块),发现其二价钙离子可在30 min内触发原位形成多孔网络涂层。该涂层具有优异的湿吸附性、生物相容性及抗氧化能力,并能促进细胞增殖和迁移。通过融合抗菌肽LL37,涂层展现出抗菌和免疫调节功能。动物实验证实,该涂层通过调控巨噬细胞M2极化、清除活性氧和抑制创面细菌,显著改善糖尿病伤口微环境,加速愈合。EGFL模块作为细胞外基质(ECM)的共性组分,其自组装特性为开发新型多功能生物材料提供了新思路,尤其在创面修复领域展现出重要的应用潜力[图4(c)]。
Sfp1是目前为止了解最为深入的一种海星黏附蛋白,其在海星分泌型黏附蛋白中含量最为丰富。Sfp1可以通过其亚基(如Beta和Delta)在水下基质上形成高效黏附,Hennebert团队[110]利用大肠杆菌重组产生Sfp1的Beta C端和Delta亚基,发现这些蛋白质在NaCl存在下能自组装成寡聚体和聚集体,并在Na+或Ca2+作用下吸附于玻璃和聚苯乙烯表面,形成不同结构的涂层。这些涂层对HeLa细胞无细胞毒性,甚至促进细胞增殖,显示出在细胞培养和生物医学应用中的潜力[图4(d)]。
本文的其它图/表
|