|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Studies on hydrogenases for hydrogen production using in vitro synthetic enzymatic biosystems
Synthetic Biology Journal
2024, 5 (6):
1461-1484.
DOI: 10.12211/2096-8280.2024-052
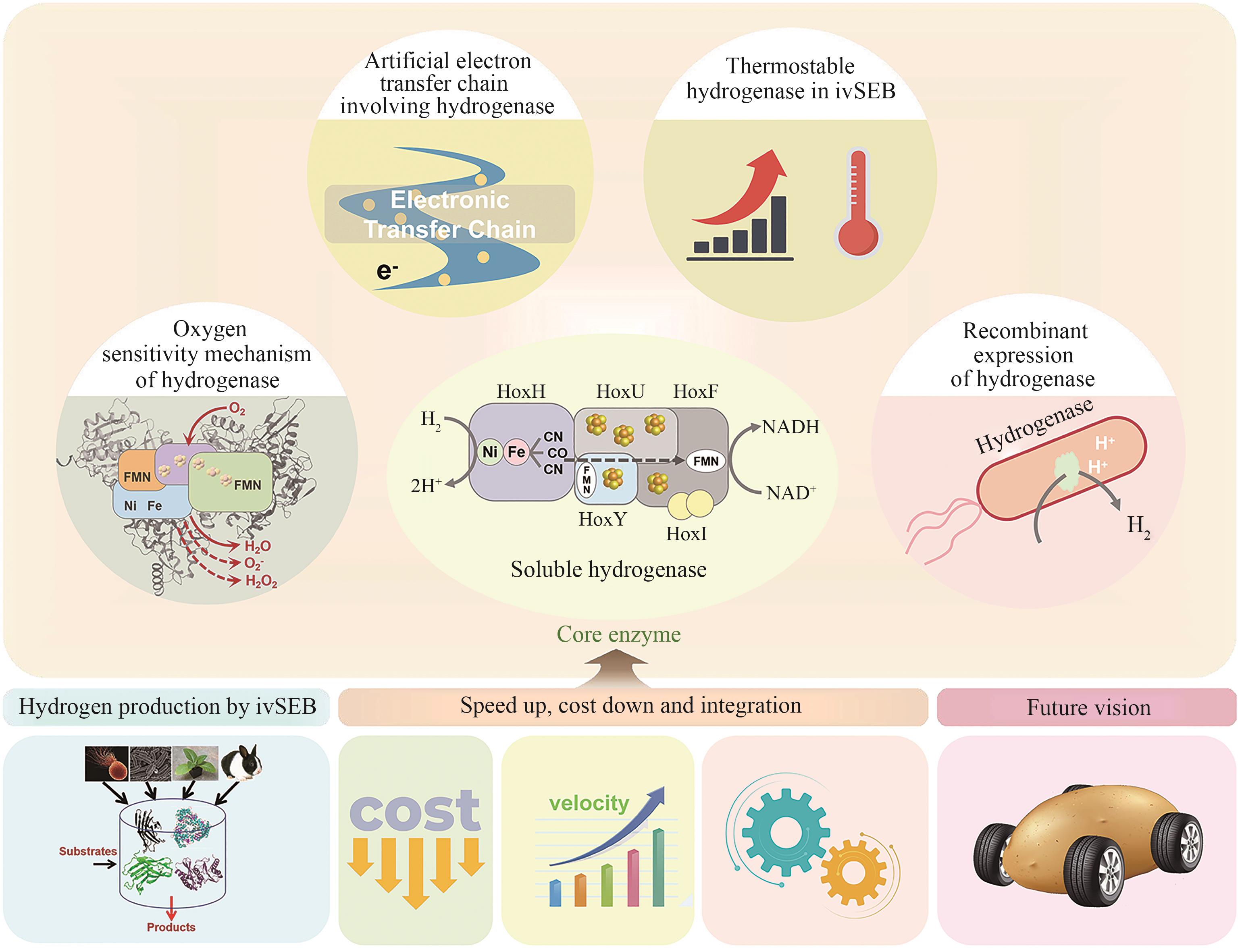
Hydrogenases are the most important enzymes in biological hydrogen production and hydrogen energy utilization. They are widely distributed, oxygen-sensitive, multiunit complexed metal enzymes. In vitro synthetic enzymatic biosystems (ivSEB) is a type of in vitro biotransformation (ivBT) technology, which is an emerging biomanufacturing powerhouse that combines microbial fermentation with enzymatic biocatalysis, allowing for novel and efficient hydrogen production, also breaking the Thauer limit and achieving a yield of hydrogen close to the theoretical value of chemistry (1 mole of glucose to produce 12 moles of hydrogen in maximum). It represents the future direction of biological hydrogen production. However, the recombinant expression of hydrogenase is the main bottleneck limiting the wide application of ivSEB for hydrogen production technology. Hydrogenases are widely distributed in all life domains, but are oxygen-sensitive and mostly consist of metalloproteins with multi-subunits, bearing [Fe] only, [NiFe] or [FeFe] dinuclear core in their catalytic center. Oxygen not only inhibits the activity of hydrogenase, but also affects the transcription of the enzyme-encoding gene and post-translational process of the enzymes. As a result, the levels of recombinant hydrogenase are usually low and the enzymatic activities are also incomparable to the native enzymes, often leading to high production costs due to the strict anaerobic purification procedures. In order to meet the requirements of industrial hydrogen production, hydrogenases must possess excellent catalytic properties, such as a high catalytic turnover number, great thermal stability, and the ability to tolerate trace amounts of oxygen. This review summarizes the studies on the structural and catalytic characterizations of hydrogenases, including their classification, oxygen resistance mechanisms, and progress in recombinant expression. Additionally, the evolution of natural electron transfer chains and the design of artificial routes, which can improve hydrogen production efficiency and reduce costs, are briefly discussed. The review also discussed the progress in the studies on the mechanisms of hydrogenases’ tolerance toward oxygen, the strategies for microbial expression of recombinant hydrogenases as well as the optimization of the artificial electron transfer chains adapted for the production of hydrogen using ivSEB, in expectations of promoting the applications of hydrogenases involved ivSEB, from renewable energy storage, anaerobic artificial respiration, to clean hydrogenation or dehydrogenation in biocatalysis.
Table 1
Recombinant [FeFe] hydrogenase activity
Extracts from the Article
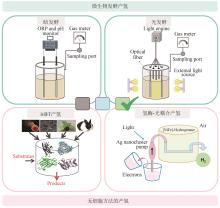
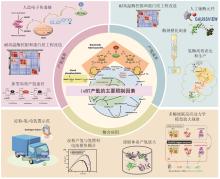
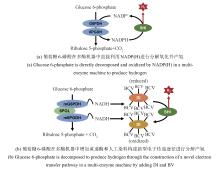
无细胞制氢主要包括多酶分子机器制氢及氢酶-光耦合产氢(图1),其中张以恒教授首先提出的多酶分子机器制氢是一种体外多酶生物转化技术(in vitro synthetic enzymatic biosystem, ivSEB),它不仅大大地突破了产氢微生物的Thauer极限,还将葡萄糖产氢的转化率提高至接近化学理论值[20-21]。多酶分子机器技术利用重组表达的酶元件,通过设计包括辅酶在内的由多酶复合体构成的催化回路,摆脱细胞能量代谢瓶颈,实现特定产物合成以及生物能量转换的人工多酶体系,迅速成为体外合成生物学的研究热点。例如,以淀粉为原料,利用该技术产氢,先将多糖降解为葡萄糖1-磷酸(G1P),通过13个酶的“一锅法”反应将其完全降解为CO2和水,并将保存于糖分子的化学能裂解水释放产物氢气[22]。因此,多酶分子机器产氢是目前唯一能够产生接近理论得率氢气的绿色温和途径,每摩尔葡萄糖可以产生近12 mol H2。2008年,英国皇家协会指出:该项研究作为一种廉价、绿色、高得率制氢的开始,是合成生物学的代表性工作,突破生物体能力极限[23]。此外,光合-氢酶耦合系统产氢也是一种高效的前沿技术,近十几年来国内外的多个研究团队对[FeFe]、[NiFe]或[NiFeSe]氢酶利用包括石墨烯在内的无机导电材料固定[24-26],将其替代昂贵的金属催化剂,可以实现太阳能的捕捉和稳定的水解产氢,这类杂合氢酶研究对于利用太阳能直接光解产氢具有重要意义[27-28]。
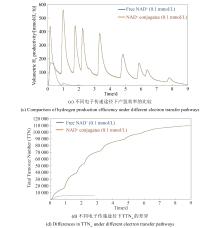
为了能够利用氢酶开展应用研究,或者对其催化机理进行深入解析,研究人员需要获取足量的氢酶,但却往往受限于氢酶的胞内浓度不高,或是其原宿主细胞发酵密度低。此外,天然氢酶缺乏利于纯化的亲和标签肽,导致纯化过程中酶活的损失较大,因此,急需对氢酶开展重组表达。几十年以来,研究人员一直在尝试各种表达策略,开展了[FeFe]和[NiFe]氢酶的同源或异源重组生产。但是由于对氢酶翻译后成熟机理的理解不多,2010年以前外源表达功能性的[FeFe]氢酶的尝试只取得了有限的成功,主要是由于异源宿主无法合成完整的H-簇,导致获得的要么是无催化活性的apo-酶[96-97],或者只能获得活性很低的重组酶[98-99]。但这些初期的尝试让研究人员发现了氢酶表达需要完备的成熟蛋白体系,同时也认识到其对氧的高敏感性带来的纯化挑战,这些前期经验对后期氢酶的重组表达工作积累了宝贵的经验。因此,近十几年来,世界各地研究人员先后通过使用同源和异源宿主成功表达了多种[FeFe]氢酶(表1)或[NiFe]氢酶(表2)。其中,利用成熟的大肠杆菌进行[NiFe]氢酶过表达的突破由美国佐治亚大学的研究组实现,他们在大肠杆菌中过表达高温古菌Pf SHⅠ的四个结构基因和九个成熟基因(hypA、B、F、C、D、E,hycI,slyD,frxA)[43],实现了有活性高温氢酶的重组生产,并且通过组氨酸标签的使用,大大降低了氢酶的纯化成本和难度。研究还表明,即使在异源重组表达时,也不是所有的氢酶加工蛋白都需要共表达。研究发现,只需过表达结构基因和氢酶大亚基的成熟蛋白酶(FrxA),大肠杆菌就可产生有活性的Pf SHⅠ。重组氢酶的比酶活相比天然氢酶相距较远,这表明在厌氧发酵时,大肠杆菌膜结合氢酶相关成熟蛋白也可参与外源高温氢酶的翻译后加工,尽管其效率不及天然高温成熟蛋白。由此,利用天然宿主(同源重组表达)或其亲缘较近物种进行重组氢酶基因表达,更容易实现功能性氢酶的过表达生产。例如,Desulfovibrio gigas的[NiFe]氢酶可成功地在Desulfovibrio fructosovorans MR400中重组表达,这两种微生物的氢酶亚基显示出64%的同源性和80%的相似性。Song等[45]使用与火球菌P. furiosus亲缘关系相近的Theromococcus kodakarensis KOD1作为底盘细胞,通过穿梭质粒高效表达并纯化了P. furiosus来源的可溶性氢酶SHⅠ。另一来自嗜氢高温菌Hydrogenophilus thermoluteolus TH-1的[NiFe]氢酶也成功地在常温嗜氢菌Ralstonia euatropha H16中成功表达,并进行了活性氢酶的性能表征[135]。但是利用高温古菌进行同源重组表达也面临微生物发酵密度低、酶表达量不足的困境,因此,开展研究实现高温古菌的高密度发酵,或者着力提升氢酶异源表达的加工效率仍然十分必要[136]。
①通过连二亚硫酸钠还原的MV每毫克蛋白质每分钟产生的氢气(μmol). ... Molecular characterization and transcriptional analysis of the putative hydrogenase gene of Clostridium acetobutylicum ATCC 824 1 1996 ... 为了能够利用氢酶开展应用研究,或者对其催化机理进行深入解析,研究人员需要获取足量的氢酶,但却往往受限于氢酶的胞内浓度不高,或是其原宿主细胞发酵密度低.此外,天然氢酶缺乏利于纯化的亲和标签肽,导致纯化过程中酶活的损失较大,因此,急需对氢酶开展重组表达.几十年以来,研究人员一直在尝试各种表达策略,开展了[FeFe]和[NiFe]氢酶的同源或异源重组生产.但是由于对氢酶翻译后成熟机理的理解不多,2010年以前外源表达功能性的[FeFe]氢酶的尝试只取得了有限的成功,主要是由于异源宿主无法合成完整的H-簇,导致获得的要么是无催化活性的apo-酶[ Complete activity profile of Clostridium acetobutylicum [FeFe]-hydrogenase and kinetic parameters for endogenous redox partners 2 2007 ... References
①通过连二亚硫酸钠还原的MV每毫克蛋白质每分钟产生的氢气(μmol). ... Enzymatic and spectroscopic properties of a thermostable [NiFe]- hydrogenase performing H2-driven NAD+-reduction in the presence of O2 1 2018 ... 为了能够利用氢酶开展应用研究,或者对其催化机理进行深入解析,研究人员需要获取足量的氢酶,但却往往受限于氢酶的胞内浓度不高,或是其原宿主细胞发酵密度低.此外,天然氢酶缺乏利于纯化的亲和标签肽,导致纯化过程中酶活的损失较大,因此,急需对氢酶开展重组表达.几十年以来,研究人员一直在尝试各种表达策略,开展了[FeFe]和[NiFe]氢酶的同源或异源重组生产.但是由于对氢酶翻译后成熟机理的理解不多,2010年以前外源表达功能性的[FeFe]氢酶的尝试只取得了有限的成功,主要是由于异源宿主无法合成完整的H-簇,导致获得的要么是无催化活性的apo-酶[ Strategies for reliable and improved large-scale production of Pyrococcus furiosus with integrated purification of hydrogenaseⅠ 1 2014 ... 为了能够利用氢酶开展应用研究,或者对其催化机理进行深入解析,研究人员需要获取足量的氢酶,但却往往受限于氢酶的胞内浓度不高,或是其原宿主细胞发酵密度低.此外,天然氢酶缺乏利于纯化的亲和标签肽,导致纯化过程中酶活的损失较大,因此,急需对氢酶开展重组表达.几十年以来,研究人员一直在尝试各种表达策略,开展了[FeFe]和[NiFe]氢酶的同源或异源重组生产.但是由于对氢酶翻译后成熟机理的理解不多,2010年以前外源表达功能性的[FeFe]氢酶的尝试只取得了有限的成功,主要是由于异源宿主无法合成完整的H-簇,导致获得的要么是无催化活性的apo-酶[ [NiFe]-hydrogenase maturation in vitro: analysis of the roles of the HybG and HypD accessory proteins 1 1 2014 ... 近年来,无细胞蛋白表达技术的进步也让研究人员开始寻求使用体外加工途径开展氢酶的翻译后成熟,Pagnier等[ [FeFe]- hydrogenase in vitro maturation 1 2022 ... 近年来,无细胞蛋白表达技术的进步也让研究人员开始寻求使用体外加工途径开展氢酶的翻译后成熟,Pagnier等[ Synthetic cascades are enabled by combining biocatalysts with artificial metalloenzymes 1 2013 ... 近年来,无细胞蛋白表达技术的进步也让研究人员开始寻求使用体外加工途径开展氢酶的翻译后成熟,Pagnier等[ Artificial metalloenzymes based on protein assembly 1 2022 ... 近年来,无细胞蛋白表达技术的进步也让研究人员开始寻求使用体外加工途径开展氢酶的翻译后成熟,Pagnier等[ Artificial hydrogenase: biomimetic approaches controlling active molecular catalysts 1 2015 ... 除了开发蛋白类新型酶种,非多肽仿真人工催化剂的研究也备受重视.例如,仿真人工氢酶可以弥补天然氢酶在应用中的诸多挑战,如获取成本高、对氧超级敏感等.因此,研究人员正着力于通过对氢酶活性中心的结构及化学配位原则进行探究,利用金属有机物设计并模拟出天然氢酶的活性位点,获得可以实现氢气的氧化及质子还原功能的仿真催化剂[ Crystal structure of the nickel-iron hydrogenase from Desulfovibrio gigas 1 1995 ... 除了开发蛋白类新型酶种,非多肽仿真人工催化剂的研究也备受重视.例如,仿真人工氢酶可以弥补天然氢酶在应用中的诸多挑战,如获取成本高、对氧超级敏感等.因此,研究人员正着力于通过对氢酶活性中心的结构及化学配位原则进行探究,利用金属有机物设计并模拟出天然氢酶的活性位点,获得可以实现氢气的氧化及质子还原功能的仿真催化剂[ Novel [FeFe]-hydrogenase mimics: unexpected course of the reaction of ferrocenyl α-thienyl thioketone with Fe3(CO)12 1 2022 ... 除了开发蛋白类新型酶种,非多肽仿真人工催化剂的研究也备受重视.例如,仿真人工氢酶可以弥补天然氢酶在应用中的诸多挑战,如获取成本高、对氧超级敏感等.因此,研究人员正着力于通过对氢酶活性中心的结构及化学配位原则进行探究,利用金属有机物设计并模拟出天然氢酶的活性位点,获得可以实现氢气的氧化及质子还原功能的仿真催化剂[ Current state of [FeFe]-hydrogenase research: biodiversity and spectroscopic investigations 1 2020 ... 除了开发蛋白类新型酶种,非多肽仿真人工催化剂的研究也备受重视.例如,仿真人工氢酶可以弥补天然氢酶在应用中的诸多挑战,如获取成本高、对氧超级敏感等.因此,研究人员正着力于通过对氢酶活性中心的结构及化学配位原则进行探究,利用金属有机物设计并模拟出天然氢酶的活性位点,获得可以实现氢气的氧化及质子还原功能的仿真催化剂[ 体外生物转化(ivBT):生物制造的新前沿 2 2024 ... 体外多酶分子机器是一种由多个酶分子构建的无细胞(或胞外)催化系统[
Other Images/Table from this Article
|