|
||
|
Studies on hydrogenases for hydrogen production using in vitro synthetic enzymatic biosystems
Synthetic Biology Journal
2024, 5 (6):
1461-1484.
DOI: 10.12211/2096-8280.2024-052
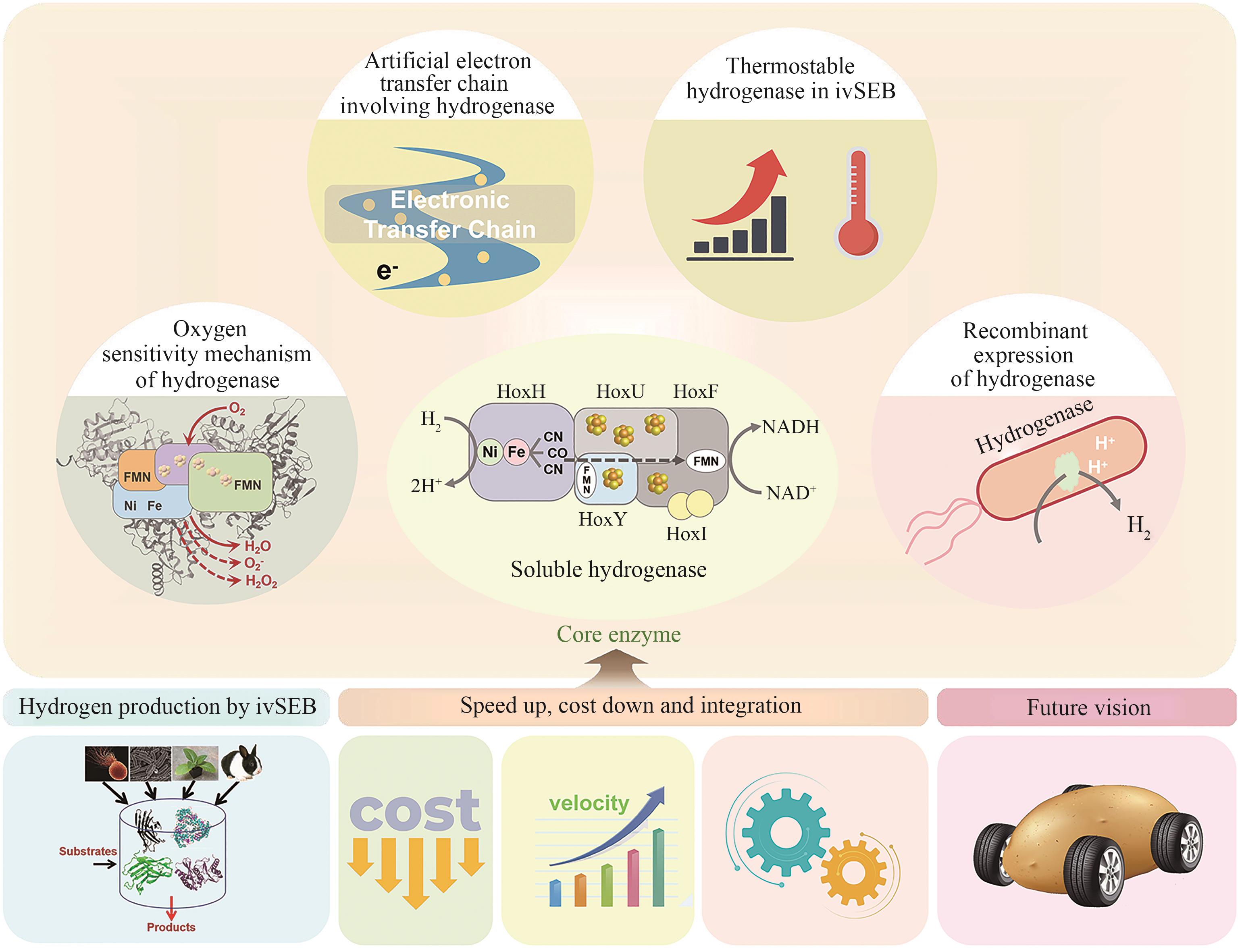
Hydrogenases are the most important enzymes in biological hydrogen production and hydrogen energy utilization. They are widely distributed, oxygen-sensitive, multiunit complexed metal enzymes. In vitro synthetic enzymatic biosystems (ivSEB) is a type of in vitro biotransformation (ivBT) technology, which is an emerging biomanufacturing powerhouse that combines microbial fermentation with enzymatic biocatalysis, allowing for novel and efficient hydrogen production, also breaking the Thauer limit and achieving a yield of hydrogen close to the theoretical value of chemistry (1 mole of glucose to produce 12 moles of hydrogen in maximum). It represents the future direction of biological hydrogen production. However, the recombinant expression of hydrogenase is the main bottleneck limiting the wide application of ivSEB for hydrogen production technology. Hydrogenases are widely distributed in all life domains, but are oxygen-sensitive and mostly consist of metalloproteins with multi-subunits, bearing [Fe] only, [NiFe] or [FeFe] dinuclear core in their catalytic center. Oxygen not only inhibits the activity of hydrogenase, but also affects the transcription of the enzyme-encoding gene and post-translational process of the enzymes. As a result, the levels of recombinant hydrogenase are usually low and the enzymatic activities are also incomparable to the native enzymes, often leading to high production costs due to the strict anaerobic purification procedures. In order to meet the requirements of industrial hydrogen production, hydrogenases must possess excellent catalytic properties, such as a high catalytic turnover number, great thermal stability, and the ability to tolerate trace amounts of oxygen. This review summarizes the studies on the structural and catalytic characterizations of hydrogenases, including their classification, oxygen resistance mechanisms, and progress in recombinant expression. Additionally, the evolution of natural electron transfer chains and the design of artificial routes, which can improve hydrogen production efficiency and reduce costs, are briefly discussed. The review also discussed the progress in the studies on the mechanisms of hydrogenases’ tolerance toward oxygen, the strategies for microbial expression of recombinant hydrogenases as well as the optimization of the artificial electron transfer chains adapted for the production of hydrogen using ivSEB, in expectations of promoting the applications of hydrogenases involved ivSEB, from renewable energy storage, anaerobic artificial respiration, to clean hydrogenation or dehydrogenation in biocatalysis. 
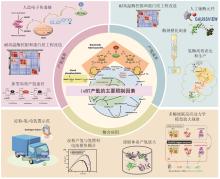
(b) 葡萄糖6-磷酸在多酶机器中增加黄递酶和人工染料构建新型电子传递途径进行分解产氢
Extracts from the Article
氢酶因其高效的产氢或氢电转换性能,在生物产氢及燃料电池开发中起着重要作用,然而对氧的高度敏感性限制了其应用范围。过去三十年间,为了揭示对氧敏感的分子机制,研究人员开展了大量的实验和理论探索[62]。通过对来自不同生物体的氢酶进行的遗传生物学、结构生物学、电化学和光谱学等领域的系统研究,揭示了一部分氢酶活性位点的作用、分子伴侣的参与、亲水性空腔的水运动、气体扩散的影响、质子转移途径及对多聚体结构的依赖等多因素影响机制[63-65],并对其催化位点开展了分子动力学模拟、密度泛函理论计算、体积溶剂可及性图等计算分析,这些研究为增加氢酶的氧耐受性的突变设计提供了重要线索[66]。探究氧气是否使氢酶失活而广泛使用的实验技术是蛋白质膜伏安法(PFV),该技术能够精确测量被吸附蛋白质的酶活性。早期研究用PFV研究了在不同条件下(氧气浓度、氢气浓度和或氧化还原电位不同)的氢酶失活动力学,发现[NiFe]和[FeFe]氢酶经历不同的中间状态,以显著不同的速率失活[67-68]。[NiFe]氢酶在饱和空气缓冲液中的半衰期约为几十分钟,一些[NiFe]氢酶能够从氧气失活状态中重新激活,而[FeFe]氢酶的半衰期大约为几十秒,只能在有限程度上从氧气结合状态重新激活[66, 69-70]。氢酶的酶活恢复速率取决于氢气浓度、氧气暴露时间和氧化还原电位等失活条件[66, 68]。
①通过连二亚硫酸钠还原的MV每毫克蛋白质每分钟产生的氢气(μmol). ... [FeFe] hydrogenases and their evolution: a genomic perspective 1 2007 ... [FeFe]和[NiFe]氢酶均可以催化产氢反应,其中[FeFe]氢酶广泛存在于厌氧细菌或含有光合细胞器的真核生物中,且原先认为在古细菌中不存在[FeFe]氢酶[ Minimal and hybrid hydrogenases are active from Archaea 1 2024 ... [FeFe]和[NiFe]氢酶均可以催化产氢反应,其中[FeFe]氢酶广泛存在于厌氧细菌或含有光合细胞器的真核生物中,且原先认为在古细菌中不存在[FeFe]氢酶[ Exceptionally high rates of biological hydrogen production by biomimetic in vitro synthetic enzymatic pathways 1 2016 ... 虽然[FeFe]和[NiFe]氢酶在一级和二级结构上的同源性很低,但是这两类氢酶在催化位点的结构上异曲同工,具有在其催化位点上类似的特征性非蛋白配体,有着共同的电子转移特征,均可以催化氢气和质子、电子之间的相互转化,但是它们参与氢气裂解或合成的方式并不相同,体现了进化中实现的两种独立的解决方案.因此,[FeFe]和[NiFe]氢酶被认为是收敛进化最深刻的案例(收敛进化是指不同物种或群体在相似的环境条件下,独立演化出相似的形态、生理特征或行为的现象).[FeFe]氢酶主要分布在厌氧发酵微生物中,主要功能是通过产生氢气回收电子,利用氧化电子辅酶的反应使其循环利用,因此是细胞能量代谢的重要组成.而[NiFe]氢酶的功能十分多样,既可产氢也可用氢,或参与还原力的再生等[ Characterization of [FeFe] hydrogenase O2 sensitivity using a new, physiological approach 1 2016 ... 虽然[FeFe]和[NiFe]氢酶在一级和二级结构上的同源性很低,但是这两类氢酶在催化位点的结构上异曲同工,具有在其催化位点上类似的特征性非蛋白配体,有着共同的电子转移特征,均可以催化氢气和质子、电子之间的相互转化,但是它们参与氢气裂解或合成的方式并不相同,体现了进化中实现的两种独立的解决方案.因此,[FeFe]和[NiFe]氢酶被认为是收敛进化最深刻的案例(收敛进化是指不同物种或群体在相似的环境条件下,独立演化出相似的形态、生理特征或行为的现象).[FeFe]氢酶主要分布在厌氧发酵微生物中,主要功能是通过产生氢气回收电子,利用氧化电子辅酶的反应使其循环利用,因此是细胞能量代谢的重要组成.而[NiFe]氢酶的功能十分多样,既可产氢也可用氢,或参与还原力的再生等[ A third type of hydrogenase catalyzing H2 activation 1 2007 ... 虽然[FeFe]和[NiFe]氢酶在一级和二级结构上的同源性很低,但是这两类氢酶在催化位点的结构上异曲同工,具有在其催化位点上类似的特征性非蛋白配体,有着共同的电子转移特征,均可以催化氢气和质子、电子之间的相互转化,但是它们参与氢气裂解或合成的方式并不相同,体现了进化中实现的两种独立的解决方案.因此,[FeFe]和[NiFe]氢酶被认为是收敛进化最深刻的案例(收敛进化是指不同物种或群体在相似的环境条件下,独立演化出相似的形态、生理特征或行为的现象).[FeFe]氢酶主要分布在厌氧发酵微生物中,主要功能是通过产生氢气回收电子,利用氧化电子辅酶的反应使其循环利用,因此是细胞能量代谢的重要组成.而[NiFe]氢酶的功能十分多样,既可产氢也可用氢,或参与还原力的再生等[ Enzymatic and bioinspired systems for hydrogen production 1 2023 ... 虽然[FeFe]和[NiFe]氢酶在一级和二级结构上的同源性很低,但是这两类氢酶在催化位点的结构上异曲同工,具有在其催化位点上类似的特征性非蛋白配体,有着共同的电子转移特征,均可以催化氢气和质子、电子之间的相互转化,但是它们参与氢气裂解或合成的方式并不相同,体现了进化中实现的两种独立的解决方案.因此,[FeFe]和[NiFe]氢酶被认为是收敛进化最深刻的案例(收敛进化是指不同物种或群体在相似的环境条件下,独立演化出相似的形态、生理特征或行为的现象).[FeFe]氢酶主要分布在厌氧发酵微生物中,主要功能是通过产生氢气回收电子,利用氧化电子辅酶的反应使其循环利用,因此是细胞能量代谢的重要组成.而[NiFe]氢酶的功能十分多样,既可产氢也可用氢,或参与还原力的再生等[ A surface-display biohybrid approach to light-driven hydrogen production in air 1 2018 ... 虽然[FeFe]和[NiFe]氢酶在一级和二级结构上的同源性很低,但是这两类氢酶在催化位点的结构上异曲同工,具有在其催化位点上类似的特征性非蛋白配体,有着共同的电子转移特征,均可以催化氢气和质子、电子之间的相互转化,但是它们参与氢气裂解或合成的方式并不相同,体现了进化中实现的两种独立的解决方案.因此,[FeFe]和[NiFe]氢酶被认为是收敛进化最深刻的案例(收敛进化是指不同物种或群体在相似的环境条件下,独立演化出相似的形态、生理特征或行为的现象).[FeFe]氢酶主要分布在厌氧发酵微生物中,主要功能是通过产生氢气回收电子,利用氧化电子辅酶的反应使其循环利用,因此是细胞能量代谢的重要组成.而[NiFe]氢酶的功能十分多样,既可产氢也可用氢,或参与还原力的再生等[ Redox-polymer-based high-current-density gas-diffusion H2-oxidation bioanode using [FeFe] hydrogenase from Desulfovibrio desulfuricans in a membrane-free biofuel cell 1 2020 ... 虽然[FeFe]和[NiFe]氢酶在一级和二级结构上的同源性很低,但是这两类氢酶在催化位点的结构上异曲同工,具有在其催化位点上类似的特征性非蛋白配体,有着共同的电子转移特征,均可以催化氢气和质子、电子之间的相互转化,但是它们参与氢气裂解或合成的方式并不相同,体现了进化中实现的两种独立的解决方案.因此,[FeFe]和[NiFe]氢酶被认为是收敛进化最深刻的案例(收敛进化是指不同物种或群体在相似的环境条件下,独立演化出相似的形态、生理特征或行为的现象).[FeFe]氢酶主要分布在厌氧发酵微生物中,主要功能是通过产生氢气回收电子,利用氧化电子辅酶的反应使其循环利用,因此是细胞能量代谢的重要组成.而[NiFe]氢酶的功能十分多样,既可产氢也可用氢,或参与还原力的再生等[ Hydrogenase-based oxidative biocatalysis without oxygen 1 2023 ... 虽然[FeFe]和[NiFe]氢酶在一级和二级结构上的同源性很低,但是这两类氢酶在催化位点的结构上异曲同工,具有在其催化位点上类似的特征性非蛋白配体,有着共同的电子转移特征,均可以催化氢气和质子、电子之间的相互转化,但是它们参与氢气裂解或合成的方式并不相同,体现了进化中实现的两种独立的解决方案.因此,[FeFe]和[NiFe]氢酶被认为是收敛进化最深刻的案例(收敛进化是指不同物种或群体在相似的环境条件下,独立演化出相似的形态、生理特征或行为的现象).[FeFe]氢酶主要分布在厌氧发酵微生物中,主要功能是通过产生氢气回收电子,利用氧化电子辅酶的反应使其循环利用,因此是细胞能量代谢的重要组成.而[NiFe]氢酶的功能十分多样,既可产氢也可用氢,或参与还原力的再生等[ Redox active motifs in selenoproteins 1 2014 ... 另有一些[NiFe]氢酶的活性位点中含有硒代半胱氨酸(Sec),它取代了原有的半胱氨酸(Cys),这类氢酶有时也称为[NiFeSe]氢酶.Sec是Cys的同源氨基酸,几乎只存在于氧化还原酶的结构域中[ The selenocysteine toolbox: a guide to studying the 21st amino acid 1 2022 ... 另有一些[NiFe]氢酶的活性位点中含有硒代半胱氨酸(Sec),它取代了原有的半胱氨酸(Cys),这类氢酶有时也称为[NiFeSe]氢酶.Sec是Cys的同源氨基酸,几乎只存在于氧化还原酶的结构域中[ Selenocysteine in thiol/disulfide-like exchange reactions 1 2013 ... 另有一些[NiFe]氢酶的活性位点中含有硒代半胱氨酸(Sec),它取代了原有的半胱氨酸(Cys),这类氢酶有时也称为[NiFeSe]氢酶.Sec是Cys的同源氨基酸,几乎只存在于氧化还原酶的结构域中[ The direct role of selenocysteine in [NiFeSe] hydrogenase maturation and catalysis 0 2017 Importance of the active site “canopy” residues in an O2-tolerant [NiFe]-hydrogenase 1 2017 ... 另有一些[NiFe]氢酶的活性位点中含有硒代半胱氨酸(Sec),它取代了原有的半胱氨酸(Cys),这类氢酶有时也称为[NiFeSe]氢酶.Sec是Cys的同源氨基酸,几乎只存在于氧化还原酶的结构域中[ Assessing historical and projected carbon balance of Alaska: a synthesis of results and policy/management implications 1 2018 ... 另有一些[NiFe]氢酶的活性位点中含有硒代半胱氨酸(Sec),它取代了原有的半胱氨酸(Cys),这类氢酶有时也称为[NiFeSe]氢酶.Sec是Cys的同源氨基酸,几乎只存在于氧化还原酶的结构域中[ Harnessing selenocysteine to enhance microbial cell factories for hydrogen production 1 2022 ... 另有一些[NiFe]氢酶的活性位点中含有硒代半胱氨酸(Sec),它取代了原有的半胱氨酸(Cys),这类氢酶有时也称为[NiFeSe]氢酶.Sec是Cys的同源氨基酸,几乎只存在于氧化还原酶的结构域中[ O2-independent formation of the inactive states of NiFe hydrogenase 1 2013 ... 氢酶因其高效的产氢或氢电转换性能,在生物产氢及燃料电池开发中起着重要作用,然而对氧的高度敏感性限制了其应用范围.过去三十年间,为了揭示对氧敏感的分子机制,研究人员开展了大量的实验和理论探索[ Structure, function and biosynthesis of O?-tolerant hydrogenases 1 2013 ... 氢酶因其高效的产氢或氢电转换性能,在生物产氢及燃料电池开发中起着重要作用,然而对氧的高度敏感性限制了其应用范围.过去三十年间,为了揭示对氧敏感的分子机制,研究人员开展了大量的实验和理论探索[ Characterization of a unique [FeS] cluster in the electron transfer chain of the oxygen tolerant [NiFe] hydrogenase from Aquifex aeolicus 1 2011 ... 对[NiFe]氢酶的氧失活机制研究发现,如同[FeFe]氢酶那样,氧气也会进入并结合到氢酶的活性位点,但对已知的具有氧气耐受性的[NiFe]氢酶来说,这种结合是可逆的,不会导致酶的不可逆降解;通常氧气会迅速通过利用质子和电子还原为水分子,并留下一个羟基固定在活性位点上,然后消耗一组质子和电子以另一个水分子的形式去除羟基[ How the oxygen tolerance of a [NiFe]-hydrogenase depends on quaternary structure 1 2016 ... 氢酶因其高效的产氢或氢电转换性能,在生物产氢及燃料电池开发中起着重要作用,然而对氧的高度敏感性限制了其应用范围.过去三十年间,为了揭示对氧敏感的分子机制,研究人员开展了大量的实验和理论探索[ Mechanism of O2 diffusion and reduction in FeFe hydrogenases 3 2017 ... 氢酶因其高效的产氢或氢电转换性能,在生物产氢及燃料电池开发中起着重要作用,然而对氧的高度敏感性限制了其应用范围.过去三十年间,为了揭示对氧敏感的分子机制,研究人员开展了大量的实验和理论探索[
Other Images/Table from this Article
|