|
||||||||||||||||||||
|
Research Progress in Plant-Derived Vaccines
Synthetic Biology Journal
DOI: 10.12211/2096-8280.2025-029
Table 2
Plant-derived antigen examples
Extracts from the Article
疫苗基因首次导入植物细胞并在植物中表达,1992年,Mason等成功在转基因烟草和番茄中表达了乙型肝炎病毒表面抗原,实现了疫苗基因首次导入植物细胞并在植物中表达[12, 13];1994年,刘玉乐等利用根癌农杆菌转化烟草,在烟草及其后代中成功表达了人乙型HIV中和人单克隆抗体2G 12肝炎病毒表面抗原(HBsAg)蛋白,他们使用了农杆菌介导的叶盘转化法,这是一种常用的植物遗传转化技术,通过这种方法,外源基因可以被导入植物细胞并整合到宿主基因组中[14]。这两个事件是植物源疫苗领域的重大突破,它们证明了植物可以被用来生产具有免疫原性的药用蛋白,为开发新型疫苗提供了一种成本效益高、易于规模化生产的新途径。这些研究为后续的植物源疫苗开发奠定了坚实的基础,并展示了植物在生物制药领域的巨大潜力。
科学家对植物源疫苗的功能进行了深入研究,验证了其免疫原性并在动物模型中进行了试验。例如,在2005年, Aoust等对植物源人乳头状瘤病毒(HPV)疫苗进行了初步动物试验,在动物模型中表现出免疫原性,但该候选疫苗并未能诱导足够强烈的免疫反应以清除被感染的细胞[15];2016年,Slavica等人在烟草中成功表达了ErbB2酪氨酸激酶受体,且在小鼠中获得了针对ErbB2+乳腺癌的保护性免疫原性,研究表明,中等剂量(100 μg)的疫苗与ErbB2特异性1型T细胞的生成相关,能够随时间产生持续的免疫反应[16]。2021年,Maharjan等在本氏烟草中表达了SARS-CoV-2刺突蛋白的受体结合结构域,并成功引发小鼠体液免疫反应,产生了高滴度的中和抗体[17]。2023年,张改平院士团队通过水稻胚乳表达猪瘟病毒的植物疫苗ht-rE2 二聚体,并在小鼠,兔子和猪的动物实验中验证疫苗的免疫应答水平和疫苗效力,低剂量284 ng ht-rE2二聚体疫苗免疫诱导产生的中和抗体滴度是减毒活疫苗的32倍,且E2特异性抗体的免疫持续期长达180天以上[18]。
抗原是指能够刺激机体免疫系统产生免疫应答,并能与免疫应答产物(抗体或致敏淋巴细胞)在体内外发生特异性反应的物质。植物能够高效表达病原体表面蛋白等抗原,为疫苗开发提供了新的平台。研究表明,通过植物表达系统,能够生产具有良好免疫原性的抗原。任兆钧等利用烟草TMV-30B外源蛋白高效表达载体,将口蹄疫毒株的免疫抗原克隆并表达于烟草叶片,该研究中提到的免疫抗原是猪O型口蹄疫病毒(FMDV)抗原表位融合结构蛋白VP1,是口蹄疫病毒的主要免疫原性蛋白,它包含了病毒的抗原表位,能够刺激机体产生免疫应答[46]。早在1999年,Buetow等就在烟草中开发了针对呼吸道合胞病毒(RSV)的植物源疫苗。RSV F蛋白由一个50 kDa的羧基末端F1片段和一个20kDa的氨基末端F2片段组成, 该二聚体的109和136氨基酸残基后存在两个furin蛋白酶切位点,酶切后将暴露F1氨基末端的疏水融合肽,使该抗原更容易被免疫细胞识别并结合[47]。同年十月,Langridge等将编码霍乱毒素B亚基(CTB)基因插入植物表达载体,成功诱导小鼠产生与天然CTB相同的免疫反应[48]。Sohrab等在2020年开发的可食用疫苗能够有效表达中东呼吸综合征冠状病毒刺突蛋白S1亚基的抗原, S1亚基包括N端结构域(NTD)和C端结构域(CTD),其中CTD也被称为受体结合结构域(RBD),负责与宿主细胞的受体结合[49](表2)。
本氏烟草是植物源疫苗研发中使用最广泛的实验宿主,因为它对许多病毒都易感。其减弱的免疫系统使得遗传物质可以成功地被植物宿主接受而不被排斥。本氏烟草也被用于商业生物制造,如激素、抗体、酶、治疗剂和疫苗等,具有在DNA转入后几天内制造外源蛋白的潜力[9]。它能够快速生产重组蛋白,适合于快速响应大流行疫苗的需求[9]。如Vanderburgt等表达猪繁殖与呼吸综合征(PRRS)的亚单位疫苗,用到了本氏烟草[30],即为动物使用的疫苗,也为人用植物源疫苗的研发提高了可行性。Medicago公司利用本氏烟草通过瞬时表达系统生产了四价、重组病毒样颗粒(VLP)流感疫苗,且这种疫苗在临床试验中显示出良好的安全性和免疫原性[67]。Dennis等人利用本氏烟草通过瞬时表达系统表达了传染性法氏囊病病毒的VP2蛋白[47]。Manu等人归纳了一些在烟草中表达的疫苗[73],如Claire等人用烟草表达了肺炎链球菌的Ⅲ型荚膜多糖,并在小鼠中诱导产生了抗肺炎链球菌多糖的血清抗体[82],他们还利用烟草表达炭疽保护性抗原(PA),通过肌肉注射免疫小鼠,诱导产生针对炭疽的免疫保护反应[74]。烟草还可以用于表达结核分枝杆菌的多种抗原,如Ag85B、ESAT-6、MPT64、MPT83等,这些抗原已投入疫苗开发[73]。除此之外,还有其他非食用植物宿主被用于生产植物源疫苗,1999年Andrés等首次将编码口蹄疫(FMDV)病毒结构蛋白的基因VPI转入紫花苜蓿中,在饲喂小鼠后,小鼠对口蹄疫病毒产生抗性。这项研究展示了紫花苜蓿作为植物源疫苗生产的潜力[75]。Venkataraman等人在生产SARS-CoV-2刺突蛋白的受体结合域(RBD)的研究中用到了蒺藜苜蓿A17细胞和烟草细胞(BY-2)[76],这项工作展示了苜蓿和烟草细胞悬浮培养作为疫苗生产宿主的潜力,通过体内外分析已成功表达并验证了多种疫苗抗原的功能性。AgroSciences在2006年获得了美国农业部(USDA)批准的首个基于HN的NDV疫苗,该疫苗是在烟草衍生的悬浮细胞系中生产的[77]。首个由植物生产的重组蛋白Taliglucerase alfa获得了FDA的批准,它是在胡萝卜悬浮培养中表达的[76]。
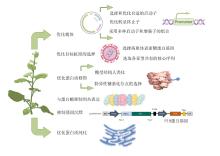
稳定表达系统是指将目标抗原基因稳定地导入植物基因组中,使其在世代间持续表达[86]。目前应用最广泛的是稳定核表达和稳定叶绿体表达,而稳定核表达主要是农杆菌介导转化法,稳定叶绿体表达主要使用基因枪和显微注射法[87]。Danniell等于2007年提供了哺乳动物对感染性病原体免疫力疫苗的方案,其用到了叶绿体这种质体转化以产生保护性抗原的载体,并成功表达药物蛋白[88]。叶绿体表达系统会丧失真核表达系统部分翻译后修饰方面的优势,比如糖基化、泛素化和磷酸化等,这些修饰可能影响蛋白的功能、定位、稳定性及与其他分子的相互作用,但叶绿体表达系统也具有自身的修饰能力,可进行一些基本的翻译后修饰过程,如二硫键形成、脂化和磷酸化等,能够满足部分蛋白的正确折叠和功能需求[89]。叶绿体表达系统适合生产亚单位疫苗如针对骨髓灰质炎病毒的加强型疫苗 CTB-VP1,VP1 属于病毒衣壳蛋白,其在烟草叶绿体中的表达具有免疫效果好、生产成本低等优势。还有霍乱毒素 B 亚基、人胰岛素原的融合蛋白等,其表达量高,且通过注射能展现出相应的功效[90]。某些病毒样颗粒的组装也不依赖糖基化修饰,因此可以使用叶绿体表达系统进行研发,如中国农业科学院生物技术研究所沈桂芳教授的叶绿体基因工程实验室在烟草叶绿体中成功表达的口蹄疫病毒主要抗原VP1基因、猪瘟病毒主要抗原 E2 基因等动物植物疫苗抗原[90]。而对于一些需要复杂糖基化修饰才能具有正确抗原性和免疫原性的疫苗抗原,叶绿体表达系统无法满足其修饰需求,导致表达的抗原活性低或无活性,如某些流感病毒疫苗抗原等,核表达系统更适合此类疫苗的生产[81],此外,叶绿体中的蛋白可能面临不同的降解风险,对于一些对稳定性要求极高、在叶绿体中易被降解的疫苗蛋白,核表达系统可通过内质网等细胞器为蛋白提供更稳定的折叠和保护环境,减少蛋白降解,更具优势[89]。常见的表达载体有Gateway、p1303、P33cym11、pBI 121、pBI 221等[91],常用的植物宿主表达器官一般为作物种子胚乳,如Matsumoto等用水稻胚乳稳定表达抗轮虫Ascaris suum的保护性抗原As16。该抗原作为与霍乱毒素B亚单位(CTB)融合的嵌合蛋白,其在胚乳中的表达水平达到了每克种子50微克。将转基因(Tg)水稻种子结合霍乱毒素(CT)作为粘膜佐剂喂给小鼠后成功诱导了特异性抗原As16的血清抗体反应。这表明,水稻稳定遗传转化递送的抗原作为一种预防性可食用疫苗,可以控制动物的寄生虫感染[42]。Yoshida等将针对阿尔茨海默病(AD)的Aβ 42基因与绿色荧光蛋白基因融合后,采用农杆菌法转入水稻中。当转基因的水稻被口服给小鼠时,血清中的抗Aβ抗体滴度明显上升。当小鼠被喂食煮熟的转基因水稻时,观察到了相同的结果。这些结果表明,使用水稻稳定表达的可食用疫苗对治疗阿尔茨海默病是可行的[45]。Nochi等开发了一种基于水稻稳定表达的口服疫苗,该疫苗表达霍乱毒素B亚单位(CTB),其表达受特定于胚乳的表达启动子2.3-kb谷蛋白GluB-1控制,并经过密码子优化以便在大米种子中表达,且每颗种子的胚乳中平均存储了30微克的CTB,当以粘膜方式喂食时,表达CTB的种子被M细胞吸收,成功诱导产生具有中和活性的CTB特异性血清IgG和粘膜IgA抗体[92]。这些基于水稻稳定遗传转化的疫苗为大规模口服接种人群提供了一种高度实用和具有成本效益的策略以应对感染[93]。Suzuki等测试了新开发的亚单位疫苗对支气管哮喘进行口服免疫治疗的可行性,该疫苗中包含了螨虫过敏原(Der p 1)的一个片段(p45-145),这个片段被包裹在转基因(Tg)水稻种子的内质网源性蛋白体中,且接种后明显降低了过敏原特异性IgE和IgG的血清水平,因此这种疫苗不会引起非特异性抑制,这在许多口服耐受方案中是一个突破。结果表明,基于水稻稳定表达的新疫苗策略是针对包括支气管哮喘在内的过敏疾病的过敏原特异性口服免疫治疗的一个有前途的方法[94]。而Yang表达一种房尘螨(HDM)过敏源Der p 1,C端带KDEL标签的Der p 1过敏源在胚乳特异性的GluB1启动子的控制下,特定积累在种子胚乳组织中,Der p 1在每粒种子中达到了最大浓度58微克,存放在内质网(ER)来源的蛋白体I(PB-I)中。结果表明,稳定转基因Der p 1水稻种子是治疗HDM过敏的安全潜在口服疫苗[43]。基因枪转化法又叫粒子轰击法,将DNA吸附在直径几微米的金粉或者钨粉上,然后将微粒高速打入外植体,高速微粒可以穿透植物细胞的细胞壁,微粒进入细胞后,吸附的DNA也从微粒中解离出来并在植物细胞中表达[95],如唐琳等用高压氦气式基因枪成功将外源基因导入番红花愈伤组织[96],张馨悦使用基因枪转化了萱草的花粉[97]。由于农杆菌转化法拥有更稳定高效的特性,所以在植物源疫苗研发生产的过程中,基因枪的使用概率并不高[95]。
启动子是控制基因表达的关键元件,选择和优化合适的启动子可以显著提高目标基因的表达水平。使用强启动子,如CaMV 35S启动子,可以增强基因的表达[112],也可以根据疫苗的应用需求,选择特定组织或细胞类型特异性表达的启动子,在需要控制基因表达时间的情况下,可以使用诱导性启动子,如受热或光诱导的启动子[113]。而启动子的优化方法使用较多的为口服疫苗,例如水稻和玉米的胚乳启动子,熊雨飞等公开了一种水稻种子胚乳优势表达启动子pNFYA2的制备方法及应用,该启动子可以用于驱动外源性基因在水稻种子胚乳中优势表达[114]。魏祥进等发明公开了一种水稻胚乳特异性表达启动子pEnd2,该启动子可以启动外源基因在植物的胚乳中特异性表达,适用于种子含胚乳的单子叶植物或胚乳型双子叶植物[115]。 宋任涛等首次分离到一个可在玉米胚乳中特异性表达的启动子PMAP,从实验水平验证了该启动子适用于启动目标基因在玉米胚乳中特异性表达,而在其他组织中低表达或不表达,为植物基因工程表达载体构建提供了合适的调控元件[116]。
一般情况下的植物源疫苗生产出的都是亚单位疫苗,仅含有具有免疫原性的抗原结构基因,一般是病原体表面糖蛋白的基因,如果是易于变异的病原体,则选取各亚型共有的核心序列作为主要保护性抗原基因序列,且不含其他遗传信息[91]。此外,植物源疫苗的研制需根据刚需疾病或症状来选择合适的目标抗原,如每年秋冬季广为流行的由轮状病毒引起的腹泻病,贾宇臣使用了植物油体作为表达载体,在花生中表达了轮状病毒抗原蛋白G3VP7[35]。目标蛋白还需具有足够的免疫原性以激发机体产生免疫应答,如冠状病毒样颗粒COVID-19候选疫苗(CoVLP)就是由表达为病毒样颗粒(VLPs)的重组刺突(S)糖蛋白组成,这种S蛋白是大多数COVID-19疫苗中的抗原,能引发高效的机体免疫应答[120]。张改平院士团队提出了一种通用的“头对尾”二聚体疫苗抗原模型,这种模型通过重新构建抗原来暴露多对具有合适距离的表位,从而有效地激活B细胞。该模型在水稻胚乳表达系统中成功制备了高效的重组抗原Osr2HN,且该抗原在水稻胚乳中的表达量高达3.7mg/g,显示出与传统疫苗相比更高的免疫效价[121]。
[本文引用: 1] [本文引用: 1]
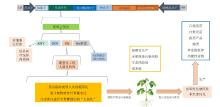
植物源疫苗的分类主要基于表达的不同重组蛋白类型以及生产和给药方式.这些疫苗可以表达特定病原体的抗原或病毒样颗粒(VLP),也可以根据给药途径设计为注射疫苗或口服疫苗,植物源疫苗具有生产成本低、易于大规模生产、便于储存和分发的优势,同时能够有效诱导粘膜免疫,此外,疫苗也可以根据不同宿主植物(如烟草、小麦、马铃薯、水稻等)进行分类,以优化其生产和应用效果. ... Plant-derived virus-like particles as vaccines 1 2013 ... 科学家对植物源疫苗的功能进行了深入研究,验证了其免疫原性并在动物模型中进行了试验.例如,在2005年, Aoust等对植物源人乳头状瘤病毒(HPV)疫苗进行了初步动物试验,在动物模型中表现出免疫原性,但该候选疫苗并未能诱导足够强烈的免疫反应以清除被感染的细胞[ Safety and immunogenicity of a plant-produced recombinant monomer hemagglutinin-based influenza vaccine derived from influenza A (H1N1)pdm09 virus: a Phase 1 dose-escalation study in healthy adults 2 2014 ... 科学家对植物源疫苗的功能进行了深入研究,验证了其免疫原性并在动物模型中进行了试验.例如,在2005年, Aoust等对植物源人乳头状瘤病毒(HPV)疫苗进行了初步动物试验,在动物模型中表现出免疫原性,但该候选疫苗并未能诱导足够强烈的免疫反应以清除被感染的细胞[
植物源疫苗的分类主要基于表达的不同重组蛋白类型以及生产和给药方式.这些疫苗可以表达特定病原体的抗原或病毒样颗粒(VLP),也可以根据给药途径设计为注射疫苗或口服疫苗,植物源疫苗具有生产成本低、易于大规模生产、便于储存和分发的优势,同时能够有效诱导粘膜免疫,此外,疫苗也可以根据不同宿主植物(如烟草、小麦、马铃薯、水稻等)进行分类,以优化其生产和应用效果. ... Clinical development of plant-produced recombinant pharmaceuticals: vaccines, antibodies and beyond 2 2011 ... 科学家对植物源疫苗的功能进行了深入研究,验证了其免疫原性并在动物模型中进行了试验.例如,在2005年, Aoust等对植物源人乳头状瘤病毒(HPV)疫苗进行了初步动物试验,在动物模型中表现出免疫原性,但该候选疫苗并未能诱导足够强烈的免疫反应以清除被感染的细胞[
植物源疫苗的分类主要基于表达的不同重组蛋白类型以及生产和给药方式.这些疫苗可以表达特定病原体的抗原或病毒样颗粒(VLP),也可以根据给药途径设计为注射疫苗或口服疫苗,植物源疫苗具有生产成本低、易于大规模生产、便于储存和分发的优势,同时能够有效诱导粘膜免疫,此外,疫苗也可以根据不同宿主植物(如烟草、小麦、马铃薯、水稻等)进行分类,以优化其生产和应用效果. ... Pre-Clinical Evaluation of a Replication-Competent Recombinant Adenovirus Serotype 4 Vaccine Expressing Influenza H5 Hemagglutinin 2 2018 ... 科学家对植物源疫苗的功能进行了深入研究,验证了其免疫原性并在动物模型中进行了试验.例如,在2005年, Aoust等对植物源人乳头状瘤病毒(HPV)疫苗进行了初步动物试验,在动物模型中表现出免疫原性,但该候选疫苗并未能诱导足够强烈的免疫反应以清除被感染的细胞[
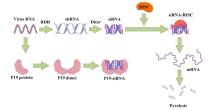
病毒样颗粒(Virus-like particles,VLPs)是一种由病毒结构蛋白自行装配而成的蛋白质颗粒.它们在形态结构上与天然的病毒颗粒相似,因此具有很强的免疫原性和生物学活性,且不含病毒核酸,没有复制能力,也不具有感染性,因此病毒样颗粒疫苗安全性较高.王跃驹于2019年利用生菜作为表达平台,成功生产病毒样颗粒的乙肝VLP疫苗,接种新西兰白兔后白兔产生免疫,并通过ELISA和假病毒颗粒中和试验验证了其生物活性[ Tobacco-Expressed FMD Plant Genetic Engineering Vaccine and Its Preparation Method 2 ... 抗原是指能够刺激机体免疫系统产生免疫应答,并能与免疫应答产物(抗体或致敏淋巴细胞)在体内外发生特异性反应的物质.植物能够高效表达病原体表面蛋白等抗原,为疫苗开发提供了新的平台.研究表明,通过植物表达系统,能够生产具有良好免疫原性的抗原.任兆钧等利用烟草TMV-30B外源蛋白高效表达载体,将口蹄疫毒株的免疫抗原克隆并表达于烟草叶片,该研究中提到的免疫抗原是猪O型口蹄疫病毒(FMDV)抗原表位融合结构蛋白VP1,是口蹄疫病毒的主要免疫原性蛋白,它包含了病毒的抗原表位,能够刺激机体产生免疫应答[
病毒样颗粒(Virus-like particles,VLPs)是一种由病毒结构蛋白自行装配而成的蛋白质颗粒.它们在形态结构上与天然的病毒颗粒相似,因此具有很强的免疫原性和生物学活性,且不含病毒核酸,没有复制能力,也不具有感染性,因此病毒样颗粒疫苗安全性较高.王跃驹于2019年利用生菜作为表达平台,成功生产病毒样颗粒的乙肝VLP疫苗,接种新西兰白兔后白兔产生免疫,并通过ELISA和假病毒颗粒中和试验验证了其生物活性[ Plant-derived vaccines against respiratory syncytial virus 3 ... 抗原是指能够刺激机体免疫系统产生免疫应答,并能与免疫应答产物(抗体或致敏淋巴细胞)在体内外发生特异性反应的物质.植物能够高效表达病原体表面蛋白等抗原,为疫苗开发提供了新的平台.研究表明,通过植物表达系统,能够生产具有良好免疫原性的抗原.任兆钧等利用烟草TMV-30B外源蛋白高效表达载体,将口蹄疫毒株的免疫抗原克隆并表达于烟草叶片,该研究中提到的免疫抗原是猪O型口蹄疫病毒(FMDV)抗原表位融合结构蛋白VP1,是口蹄疫病毒的主要免疫原性蛋白,它包含了病毒的抗原表位,能够刺激机体产生免疫应答[
病毒样颗粒(Virus-like particles,VLPs)是一种由病毒结构蛋白自行装配而成的蛋白质颗粒.它们在形态结构上与天然的病毒颗粒相似,因此具有很强的免疫原性和生物学活性,且不含病毒核酸,没有复制能力,也不具有感染性,因此病毒样颗粒疫苗安全性较高.王跃驹于2019年利用生菜作为表达平台,成功生产病毒样颗粒的乙肝VLP疫苗,接种新西兰白兔后白兔产生免疫,并通过ELISA和假病毒颗粒中和试验验证了其生物活性[ Development Of An Edible Vaccine 2 ... 抗原是指能够刺激机体免疫系统产生免疫应答,并能与免疫应答产物(抗体或致敏淋巴细胞)在体内外发生特异性反应的物质.植物能够高效表达病原体表面蛋白等抗原,为疫苗开发提供了新的平台.研究表明,通过植物表达系统,能够生产具有良好免疫原性的抗原.任兆钧等利用烟草TMV-30B外源蛋白高效表达载体,将口蹄疫毒株的免疫抗原克隆并表达于烟草叶片,该研究中提到的免疫抗原是猪O型口蹄疫病毒(FMDV)抗原表位融合结构蛋白VP1,是口蹄疫病毒的主要免疫原性蛋白,它包含了病毒的抗原表位,能够刺激机体产生免疫应答[
Other Images/Table from this Article
|