|
||||||||||||||||||||
|
Research on market access and regulation of global bio-manufactured feed protein materials and additives
Synthetic Biology Journal
DOI: 10.12211/2096-8280.2025-060
Table 2
EFSA’s classification of genetically modified microorganisms with typical cases for feeding
Extracts from the Article
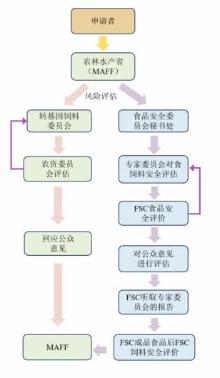
欧盟对于GMMs制造饲料原料和添加剂的监管是分类明确的,在世界范围内备受关注。他们对饲料原料或添加剂的单一产品、复杂产品、含有改造遗传物质但不增值不转移的产品与含有改造遗传物质具有活细胞可增殖的产品有较为严格细致的分类和监管。这一监管方式可能源于GMMs产品与传统饲料产品在动物健康影响方面仍存在差异,尚需长期研究验证,且目前尚无明确结论。欧盟在GMMs生物制造饲料产品的市场准入与监管中,采取了标识清晰、较为科学的管理机制,正因如此,其标准在国际上获得了较高的认可度。在欧盟关于GMMs的监管体系中,首先亲本/受体菌株的物种符合QPS,并且转基因状态不会引起安全问题,QPS方法可以扩展到转基因生产菌株,EFSA相应部门针对每种转基因菌株评估其安全性[42, 43]。对GMMs的应用,EFSA给出了指示性的分类(表2)与参照的法规、指南文件(表3)等。属于第一类和第二类饲料添加剂的氨基酸和酶以及属于第四类的微生物饲料添加剂根据(EC) No 1831/2003的实施细则进行评估。属于第三类的作为饲料用途的产品根据(EC)No 1829/2003法规评估。
Other Images/Table from this Article
|