Fig. 3
Mechanisms and applications of riboregulator-enabled synthetic biosensors
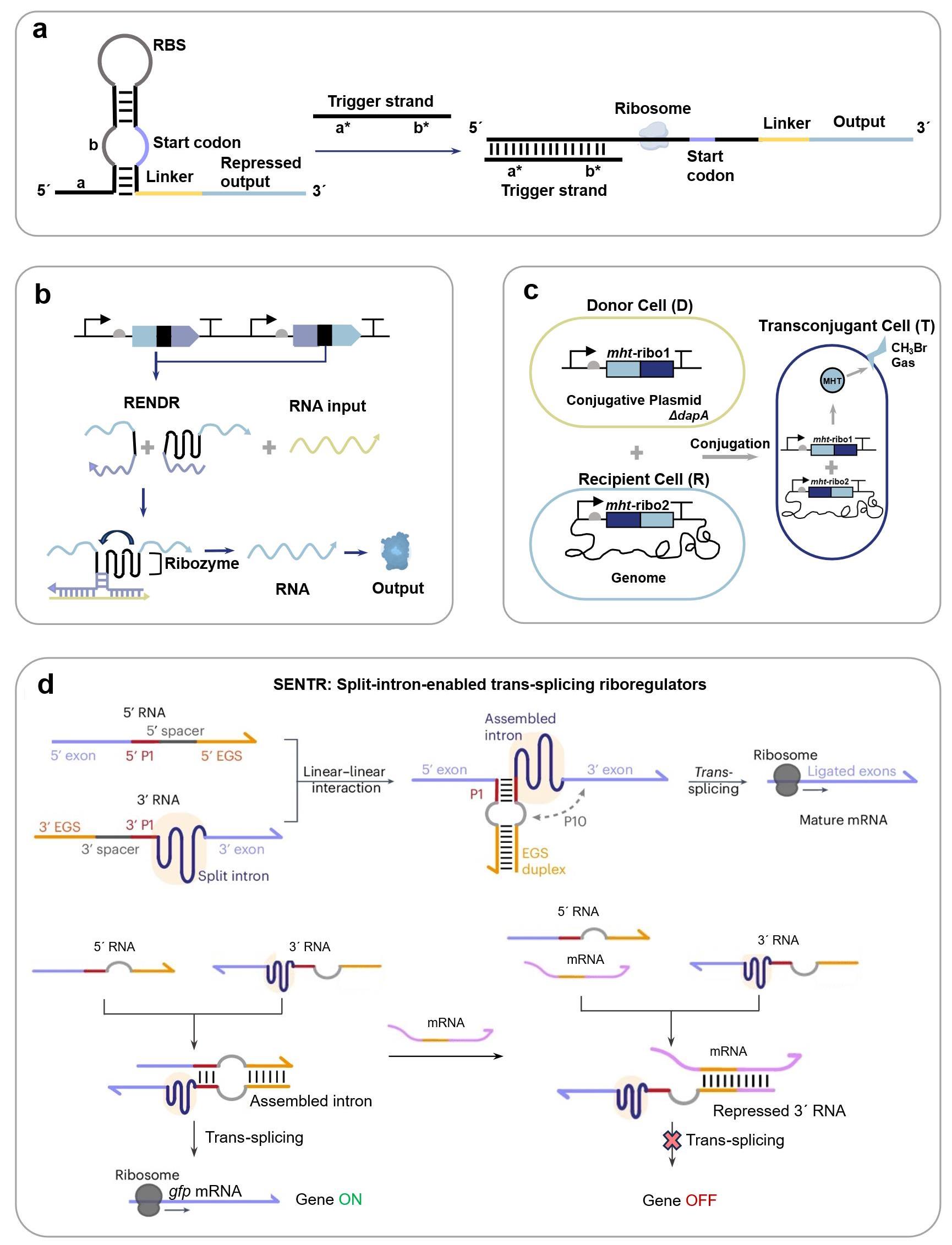
(a) Mechanism of the toehold switch[124]; (b) A ribozyme-based sensing platform RENDR[125]; (c) Gene circuit of a sensor for reporting bacterial DNA transfer in soil using split ribozymes[133]; (d) Mechanism of the group I intron-enabled RNA trans-splicing system SENTR and its application for intracellular mRNA detection [122].
Extracts from the Article
作为原核系统中经典核糖核酸调节子,toehold开关通过发夹结构遮蔽RBS及起始密码子抑制翻译。当触发RNA与开关互补结合时,发夹结构将解旋并暴露翻译起始元件,启动下游基因表达,与传统的核糖开关相比具有更高可编程性(图3a)。在应用层面,toehold开关展现出跨体系适配性:Zhang等[34]通过整合汞离子转录因子与toehold开关,构建了11种可编程双输入逻辑电路,实现对汞离子检测阈值的精准调控;K?ksald?等[129]结合toehold开关和核酸序列扩增技术(NASBA)开发了SARS-CoV-2病毒无细胞传感器;Chen等[130]基于toehold开关设计了高特异性、高敏感性的寨卡病毒无细胞传感器。目前研究者已建立系统的toehold开关设计优化平台:Cisneros等[131]开发了基于分子动力学模拟的自动化设计软件Toeholder;Valeri等[132]则利用深度学习架构(STORM/NuSpeak)实现了toehold开关性能的智能优化。
核酶(Ribozyme)作为具有催化活性的RNA分子,可催化磷酸二酯键的断裂或形成,从而实现RNA链的特异性剪接,这一特性使其成为构建RNA响应型生物传感器的理想元件[125]。Gambill等[125]基于这一原理构建了核酶传感平台RENDR,其将天然核酶拆分为两个失活片段,分别连接一段与靶标RNA互补的引导序列。当靶标RNA存在时,引导序列将通过碱基互补配对与之结合并形成具有催化活性中心的核酶复合物,从而剪接产生具有信号输出功能的mRNA,这一设计后续被用于检测细菌中的抗生素耐药基因(图3b);Selinidis等[133]将甲基卤化物转移酶基因拆分至两个接合质粒,分别携带互补的核酶片段,细菌接合过程中,两个质粒转录出的mRNA形成复合物恢复核酶活性,产生可以表达甲基卤化物转移酶的完整mRNA,进而释放出甲基卤化物以报告土壤中细菌的DNA转移(图3c);Gao等[122]近期开发的断裂内含子反式剪接(SENTR)技术革新了RNA调控策略,该技术基于核酶I型内含子的反式剪接机制,将前体RNA分割为多片段并与分裂内含子序列相连,只有当各片段同时表达时内含子才能重新组装并将分裂前体RNA连接。他们利用这一技术实现了对基因编码区(CDS)、5′非翻译区(5'UTR)及单链向导RNA(sgRNA)的高效精准剪接,并进一步证实SENTR可响应胞内mRNA动态变化(mRNA竞争性结合3′RNA阻碍反式剪接发生),为构建多功能RNA传感平台提供了新范式,在活细胞RNA互作监测与基因线路调控中展现出应用潜力(图3d)。
Other Images/Table from this Article
|