Fig. 8
Strategies for increasing the sensitivity of genetic circuit-enabled synthetic biosensors
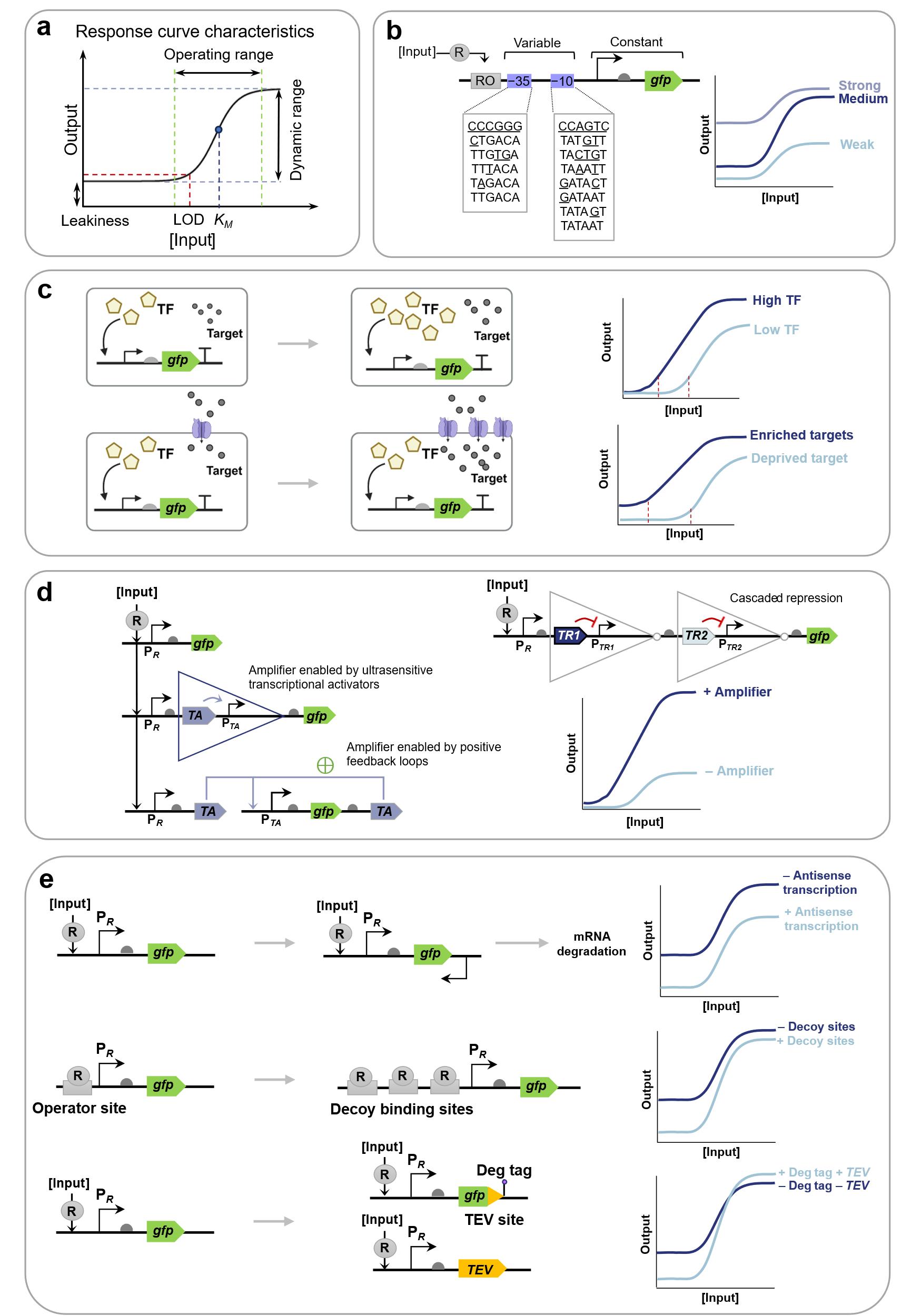
(a) Typical response curves and characteristics of genetic circuit-enabled synthetic biosensors.; (b) Dynamic range optimization based on promoter engineering; (c) Limit of detection optimization by gradient regulation of biorecognition components concentration and target enrichment technology; (d) Dynamic range optimization using sensing signal amplifiers based on activator transcription factors, positive feedback loops and cascade repressors [7]; (e) Leakage optimization utilizing antisense RNA-mediated translation blocking, decoy DNA binding site competitive inhibition, and output protein degradation tags[1].
Extracts from the Article
与实现类似功能的电子或化学传感器相比,许多早期生物传感器的性能在现场应用中缺乏竞争力[167]。近年来随着合成生物学的发展,众多全新的工具和策略为改进合成生物传感器的性能提供了助力。其性能可通过响应曲线进行系统评估(图8a),核心评价参数包括:
半最大激活效应浓度(KM )是最直观反映生物传感器敏感性的指标,与敏感度呈负相关,Landry等[173]通过引入磷酸酶的突变增加其磷酸化活性,显著降低了双组分系统传感器的KM,提高了检测敏感性;Wan等[32]设计级联放大基因线路降低了传感器的KM,实现了砷离子和汞离子的超灵敏检测。此外,敏感性也与生物传感器的检测限密切相关。相关优化可通过调控生物识别元件的浓度、提高局部靶标富集程度及优化报告系统等方式实现(图8c)。Wang等[174]通过调控细胞内转录因子浓度阐明降低阻遏型转录因子(如TetR、ArsR)的胞内浓度或提升激活型转录因子(如LuxR)的表达水平的方法,显著降低全细胞生物传感器的LOD并拓宽动态范围。该策略已成功应用于砷离子、汞离子传感器等多类系统,成为响应曲线优化的经典范式。在靶标富集方面,一般可通过以下策略提高靶标浓度:对于检测化学小分子的全细胞传感器,可通过强化细胞膜上的内转运系统或弱化外排系统来提升胞内靶标浓度[175](图8c);对于可执行核酸检测的无细胞传感器可采用核酸扩增技术(如滚环扩增RCA[176]、聚合酶链回收(PSR)[70]和crRNA竞争性反应[177])提高反应体系中待检测靶标的浓度,从而显著降低LOD和半最大激活效应浓度。值得注意的是,报告基因对LOD具有重要影响。Lopreside等[178]使用全细胞和无细胞表达体系评估了三类报告基因(荧光、比色、生物发光)中的八种报告器的性能,结果显示:全细胞体系中生物发光报告基因(如NanoLuc)具有更快的响应速度(≤30分钟)和检测敏感性(pmol级);无细胞体系中deGFP与NanoLuc则具有更低的LOD(nmol级)。
1、启动子工程优化:RNA聚合酶亲和力与转录因子调控效力的平衡是动态范围调控的核心参数:强启动子易引发高本底泄漏,但激活态信号增幅有限;弱启动子虽可降低本底噪声,但最大输出强度显著受限(图8b)。Chen等[179]系统比对了ArsR结合位点序列与RNA聚合酶结合位点库,确定了最佳启动子模型,经过优化成功开发出具有低泄漏与高动态范围(183.52倍)的新型启动子,该设计显著提升了砷离子荧光与比色传感器的性能指标。此外,基于启动子构效关系的高通量筛选技术为动态范围优化提供了新范式:例如另一研究组通过构建包含不同保守区域序列的启动子文库,建立了动态范围量化评估体系[180]。利用该体系筛选获得的高性能启动子元件已被成功应用于复杂基因线路构建,验证了"设计-构建-测试"(DBTL)循环在生物传感器启动子优化中的有效性。这种模块化设计策略不仅提升了单参数性能,更为多层级联系统的精准调控奠定了基础。
3、基于基因信号放大器及其他优化策略的传感信号增强:基因信号放大技术通过重构基因线路的调控层级,显著提升生物传感器的检测性能。目前主要策略包括利用激活转录因子、正反馈回路和双抑制因子实现信号放大[7](图8d)。例如,Wang等[181]利用hrpRS和hrpV转录因子构建了模块化、增益可调的传感信号放大器提高了传感器动态范围;Wan等[32]设计了级联放大基因线路,相比于单一放大器进一步将动态范围提升;Liu等[182]利用铜离子激活型CusSR双组分系统诱导T7 RNA聚合酶(T7 RNAP)表达,最终驱动T7启动子控制的目的基因高效转录,该系统不仅能实现输入信号的指数级放大,还可作为记忆模块维持基因持续表达。此外如本文3.1.1部分所述,核酸扩增技术是无细胞领域内重要的信号放大手段,例如Li等[70]人开发了聚合酶链循环(PSR)技术,利用T7 RNA聚合酶的脱靶转录特性,在无细胞体系中建立了核酸信号循环放大回路。该技术使四环素和锌离子传感器的检测限分别降低至0.025 μM和0.1 μM,动态范围扩展达17-20倍,为传感器信号放大设计提供了新思路。然而,信号放大过程中存在本底噪声协同放大的问题,为克服这一弊端,研究者提出系列优化策略:Son等[183]开发了基因拷贝数动态调控ADEPT系统,能够通过带有负反馈机制的CRISPR-Cas9质粒消除系统将基因表达泄漏降低,同时通过F型接合转移和抗生素选择机制快速提升携带质粒细菌的比例从而放大信号,在提高传感器动态范围方面前景广阔;翻译后修饰是另一种有效方法,例如在输出蛋白中引入降解标签,并通过诱导表达同源蛋白酶构建自调控回路,该设计使基础表达量显著降低,同时维持最大输出强度[32](图8e)。
合成生物传感器的本底泄漏抑制是提升检测敏感性的关键环节,当前研究通过分子互作机制与基因线路拓扑重构等路径实现泄漏的精准调控。在分子调控层面,融合降解标签[44]并诱导表达特异性蛋白酶可靶向降低本底蛋白表达[32],而反向启动子介导的反义RNA转录能通过阻碍核糖体结合或触发RNA降解通路实现翻译级泄漏抑制[184](图8e)。Ho等[185]将分裂内含肽与拆分的目标蛋白分别偶联,并用两个独立启动子控制,使得单一启动子泄漏不足以产生活性蛋白,这种基于AND逻辑的策略成功降低了目标蛋白泄漏表达,在传感器泄漏优化方面有着应用潜力。本文1.4部分提及的断裂内含子反式剪接(SENTR)技术[122]同样有望通过类似策略降低传感器泄漏。在线路设计层面,Wan等[186]通过引入多拷贝的转录因子结合位点作为诱饵(DNA海绵[187])竞争性捕获游离转录因子,使大肠杆菌报告系统泄漏表达降低20倍以上,动态范围提高70倍,同时降低宿主细胞毒性;结合位点空间排布的优化(如调整其与转录起始位点间距[180,188]或在下游增设额外结合位点[189])也可从转录层面有效降低泄漏表达(图8e)。此外,通过正交调控模块的协同级联调控可实现泄漏的精准控制,如Greco等[190]开发的多级控制器(MLC)在转录因子与翻译调节因子同时激活时才能启动报告基因表达,使泄漏水平较传统系统明显降低,动态范围提高1000倍以上。
Other Images/Table from this Article
|