Fig. 5
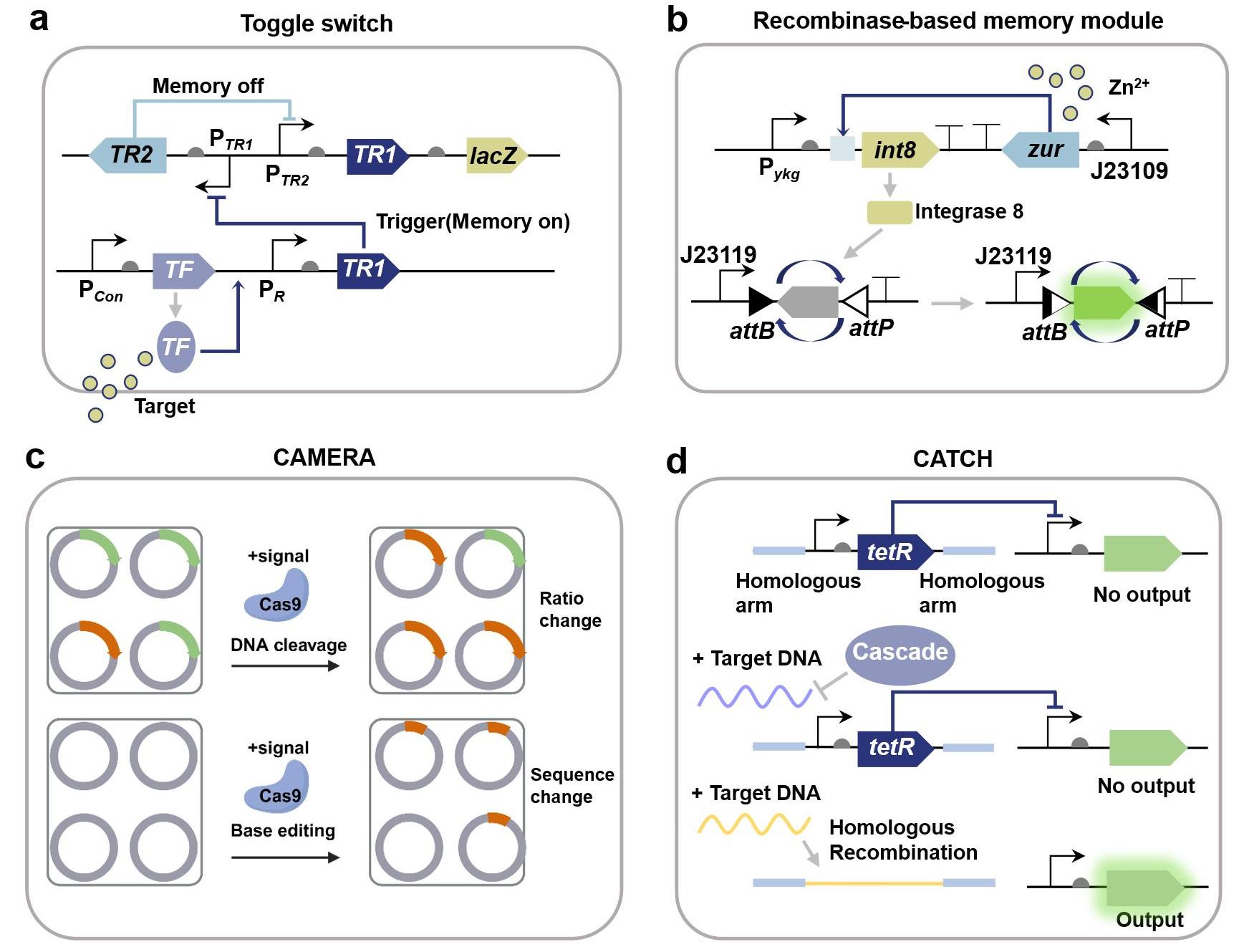
Typical biomemory modules for recording biosensing signals
(a) Gene circuit for a biomemory module based on toggle switch; (b) Gene circuit of a zinc ion memory module based on the recombinase flip mechanism[153]; (c) Principle of the CAMERA recording system based on CRISPR/Cas[158]; (d) Gene circuit of the DNA sensing and recording module (CATCH) based on CRISPR/Cas[159].
Extracts from the Article
拨动开关(Toggle Switch)作为最早的可逆记忆元器件[148],通过两个相互抑制的转录因子(TR1/TR2)实现双稳态调控[149](图5a)。瞬时诱导可触发状态转换并维持稳定,直至反向诱导发生。这种二元状态特性可将连续输入信号转换为数字输出,显著提升传感器的鲁棒性与决策能力。例如,Zou等[47]通过设计拨动开关,实现了粪便和尿液中血液标志物的超灵敏检测;Mannan等[62]通过设计FadR-TetR正反馈回路构建了不可逆代谢开关,仅需单次诱导即可调控菌株从对数生长期向产物生产期转变。
位点特异性重组酶系统通过精准识别DNA重组元件的特征性识别位点并催化DNA的精准剪切和倒置反应,实现遗传信息的稳定记录[150]。其记忆功能可通过两种方式实现:当识别位点正向排列时,重组酶在位点之间进行切除;当识别位点反向排列时,重组酶使位点间基因倒位[151]。只要识别位点间的DNA是功能性生物元件,以上方式均可实现记忆元器件的功能[152]。Zhu等[153]利用重组酶int8构建了肠道炎症标志物响应型基因线路,感知炎症信号后可触发sfgfp基因倒位改变输出水平,实现肠道炎症的长期记录(图5b);Abedi等[154]开发了超声热控重组酶系统,通过Bxb1介导的attP/attB位点倒位实现肿瘤治疗基因的不可逆激活。此外,利用整合酶-切除酶系统可构建可逆的记忆系统,实现信息的重复写入与擦除[152]。
CRISPR/Cas系统不仅可用于基因编辑,其天然免疫记忆功能也为生物记忆模块设计提供了新思路。CRISPR介导的模拟多事件记录装置(CAMERA)通过选择性切割记录质粒以改变特定质粒的比例,或直接编辑质粒DNA序列实现了对抗生素、光照等众多刺激信号的记录[158](图5c);Cooper等[159]开发的CRISPR区分水平基因转移(CATCH)策略将CRISPR-Cas系统与水平基因转移(HGT)机制结合,样品中具有野生型序列的片段将被I-F CRISPR-CAS效应复合物Cascade识别并降解,而具有特定突变的肿瘤DNA可避免这种降解并被整合进入基因组,以去除对下游报告基因的抑制从而记录肿瘤信息(图5d);Zou等[54]设计的记录和翻译激活(RAT)系统基于第二代碱基编辑器(BE2),当肠炎标志物硫代硫酸盐存在时,ACG被编辑为起始密码子ATG,从而激活靶蛋白翻译,实现肠炎信号的特异性记忆。除上述模块外,还有一些新颖的传感记忆机制,例如近期Kalvapalle等[160]报道的RNA地址化修饰(RAM)技术,该技术基于由剪切核酶催化核心和特异性RNA识别区组成的合成RNA(cat-RNA),当细菌获取携带cat-RNA基因的质粒时,一个RNA条形码序列将被拼接到细胞rRNA上,在微生物群落中实现基因转移的自动传感记录。这些记忆模块通过稳定记录环境信号变化,为复杂生物传感与诊断提供了强大的信息存储与检索能力,扩展了合成生物学传感器的应用范围。
Other Images/Table from this Article
|