Fig. 11
Examples of stability and biosafety optimization for genetic circuit-enabled synthetic biosensors
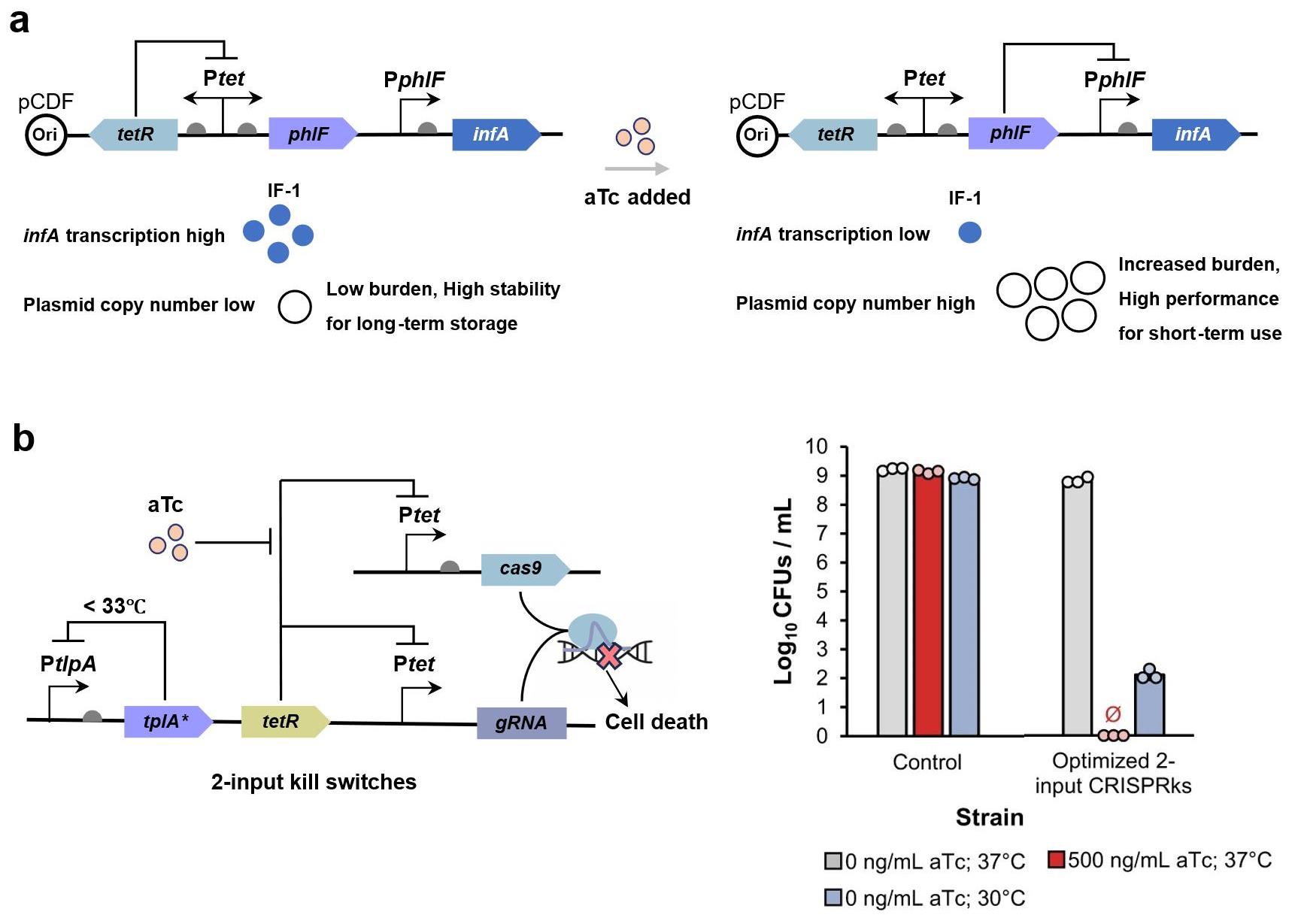
(a) A plasmid copy number control platform in Escherichia coli based on dynamic regulation of translation initiation factors[204]; (b) A biocontaining CRISPR-Cas9 dual-modal kill switch (CRISPRks) for E. coli under the dual control of chemical inducer anhydrotetracycline (aTc) and temperature changes[212].
Extracts from the Article
首先,基因线路内嵌的动态调控网络可显著提升系统鲁棒性。例如,通过转录因子的自调控机制稳定其胞内浓度,可有效降低表达波动性并维持稳定的响应阈值[201]。此外,代谢负荷的精准调控是维持线路功能的关键,外源基因的过量插入可能引发宿主资源竞争,导致线路功能退化甚至基因突变。因此,Shao等[202]将控制论引入启动子工程,设计出可在不同基因组位点及质粒载体中维持恒定表达水平的启动子系统,为代谢负荷控制提供了标准化工具,该团队进一步开发了多维度单细胞分析技术,通过融合荧光报告系统与质粒或RNA结合蛋白,实现了质粒拷贝数、启动子活性(以RNA聚合酶/秒为单位)及蛋白质表达的同步量化分析[203]。Park等[204]在敲除宿主染色体中生长必需基因infA(编码翻译起始因子IF-1)的基础上,整合了带有反馈回路与诱导系统的功能质粒,实现了必需基因infA表达量(与质粒拷贝数成反比)的动态调控,从而建立了无需抗生素的大肠杆菌质粒拷贝数自适应调控平台,为精准优化基因线路负载开辟了新路径(图11a)。在储存稳定性方面,冻干封装技术[39,205]的突破显著延长了传感器活性保存周期,但其对储存条件的要求严苛;而基于产孢子细菌的储存策略展现出独特优势:研究人员将传感器线路整合至产孢子菌株,产生的孢子可在休眠状态下实现传感线路的长期稳定保存,待检测时则可通过特定诱导程序激活其功能[206-207];廉价的微流控装置也被开发作为生物传感器的应用平台,但在现场检测多样本时仍存在不便[32]。这些生物传感器储存模式为开发实地部署型生物传感器提供了创新的稳定性提升思路。
现阶段,生物安全问题仍是制约合成生物传感器商业化与现场应用的关键瓶颈[23],针对这一难题,合成生物学领域已发展出多种创新性解决方案。例如“GeneGuard”系统通过整合三种生物防护机制有效控制了大肠杆菌的生物安全风险:营养缺陷型选择标记、宿主依赖性复制起点和毒素-抗毒素系统[208]。也有研究将毒性基因置于合成计时器[209]或计数电路[210]控制下,促使宿主细胞在环境滞留超过预设时限后启动自毁程序。此外,通过引入非典型氨基酸构建物种特异性屏障能够有效阻断人工基因元件向环境微生物的水平转移,例如在关键位点插入非天然碱基替代终止密码子使未经改造的生物体在获得外源基因时仅能合成截短蛋白[211]。CRISPR相关技术的创新应用为传感器生物安全优化提供了新范式,例如Rottinghaus等[212]在EcN菌株中构建的CRISPR-Cas9双模态杀伤开关(CRISPRks)展现出双重控制优势:既能响应化学诱导剂无水四环素(aTc),又可感知宿主体外排泄时的温度变化,该CRISPR系统在感知信号后介导必需基因的剪切使细菌无法存活,从而实现肠道细菌的原位清除与体外细菌存活的遏制(图11b);Hayashi等[213]在B. thetaiotaomicron中敲除胸苷合成酶编码基因thyA构建了营养缺陷型菌株,同时引入定向敲除thyA的CRISPR装置(CD),该设计既能维持工程菌的代谢依赖性,又可清除获得外源基因的野生菌株,形成基因扩散的双向屏障。值得注意的是,尽管现有技术在细胞内安全维持方面取得显著进展,然而公众对基因改造生物传感器(特别是用于人体的在体检测类型)的接受度仍存在显著落差,这仍是生物传感领域面临的一大难题。
Other Images/Table from this Article
|