|
|||||||||||||||||
|
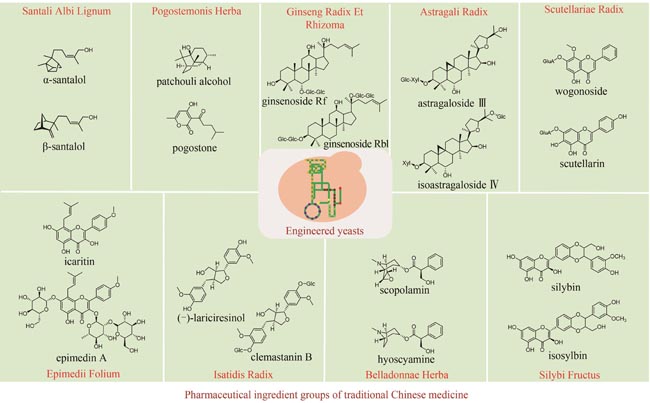
Advances in synthetic biology for producing potent pharmaceutical ingredients of traditional Chinese medicine
Synthetic Biology Journal
2024, 5 (3):
631-657.
DOI: 10.12211/2096-8280.2023-082
Traditional Chinese medicine (TCM) is a treasure of Chinese civilization and also a good mine for drug development in China. Many TCM components come from rare biological species including plants, animals, and insects, making the preparation of these TCM pharmaceutical substances at large scales a bottleneck that substantially impedes TCM-based drug development. However, the rapid development of synthetic biology has provided a strategy for addressing this challenge. At present, significant progress has been made in the bio-production of individual TCM components, but the efficacy of TCM is mainly due to the synergistic effect of those ingredients, which are termed as pharmaceutical ingredient groups. Reports on constructing the bio-production platform of pharmaceutical ingredient groups are limited. Herein, we summarize research progress in the biogenic mechanism of important TCM pharmaceutical ingredient groups, such as volatile oils, saponins, flavonoids, lignans and alkaloids. Some individual components of pharmaceutical ingredient groups (e.g. ginsenosides) are synthesized by multiple branching pathways, which can be produced and formatted thereafter. On the other hand, some pharmaceutical ingredients such as sandalwood oil can be synthesized through single pathways/enzymatic reactions by engineering the key enzymes to optimize their ratio. We comment the strategy of combining enzyme engineering and metabolic engineering to optimize both the production of pharmaceutical ingredient groups and their ratio. At the end, we outline the prospect of synthetic biology research for producing pharmaceutical ingredient groups, including: (1) complete clarification of the biogenic mechanism of more complex pharmaceutical ingredient groups, (2) development of novel metabolic engineering approaches for breaking through homogenization of methodology, and (3) optimization of the catalytic characteristics of key synthetic enzymes by combining rational design and directed evolution.
Table 1
Cytochrome P450 enzymes for santalols biosynthesis
Extracts from the Article
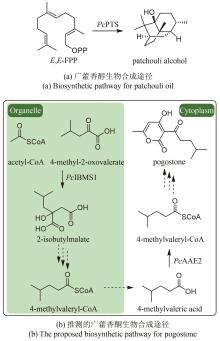
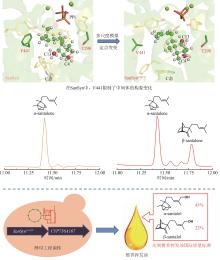
第二步:α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯在CYP的催化下,发生C12位羟基化,生成α-檀香醇、β-檀香醇、epi-β-檀香醇和exo-α-香柠檬醇[42]。目前,已经从檀香中表征了10个催化上述反应的CYP(表1)。其中,CYP76F41、CYP76F42和CYP76F39v1能够产生全部Z型和E型的α-檀香醇、β-檀香醇、exo-α-香柠檬醇和epi-β-檀香醇;CYP76F39v2能够生成除Z-epi-β-檀香醇外的7种产物;CYP76F40仅能够产生Z-α-檀香醇、E-β-檀香醇和E-exo-α-香柠檬醇;CYP76F37v1、CYP76F37v2、CYP76F38v1和CYP76F38v2只产生E型的α-檀香醇、β-檀香醇和exo-α-香柠檬醇[42];CYP736A167特异性地生成Z型的α-檀香醇、β-檀香醇、exo-α-香柠檬醇和epi-β-檀香醇[43]。
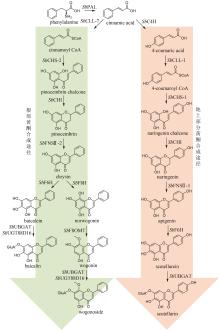
黄芩是临床常用中药,以唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥根入药,具有清热燥湿、泻火解毒、止血以及安胎等功效[83]。现代药理研究表明,黄芩具有抗菌、抗流感病毒、抗炎以及镇静解热等作用[84]。黄酮类成分被认为是黄芩的主要药效成分,其中包含一类黄芩属植物特有的4′-脱氧黄酮化合物。这类黄酮化合物的代表分子包括黄芩苷(baicalin)、黄芩素(baicalein)、汉黄芩苷(wogonoside)、汉黄芩素(wogonin)以及去甲汉黄芩素(norwogonin)等[85]。黄芩采用两种不同的途径合成黄酮类成分,包括地上部分的典型黄酮生物合成途径以及根部的4′-脱氧黄酮生物合成途径(图6)[86]。首先,苯丙氨酸在苯丙氨酸解氨酶(PAL)的催化下被转化为肉桂酸。目前,从黄芩中表征了SbPAL1、SbPAL2和SbPAL3三个PAL,分别在茎、叶和根中表达水平最高,说明在不同组织中黄芩采用不同的PAL酶完成肉桂酸的合成[87]。在地上部分的典型途径中,肉桂酸在肉桂酸-4羟化酶(SbC4H)、4-香豆酰辅酶A连接酶(SbCLL-1)、查尔酮合成酶(SbCHS-1)、查尔酮异构酶(SbCHI)和黄酮合酶(SbFNSⅡ-1)的顺序催化下,依次经4-香豆酸(4-coumaric acid)、4-香豆酰辅酶A(4-coumaroyl CoA)、柚皮素查尔酮(naringenin chalcone)和柚皮素(naringenin),生成芹菜素(apigenin);之后,芹菜素被进一步羟基化和糖基化形成野黄芩素(scutellarein)和野黄芩苷(scutellarin)等化合物(图6)[88-89]。在根中,肉桂酸不被氧化成4-香豆酸,而是在肉桂酰辅酶A连接酶(SbCLL-7)的催化下,直接与辅酶A连接生成肉桂酰辅酶A(cinnamoyl CoA);肉桂酰辅酶A在乔松素查尔酮合成酶(SbCHS-2)和SbCHI的连续催化下,生成4′-脱氧二氢黄酮乔松素(pinocembrin);乔松素在SbFNSⅡ-2的催化下,转化为4′-脱氧黄酮白杨素(chrysin);白杨素的C6和C8分别在黄酮6-羟化酶(SbF6H)和黄酮8-羟化酶(SbF8H)的作用下被羟基化,生成黄芩素和去甲汉黄芩素[85,89];黄酮8-O-甲基转移酶(SbF8OMT)在去甲汉黄芩素的C8位羟基引入甲基,生成汉黄芩素[90];葡萄糖醛酸转移酶SbUGT88D16/SbUBGAT催化黄芩素和汉黄芩素的7位O-葡萄糖醛酸化反应,分别生成黄芩苷和汉黄芩苷[91-92](图6)。黄芩中黄酮类成分的生物合成是植物代谢产物生物合成空间差异分布的典型范例。
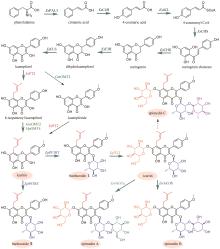
板蓝根是菘蓝(Isatis indigotica Fortune)的干燥根,具有清热解毒、凉血利咽的功效,临床上常用于治疗流行性感冒和病毒性感染等[102]。研究表明,板蓝根抗病毒的药效成分为木脂素类化合物,主要包括:落叶松脂醇(lariciresinol)、开环异落叶松脂醇(secoisolariciresinol)、落叶松脂醇苷以及直铁线莲宁B(clemastanin B)等。目前,已经基本解析了这些成分的生物合成途径(图8)。与典型黄酮生物合成途径的前两步相同,苯丙氨酸在苯丙氨酸解氨酶(IiPAL1和IiPAL2)和肉桂酸-4-羟化酶(IiC4H)催化下生成4-香豆酸(图8)[103]。在菘蓝中,4-香豆酸可经过两条路径生成松柏醛。第一条路径:在4-香豆酰辅酶A连接酶(Ii4CL2)催化下,得到4-香豆酰辅酶A;4-香豆酰辅酶A在羟基肉桂酰转移酶(IiHCT)和香豆酸-3-羟化酶(IiC3H)催化下,经中间体4-香豆酰莽草酸酯,生成咖啡酰辅酶A(caffeoyl CoA);咖啡酰辅酶A氧甲基转移酶(IiCCoAOMT)和肉桂酰辅酶A还原酶(IiCCR)顺序催化羟基甲基化和还原反应,生成松柏醛(coniferaldehyde)(图8)[103]。在第二条途径中,首先IiC3H羟基化4-香豆酸,得到咖啡酸;然后在Ii4CL2/3以及IiCCoAOMT的催化下,与辅酶A连接并甲基化得到阿魏酰辅酶A;IiCCR催化阿魏酰辅酶A的还原,生成松柏醛(图8)[103]。除以上两条途径外,在大多数植物中还存在第三条合成松柏醛的途径:首先在咖啡酸氧甲基转移酶(COMT)的催化下,咖啡酸转化为阿魏酸,进一步在4CL的催化下连接辅酶A生成阿魏酰辅酶A;最后CCR催化阿魏酰辅酶A还原,生成松柏醛[103-104]。由于目前未从菘蓝中发现COMT,因此是否存在这条路径尚不确定。松柏醛经肉桂醇脱氢酶(IiCAD)氧化,生成木脂素的关键前体化合物松柏醇(coniferyl alcohol)[103]。2分子松柏醇通过自由基偶联反应生成第一个具有木脂素骨架的化合物松脂醇(pinoresinol),这步反应被认为由过氧化物酶或漆酶催化完成,dirigent蛋白可保证反应的立体选择性[105]。陈瑞兵等[106]从菘蓝转录组中鉴定了19条dirigent蛋白编码基因,在菘蓝毛状根中过表达这些基因,发现IiDIR1和IiDIR2的表达选择性地促进(-)-松脂醇合成,证明了这两个酶在立体选择性控制方面的重要作用。松脂醇/落叶松脂醇还原酶(IiPLR1)连续催化松脂醇的C7-O-C9′和C7′-O-C9醚键的开裂,生成落叶松脂醇(lariciresinol)和开环异落叶松脂醇(secoisolariciresinol)(图8)。IiPLR1和AtPrR1(拟南芥的松脂醇还原酶)均为首尾连接的同源二聚体[107]。通过两种酶结构的比较分析,揭示了IiPLR1的催化机制[107]。IiPLR1催化松脂醇向开环异落叶松脂醇转化的过程包括:松脂醇的结合、落叶松脂醇的生成、落叶松脂醇的释放、落叶松脂醇的结合以及开环异落叶松脂醇的生成。即落叶松脂醇生成后并未立刻继续开环生成开环异落叶松脂醇,而是经历了释放-再结合的过程。相对于IiPLR1,AtPrR1的底物结合口袋空间更小并且底物的进入被更严格地控制,因此阻碍了释放出的落叶松脂醇再次进入活性口袋,不能进一步开环生成开环异落叶松脂醇。两种酶中的β4 loop在底物/产物以及辅因子NADPH/NADP+的结合与释放中发挥了关键作用。具体来讲,β4 loop负责招募NADPH,并且在底物结合后覆盖底物结合槽。β4 loop上的98位氨基酸残基显著影响β4 loop的摆动,从而与底物的选择性密切相关。当把AtPrR1中体积较大的N98突变为体积较小的S98(与IiPLR1相同)后,AtPrR1N98S可产生开环异落叶松脂醇。目前,从菘蓝中表征了四个与木脂素苷生物合成相关的糖基转移酶。其中,IiUGT1是糖基化松脂醇的主要糖基转移酶,可产生松脂醇-4-O-葡萄糖苷(pinoresinol-4-O-glucoside)和松脂醇-4,4′-O-二葡萄糖苷(pinoresinol-4,4′-O-diglucoside)(图8)[108];IiUGT71B5a和IiUGT71B5b同样具有糖基化松脂醇的功能,前者产生松脂醇-4-O-葡萄糖苷和松脂醇-4,4′-O-二葡萄糖苷,后者仅能产生松脂醇-4-O-葡萄糖苷(图8)[109];IiUGT4负责落叶松脂醇的糖基化,可产生落叶松脂醇-4-O-葡萄糖苷(lariciresinol-4-O-glucoside)、落叶松脂醇-4′-O-葡萄糖苷(lariciresinol-4′-O-glucoside)和直铁线莲宁B[108](图8)。
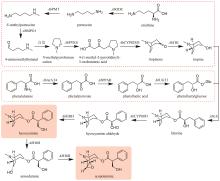
通过在颠茄毛状根中饲喂鸟氨酸脱羧酶(ODC)或精氨酸脱羧酶(ADC)的特异性抑制剂,以及分析ODC和ADC基因的表达水平与托品烷生物碱含量的关联性,证明AbODC在托品的生物合成中起主要作用[21]。AbODC催化鸟氨酸脱羧生成腐胺(putrescine)[21];腐胺经腐胺N-甲基转移酶(AbPMT)和N-甲基腐胺氧化酶(AbMPO)顺序催化,一个氨基被甲基化,另一个氨基被氧化成醛基,从而生成4-氨甲基正丁醛(4-aminomethylbutanal)(图9)[22-23]。在颠茄中发现了两个AbMPO(AbMPO1和AbMPO2),AbMPO1主要在根中表达,而AbMPO2主要在地上部分表达,并且抑制AbMPO1的表达会显著降低莨菪碱和东莨菪碱的含量,因此AbMPO1是托品烷生物碱生物合成的主要功能性N-甲基腐胺氧化酶。4-氨甲基正丁醛通过自发环化,形成N-甲基吡咯啉正离子(N-methylpyrrolinium cation)(图9)[24]。N-甲基吡咯啉正离子和丙二酰辅酶A在非典型Ⅲ型聚酮合酶AbPYKS的催化下生成4-(1-甲基-2-吡咯烷基)-3-氧丁酸[4-(1-methyl-2-pyrrolidinyl)-3-oxobutanoic acid](图9)[25]。4-(1-甲基-2-吡咯烷基)-3-氧丁酸在托品酮合酶AbCYP82M3的介导下发生氧化和环化反应生成托品酮(tropinone)(图9)[25]。最后,托品酮在托品酮还原酶I(AbTRI)的催化下生成托品(tropine)(图9)[23]。通过解析AbPYKS的同工酶AaPYKS(源于三分三,Anisodus acutangulus)的蛋白晶体结构,阐明了该类非典型Ⅲ型聚酮合酶的催化机制。AaPYKS活性口袋内的保守三联体Cys166-His305-Asn338负责产生关键中间体3-羰基戊二酸;3-羰基戊二酸与N-甲基吡咯啉正离子通过自发缩合产生4-(1-甲基-2-吡咯烷基)-3-氧丁酸[26]。
在水飞蓟宾类成分的生物合成途径中,从酪氨酸到最终产物需要多达15个生物合成酶,并且涉及多种辅因子和毒性中间体。本课题组采用细胞工厂结合体外酶法的策略实现了水飞蓟宾类成分的“从头”合成[120]。首先建立了紫杉叶素和松柏醇的细胞工厂。通过表达莽草酸/芳香氨基酸合成途径中两个关键酶的突变体ScARO4K229L和ScARO7G229S,解除酪氨酸对ScARO4和ScARO7的负反馈抑制作用。重点选择与前体供给、辅因子再生以及细胞耐受等多种因素关联的关键蛋白,开展优化,简化调控环节,从而减轻细胞负荷。例如:通过过表达TYR1和ARO8,既加速了前体化合物酪氨酸的合成,又促进了NADPH和α-酮戊二酸两种辅因子的再生循环;通过过表达ZWF1,既加快了NADPH循环,又显著降低了中间体松柏醛对酵母细胞的毒性(图11)。最终,组合表达6种酵母内源基因以及14种来自于不同植物和细菌的异源基因,构建了紫杉叶素和松柏醇的细胞工厂。最后,采用大肠杆菌表达APX1t,通过体外酶法合成水飞蓟宾类化合物,经大孔吸附树脂纯化后,产率达301 mg/L,并且水飞蓟宾A、水飞蓟宾B以及异水飞蓟宾A、异水飞蓟宾B含量超过90%[120]。从而实现了水飞蓟宾类药效成分的高度富集。
Z/E-α-檀香醇、 ... Heartwood-specific transcriptome and metabolite signatures of tropical sandalwood (Santalum album) reveal the final step of (Z)- santalol fragrance biosynthesis 2 2016 ... 第二步:α-檀香烯、β-檀香烯、epi-β-檀香烯和exo-α-香柠檬烯在CYP的催化下,发生C12位羟基化,生成α-檀香醇、β-檀香醇、epi-β-檀香醇和exo-α-香柠檬醇[
Other Images/Table from this Article
|