|
||
|
Advances in synthetic biology for producing potent pharmaceutical ingredients of traditional Chinese medicine
Synthetic Biology Journal
2024, 5 (3):
631-657.
DOI: 10.12211/2096-8280.2023-082
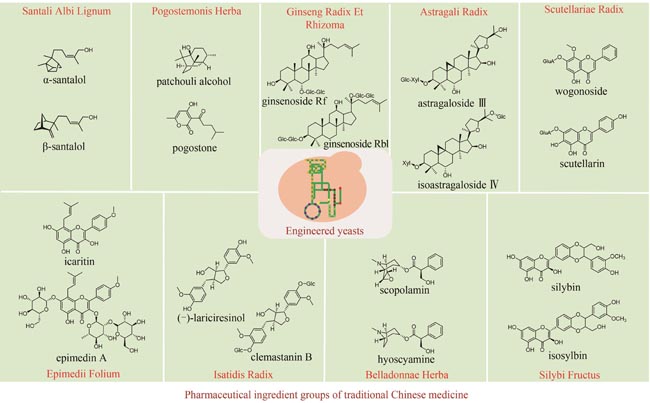
Traditional Chinese medicine (TCM) is a treasure of Chinese civilization and also a good mine for drug development in China. Many TCM components come from rare biological species including plants, animals, and insects, making the preparation of these TCM pharmaceutical substances at large scales a bottleneck that substantially impedes TCM-based drug development. However, the rapid development of synthetic biology has provided a strategy for addressing this challenge. At present, significant progress has been made in the bio-production of individual TCM components, but the efficacy of TCM is mainly due to the synergistic effect of those ingredients, which are termed as pharmaceutical ingredient groups. Reports on constructing the bio-production platform of pharmaceutical ingredient groups are limited. Herein, we summarize research progress in the biogenic mechanism of important TCM pharmaceutical ingredient groups, such as volatile oils, saponins, flavonoids, lignans and alkaloids. Some individual components of pharmaceutical ingredient groups (e.g. ginsenosides) are synthesized by multiple branching pathways, which can be produced and formatted thereafter. On the other hand, some pharmaceutical ingredients such as sandalwood oil can be synthesized through single pathways/enzymatic reactions by engineering the key enzymes to optimize their ratio. We comment the strategy of combining enzyme engineering and metabolic engineering to optimize both the production of pharmaceutical ingredient groups and their ratio. At the end, we outline the prospect of synthetic biology research for producing pharmaceutical ingredient groups, including: (1) complete clarification of the biogenic mechanism of more complex pharmaceutical ingredient groups, (2) development of novel metabolic engineering approaches for breaking through homogenization of methodology, and (3) optimization of the catalytic characteristics of key synthetic enzymes by combining rational design and directed evolution.
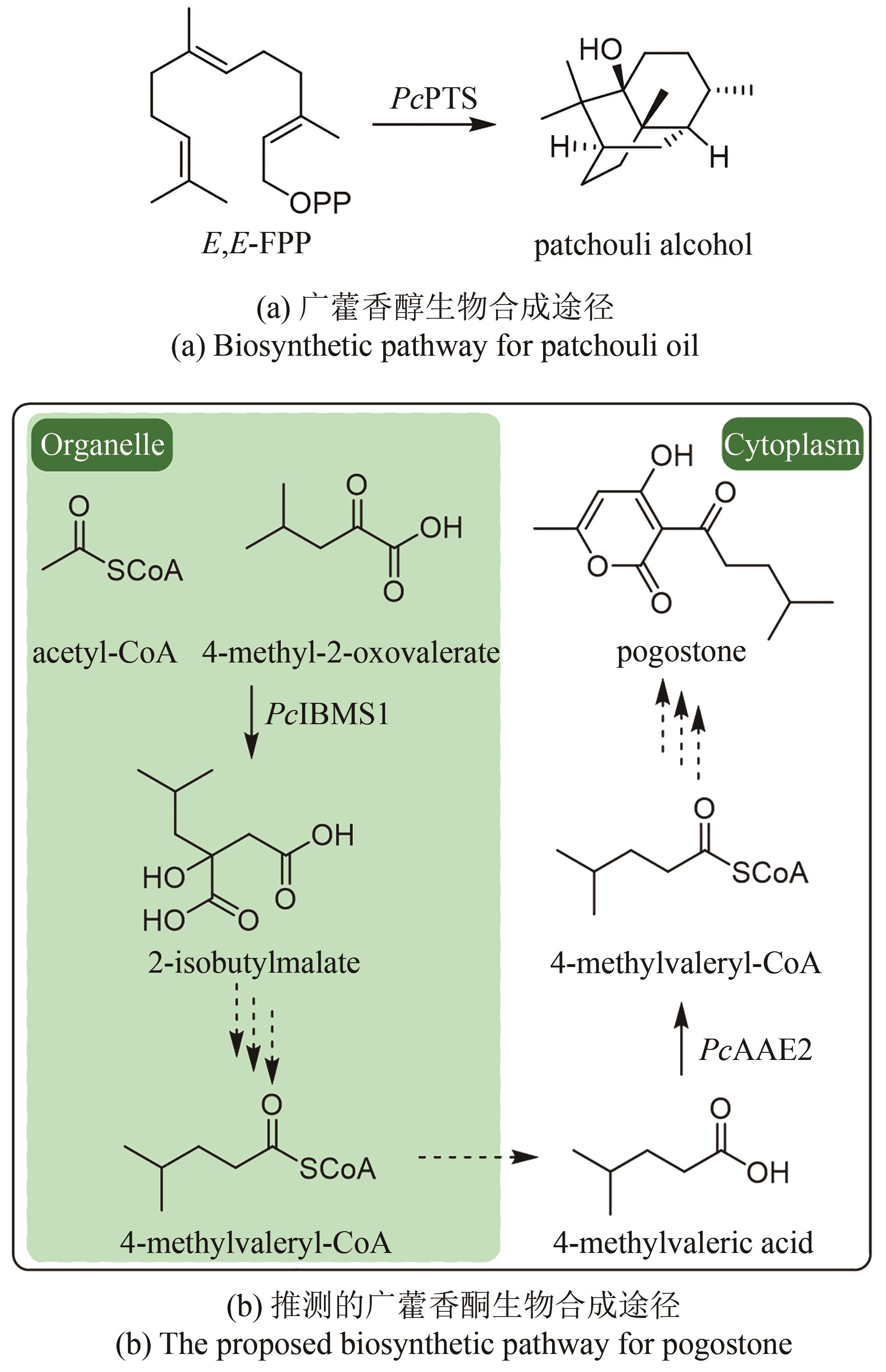
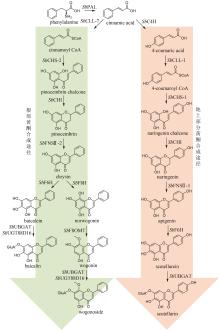
Fig. 2
Biosynthetic pathways for patchouli oils
Extracts from the Article
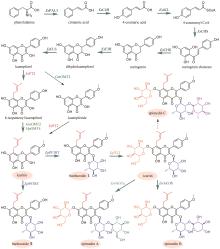
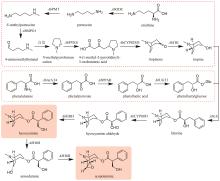
广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效。挥发油是其芳香化湿的物质基础[44],也是多种中成药的重要药效成分,例如藿香正气口服液等。药理研究表明,广藿香挥发油还具有抗菌、抗炎以及抗肿瘤等作用[45],主要含有倍半萜化合物广藿香醇(patchouli alcohol)和聚酮化合物广藿香酮(pogostone)。广藿香醇生物合成机制已被阐明。广藿香醇合酶PcPTS催化E,E-FPP生成主产物广藿香醇以及其他13个微量倍半萜化合物[图2(a)],包括β-广藿香烯、(+)-吉马烯A、E-β-石竹烯、α-愈创木烯、西车烯、α-蛇麻烯、α-广藿香烯以及γ-广藿香烯等[46]。PcPTS的表达受多个转录因子调控。例如,Chen等[47]发现MYB转录因子家族的PatMYB46可与PatJAZ4结合,显著上调PcPTS的表达;Yu等[48]发现SPL家族的SPL10也可上调PcPTS的表达,从而促进广藿香醇的合成。广藿香酮的生物合成途径目前尚未被完全解析。Wang等[49]采用同位素标记法,证实了4-甲基戊酸是广藿香酮生物合成的前体化合物,并发现PcIBMS1酶在线粒体中可催化4-甲基-2-氧戊酸(4-methyl-2-oxovalerate)和乙酰辅酶A发生aldol缩合,生成2-异丁基苹果酸(2-isobutylmalate),2-异丁基苹果酸通过异构化、脱酸以及与辅酶A相连,生成4-甲基戊酰辅酶A,4-甲基戊酰辅酶A被转运至细胞质,同时失去辅酶A,生成4-甲基戊酸[图2(b)][49]。广藿香酮的生物合成具有时空特异性,主要在幼苗期和7周以下植株的主茎和顶叶中生成,并且发现细胞质中的酰基激活酶基因PcAAE2和Ⅲ型聚酮合酶基因PcPKS3的表达模式与广藿香酮的分布模式具有显著相关性[50]。PcAAE2可以把4-甲基戊酸重新转化为4-甲基戊酰辅酶A,PcPKS3可催化4-甲基戊酰辅酶A和异戊酰辅酶A(推测为广藿香酮B的前体)与丙二酸单酰辅酶A发生反应,但产物不是广藿香酮和广藿香酮B[51]。因此,鉴定广藿香酮生物合成途径中的聚酮合酶是完整解析广藿香挥发油生物合成机制的关键所在。
广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[ Patchouli oil ameliorates 5-fluorouracil-induced intestinal mucositis in rats via protecting intestinal barrier and regulating water transport 1 2020 ... 广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[ A comprehensive review on pharmacological activities of pachypodol: a bioactive compound of an aromatic medicinal plant Pogostemon cablin Benth 1 2023 ... 广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[ The diverse sesquiterpene profile of patchouli, Pogostemon cablin, is correlated with a limited number of sesquiterpene synthases 1 2006 ... 广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[ PatDREB transcription factor activates patchoulol synthase gene promoter and positively regulates jasmonate-induced patchoulol biosynthesis 1 2022 ... 广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[ Progressive regulation of sesquiterpene biosynthesis in Arabidopsis and Patchouli (Pogostemon cablin) by the miR156-targeted SPL transcription factors 1 2015 ... 广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[ Synthesis of 4-methylvaleric acid, a precursor of pogostone, involves a 2-isobutylmalate synthase related to 2-isopropylmalate synthase of leucine biosynthesis 2 2022 ... 广藿香(Pogostemonis Herba)为唇形科植物广藿香[Pogostemon cablin (Blanco) Benth.]的干燥地上部分,具有芳香化浊、和中止呕以及发表解暑等功效.挥发油是其芳香化湿的物质基础[
Other Images/Table from this Article
|