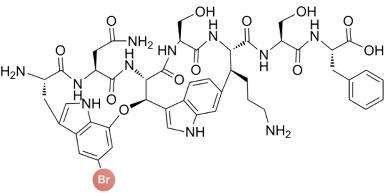
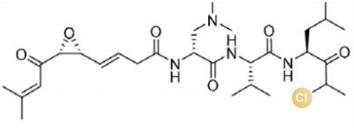
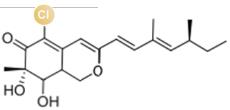
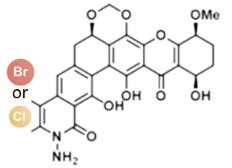
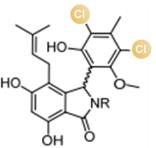
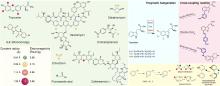
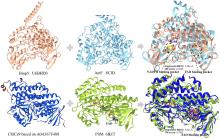
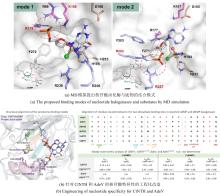
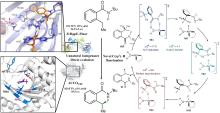
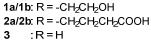... 近期,唐奕课题组从Penicillium oxalicum中鉴定并表征了自由基卤化酶家族中的首个铜依赖型成员ApnU[81].该酶的活性中心采用Cu2?取代传统的Fe2?辅因子,通过独特的金属配位结构和自由基介导机制实现C(sp3)-H的迭代卤化(图12).在结构特征方面,ApnU含有两个HXXHC保守基序,形成一个由四个组氨酸侧链构成的平面位点(尺寸约5.4 ? × 6.1 ?)及两个半胱氨酸组成的铜结合位点,与NHFeHal的活性中心结构呈显著差异.功能研究表明,ApnU严格依赖Cu2?、O?以及抗坏血酸作为辅因子,能够催化天然底物atpenin B(1)在C5′位C(sp3 )-H进行氯化反应,生成单氯(2)、二氯(3)和三氯产物(4),同时通过氢原子抽取机制产生脱氢副产物(5).实验数据显示,ApnU的催化活性受NaCl浓度显著影响:当NaCl浓度为50 mM时氯化效率达到峰值,而在NaCl缺失条件下反应转向脱氢途径,这表明卤素配位在C-H键活化中起关键作用.与NHFeHal相比,ApnU表现出显著抑制羟基回弹副反应的能力,从而提升了卤代选择性,这一机制差异可能与金属中心的氧化还原特性相关.此外,ApnU展现出独特的广谱卤素兼容性,不仅能催化Cl?,还能利用Br?、I?、SCN?及SeCN?对天然底物(包括非天然底物DIF-3)进行C(sp3)-H官能化修饰,生成相应的单卤取代产物.基于软硬酸碱理论,Cu2?活性中心的较软特性使其能够高效结合较软的配体(如硫和碘),这一特性赋予ApnU催化C(sp3)-H碘化、硫氰化和硒氰化的独特能力,突破了NHFeHals仅能催化硬性卤素(Cl?/Br?)的限制,实现了C(sp3)-H的多样化修饰及软性卤素的高效利用.ApnU的发现不仅深化了对卤化酶金属依赖性的理解,更为复杂天然产物及药物中间体的生物合成提供了一种新型工具酶. ...
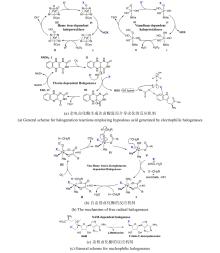
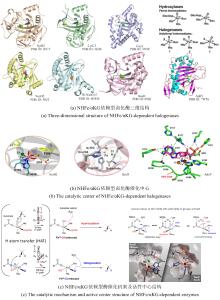
2002年,O’Hagan团队[
82]首次从土壤细菌
Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过S
N2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[
83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[
图13(a)].源自海洋细菌
Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[
图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[
84-
85].早期研究[
86-
87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[
图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(
kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(
kcat=0.16 min-1)和FlASxin(
kcat=0.22 min-1)[
88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[
89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[
90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[
91][
图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[
92]. ...
2002年,O’Hagan团队[
82]首次从土壤细菌
Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过S
N2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[
83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[
图13(a)].源自海洋细菌
Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[
图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[
84-
85].早期研究[
86-
87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[
图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(
kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(
kcat=0.16 min-1)和FlASxin(
kcat=0.22 min-1)[
88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[
89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[
90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[
91][
图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[
92]. ...
蓝光照射光催化蛋白质内部 ...
Biosynthesis of an organofluorine molecule
1
2002
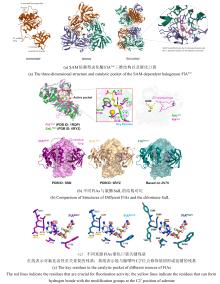
... 2002年,O’Hagan团队[82]首次从土壤细菌 Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过SN2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[图13(a)].源自海洋细菌Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[84-85].早期研究[86-87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(kcat=0.16 min-1)和FlASxin(kcat=0.22 min-1)[88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[91][图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[92]. ...
Crystal structure and mechanism of a bacterial fluorinating enzyme
2
2004
... 2002年,O’Hagan团队[82]首次从土壤细菌 Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过SN2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[图13(a)].源自海洋细菌Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[84-85].早期研究[86-87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(kcat=0.16 min-1)和FlASxin(kcat=0.22 min-1)[88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[91][图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[92]. ...
The red lines indicate the residues that are crucial for fluorination activity; the yellow lines indicate the residues that can form hydrogen bonds with the modification groups at the C2′ position of adenine ...
The fluorinase, the chlorinase and the duf-62 enzymes
1
2008
... 2002年,O’Hagan团队[82]首次从土壤细菌 Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过SN2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[图13(a)].源自海洋细菌Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[84-85].早期研究[86-87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(kcat=0.16 min-1)和FlASxin(kcat=0.22 min-1)[88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[91][图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[92]. ...
Mechanistic considerations of halogenating enzymes
2
2009
... 2002年,O’Hagan团队[82]首次从土壤细菌 Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过SN2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[图13(a)].源自海洋细菌Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[84-85].早期研究[86-87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(kcat=0.16 min-1)和FlASxin(kcat=0.22 min-1)[88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[91][图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[92]. ...
卤化酶则具备高度的专一性和选择性,可在温和条件下定向引入卤素基团,减少副反应,提高产率和纯度,为有机卤化物的合成提供了替代方案.此外,利用合成生物学手段将卤化酶引入酿酒酵母等工程微生物体系[
112],通过下游反应进一步改造修饰卤化中间产物,能够形成结构更为复杂的化合物,已成为分子合成领域新的发展趋势. ...
Enzymatic fluorination and biotechnological developments of the fluorinase
2
2015
... 2002年,O’Hagan团队[82]首次从土壤细菌 Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过SN2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[图13(a)].源自海洋细菌Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[84-85].早期研究[86-87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(kcat=0.16 min-1)和FlASxin(kcat=0.22 min-1)[88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[91][图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[92]. ...
卤化酶则具备高度的专一性和选择性,可在温和条件下定向引入卤素基团,减少副反应,提高产率和纯度,为有机卤化物的合成提供了替代方案.此外,利用合成生物学手段将卤化酶引入酿酒酵母等工程微生物体系[
112],通过下游反应进一步改造修饰卤化中间产物,能够形成结构更为复杂的化合物,已成为分子合成领域新的发展趋势. ...
A nonconventional archaeal fluorinase identified by in silico mining for enhanced fluorine biocatalysis
1
2022
... 2002年,O’Hagan团队[82]首次从土壤细菌 Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过SN2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[图13(a)].源自海洋细菌Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[84-85].早期研究[86-87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(kcat=0.16 min-1)和FlASxin(kcat=0.22 min-1)[88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[91][图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[92]. ...
Enzyme engineering renders chlorinase the activity of fluorinase
2
2024
... 2002年,O’Hagan团队[82]首次从土壤细菌 Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过SN2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[图13(a)].源自海洋细菌Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[84-85].早期研究[86-87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(kcat=0.16 min-1)和FlASxin(kcat=0.22 min-1)[88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[91][图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[92]. ...
The red lines indicate the residues that are crucial for fluorination activity; the yellow lines indicate the residues that can form hydrogen bonds with the modification groups at the C2′ position of adenine ...
Advances in enzymatic incorporation of small fluorine modules
2
2024
... 2002年,O’Hagan团队[82]首次从土壤细菌 Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过SN2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[图13(a)].源自海洋细菌Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[84-85].早期研究[86-87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(kcat=0.16 min-1)和FlASxin(kcat=0.22 min-1)[88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[91][图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[92]. ...
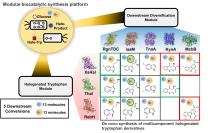
氨基吡咯菌素(APRN)是一种天然卤代苯基吡咯衍生物(HPD),具有很强的抗真菌和抗寄生虫活性,应用前景广阔.Putri等[
114]在谷氨酸棒状杆菌中构建了多酶级联催化体系,其中卤化酶RebH和PrnC分别选择性催化色氨酸C7位和吡咯环C3位的氯化,从而以葡萄糖为底物从头合成APRN,摇瓶发酵产量可达29.5 mg/L.通过计算建模和位点突变分析,Peh等[
115]鉴定出吡咯环卤化酶PrnC催化口袋中的三个位关键残基.单粒子冷冻电镜分析表明,PrnC在溶液中以二聚体形式存在.除了天然底物以外,PrnC能够选择性卤化结构多样的吡咯类杂环化合物,还可用于杀真菌剂氟咯菌腈的结构类似物的化学-酶促合成.7-氯-4-二甲基烯丙基-L-色氨酸(7-Cl-4-Pren-Trp)片段是克里诺霉素Krisynomycin的关键组分,对其抗菌活性至关重要.Mowzoon-Mogharrabi等[
116]报道了一种色氨酸先经C4异戊烯基化再被卤化酶催化C7氯化合成7-Cl-4-Pren-Trp的合成顺序,为克里诺霉素等大环酯肽类物质的生物合成机制提供了重要线索.单萜类吲哚生物碱(MIA)是由大型植物产生的一类天然产物,具有治疗包括癌症、疟疾和高血压等适应症的潜力.卤化MIAs显示出更好的药物性能.然而,新型卤化MIAs的合成仍然是一个挑战.Bradley等[
117]构建了一个在酿酒酵母中从头合成两种MIAs(蛇纹石素,serpentine;鸭脚木碱,alstonine)的平台,并利用该平台系统地探索重构MIAs途径生产卤化MIAs的生物催化潜力.通过工艺优化和卤化酶的异源表达,实现了从头合成氯化鸭脚木碱.随后,该团队评估了8种色氨酸卤化酶在酿酒酵母中的表达情况,并与生物合成途径共表达从而实现7-氯萝芙素从头合成. ...
Fermentative aminopyrrolnitrin production by metabolically engineered Corynebacterium glutamicum
1
2024
... 氨基吡咯菌素(APRN)是一种天然卤代苯基吡咯衍生物(HPD),具有很强的抗真菌和抗寄生虫活性,应用前景广阔.Putri等[114]在谷氨酸棒状杆菌中构建了多酶级联催化体系,其中卤化酶RebH和PrnC分别选择性催化色氨酸C7位和吡咯环C3位的氯化,从而以葡萄糖为底物从头合成APRN,摇瓶发酵产量可达29.5 mg/L.通过计算建模和位点突变分析,Peh等[115]鉴定出吡咯环卤化酶PrnC催化口袋中的三个位关键残基.单粒子冷冻电镜分析表明,PrnC在溶液中以二聚体形式存在.除了天然底物以外,PrnC能够选择性卤化结构多样的吡咯类杂环化合物,还可用于杀真菌剂氟咯菌腈的结构类似物的化学-酶促合成.7-氯-4-二甲基烯丙基-L-色氨酸(7-Cl-4-Pren-Trp)片段是克里诺霉素Krisynomycin的关键组分,对其抗菌活性至关重要.Mowzoon-Mogharrabi等[116]报道了一种色氨酸先经C4异戊烯基化再被卤化酶催化C7氯化合成7-Cl-4-Pren-Trp的合成顺序,为克里诺霉素等大环酯肽类物质的生物合成机制提供了重要线索.单萜类吲哚生物碱(MIA)是由大型植物产生的一类天然产物,具有治疗包括癌症、疟疾和高血压等适应症的潜力.卤化MIAs显示出更好的药物性能.然而,新型卤化MIAs的合成仍然是一个挑战.Bradley等[117]构建了一个在酿酒酵母中从头合成两种MIAs(蛇纹石素,serpentine;鸭脚木碱,alstonine)的平台,并利用该平台系统地探索重构MIAs途径生产卤化MIAs的生物催化潜力.通过工艺优化和卤化酶的异源表达,实现了从头合成氯化鸭脚木碱.随后,该团队评估了8种色氨酸卤化酶在酿酒酵母中的表达情况,并与生物合成途径共表达从而实现7-氯萝芙素从头合成. ...
Site-selective chlorination of pyrrolic heterocycles by flavin dependent enzyme PrnC
1
2024
... 氨基吡咯菌素(APRN)是一种天然卤代苯基吡咯衍生物(HPD),具有很强的抗真菌和抗寄生虫活性,应用前景广阔.Putri等[114]在谷氨酸棒状杆菌中构建了多酶级联催化体系,其中卤化酶RebH和PrnC分别选择性催化色氨酸C7位和吡咯环C3位的氯化,从而以葡萄糖为底物从头合成APRN,摇瓶发酵产量可达29.5 mg/L.通过计算建模和位点突变分析,Peh等[115]鉴定出吡咯环卤化酶PrnC催化口袋中的三个位关键残基.单粒子冷冻电镜分析表明,PrnC在溶液中以二聚体形式存在.除了天然底物以外,PrnC能够选择性卤化结构多样的吡咯类杂环化合物,还可用于杀真菌剂氟咯菌腈的结构类似物的化学-酶促合成.7-氯-4-二甲基烯丙基-L-色氨酸(7-Cl-4-Pren-Trp)片段是克里诺霉素Krisynomycin的关键组分,对其抗菌活性至关重要.Mowzoon-Mogharrabi等[116]报道了一种色氨酸先经C4异戊烯基化再被卤化酶催化C7氯化合成7-Cl-4-Pren-Trp的合成顺序,为克里诺霉素等大环酯肽类物质的生物合成机制提供了重要线索.单萜类吲哚生物碱(MIA)是由大型植物产生的一类天然产物,具有治疗包括癌症、疟疾和高血压等适应症的潜力.卤化MIAs显示出更好的药物性能.然而,新型卤化MIAs的合成仍然是一个挑战.Bradley等[117]构建了一个在酿酒酵母中从头合成两种MIAs(蛇纹石素,serpentine;鸭脚木碱,alstonine)的平台,并利用该平台系统地探索重构MIAs途径生产卤化MIAs的生物催化潜力.通过工艺优化和卤化酶的异源表达,实现了从头合成氯化鸭脚木碱.随后,该团队评估了8种色氨酸卤化酶在酿酒酵母中的表达情况,并与生物合成途径共表达从而实现7-氯萝芙素从头合成. ...
Chemoenzymatic synthesis of 7-chloro-4-dimethylallyl-L-tryptophan, a fragment of Krisynomycin
1
2024
... 氨基吡咯菌素(APRN)是一种天然卤代苯基吡咯衍生物(HPD),具有很强的抗真菌和抗寄生虫活性,应用前景广阔.Putri等[114]在谷氨酸棒状杆菌中构建了多酶级联催化体系,其中卤化酶RebH和PrnC分别选择性催化色氨酸C7位和吡咯环C3位的氯化,从而以葡萄糖为底物从头合成APRN,摇瓶发酵产量可达29.5 mg/L.通过计算建模和位点突变分析,Peh等[115]鉴定出吡咯环卤化酶PrnC催化口袋中的三个位关键残基.单粒子冷冻电镜分析表明,PrnC在溶液中以二聚体形式存在.除了天然底物以外,PrnC能够选择性卤化结构多样的吡咯类杂环化合物,还可用于杀真菌剂氟咯菌腈的结构类似物的化学-酶促合成.7-氯-4-二甲基烯丙基-L-色氨酸(7-Cl-4-Pren-Trp)片段是克里诺霉素Krisynomycin的关键组分,对其抗菌活性至关重要.Mowzoon-Mogharrabi等[116]报道了一种色氨酸先经C4异戊烯基化再被卤化酶催化C7氯化合成7-Cl-4-Pren-Trp的合成顺序,为克里诺霉素等大环酯肽类物质的生物合成机制提供了重要线索.单萜类吲哚生物碱(MIA)是由大型植物产生的一类天然产物,具有治疗包括癌症、疟疾和高血压等适应症的潜力.卤化MIAs显示出更好的药物性能.然而,新型卤化MIAs的合成仍然是一个挑战.Bradley等[117]构建了一个在酿酒酵母中从头合成两种MIAs(蛇纹石素,serpentine;鸭脚木碱,alstonine)的平台,并利用该平台系统地探索重构MIAs途径生产卤化MIAs的生物催化潜力.通过工艺优化和卤化酶的异源表达,实现了从头合成氯化鸭脚木碱.随后,该团队评估了8种色氨酸卤化酶在酿酒酵母中的表达情况,并与生物合成途径共表达从而实现7-氯萝芙素从头合成. ...
Biosynthesis of natural and halogenated plant monoterpene indole alkaloids in yeast
1
2023
... 氨基吡咯菌素(APRN)是一种天然卤代苯基吡咯衍生物(HPD),具有很强的抗真菌和抗寄生虫活性,应用前景广阔.Putri等[114]在谷氨酸棒状杆菌中构建了多酶级联催化体系,其中卤化酶RebH和PrnC分别选择性催化色氨酸C7位和吡咯环C3位的氯化,从而以葡萄糖为底物从头合成APRN,摇瓶发酵产量可达29.5 mg/L.通过计算建模和位点突变分析,Peh等[115]鉴定出吡咯环卤化酶PrnC催化口袋中的三个位关键残基.单粒子冷冻电镜分析表明,PrnC在溶液中以二聚体形式存在.除了天然底物以外,PrnC能够选择性卤化结构多样的吡咯类杂环化合物,还可用于杀真菌剂氟咯菌腈的结构类似物的化学-酶促合成.7-氯-4-二甲基烯丙基-L-色氨酸(7-Cl-4-Pren-Trp)片段是克里诺霉素Krisynomycin的关键组分,对其抗菌活性至关重要.Mowzoon-Mogharrabi等[116]报道了一种色氨酸先经C4异戊烯基化再被卤化酶催化C7氯化合成7-Cl-4-Pren-Trp的合成顺序,为克里诺霉素等大环酯肽类物质的生物合成机制提供了重要线索.单萜类吲哚生物碱(MIA)是由大型植物产生的一类天然产物,具有治疗包括癌症、疟疾和高血压等适应症的潜力.卤化MIAs显示出更好的药物性能.然而,新型卤化MIAs的合成仍然是一个挑战.Bradley等[117]构建了一个在酿酒酵母中从头合成两种MIAs(蛇纹石素,serpentine;鸭脚木碱,alstonine)的平台,并利用该平台系统地探索重构MIAs途径生产卤化MIAs的生物催化潜力.通过工艺优化和卤化酶的异源表达,实现了从头合成氯化鸭脚木碱.随后,该团队评估了8种色氨酸卤化酶在酿酒酵母中的表达情况,并与生物合成途径共表达从而实现7-氯萝芙素从头合成. ...
Production of Tyrian purple indigoid dye from tryptophan in Escherichia coli
1
2021
... 靛蓝(Indigo)是一种天然染料,广泛用于食品、医药和印染工业.通过在靛蓝吲哚环的不同位置添加卤素,可以生成多种有色卤化靛蓝衍生物.其中,提尔紫(Tyrian purple,主要由6,6’-Dibromoindigo组成),又称帝王紫,是一种从海螺中提取的古老染料,近期被发现具有生物相容性半导体特性,商业价值可观.然而,由于其生物合成途径不明和区域选择性溴化困难,规模化生产受到限制.为此,Lee等[118]设计了一种多酶级联催化系统,利用色氨酸6-卤化酶SttH、色氨酸酶TnaA和黄素单加氧酶MaFMO在大肠杆菌中生产提尔紫.他们通过优化三种酶的催化过程,建立了连续的双细胞反应系统,将色氨酸的溴化与吲哚生成步骤分开,成功获得315.0 mg/L的提尔紫,色氨酸转化率为60%.尽管如此,当前的生产方法存在体系复杂、耗时长、成本高等问题,规模化生产仍面临巨大挑战.最近,罗小舟研究团队[119]提出了一种简化的一锅法工艺,利用λpL/pR-cI857热诱导体系分时控制色氨酸优先溴化而非脱羧形成吲哚,从而减少靛蓝副产物的生成.最终,通过优化发酵工艺获得44.5 mg/L提尔紫,转化率达42%.此外,Yi等[120]通过序列比对从Pseudoalteromonas nigrifaciens中鉴定出一种新型色氨酸6-卤化酶,与SttH的序列匹配度达87%,命名为SttH-nig02.随后将SttH-nig02转入大肠杆菌并建立全细胞催化系统生产卤化靛蓝,最高转化率达32%.新型卤化酶的挖掘与应用有望进一步释放酶促合成卤化靛蓝类染料的潜力. ...
One-pot selective biosynthesis of Tyrian purple in Escherichia coli
1
2024
... 靛蓝(Indigo)是一种天然染料,广泛用于食品、医药和印染工业.通过在靛蓝吲哚环的不同位置添加卤素,可以生成多种有色卤化靛蓝衍生物.其中,提尔紫(Tyrian purple,主要由6,6’-Dibromoindigo组成),又称帝王紫,是一种从海螺中提取的古老染料,近期被发现具有生物相容性半导体特性,商业价值可观.然而,由于其生物合成途径不明和区域选择性溴化困难,规模化生产受到限制.为此,Lee等[118]设计了一种多酶级联催化系统,利用色氨酸6-卤化酶SttH、色氨酸酶TnaA和黄素单加氧酶MaFMO在大肠杆菌中生产提尔紫.他们通过优化三种酶的催化过程,建立了连续的双细胞反应系统,将色氨酸的溴化与吲哚生成步骤分开,成功获得315.0 mg/L的提尔紫,色氨酸转化率为60%.尽管如此,当前的生产方法存在体系复杂、耗时长、成本高等问题,规模化生产仍面临巨大挑战.最近,罗小舟研究团队[119]提出了一种简化的一锅法工艺,利用λpL/pR-cI857热诱导体系分时控制色氨酸优先溴化而非脱羧形成吲哚,从而减少靛蓝副产物的生成.最终,通过优化发酵工艺获得44.5 mg/L提尔紫,转化率达42%.此外,Yi等[120]通过序列比对从Pseudoalteromonas nigrifaciens中鉴定出一种新型色氨酸6-卤化酶,与SttH的序列匹配度达87%,命名为SttH-nig02.随后将SttH-nig02转入大肠杆菌并建立全细胞催化系统生产卤化靛蓝,最高转化率达32%.新型卤化酶的挖掘与应用有望进一步释放酶促合成卤化靛蓝类染料的潜力. ...
Production of halogenated indigo by Escherichia coli whole-cell conversion system with novel halogenase derived from Pseudoalteromonas nigrifaciens
1
2024
... 靛蓝(Indigo)是一种天然染料,广泛用于食品、医药和印染工业.通过在靛蓝吲哚环的不同位置添加卤素,可以生成多种有色卤化靛蓝衍生物.其中,提尔紫(Tyrian purple,主要由6,6’-Dibromoindigo组成),又称帝王紫,是一种从海螺中提取的古老染料,近期被发现具有生物相容性半导体特性,商业价值可观.然而,由于其生物合成途径不明和区域选择性溴化困难,规模化生产受到限制.为此,Lee等[118]设计了一种多酶级联催化系统,利用色氨酸6-卤化酶SttH、色氨酸酶TnaA和黄素单加氧酶MaFMO在大肠杆菌中生产提尔紫.他们通过优化三种酶的催化过程,建立了连续的双细胞反应系统,将色氨酸的溴化与吲哚生成步骤分开,成功获得315.0 mg/L的提尔紫,色氨酸转化率为60%.尽管如此,当前的生产方法存在体系复杂、耗时长、成本高等问题,规模化生产仍面临巨大挑战.最近,罗小舟研究团队[119]提出了一种简化的一锅法工艺,利用λpL/pR-cI857热诱导体系分时控制色氨酸优先溴化而非脱羧形成吲哚,从而减少靛蓝副产物的生成.最终,通过优化发酵工艺获得44.5 mg/L提尔紫,转化率达42%.此外,Yi等[120]通过序列比对从Pseudoalteromonas nigrifaciens中鉴定出一种新型色氨酸6-卤化酶,与SttH的序列匹配度达87%,命名为SttH-nig02.随后将SttH-nig02转入大肠杆菌并建立全细胞催化系统生产卤化靛蓝,最高转化率达32%.新型卤化酶的挖掘与应用有望进一步释放酶促合成卤化靛蓝类染料的潜力. ...
Enzymatic peptide and protein bromination: the BromoTrp tag
1
2024
... 生物正交反应为蛋白修饰提供了灵活且高效的工具,可有效改变蛋白质的功能和性质,并拓展其在生物、化学、医学和材料科学中的应用.卤化酶能够特异性地将卤素原子引入蛋白质,实现精准标记,为后续的改造和修饰提供了明确的靶点.Montua等[121]采用半理性蛋白工程方法获得了色氨酸卤化酶突变体Thal-E461A-N54A-Y454C,能够高效地溴化C端含有色氨酸残基的肽段,其中四肽YNIW的溴化效率最高,将其命名为BromoTrp标签.利用大肠杆菌共表达溴化酶和连接BromoTrp的目标蛋白,通过优化培养和纯化步骤即可实现制备规模的蛋白翻译后溴化.随后,溴标记蛋白在37°C条件下耦联钯纳米颗粒催化的Suzuki-Miyaura反应转变为苯环标记蛋白.该研究证实酶促卤化与过渡金属催化交叉偶联的结合为蛋白修饰提供了一种可行的方法.Guo等[122]利用卤化酶异源表达和遗传密码扩展技术成功开发了一种完全自主的大肠杆菌菌株.该菌株能够高效且准确地对色氨酸进行氯化和溴化,并将卤化色氨酸整合到目标蛋白中.该研究为合成多种卤化色氨酸的工程蛋白提供了通用平台,扩展了蛋白修饰所用生物正交反应的选择范围.Saha等[123]利用核糖体翻译后修饰卤化酶SrpI与Sonogashira反应偶联,在体外实现了肽链的区域选择性溴化标记转化为末端炔标记.该结果表明全新的化学手柄被引入到核糖体肽,包括但不限于末端炔,还可以通过炔叠氮点击化学进一步多样化.肽链中色氨酸特定位置的体外溴化过程无需基因密码的扩展和肽链上其他反应手柄的钝化,凸显了卤化酶在蛋白修饰化学中的便捷性和适用性. ...
Biosynthesis of halogenated tryptophans for protein engineering using genetic code expansion
1
2024
... 生物正交反应为蛋白修饰提供了灵活且高效的工具,可有效改变蛋白质的功能和性质,并拓展其在生物、化学、医学和材料科学中的应用.卤化酶能够特异性地将卤素原子引入蛋白质,实现精准标记,为后续的改造和修饰提供了明确的靶点.Montua等[121]采用半理性蛋白工程方法获得了色氨酸卤化酶突变体Thal-E461A-N54A-Y454C,能够高效地溴化C端含有色氨酸残基的肽段,其中四肽YNIW的溴化效率最高,将其命名为BromoTrp标签.利用大肠杆菌共表达溴化酶和连接BromoTrp的目标蛋白,通过优化培养和纯化步骤即可实现制备规模的蛋白翻译后溴化.随后,溴标记蛋白在37°C条件下耦联钯纳米颗粒催化的Suzuki-Miyaura反应转变为苯环标记蛋白.该研究证实酶促卤化与过渡金属催化交叉偶联的结合为蛋白修饰提供了一种可行的方法.Guo等[122]利用卤化酶异源表达和遗传密码扩展技术成功开发了一种完全自主的大肠杆菌菌株.该菌株能够高效且准确地对色氨酸进行氯化和溴化,并将卤化色氨酸整合到目标蛋白中.该研究为合成多种卤化色氨酸的工程蛋白提供了通用平台,扩展了蛋白修饰所用生物正交反应的选择范围.Saha等[123]利用核糖体翻译后修饰卤化酶SrpI与Sonogashira反应偶联,在体外实现了肽链的区域选择性溴化标记转化为末端炔标记.该结果表明全新的化学手柄被引入到核糖体肽,包括但不限于末端炔,还可以通过炔叠氮点击化学进一步多样化.肽链中色氨酸特定位置的体外溴化过程无需基因密码的扩展和肽链上其他反应手柄的钝化,凸显了卤化酶在蛋白修饰化学中的便捷性和适用性. ...
Halogenase-assisted alkyne/aryl bromide Sonogashira coupling for ribosomally synthesized peptides
1
2024
... 生物正交反应为蛋白修饰提供了灵活且高效的工具,可有效改变蛋白质的功能和性质,并拓展其在生物、化学、医学和材料科学中的应用.卤化酶能够特异性地将卤素原子引入蛋白质,实现精准标记,为后续的改造和修饰提供了明确的靶点.Montua等[121]采用半理性蛋白工程方法获得了色氨酸卤化酶突变体Thal-E461A-N54A-Y454C,能够高效地溴化C端含有色氨酸残基的肽段,其中四肽YNIW的溴化效率最高,将其命名为BromoTrp标签.利用大肠杆菌共表达溴化酶和连接BromoTrp的目标蛋白,通过优化培养和纯化步骤即可实现制备规模的蛋白翻译后溴化.随后,溴标记蛋白在37°C条件下耦联钯纳米颗粒催化的Suzuki-Miyaura反应转变为苯环标记蛋白.该研究证实酶促卤化与过渡金属催化交叉偶联的结合为蛋白修饰提供了一种可行的方法.Guo等[122]利用卤化酶异源表达和遗传密码扩展技术成功开发了一种完全自主的大肠杆菌菌株.该菌株能够高效且准确地对色氨酸进行氯化和溴化,并将卤化色氨酸整合到目标蛋白中.该研究为合成多种卤化色氨酸的工程蛋白提供了通用平台,扩展了蛋白修饰所用生物正交反应的选择范围.Saha等[123]利用核糖体翻译后修饰卤化酶SrpI与Sonogashira反应偶联,在体外实现了肽链的区域选择性溴化标记转化为末端炔标记.该结果表明全新的化学手柄被引入到核糖体肽,包括但不限于末端炔,还可以通过炔叠氮点击化学进一步多样化.肽链中色氨酸特定位置的体外溴化过程无需基因密码的扩展和肽链上其他反应手柄的钝化,凸显了卤化酶在蛋白修饰化学中的便捷性和适用性. ...
Directed evolution of RebH for site-selective halogenation of large biologically active molecules
1
2015
... Lewis课题组一直致力于FDHs的定向进化及其在合成应用方面的研究.在过去的几年里,该研究小组针对RebH卤化酶构建了一系列突变体[124],并确定改造后的RebH可以催化包括去对称化反应、阻转选择性卤化和卤代环化反应在内的对映选择性反应(表4),其多样化的卤化产物为后续复杂分子的有机合成提供了丰富的骨架结构[125-127].最近研究了单组分黄素依赖的卤化酶AetF的催化性能[128].该酶不仅能选择性地对多种芳香族底物进行位点选择性的溴化和碘化,还能实现含有侧链羧酸或醇取代基的苯乙烯的对映选择性溴内酯化和碘醚化[129].进一步研究表明,AetF能够催化多种1,1-二取代苯乙烯的卤化,通常具有较高的立体选择性[130].此外,AetF还能卤化末端炔烃,尽管其催化效率低于JamD和MCE9[131].通过突变体活性测试和氘同位素效应分析,研究支持了AetF通过共价催化机制实现炔烃卤化的假说.这些发现显著拓展了FDH催化的适用范围,并揭示了AetF在生物催化中的独特功能. ...
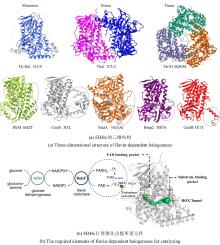
Flavin-dependent halogenases catalyze enantioselective olefin halocyclization
3
2021
... Lewis课题组一直致力于FDHs的定向进化及其在合成应用方面的研究.在过去的几年里,该研究小组针对RebH卤化酶构建了一系列突变体[124],并确定改造后的RebH可以催化包括去对称化反应、阻转选择性卤化和卤代环化反应在内的对映选择性反应(表4),其多样化的卤化产物为后续复杂分子的有机合成提供了丰富的骨架结构[125-127].最近研究了单组分黄素依赖的卤化酶AetF的催化性能[128].该酶不仅能选择性地对多种芳香族底物进行位点选择性的溴化和碘化,还能实现含有侧链羧酸或醇取代基的苯乙烯的对映选择性溴内酯化和碘醚化[129].进一步研究表明,AetF能够催化多种1,1-二取代苯乙烯的卤化,通常具有较高的立体选择性[130].此外,AetF还能卤化末端炔烃,尽管其催化效率低于JamD和MCE9[131].通过突变体活性测试和氘同位素效应分析,研究支持了AetF通过共价催化机制实现炔烃卤化的假说.这些发现显著拓展了FDH催化的适用范围,并揭示了AetF在生物催化中的独特功能. ...
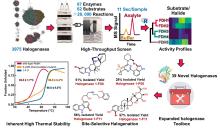
当前,卤化酶研究领域已取得许多显著进展(
图17),包括酶库容量的不断增长,催化性能的持续改善,反应机制的逐步揭示以及应用范围的大幅扩展,在药物合成、染料制备及有机化工等领域展现出独特潜力. ...
The single-component flavin reductase/flavin-dependent halogenase AetF is a versatile catalyst for selective bromination and iodination of arenes and olefins
1
2022
... Lewis课题组一直致力于FDHs的定向进化及其在合成应用方面的研究.在过去的几年里,该研究小组针对RebH卤化酶构建了一系列突变体[124],并确定改造后的RebH可以催化包括去对称化反应、阻转选择性卤化和卤代环化反应在内的对映选择性反应(表4),其多样化的卤化产物为后续复杂分子的有机合成提供了丰富的骨架结构[125-127].最近研究了单组分黄素依赖的卤化酶AetF的催化性能[128].该酶不仅能选择性地对多种芳香族底物进行位点选择性的溴化和碘化,还能实现含有侧链羧酸或醇取代基的苯乙烯的对映选择性溴内酯化和碘醚化[129].进一步研究表明,AetF能够催化多种1,1-二取代苯乙烯的卤化,通常具有较高的立体选择性[130].此外,AetF还能卤化末端炔烃,尽管其催化效率低于JamD和MCE9[131].通过突变体活性测试和氘同位素效应分析,研究支持了AetF通过共价催化机制实现炔烃卤化的假说.这些发现显著拓展了FDH催化的适用范围,并揭示了AetF在生物催化中的独特功能. ...
Expanding the reactivity of flavin-dependent halogenases toward olefins via enantioselective intramolecular haloetherification and chemoenzymatic oxidative rearrangements
1
2022
... Lewis课题组一直致力于FDHs的定向进化及其在合成应用方面的研究.在过去的几年里,该研究小组针对RebH卤化酶构建了一系列突变体[124],并确定改造后的RebH可以催化包括去对称化反应、阻转选择性卤化和卤代环化反应在内的对映选择性反应(表4),其多样化的卤化产物为后续复杂分子的有机合成提供了丰富的骨架结构[125-127].最近研究了单组分黄素依赖的卤化酶AetF的催化性能[128].该酶不仅能选择性地对多种芳香族底物进行位点选择性的溴化和碘化,还能实现含有侧链羧酸或醇取代基的苯乙烯的对映选择性溴内酯化和碘醚化[129].进一步研究表明,AetF能够催化多种1,1-二取代苯乙烯的卤化,通常具有较高的立体选择性[130].此外,AetF还能卤化末端炔烃,尽管其催化效率低于JamD和MCE9[131].通过突变体活性测试和氘同位素效应分析,研究支持了AetF通过共价催化机制实现炔烃卤化的假说.这些发现显著拓展了FDH催化的适用范围,并揭示了AetF在生物催化中的独特功能. ...
Selective C-H halogenation of alkenes and alkynes using flavin-dependent halogenases
1
2024
... Lewis课题组一直致力于FDHs的定向进化及其在合成应用方面的研究.在过去的几年里,该研究小组针对RebH卤化酶构建了一系列突变体[124],并确定改造后的RebH可以催化包括去对称化反应、阻转选择性卤化和卤代环化反应在内的对映选择性反应(表4),其多样化的卤化产物为后续复杂分子的有机合成提供了丰富的骨架结构[125-127].最近研究了单组分黄素依赖的卤化酶AetF的催化性能[128].该酶不仅能选择性地对多种芳香族底物进行位点选择性的溴化和碘化,还能实现含有侧链羧酸或醇取代基的苯乙烯的对映选择性溴内酯化和碘醚化[129].进一步研究表明,AetF能够催化多种1,1-二取代苯乙烯的卤化,通常具有较高的立体选择性[130].此外,AetF还能卤化末端炔烃,尽管其催化效率低于JamD和MCE9[131].通过突变体活性测试和氘同位素效应分析,研究支持了AetF通过共价催化机制实现炔烃卤化的假说.这些发现显著拓展了FDH催化的适用范围,并揭示了AetF在生物催化中的独特功能. ...
Enzymatic halogenation of terminal alkynes
1
2023
... Lewis课题组一直致力于FDHs的定向进化及其在合成应用方面的研究.在过去的几年里,该研究小组针对RebH卤化酶构建了一系列突变体[124],并确定改造后的RebH可以催化包括去对称化反应、阻转选择性卤化和卤代环化反应在内的对映选择性反应(表4),其多样化的卤化产物为后续复杂分子的有机合成提供了丰富的骨架结构[125-127].最近研究了单组分黄素依赖的卤化酶AetF的催化性能[128].该酶不仅能选择性地对多种芳香族底物进行位点选择性的溴化和碘化,还能实现含有侧链羧酸或醇取代基的苯乙烯的对映选择性溴内酯化和碘醚化[129].进一步研究表明,AetF能够催化多种1,1-二取代苯乙烯的卤化,通常具有较高的立体选择性[130].此外,AetF还能卤化末端炔烃,尽管其催化效率低于JamD和MCE9[131].通过突变体活性测试和氘同位素效应分析,研究支持了AetF通过共价催化机制实现炔烃卤化的假说.这些发现显著拓展了FDH催化的适用范围,并揭示了AetF在生物催化中的独特功能. ...
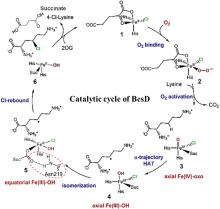
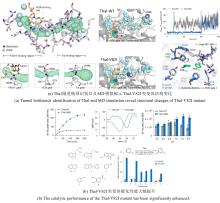
Controllable multi-halogenation of a non-native substrate by SyrB2 iron halogenase
1
2024
... 多卤化官能团在天然产物和药物中具有广泛存在,但选择性多卤化非活化C-H键仍面临挑战.NHFe/αKGHs为解决这一问题提供了新思路.Wilson等[132]利用SyrB2酶催化非天然底物α-氨基丁酸(Aba)的卤化,成功合成了单氯、二氯和三氯产物.特别值得注意的是,三氯产物的产量达到前所未有的数量级.这项研究还证实了SyrB2在多溴化反应中的应用潜力,并揭示了底物C-C键在催化位点的转动自由度对控制卤化程度的关键作用.这些结果表明,NHFe/αKGHs在多位点C-H功能化方面具有重要应用前景. ...
Unspecific Peroxygenase (UPO) can be Tuned for Oxygenation or Halogenation Activity by Controlling the Reaction pH
1
2024
... 非特异性过氧酶(UPOs)因其高稳定性和高活性,已成为选择性氧化反应领域的重要工具.与之结构相似的氯过氧化物酶(CPO)提示了UPOs可能具有卤化功能.Barber等[133]研究证明,通过调节pH值可控制UPO的卤化或氧化选择性.在pH 3.0和6.0条件下,分别实现了芳香化合物(如百里香酚)的溴化和氧化.该系统在100 mg制备规模下实现了60-72%的溴化产物收率.在4-乙基苯甲醚的溴化-氧合级联反应中,通过中途调节pH值(从3.0调整至6.0),成功合成了溴化-氧合产物1-(3-溴-4-甲氧基苯基)乙醇和3-溴-4-甲氧基苯乙酮,总转化率达到82%. ...
A collaborative journey towards the late-stage functionalization of added-value chemicals using engineered halogenases
1
2023
... 制药企业在工业生物催化技术发展中表现出强烈的前瞻性.早在2017年,诺华公司(Novartis AG)和先正达公司(Syngenta AG)便与苏黎世应用科学大学生物催化能力中心(CCBIO)展开合作,共同探索卤化酶工程改造在农业化学品及药物分子骨架卤化中的应用潜力[134].近年来,酶促卤化技术的研发已成为化工、印染、农化等各个领域的关键技术需求.通过持续的基础研究积累,卤化酶技术取得了显著进展,部分研究成果展现出良好的工业化应用前景,相关技术的具体应用案例及关键数据分析如表5所示. ...
Fermentative production of halogenated tryptophan derivatives with Corynebacterium glutamicum overexpressing tryptophanase or decarboxylase genes
1
2022
... Recent cases and key data related to the potential industrial application of halogenases
Other Images/Table from this Article