Fig. 14
Tunnel engineering improves the catalytic performance of Thal halogenase[96]
Extracts from the Article
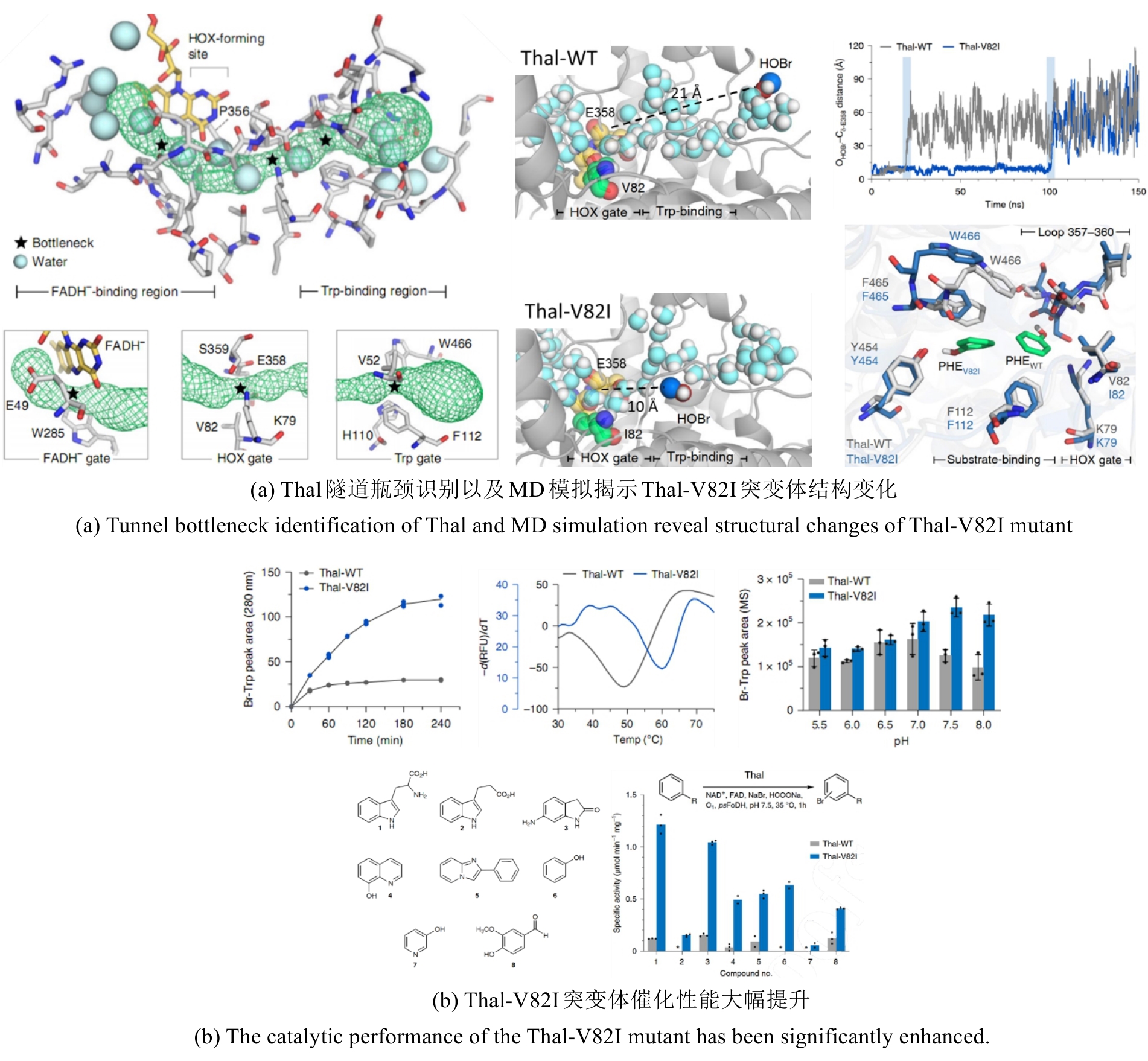
蛋白分子内的隧道是小分子、水分子和离子的潜在运输途径,在多种蛋白质执行功能过程中起着重要作用[94]。最近,有报道提到FDHs内部10?的隧道区域是以往被忽略的重要功能区,其氨基酸组成影响HOX的转运效率,可能是FDHs活力低下的又一重要原因[95]。Prakinee团队近期针对Thal蛋白的催化开展系统性研究[96]。通过定向改造Thal蛋白内部10 ?隧道区域瓶颈处的关键氨基酸[图14(a)],获得突变体V82I,其催化活性(kcat/KM比值45℃下提升4倍)与热稳定性(Tm 升高12 ℃)均显著提升[图14(b)]。MD模拟揭示突变引入的疏水相互作用引发双重效应:1)调控通道动力学并重构水分子网络,有效抑制HOX泄漏(HOBr在隧道停留时间显著延长);2)诱导357-360位点loop区构象重排(8 ns时与野生型差异显著)[图14(a)]。底物谱拓展实验表明,V82I对具有药用价值的氧吲哚化合物(3)的亲和力接近天然底物,并可高效催化羟基喹啉(4)、酚类(6、7)及芳香醛(8)的卤化反应[图14(b)]。该研究证实,结合计算模拟与实验验证,可深入解析卤化酶动态催化机制,为理性设计多功能酶催化剂提供新范式。
Reed等[113]利用卤化酶偶联下游通路,通过代谢工程和共培养合成体系,安全高效地生成具有工业应用前景的卤化分子。首先研究团队通过不同温度下的色氨酸饲喂试验评估一系列卤化酶在大肠杆菌胞内的卤化特性,包括稳定性、对氯和溴的偏好性等。基于在30°C具有优越的转化能力以及多样化的取代位置/卤素种类选择性,选择了分别卤化色氨酸C5、C6、C7位的卤化酶XsHal、Thal和RebH。随后,通过代谢工程策略成功构建了一株高产色氨酸的菌株(E. coli sKR-Trp4),并分别引入上述选择的卤化酶形成三种能够产生不同取代位卤化色氨酸的菌株。最后,将卤化色氨酸高产菌株(300-700 mg/L)和表达下游酶的菌株以模块化共培养方式组合,以葡萄糖为底物首次合成了26种不同的卤化分子,其中15种是首次从头生物合成的(图14,绿色及红色框出),6种是全新的天然产物(图14,红色框出)。卤化产物种类包括新型β-咔啉,药物前体4-氯和4-溴-犬尿氨酸,植物激素前体,以及其他药物相关的前体分子,如色胺和吲哚类化合物。该生物催化平台展示了一种生物-化学组合的方法,以新型合成方式生产多种与工业领域相关的卤化物,为后续更多应用打开了大门。
Other Images/Table from this Article
|