Fig. 9
The typical structure of NHFe/αKGHs[25,70-76]
Extracts from the Article
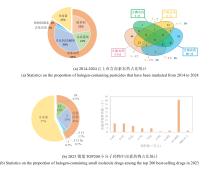
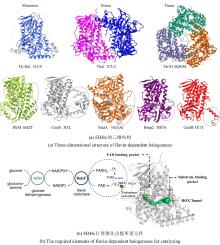
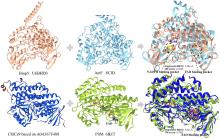
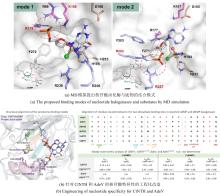
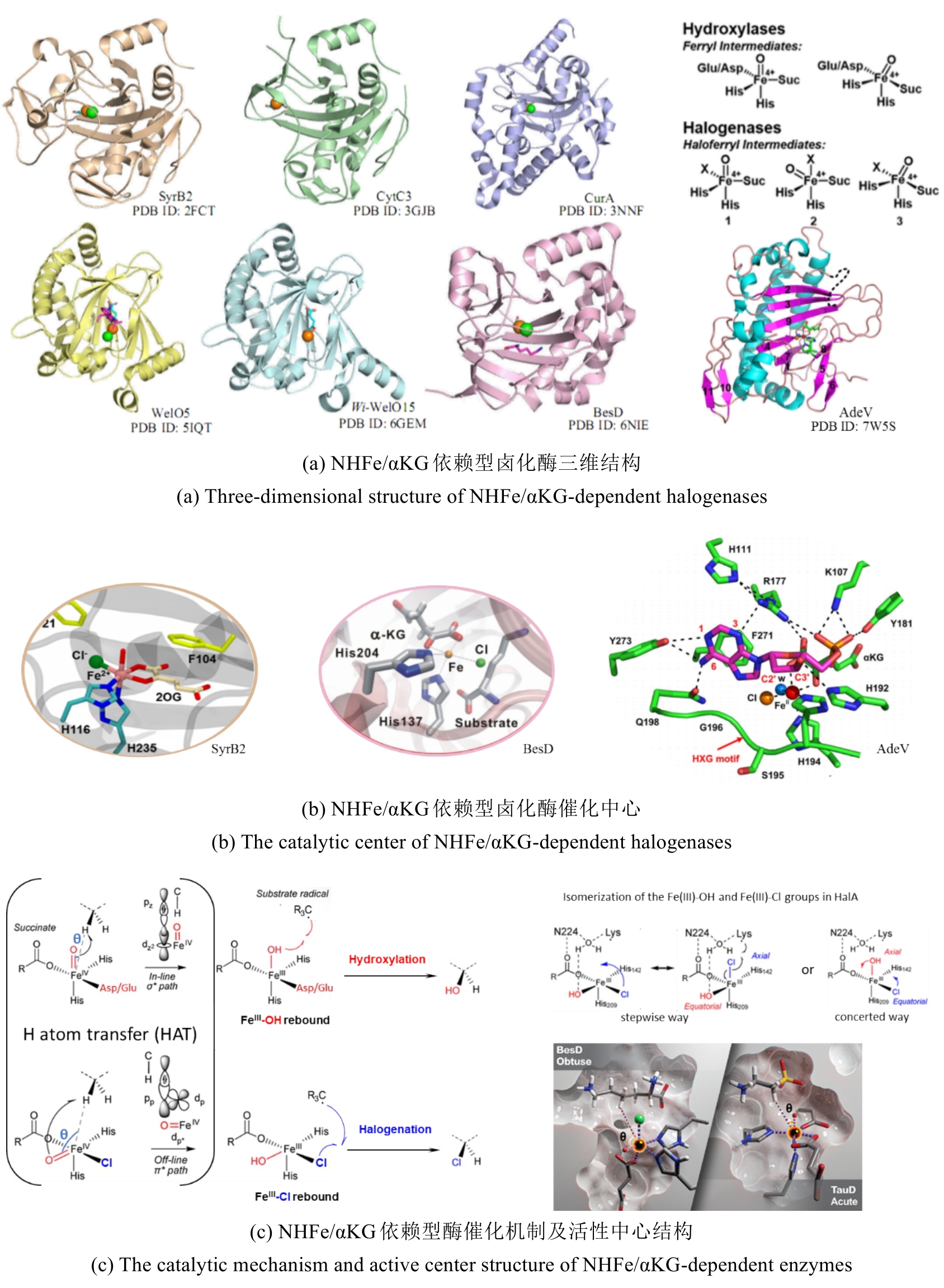
NHFe/αKG依赖型卤化酶(NHFe/αKGHs)通常具有Fe/αKG依赖型加氧酶超家族典型的β-三明治果冻卷拓扑结构[图9(a)],催化中心由两个组氨酸、α-酮戊二酸以及Fe共同配位组成[图9(b)]。与同属超家族的羟化酶相比,卤化酶中Fe的配位环境缺少羧酸配体(天冬氨酸/谷氨酸),而是被非极性氨基酸如丙氨酸或甘氨酸所替代[25]。这种氨基酸的替换使卤化酶能够有效容纳与Fe配位的卤素阴离子,是卤化反应的结构基础。最近,研究者发现了一种新型核苷酸卤化酶AdeV并解析其晶体结构[45,70]。尽管AdeV与已知NHFe/αKGHs的序列相似性较低,但其三维结构与催化中心的局部结构依然具有保守性。
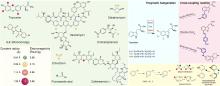
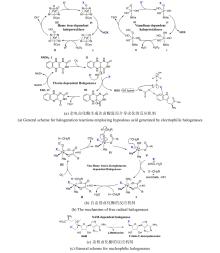
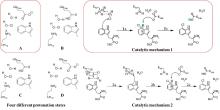
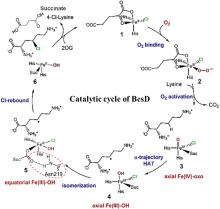
研究表明,Fe/αKG依赖型羟化酶和卤化酶的催化机制非常相似[73-75]。一旦αKG、Fe和底物结合到酶上,就会触发构象变化(BesD中 E119残基起关键作用[76]),促进O?与Fe中心配位,随后α-KG氧化脱羧驱动O-O键断裂,生成关键中间体Fe(IV)=O。该中间体通过氢原子转移(HAT)形成Fe(III)-OH和底物自由基,此后反应路径显著分化[图9(c)]。在羟化酶中,结合在Fe上的羟基会直接回弹并与底物自由基结合,生成羟基化产物。而卤化酶通过次级配位层(Secondary Coordination Sphere,SCS)残基氢键网络的定向作用,引起Fe配位球的构象转变[77](分步或协同的方式发生),使卤素配体优先接近底物自由基,从而主导卤化反应,尽管也会通过羟基回弹生成少量羟化产物。MD模拟表明,底物定位角度呈现显著差异:羟化酶TauD偏好氧-铁-氢呈锐角,由Asp94等残基稳定;卤化酶BesD则倾向维持钝角,依赖His127等残基[73]。此外,卤化酶(如BesD、HalB、HalD)通过C端底物结合盖的构象变化(如螺旋-片层转换)精确调控底物构象,决定氯化的位点(如C4或C5)及底物链长选择性(赖氨酸vs鸟氨酸)。定点突变及MD模拟表明,结合盖区关键残基(如HalB的Met246和HalD的Trp254)通过立体效应主导底物定位[78]。这些发现揭示了SCS微环境对Fe/αKG依赖型酶反应选择性的精确调控机制,为后续理性设计提供分子基础。
研究表明,Fe/αKG依赖型羟化酶和卤化酶的催化机制非常相似[ 73- 75].一旦αKG、Fe和底物结合到酶上,就会触发构象变化(BesD中 E119残基起关键作用[ 76]),促进O?与Fe中心配位,随后α-KG氧化脱羧驱动O-O键断裂,生成关键中间体Fe(IV)=O.该中间体通过氢原子转移(HAT)形成Fe(III)-OH和底物自由基,此后反应路径显著分化[ 图9(c)].在羟化酶中,结合在Fe上的羟基会直接回弹并与底物自由基结合,生成羟基化产物.而卤化酶通过次级配位层(Secondary Coordination Sphere,SCS)残基氢键网络的定向作用,引起Fe配位球的构象转变[ 77](分步或协同的方式发生),使卤素配体优先接近底物自由基,从而主导卤化反应,尽管也会通过羟基回弹生成少量羟化产物.MD模拟表明,底物定位角度呈现显著差异:羟化酶TauD偏好氧-铁-氢呈锐角,由Asp94等残基稳定;卤化酶BesD则倾向维持钝角,依赖His127等残基[ 73].此外,卤化酶(如BesD、HalB、HalD)通过C端底物结合盖的构象变化(如螺旋-片层转换)精确调控底物构象,决定氯化的位点(如C4或C5)及底物链长选择性(赖氨酸vs鸟氨酸).定点突变及MD模拟表明,结合盖区关键残基(如HalB的Met246和HalD的Trp254)通过立体效应主导底物定位[ 78].这些发现揭示了SCS微环境对Fe/αKG依赖型酶反应选择性的精确调控机制,为后续理性设计提供分子基础. ...
研究表明,Fe/αKG依赖型羟化酶和卤化酶的催化机制非常相似[ 73- 75].一旦αKG、Fe和底物结合到酶上,就会触发构象变化(BesD中 E119残基起关键作用[ 76]),促进O?与Fe中心配位,随后α-KG氧化脱羧驱动O-O键断裂,生成关键中间体Fe(IV)=O.该中间体通过氢原子转移(HAT)形成Fe(III)-OH和底物自由基,此后反应路径显著分化[ 图9(c)].在羟化酶中,结合在Fe上的羟基会直接回弹并与底物自由基结合,生成羟基化产物.而卤化酶通过次级配位层(Secondary Coordination Sphere,SCS)残基氢键网络的定向作用,引起Fe配位球的构象转变[ 77](分步或协同的方式发生),使卤素配体优先接近底物自由基,从而主导卤化反应,尽管也会通过羟基回弹生成少量羟化产物.MD模拟表明,底物定位角度呈现显著差异:羟化酶TauD偏好氧-铁-氢呈锐角,由Asp94等残基稳定;卤化酶BesD则倾向维持钝角,依赖His127等残基[ 73].此外,卤化酶(如BesD、HalB、HalD)通过C端底物结合盖的构象变化(如螺旋-片层转换)精确调控底物构象,决定氯化的位点(如C4或C5)及底物链长选择性(赖氨酸vs鸟氨酸).定点突变及MD模拟表明,结合盖区关键残基(如HalB的Met246和HalD的Trp254)通过立体效应主导底物定位[ 78].这些发现揭示了SCS微环境对Fe/αKG依赖型酶反应选择性的精确调控机制,为后续理性设计提供分子基础. ... Recent advances of enzymatic synthesis of organohalogens catalyzed by Fe/αKG-dependent halogenases 7 2022 ... 在过去的二十年里,有关卤化酶的分类鉴定、工程改造或应用开发的研究文章出现爆炸式增长.近年来,随着基因测序、蛋白质工程、计算酶学以及合成生物学技术的不断进步,人们已在卤化酶资源挖掘和性能优化方面取得了显著进展,开发了一系列极具实际生产潜力的工程卤化酶,参与多种重要的生物转化、分子合成以及制备反应.已有多篇优秀的综述[1,4,17-25]对卤化酶前期研究进展进行了详细归纳和总结,涉及结构基础解析,催化机制揭示,优化改造策略以及应用案例等内容,为该领域的研究者提供了重要理论指导.然而,现阶段卤化酶的相关研究仍面临诸多问题和挑战.生物卤化机制研究不够深入,酶催化过程中涉及的关键细节仍未揭示清楚,比如黄素依赖型卤化酶(Flavin-Dependent Halogenases,FDHs)的催化模式,目前存在两种假说,一种认为酶分子内部形成的次卤酸(HOX)与活性位点Lys的氨基以共价键结合形成中间体[26];另一种认为HOX与Lys以氢键配位形成相对松散的过渡态,而不形成中间体[27].因此,卤化酶研究仍需大量科研工作者的共同努力,在取得新成果的同时,及时总结现有问题并不断反思,以此指导未来工作,从而实现卤化酶工具的高效催化和广泛应用.此外,机器学习(Machine learning,ML)、人工智能(Artificial intelligence,AI)等新兴技术为卤化酶研究带来了新的发展机遇.本综述结合近三年出现的新工具、新技术、新策略,重点介绍卤化酶在资源挖掘、构效关系、修饰策略及应用前景等方面的最新进展,归纳总结新视角、新理论、新方向,对前期研究中待解决的问题或未详尽阐明的理论进行必要的补充和修正,以期为今后的研究提供有益启发和参考. ...
研究表明,Fe/αKG依赖型羟化酶和卤化酶的催化机制非常相似[ 73- 75].一旦αKG、Fe和底物结合到酶上,就会触发构象变化(BesD中 E119残基起关键作用[ 76]),促进O?与Fe中心配位,随后α-KG氧化脱羧驱动O-O键断裂,生成关键中间体Fe(IV)=O.该中间体通过氢原子转移(HAT)形成Fe(III)-OH和底物自由基,此后反应路径显著分化[ 图9(c)].在羟化酶中,结合在Fe上的羟基会直接回弹并与底物自由基结合,生成羟基化产物.而卤化酶通过次级配位层(Secondary Coordination Sphere,SCS)残基氢键网络的定向作用,引起Fe配位球的构象转变[ 77](分步或协同的方式发生),使卤素配体优先接近底物自由基,从而主导卤化反应,尽管也会通过羟基回弹生成少量羟化产物.MD模拟表明,底物定位角度呈现显著差异:羟化酶TauD偏好氧-铁-氢呈锐角,由Asp94等残基稳定;卤化酶BesD则倾向维持钝角,依赖His127等残基[ 73].此外,卤化酶(如BesD、HalB、HalD)通过C端底物结合盖的构象变化(如螺旋-片层转换)精确调控底物构象,决定氯化的位点(如C4或C5)及底物链长选择性(赖氨酸vs鸟氨酸).定点突变及MD模拟表明,结合盖区关键残基(如HalB的Met246和HalD的Trp254)通过立体效应主导底物定位[ 78].这些发现揭示了SCS微环境对Fe/αKG依赖型酶反应选择性的精确调控机制,为后续理性设计提供分子基础. ...
研究表明,Fe/αKG依赖型羟化酶和卤化酶的催化机制非常相似[ 73- 75].一旦αKG、Fe和底物结合到酶上,就会触发构象变化(BesD中 E119残基起关键作用[ 76]),促进O?与Fe中心配位,随后α-KG氧化脱羧驱动O-O键断裂,生成关键中间体Fe(IV)=O.该中间体通过氢原子转移(HAT)形成Fe(III)-OH和底物自由基,此后反应路径显著分化[ 图9(c)].在羟化酶中,结合在Fe上的羟基会直接回弹并与底物自由基结合,生成羟基化产物.而卤化酶通过次级配位层(Secondary Coordination Sphere,SCS)残基氢键网络的定向作用,引起Fe配位球的构象转变[ 77](分步或协同的方式发生),使卤素配体优先接近底物自由基,从而主导卤化反应,尽管也会通过羟基回弹生成少量羟化产物.MD模拟表明,底物定位角度呈现显著差异:羟化酶TauD偏好氧-铁-氢呈锐角,由Asp94等残基稳定;卤化酶BesD则倾向维持钝角,依赖His127等残基[ 73].此外,卤化酶(如BesD、HalB、HalD)通过C端底物结合盖的构象变化(如螺旋-片层转换)精确调控底物构象,决定氯化的位点(如C4或C5)及底物链长选择性(赖氨酸vs鸟氨酸).定点突变及MD模拟表明,结合盖区关键残基(如HalB的Met246和HalD的Trp254)通过立体效应主导底物定位[ 78].这些发现揭示了SCS微环境对Fe/αKG依赖型酶反应选择性的精确调控机制,为后续理性设计提供分子基础. ... Chlorination by a long-lived intermediate in the mechanism of flavin-dependent halogenases 2 2007 ... 在过去的二十年里,有关卤化酶的分类鉴定、工程改造或应用开发的研究文章出现爆炸式增长.近年来,随着基因测序、蛋白质工程、计算酶学以及合成生物学技术的不断进步,人们已在卤化酶资源挖掘和性能优化方面取得了显著进展,开发了一系列极具实际生产潜力的工程卤化酶,参与多种重要的生物转化、分子合成以及制备反应.已有多篇优秀的综述[1,4,17-25]对卤化酶前期研究进展进行了详细归纳和总结,涉及结构基础解析,催化机制揭示,优化改造策略以及应用案例等内容,为该领域的研究者提供了重要理论指导.然而,现阶段卤化酶的相关研究仍面临诸多问题和挑战.生物卤化机制研究不够深入,酶催化过程中涉及的关键细节仍未揭示清楚,比如黄素依赖型卤化酶(Flavin-Dependent Halogenases,FDHs)的催化模式,目前存在两种假说,一种认为酶分子内部形成的次卤酸(HOX)与活性位点Lys的氨基以共价键结合形成中间体[26];另一种认为HOX与Lys以氢键配位形成相对松散的过渡态,而不形成中间体[27].因此,卤化酶研究仍需大量科研工作者的共同努力,在取得新成果的同时,及时总结现有问题并不断反思,以此指导未来工作,从而实现卤化酶工具的高效催化和广泛应用.此外,机器学习(Machine learning,ML)、人工智能(Artificial intelligence,AI)等新兴技术为卤化酶研究带来了新的发展机遇.本综述结合近三年出现的新工具、新技术、新策略,重点介绍卤化酶在资源挖掘、构效关系、修饰策略及应用前景等方面的最新进展,归纳总结新视角、新理论、新方向,对前期研究中待解决的问题或未详尽阐明的理论进行必要的补充和修正,以期为今后的研究提供有益启发和参考. ...
NHFe/αKG依赖型卤化酶(NHFe/αKGHs)通常具有Fe/αKG依赖型加氧酶超家族典型的β-三明治果冻卷拓扑结构[ 图9(a)],催化中心由两个组氨酸、α-酮戊二酸以及Fe共同配位组成[ 图9(b)].与同属超家族的羟化酶相比,卤化酶中Fe的配位环境缺少羧酸配体(天冬氨酸/谷氨酸),而是被非极性氨基酸如丙氨酸或甘氨酸所替代[ 25].这种氨基酸的替换使卤化酶能够有效容纳与Fe配位的卤素阴离子,是卤化反应的结构基础.最近,研究者发现了一种新型核苷酸卤化酶AdeV并解析其晶体结构[ 45, 70].尽管AdeV与已知NHFe/αKGHs的序列相似性较低,但其三维结构与催化中心的局部结构依然具有保守性. ...
NHFe/αKG依赖型卤化酶(NHFe/αKGHs)通常具有Fe/αKG依赖型加氧酶超家族典型的β-三明治果冻卷拓扑结构[ 图9(a)],催化中心由两个组氨酸、α-酮戊二酸以及Fe共同配位组成[ 图9(b)].与同属超家族的羟化酶相比,卤化酶中Fe的配位环境缺少羧酸配体(天冬氨酸/谷氨酸),而是被非极性氨基酸如丙氨酸或甘氨酸所替代[ 25].这种氨基酸的替换使卤化酶能够有效容纳与Fe配位的卤素阴离子,是卤化反应的结构基础.最近,研究者发现了一种新型核苷酸卤化酶AdeV并解析其晶体结构[ 45, 70].尽管AdeV与已知NHFe/αKGHs的序列相似性较低,但其三维结构与催化中心的局部结构依然具有保守性. ...
研究表明,Fe/αKG依赖型羟化酶和卤化酶的催化机制非常相似[ 73- 75].一旦αKG、Fe和底物结合到酶上,就会触发构象变化(BesD中 E119残基起关键作用[ 76]),促进O?与Fe中心配位,随后α-KG氧化脱羧驱动O-O键断裂,生成关键中间体Fe(IV)=O.该中间体通过氢原子转移(HAT)形成Fe(III)-OH和底物自由基,此后反应路径显著分化[ 图9(c)].在羟化酶中,结合在Fe上的羟基会直接回弹并与底物自由基结合,生成羟基化产物.而卤化酶通过次级配位层(Secondary Coordination Sphere,SCS)残基氢键网络的定向作用,引起Fe配位球的构象转变[ 77](分步或协同的方式发生),使卤素配体优先接近底物自由基,从而主导卤化反应,尽管也会通过羟基回弹生成少量羟化产物.MD模拟表明,底物定位角度呈现显著差异:羟化酶TauD偏好氧-铁-氢呈锐角,由Asp94等残基稳定;卤化酶BesD则倾向维持钝角,依赖His127等残基[ 73].此外,卤化酶(如BesD、HalB、HalD)通过C端底物结合盖的构象变化(如螺旋-片层转换)精确调控底物构象,决定氯化的位点(如C4或C5)及底物链长选择性(赖氨酸vs鸟氨酸).定点突变及MD模拟表明,结合盖区关键残基(如HalB的Met246和HalD的Trp254)通过立体效应主导底物定位[ 78].这些发现揭示了SCS微环境对Fe/αKG依赖型酶反应选择性的精确调控机制,为后续理性设计提供分子基础. ...
研究表明,Fe/αKG依赖型羟化酶和卤化酶的催化机制非常相似[ 73- 75].一旦αKG、Fe和底物结合到酶上,就会触发构象变化(BesD中 E119残基起关键作用[ 76]),促进O?与Fe中心配位,随后α-KG氧化脱羧驱动O-O键断裂,生成关键中间体Fe(IV)=O.该中间体通过氢原子转移(HAT)形成Fe(III)-OH和底物自由基,此后反应路径显著分化[ 图9(c)].在羟化酶中,结合在Fe上的羟基会直接回弹并与底物自由基结合,生成羟基化产物.而卤化酶通过次级配位层(Secondary Coordination Sphere,SCS)残基氢键网络的定向作用,引起Fe配位球的构象转变[ 77](分步或协同的方式发生),使卤素配体优先接近底物自由基,从而主导卤化反应,尽管也会通过羟基回弹生成少量羟化产物.MD模拟表明,底物定位角度呈现显著差异:羟化酶TauD偏好氧-铁-氢呈锐角,由Asp94等残基稳定;卤化酶BesD则倾向维持钝角,依赖His127等残基[ 73].此外,卤化酶(如BesD、HalB、HalD)通过C端底物结合盖的构象变化(如螺旋-片层转换)精确调控底物构象,决定氯化的位点(如C4或C5)及底物链长选择性(赖氨酸vs鸟氨酸).定点突变及MD模拟表明,结合盖区关键残基(如HalB的Met246和HalD的Trp254)通过立体效应主导底物定位[ 78].这些发现揭示了SCS微环境对Fe/αKG依赖型酶反应选择性的精确调控机制,为后续理性设计提供分子基础. ...
研究表明,Fe/αKG依赖型羟化酶和卤化酶的催化机制非常相似[ 73- 75].一旦αKG、Fe和底物结合到酶上,就会触发构象变化(BesD中 E119残基起关键作用[ 76]),促进O?与Fe中心配位,随后α-KG氧化脱羧驱动O-O键断裂,生成关键中间体Fe(IV)=O.该中间体通过氢原子转移(HAT)形成Fe(III)-OH和底物自由基,此后反应路径显著分化[ 图9(c)].在羟化酶中,结合在Fe上的羟基会直接回弹并与底物自由基结合,生成羟基化产物.而卤化酶通过次级配位层(Secondary Coordination Sphere,SCS)残基氢键网络的定向作用,引起Fe配位球的构象转变[ 77](分步或协同的方式发生),使卤素配体优先接近底物自由基,从而主导卤化反应,尽管也会通过羟基回弹生成少量羟化产物.MD模拟表明,底物定位角度呈现显著差异:羟化酶TauD偏好氧-铁-氢呈锐角,由Asp94等残基稳定;卤化酶BesD则倾向维持钝角,依赖His127等残基[ 73].此外,卤化酶(如BesD、HalB、HalD)通过C端底物结合盖的构象变化(如螺旋-片层转换)精确调控底物构象,决定氯化的位点(如C4或C5)及底物链长选择性(赖氨酸vs鸟氨酸).定点突变及MD模拟表明,结合盖区关键残基(如HalB的Met246和HalD的Trp254)通过立体效应主导底物定位[ 78].这些发现揭示了SCS微环境对Fe/αKG依赖型酶反应选择性的精确调控机制,为后续理性设计提供分子基础. ...
研究表明,Fe/αKG依赖型羟化酶和卤化酶的催化机制非常相似[ 73- 75].一旦αKG、Fe和底物结合到酶上,就会触发构象变化(BesD中 E119残基起关键作用[ 76]),促进O?与Fe中心配位,随后α-KG氧化脱羧驱动O-O键断裂,生成关键中间体Fe(IV)=O.该中间体通过氢原子转移(HAT)形成Fe(III)-OH和底物自由基,此后反应路径显著分化[ 图9(c)].在羟化酶中,结合在Fe上的羟基会直接回弹并与底物自由基结合,生成羟基化产物.而卤化酶通过次级配位层(Secondary Coordination Sphere,SCS)残基氢键网络的定向作用,引起Fe配位球的构象转变[ 77](分步或协同的方式发生),使卤素配体优先接近底物自由基,从而主导卤化反应,尽管也会通过羟基回弹生成少量羟化产物.MD模拟表明,底物定位角度呈现显著差异:羟化酶TauD偏好氧-铁-氢呈锐角,由Asp94等残基稳定;卤化酶BesD则倾向维持钝角,依赖His127等残基[ 73].此外,卤化酶(如BesD、HalB、HalD)通过C端底物结合盖的构象变化(如螺旋-片层转换)精确调控底物构象,决定氯化的位点(如C4或C5)及底物链长选择性(赖氨酸vs鸟氨酸).定点突变及MD模拟表明,结合盖区关键残基(如HalB的Met246和HalD的Trp254)通过立体效应主导底物定位[ 78].这些发现揭示了SCS微环境对Fe/αKG依赖型酶反应选择性的精确调控机制,为后续理性设计提供分子基础. ...
Other Images/Table from this Article
|