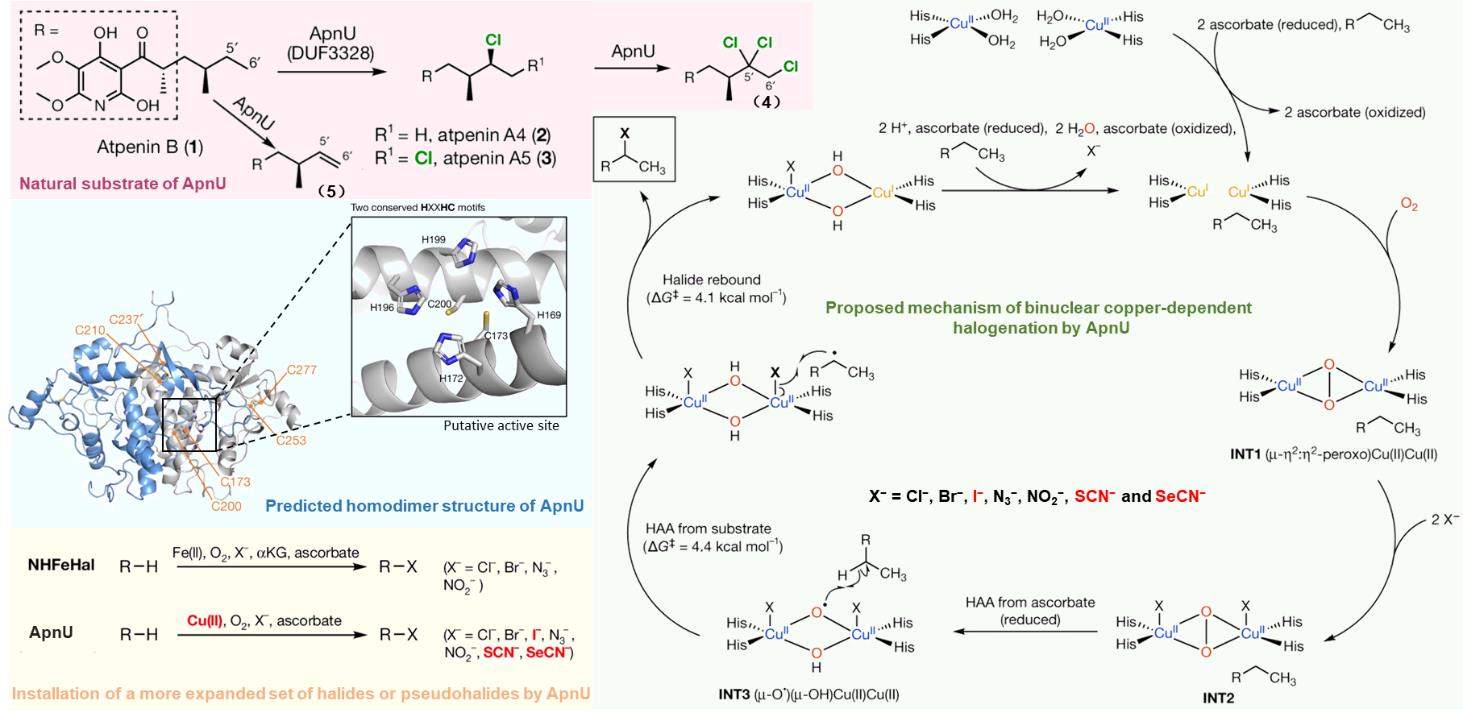
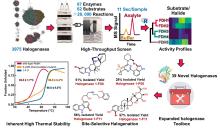
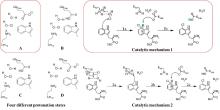
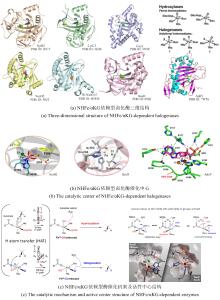
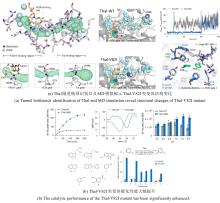
近期,唐奕课题组从
Penicillium oxalicum中鉴定并表征了自由基卤化酶家族中的首个铜依赖型成员ApnU[
81].该酶的活性中心采用Cu2?取代传统的Fe2?辅因子,通过独特的金属配位结构和自由基介导机制实现C(
sp3)-H的迭代卤化(
图12).在结构特征方面,ApnU含有两个HXXHC保守基序,形成一个由四个组氨酸侧链构成的平面位点(尺寸约5.4 ? × 6.1 ?)及两个半胱氨酸组成的铜结合位点,与NHFeHal的活性中心结构呈显著差异.功能研究表明,ApnU严格依赖Cu2?、O?以及抗坏血酸作为辅因子,能够催化天然底物atpenin B(
1)在C5′位C(
sp3 )-H进行氯化反应,生成单氯(
2)、二氯(
3)和三氯产物(
4),同时通过氢原子抽取机制产生脱氢副产物(
5).实验数据显示,ApnU的催化活性受NaCl浓度显著影响:当NaCl浓度为50 mM时氯化效率达到峰值,而在NaCl缺失条件下反应转向脱氢途径,这表明卤素配位在C-H键活化中起关键作用.与NHFeHal相比,ApnU表现出显著抑制羟基回弹副反应的能力,从而提升了卤代选择性,这一机制差异可能与金属中心的氧化还原特性相关.此外,ApnU展现出独特的广谱卤素兼容性,不仅能催化Cl?,还能利用Br?、I?、SCN?及SeCN?对天然底物(包括非天然底物DIF-3)进行C(
sp3)-H官能化修饰,生成相应的单卤取代产物.基于软硬酸碱理论,Cu2?活性中心的较软特性使其能够高效结合较软的配体(如硫和碘),这一特性赋予ApnU催化C(
sp3)-H碘化、硫氰化和硒氰化的独特能力,突破了NHFeHals仅能催化硬性卤素(Cl?/Br?)的限制,实现了C(
sp3)-H的多样化修饰及软性卤素的高效利用.ApnU的发现不仅深化了对卤化酶金属依赖性的理解,更为复杂天然产物及药物中间体的生物合成提供了一种新型工具酶. ...
近期,唐奕课题组从
Penicillium oxalicum中鉴定并表征了自由基卤化酶家族中的首个铜依赖型成员ApnU[
81].该酶的活性中心采用Cu2?取代传统的Fe2?辅因子,通过独特的金属配位结构和自由基介导机制实现C(
sp3)-H的迭代卤化(
图12).在结构特征方面,ApnU含有两个HXXHC保守基序,形成一个由四个组氨酸侧链构成的平面位点(尺寸约5.4 ? × 6.1 ?)及两个半胱氨酸组成的铜结合位点,与NHFeHal的活性中心结构呈显著差异.功能研究表明,ApnU严格依赖Cu2?、O?以及抗坏血酸作为辅因子,能够催化天然底物atpenin B(
1)在C5′位C(
sp3 )-H进行氯化反应,生成单氯(
2)、二氯(
3)和三氯产物(
4),同时通过氢原子抽取机制产生脱氢副产物(
5).实验数据显示,ApnU的催化活性受NaCl浓度显著影响:当NaCl浓度为50 mM时氯化效率达到峰值,而在NaCl缺失条件下反应转向脱氢途径,这表明卤素配位在C-H键活化中起关键作用.与NHFeHal相比,ApnU表现出显著抑制羟基回弹副反应的能力,从而提升了卤代选择性,这一机制差异可能与金属中心的氧化还原特性相关.此外,ApnU展现出独特的广谱卤素兼容性,不仅能催化Cl?,还能利用Br?、I?、SCN?及SeCN?对天然底物(包括非天然底物DIF-3)进行C(
sp3)-H官能化修饰,生成相应的单卤取代产物.基于软硬酸碱理论,Cu2?活性中心的较软特性使其能够高效结合较软的配体(如硫和碘),这一特性赋予ApnU催化C(
sp3)-H碘化、硫氰化和硒氰化的独特能力,突破了NHFeHals仅能催化硬性卤素(Cl?/Br?)的限制,实现了C(
sp3)-H的多样化修饰及软性卤素的高效利用.ApnU的发现不仅深化了对卤化酶金属依赖性的理解,更为复杂天然产物及药物中间体的生物合成提供了一种新型工具酶. ...
Regioselective halogenation of lavanducyanin by a site-selective vanadium-dependent chloroperoxidase
1
2024
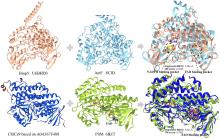
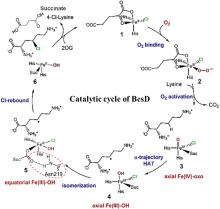
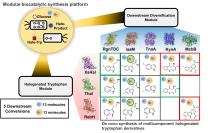
... 此外,非血红素铁/α-酮戊二酸依赖型卤化酶家族也增添了新成员AdeV和CtNTH,分别催化2'-脱氧腺苷-5'-单磷酸(dAMP)和2'-脱氧鸟苷-5'-单磷酸(dGMP)的氯化[45-46].这些核苷酸卤化酶的发现扩大了卤化酶家族可催化底物的范围.Baumgartner和McKinnie报道第一个以吩嗪酮为底物的新型卤化酶LvcH,属于VHPO家族[47]. ...
UniProt: the universal protein knowledgebase in 2021
1
2021
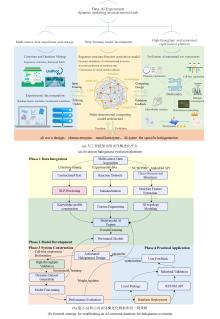
... 随着DNA测序技术的发展,特别是基因组学和宏基因组学工具的发展,人们发现了大量的蛋白质序列.然而,目前科学家只对蛋白质序列总量的0.3% (约50万)进行过研究,其中有明确实验证据支持的序列占比不足20%(<19.4%)[48-50].另一方面,蛋白质功能注释高度依赖于计算模型的运行方式.一项大规模的蛋白质功能注释关键评估(CAFA)研究发现,使用现有计算工具自动注释的酶中有40%是不正确的[50].因此,从有限的实验数据基础上对未知或未表征酶进行准确功能注释预测,对于蛋白质序列数据分析处理和应用至关重要.为了突破已有方法的局限性(表2),赵惠民团队开发了一种基于对比学习的机器学习模型CLEAN(Contrastive Learning-enabled Enzyme ANnotation)[51].在CLEAN的任务中,具有相同酶分类编号(EC,Enzyme commission,指示酶催化何种反应的ID代码)的氨基酸序列具有较小的欧氏距离,反映了功能相似性.CLEAN基于UniProt的高质量数据库进行训练,输入氨基酸序列,随后计算对比输入样本间的欧式距离,就可得到EC可能性排序列表.为了验证CLEAN的准确性和稳健性,针对UniProt数据库中样本有限,研究不足的卤化酶数据集,使用CLEAN及其他六种最先进的注释工具(ProteInfer、BLASTp、DeepEC、DEEPre、COFACTOR和ECPred)对36种未完全注释的卤化酶的EC编号进行重新分配,结合实验验证结果,综合表明CLEAN(预测精度86.7至100%)在酶功能预测任务中比其他工具(例如,DeepEC中约11.1%,ProteInfer中11.1至61.1%)更具优越性.此外,所有预测工具中只有CLEAN成功将原本功能注释不准确甚至相互矛盾的卤化酶MJ1651(EC 3.13.1.8)和TTHA0338(EC 3.13.1.8)精准区分,并准确识别SsFlA多功能酶具备三种催化能力(EC 2.5.1.63, EC 2.5.1.94和EC 3.13.1.8).结果表明,CLEAN能够高效处理低相似性序列、数据不平衡及混杂酶等复杂数据集,预测准确率显著提升并兼具抗噪性和纠错能力,为酶功能注释提供高精度、强鲁棒的计算工具.此外,该项工作证实了机器学习等AI技术在卤化酶识别、分类、鉴定方面的高效性和准确性,具有巨大应用潜力. ...
An unusual aromatase/cyclase programs the formation of the phenyldimethylanthrone framework in anthrabenzoxocinones and fasamycin
0
2024
A large-scale evaluation of computational protein function prediction
2
2013
... 随着DNA测序技术的发展,特别是基因组学和宏基因组学工具的发展,人们发现了大量的蛋白质序列.然而,目前科学家只对蛋白质序列总量的0.3% (约50万)进行过研究,其中有明确实验证据支持的序列占比不足20%(<19.4%)[48-50].另一方面,蛋白质功能注释高度依赖于计算模型的运行方式.一项大规模的蛋白质功能注释关键评估(CAFA)研究发现,使用现有计算工具自动注释的酶中有40%是不正确的[50].因此,从有限的实验数据基础上对未知或未表征酶进行准确功能注释预测,对于蛋白质序列数据分析处理和应用至关重要.为了突破已有方法的局限性(表2),赵惠民团队开发了一种基于对比学习的机器学习模型CLEAN(Contrastive Learning-enabled Enzyme ANnotation)[51].在CLEAN的任务中,具有相同酶分类编号(EC,Enzyme commission,指示酶催化何种反应的ID代码)的氨基酸序列具有较小的欧氏距离,反映了功能相似性.CLEAN基于UniProt的高质量数据库进行训练,输入氨基酸序列,随后计算对比输入样本间的欧式距离,就可得到EC可能性排序列表.为了验证CLEAN的准确性和稳健性,针对UniProt数据库中样本有限,研究不足的卤化酶数据集,使用CLEAN及其他六种最先进的注释工具(ProteInfer、BLASTp、DeepEC、DEEPre、COFACTOR和ECPred)对36种未完全注释的卤化酶的EC编号进行重新分配,结合实验验证结果,综合表明CLEAN(预测精度86.7至100%)在酶功能预测任务中比其他工具(例如,DeepEC中约11.1%,ProteInfer中11.1至61.1%)更具优越性.此外,所有预测工具中只有CLEAN成功将原本功能注释不准确甚至相互矛盾的卤化酶MJ1651(EC 3.13.1.8)和TTHA0338(EC 3.13.1.8)精准区分,并准确识别SsFlA多功能酶具备三种催化能力(EC 2.5.1.63, EC 2.5.1.94和EC 3.13.1.8).结果表明,CLEAN能够高效处理低相似性序列、数据不平衡及混杂酶等复杂数据集,预测准确率显著提升并兼具抗噪性和纠错能力,为酶功能注释提供高精度、强鲁棒的计算工具.此外,该项工作证实了机器学习等AI技术在卤化酶识别、分类、鉴定方面的高效性和准确性,具有巨大应用潜力. ...
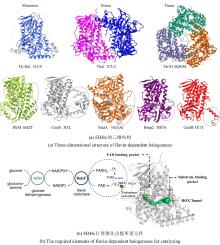
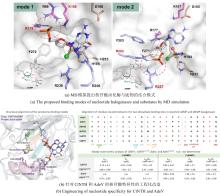
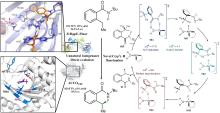
C2'位卤化修饰作为提升核苷酸类似物药物性质的关键策略,其酶催化实现途径备受关注.近期研究利用腺苷卤化酶AdeV实现了2
'-脱氧腺苷-5
'-单磷酸(dAMP)C2
'位的直接卤化[
45,
70],但该酶底物谱狭窄限制了其应用拓展.为突破这一瓶颈,Ni等[
46]通过进化基因组学筛选获得新型2
'-脱氧鸟苷-5
'-单磷酸(dGMP)卤化酶CtNTH与VaNTH,其催化活性较AdeV提升43倍.尽管CtNTH与AdeV序列同源性达51%,两者却呈现显著底物偏好性差异.分子动力学模拟表明,核苷酸卤化酶的底物特异性由催化口袋中5'-磷酸基团结合模式决定,而非传统认知的碱基结合残基:CtNTH优先采用mode 1结合dGMP的磷酸基团,而AdeV倾向mode 2适配dAMP[
图11(a)].通过工程化磷酸结合位点SCS范围内的关键残基,成功实现了底物选择性的定向切换及酶动力学参数转变[
图11(b)].结构及动力学分析揭示,SCS通过调控磷酸结合位点模式(如氢键网络重构及静电势调整)精确控制底物取向.该研究不仅拓展了核苷酸卤化酶资源库,更为此类酶的理性设计改造提供了分子机制指导. ...
Copper-dependent halogenase catalyses unactivated C-H bond functionalization
5
2025
... 近期,唐奕课题组从Penicillium oxalicum中鉴定并表征了自由基卤化酶家族中的首个铜依赖型成员ApnU[81].该酶的活性中心采用Cu2?取代传统的Fe2?辅因子,通过独特的金属配位结构和自由基介导机制实现C(sp3)-H的迭代卤化(图12).在结构特征方面,ApnU含有两个HXXHC保守基序,形成一个由四个组氨酸侧链构成的平面位点(尺寸约5.4 ? × 6.1 ?)及两个半胱氨酸组成的铜结合位点,与NHFeHal的活性中心结构呈显著差异.功能研究表明,ApnU严格依赖Cu2?、O?以及抗坏血酸作为辅因子,能够催化天然底物atpenin B(1)在C5′位C(sp3 )-H进行氯化反应,生成单氯(2)、二氯(3)和三氯产物(4),同时通过氢原子抽取机制产生脱氢副产物(5).实验数据显示,ApnU的催化活性受NaCl浓度显著影响:当NaCl浓度为50 mM时氯化效率达到峰值,而在NaCl缺失条件下反应转向脱氢途径,这表明卤素配位在C-H键活化中起关键作用.与NHFeHal相比,ApnU表现出显著抑制羟基回弹副反应的能力,从而提升了卤代选择性,这一机制差异可能与金属中心的氧化还原特性相关.此外,ApnU展现出独特的广谱卤素兼容性,不仅能催化Cl?,还能利用Br?、I?、SCN?及SeCN?对天然底物(包括非天然底物DIF-3)进行C(sp3)-H官能化修饰,生成相应的单卤取代产物.基于软硬酸碱理论,Cu2?活性中心的较软特性使其能够高效结合较软的配体(如硫和碘),这一特性赋予ApnU催化C(sp3)-H碘化、硫氰化和硒氰化的独特能力,突破了NHFeHals仅能催化硬性卤素(Cl?/Br?)的限制,实现了C(sp3)-H的多样化修饰及软性卤素的高效利用.ApnU的发现不仅深化了对卤化酶金属依赖性的理解,更为复杂天然产物及药物中间体的生物合成提供了一种新型工具酶. ...
Other Images/Table from this Article