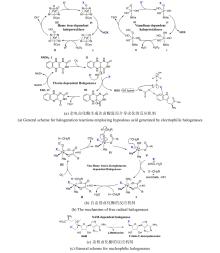
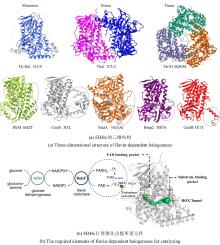
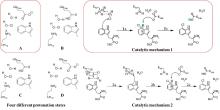
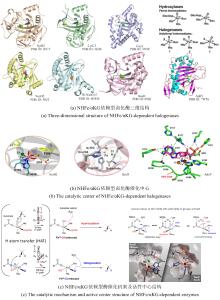
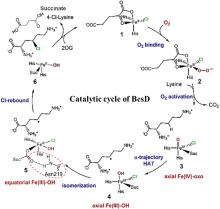
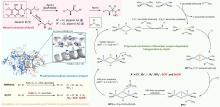
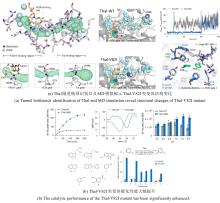
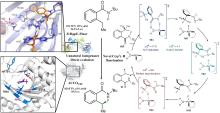
最近,有两个研究组利用定向进化手段分别在不同的非血红素铁金属酶中实现了铁催化自由基氟转移反应,即在同一底物分子内将N-F键转化为高对映体选择性的C(sp3)-F键[108-109]。虽然,植物来源的1-氨基环丙烷-1-羧酸氧化酶(ACCO)与链霉菌来源的(S)-2-羟基丙基膦酸酯环氧酶(SvHppE)在序列和结构上具有显著差异,但二者的Fe催化中心及与各配体的相互作用使其各自具有初始微弱的氟基转移能力。经过定向进化及反应条件优化后,六突变体ACCOCHF和三突变体SvHppE-Fluor的氟化性能进一步提升,化学选择性及对映选择性显著改善,能够将多种结构类似底物转化为一系列高对映体选择性的有机氟化物产品(图13)。此外,研究者提出了新型酶促C(sp3)-H氟化反应机制,即氧化还原性质活泼的金属氟基配合物捕获碳中心自由基形成C-F键。DFT计算和MD模拟结果显示,N-F键激活是整个反应的限速步骤,并且在过量NaN3存在条件下SvHppE-Fluor仍强烈偏好催化氟基转移可归因于碳中心自由基与Fe(III)-F中间体接近的空间取向和自由基回弹步骤较低的活化能垒。定向进化的非血红素铁氟化酶为手性有机氟化合物的生物合成提供了重要工具。金属介导的自由基氟转移作为生物催化C-F键形成的一种新机制,也将促进对其他金属酶的工程改造,以实现新型氟化反应。
2002年,O’Hagan团队[
82]首次从土壤细菌
Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过S
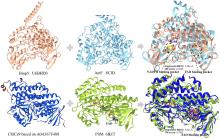
N2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[
83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[
图13(a)].源自海洋细菌
Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[
图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[
84-
85].早期研究[
86-
87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[
图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(
kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(
kcat=0.16 min-1)和FlASxin(
kcat=0.22 min-1)[
88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[
89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[
90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[
91][
图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[
92]. ...
2002年,O’Hagan团队[
82]首次从土壤细菌
Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过S
N2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[
83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[
图13(a)].源自海洋细菌
Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[
图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[
84-
85].早期研究[
86-
87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[
图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(
kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(
kcat=0.16 min-1)和FlASxin(
kcat=0.22 min-1)[
88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[
89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[
90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[
91][
图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[
92]. ...
蓝光照射光催化蛋白质内部 ...
Biosynthesis of an organofluorine molecule
1
2002
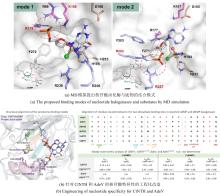
... 2002年,O’Hagan团队[82]首次从土壤细菌 Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过SN2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[图13(a)].源自海洋细菌Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[84-85].早期研究[86-87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(kcat=0.16 min-1)和FlASxin(kcat=0.22 min-1)[88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[91][图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[92]. ...
Crystal structure and mechanism of a bacterial fluorinating enzyme
2
2004
... 2002年,O’Hagan团队[82]首次从土壤细菌 Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过SN2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[图13(a)].源自海洋细菌Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[84-85].早期研究[86-87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(kcat=0.16 min-1)和FlASxin(kcat=0.22 min-1)[88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[91][图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[92]. ...
The red lines indicate the residues that are crucial for fluorination activity; the yellow lines indicate the residues that can form hydrogen bonds with the modification groups at the C2′ position of adenine ...
The fluorinase, the chlorinase and the duf-62 enzymes
1
2008
... 2002年,O’Hagan团队[82]首次从土壤细菌 Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过SN2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[图13(a)].源自海洋细菌Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[84-85].早期研究[86-87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(kcat=0.16 min-1)和FlASxin(kcat=0.22 min-1)[88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[91][图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[92]. ...
Mechanistic considerations of halogenating enzymes
2
2009
... 2002年,O’Hagan团队[82]首次从土壤细菌 Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过SN2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[图13(a)].源自海洋细菌Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[84-85].早期研究[86-87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(kcat=0.16 min-1)和FlASxin(kcat=0.22 min-1)[88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[91][图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[92]. ...
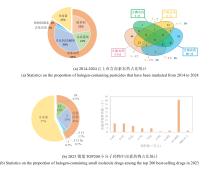
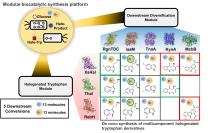
卤化酶则具备高度的专一性和选择性,可在温和条件下定向引入卤素基团,减少副反应,提高产率和纯度,为有机卤化物的合成提供了替代方案.此外,利用合成生物学手段将卤化酶引入酿酒酵母等工程微生物体系[
112],通过下游反应进一步改造修饰卤化中间产物,能够形成结构更为复杂的化合物,已成为分子合成领域新的发展趋势. ...
Enzymatic fluorination and biotechnological developments of the fluorinase
2
2015
... 2002年,O’Hagan团队[82]首次从土壤细菌 Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过SN2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[图13(a)].源自海洋细菌Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[84-85].早期研究[86-87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(kcat=0.16 min-1)和FlASxin(kcat=0.22 min-1)[88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[91][图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[92]. ...
卤化酶则具备高度的专一性和选择性,可在温和条件下定向引入卤素基团,减少副反应,提高产率和纯度,为有机卤化物的合成提供了替代方案.此外,利用合成生物学手段将卤化酶引入酿酒酵母等工程微生物体系[
112],通过下游反应进一步改造修饰卤化中间产物,能够形成结构更为复杂的化合物,已成为分子合成领域新的发展趋势. ...
A nonconventional archaeal fluorinase identified by in silico mining for enhanced fluorine biocatalysis
1
2022
... 2002年,O’Hagan团队[82]首次从土壤细菌 Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过SN2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[图13(a)].源自海洋细菌Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[84-85].早期研究[86-87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(kcat=0.16 min-1)和FlASxin(kcat=0.22 min-1)[88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[91][图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[92]. ...
Enzyme engineering renders chlorinase the activity of fluorinase
2
2024
... 2002年,O’Hagan团队[82]首次从土壤细菌 Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过SN2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[图13(a)].源自海洋细菌Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[84-85].早期研究[86-87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(kcat=0.16 min-1)和FlASxin(kcat=0.22 min-1)[88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[91][图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[92]. ...
The red lines indicate the residues that are crucial for fluorination activity; the yellow lines indicate the residues that can form hydrogen bonds with the modification groups at the C2′ position of adenine ...
Advances in enzymatic incorporation of small fluorine modules
2
2024
... 2002年,O’Hagan团队[82]首次从土壤细菌 Streptomyces cattleya 中分离鉴定出天然氟化酶FlAScat(EC 2.5.1.63),标志着SAM依赖性卤化酶研究的开端.该酶通过SN2机制介导F?对SAM-C5′位的亲核取代,生成5′-氟-5′-脱氧腺苷(5′-FDA),故被命名为5′-氟-5′-脱氧腺苷合酶(5′-FDAS).2004年解析的FlAScat晶体结构(PDB ID:1RQP)显示[83],其单体由N端Rossmann样结构域和C端β-折叠结构域组成,生理状态下通过三聚体堆叠形成活性六聚体;催化口袋位于相邻单体N-C端界面,由末端残基构成包围SAM底物或5′-FDA产物的动态催化微环境[图13(a)].源自海洋细菌Salinispora tropica的氯酶SalL与FlAScat序列同源性为35%,虽具有相似折叠构象[图13(b)]及催化机制,但其卤素选择性与FlAScat显著不同:SalL催化Cl?与SAM发生取代反应生成5′-ClDA[84-85].早期研究[86-87]推测FlA特有的23残基loop(SalL中缺失)可能通过构象调控影响卤素选择性[图13(b)],但最新证据表明催化口袋关键残基起决定性作用.例如,古菌来源的氟酶FlAPtaU1虽缺乏该loop,其氟化效率(kcat=0.41 min-1)却显著优于典型氟酶FlAMA37(kcat=0.16 min-1)和FlASxin(kcat=0.22 min-1)[88];而SalL的Y70A/C/S/T/G突变体均表现出氟化活性[89].与卤素选择性类似,FlA对底物腺嘌呤环C2′位修饰也具有选择性耐受:当H被NH-甲基、NH-丙基、NH-丁基或O-丁基取代时仍保留催化活性,但被叠氮基和硫醚基取代则活性完全丧失[90].QM/MM分析表明,催化口袋N278残基和A279主链酰胺能够分别与腺嘌呤C2′位的NH和O取代基形成有利氢键,从而保留了氟化活性.此外,基因组挖掘以及突变实验证实催化口袋W50/F50保守残基对于FlAs的氟化活性至关重要[91][图13(c)].这些发现表明,催化口袋内关键氨基酸的静电微环境及空间排布(而非loop区域的间接调控)是影响氟/氯酶底物选择性的核心结构基础[92]. ...
Other Images/Table from this Article